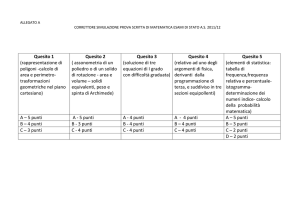
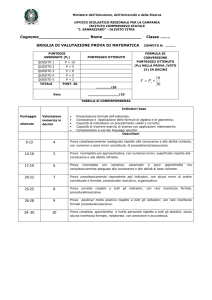
LICEO SCIENTIFICO STATALE “P. MAZZONE” – ROCCELLA IONICA
A.S. 2013/14
VERIFICA FINALE RECUPERO ESTIVO
FISICA
ALUNNO __________________________ CLASSE IV SEZ. ______
DATA 18/07/2014
1) Per portare una certa quantità di acqua da 10 °C a 70 °C occorrono Q 1,26 105 J di calore.
Qual è la capacità termica di tale quantità di acqua? Sapendo che il calore specifico
dell’acqua corrisponde a c 4186
J
kg K
, si può calcolare la massa dell’acqua in esame? In
caso affermativo, determina tale massa.
(2.0)
2) Una massa di gas perfetto avente una temperatura t1 350 C ed una pressione p1 2 105 Pa ,
subisce una trasformazione a volume costante fino a raggiungere una temperatura t 2 .
Calcola
t 2 sapendo che in tale trasformazione la pressione finale corrisponde a
p2 9 10 4 Pa
(2.0)
3) Quanto calore occorre per fondere una massa m 3 kg di rame che si trova alla temperatura
di 25 °C?
( c 387
J
kg K
, t f 1083 C , L f 207 103
J
kg
)
(2.5)
4) Una mole di un gas ideale monoatomico che si trova alla temperatura T1 293 K subisce una
trasformazione isocora, durante la quale assorbe una quantità di calore Q 335 J . Determina
il lavoro compiuto dal sistema, la variazione di energia interna, e la temperatura T2 finale del
sistema.
(2.5)
SOLUZIONI (classi IV)
Quesito 1
J
kg K
Si definisce capacità termica di un corpo la quantità di energia necessaria per aumentare di un Kelvin la sua
E
temperatura, cioè: C
. Poiché sono note sia l’energia necessaria sia la variazione di temperatura si può calcolare
T
la capacità termica della quantità d’acqua. (Non è necessario trasformare la temperatura da Celsius in Kelvin in quanto
il valore della variazione di temperatura è lo stesso).
Dati: ti 10 C ;
t f 70 C ;
Q 1,26 105 J ;
c 4186
E 1,26 10 5
J
2,1 10 3
T 70 10
K
Poiché la capacità termica di un corpo è direttamente proporzionale alla massa del corpo e la costante di proporzionalità
è il calore specifico, cioè C c m , noto c si può determinare la massa con:
C
m
C 2,1 103
0,5 kg
c
4186
Quesito 2
Dati: t1 350 C ;
p1 2 105 Pa ;
p2 9 10 4 Pa .
Trattandosi di trasformazioni di un gas perfetto, ci possiamo servire dell’equazione di stato cioè pV nRT . Poiché la
trasformazione è isocora si ha che V2 V1 . Dall’equazione di stato si ha che V
V2
nRT1
nRT
, perciò V1
e
p1
p
nRT2
nRT2 nRT1
T
T
T
e quindi
, da cui 2 1 , ed infine: T2 1 p 2 .
p 2 p1
p2
p2
p1
p1
Poiché le temperature nell’equazione di stato devono essere espresse in Kelvin, si trasforma la temperatura t1 .
T1 t1 273 350 273 623 K , ed infine:
T2
T1
623 9 10 4
p2
280,4 K , che trasformato in Celsius sarà t 2 T2 273 280,4 273 7,4 C .
p1
2 10 5
Quesito 3
Dati:
ti 25 C ,
m 3 kg .
Per poter fondere interamente il rame, bisogna prima fornire l’energia per portare
la massa di rame dalla temperatura di 25° C alla temperatura di fusione
( t f 1083 C ) (tratto AB del grafico) e quindi l’energia per fondere l’intera
massa, cioè l’energia per trasformare i legami molecolari dei solidi in legami
molecolari dei liquidi, che sappiamo essere meno intensi (tratto BC del grafico).
Tale trasformazione avviene, come sappiamo, a temperatura costante. Nel grafico
la prima quantità di energia è indicata con Q1 , mentre la seconda con Q2 . Si ha
quindi:
Q1 c m t 387 3 1083 25 1,23 106 J
Q2 L f m 207 103 3 6,21 105 J e quindi:
Qtot Q1 Q2 1,23 106 0,621 10 6 1,85 106 J
Quesito 4
Dati : T1 293 K , Q2 335 J .
Poiché in una trasformazione isocora il lavoro che il sistema compie è nullo, il primo principio della termodinamica in
tale trasformazione corrisponde a U Q , per cui U 335 J . Poiché la variazione di energia interna per un gas
l
perfetto è data dalla relazione U nRT , dove l=3 rappresenta il grado di libertà per un gas monoatomico, n il
2
2U
numero di moli ed R la costante universale dei gas, da questa si ricava T
. Si avrà quindi:
lnR
2U
2 335
T
26,87 K e quindi:
l n R 3 1 8,3145
T2 T1 T 293 26,87 319,87 K .