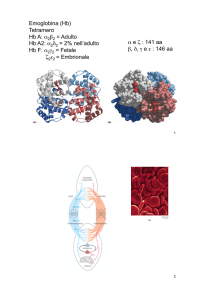
Emoglobina
La biochimica comparata della mioglobina
e dell’emoglobina
mioglobina: singola catena polipeptidica di
153 amminoacidi
emoglobina: 4 catene polipeptidiche, di cui
due di 141 amminoacidi (a) e
due di 146 amminoacidi (b)
propanoile
metile
vinile
Mioglobina: la porzione polipeptidica della Mb racchiude il gruppo eme
inclinazione di 60°
il legame dell’ossigeno alla
mioglobina
ossimioglobina: sesto ligando ossigeno
deossimioglobina: sesta posizione vuota
metamioglobina: sesto ligando una molecola
d’acqua
catena laterale di istidina
La funzione principale della mioglobina è quella di facilitare il trasporto
dell’ossigeno nel muscolo
Curva di legame dell’ossigeno alla mioglobina
Curve di dissociazione dell’ossigeno dell’emoglobina e della mioglobina
Deossiemoglobina
movimento molecolare
elica F
contatti di scivolamento
a1b2 e a2b1
Ossiemoglobina
l’ossigenazione avvicina le due
subunità b
I cambiamenti nella posizione dell’atomo di ferro del gruppo eme dopo l’ossigenazione
determinano modificazioni conformazionali nella molecola di emoglobina
Movimenti dell’eme e dell’elica F durante la transizione T
dell’emoglobina
R
Forma T
Forma R
Legame dell’ossigeno all’emoglobina: curva sigmoide
In ogni sistema di legame una curva di tipo sigmoide è indicativa della
presenza di interazioni cooperative tra i siti di legame.
Il legame dell’ emoglobina all’ossigeno è influenzato da:
-protoni
-biossido di carbonio
-2,3-bisfosfoglicerato
effettori allosterici
Curve di dissociazione dell’ossigeno della mioglobina e dell’emoglobina
a cinque diversi valori di pH
HbO2 + H+
Hb H+ + O2
Effetto Bohr
biossido di carbonio
CO2 + H2O
anidrasi
carbonica
H2CO3
H+ + HCO3
molti degli ioni H+ sono catturati dall’Hb quando l’O2 si dissocia .
Quando l’Hb viene di nuovo ossigenata nei polmoni, l’ H+ viene
rilasciato per formare di nuovo H2CO3
Ruolo dell’emoglobina nel trasporto
dell’O2 dai polmoni ai tessuti che respirano e
della CO2 (sotto forma di HCO3-) dai tessuti ai polmoni.
l’ossigeno entra nei polmoni
con un’elevata pressione
Protoni e ossigeno non si legano allo stesso sito. L’ossigeno
si lega agli ioni ferrosi dei gruppi eme mentre lo ione H+ può
legarsi alle catene laterali di diversi residui amminoacidici
della proteina.
Quando la concentrazione di ioni idrogeno aumenta la conseguente protonazione
dell’emoglobina favorisce il rilascio dell’ossigeno e la transizione allo stato T.
L’anidride carbonica si lega all’estremità amminoterminale
di ciascuna globina formando carbamminoemoglobina.
Quando la concentrazione di anidride carbonica è alta, come nei tessuti periferici, alcune
molecole di anidride carbonica si legano all’emoglobina diminuendone l’affinità per
l’ossigeno.
Viceversa quando l’emoglobina raggiunge i polmoni, l’elevata concentrazione di ossigeno
determina il distacco della CO2 e la saturazione dell’HB.
Tutto ciò rende l’Hb particolarmente adatta al trasporto integrato di
ossigeno, anidride carbonica e ioni idrogeno da parte degli eritrociti.
Effetto del BPG e della CO2
sulla curva di dissociazione dell’O2
dell’emoglobina
Struttura del 2,3-bisfosfoglicerato (BPG)
L’interazione dell’Hb con il 2,3-bifosfoglicerato è un esempio
di regolazione alloasterica eterotropica.
Legame del BPG alla deossiemoglobina
avviene tramite le catene b
BPG e O2 sono effettori allosterici
mutualmente esclusivi per l’Hb
anche se i loro siti di legame sono
fisicamente distinti
Il BPG è una molecola fortemente negativa e si lega all’ Hb mediante
interazioni elettrostatiche con gruppi funzionali carichi positivamente
di residui di entrambe le catene b. Nell’ossiemoglobina il BPG non può
entrare e con la sua presenza induce l’ Hb a rilasciare ossigeno.
Il BPG svolge una funzione importante
nell’adattamento fisiologico alla bassa
pressione di ossigeno che si ha per
esempio a quote elevate.
Per un uomo sano il legame di O2 all’Hb
è regolato in modo che il gas trasferito
ai tessuti sia circa il 40% della quantità
totale di gas che il sangue può trasportare.
A 4500 metri di altezza, dove la pressione di ossigeno è più bassa, il
trasferimento di ossigeno ai tessuti si riduce.
Alcune ore più tardi la concentrazione di BPG nel sangue comincia ad
aumentare generando una diminuzione dell’affinità dell’Hb per l’O2 e
favorendo il rilascio di ossigeno a livello dei tessuti.
L’emoglobina fetale ha una struttura del tipo a2g2
L’emoglobina fetale ha una maggiore affinità per l’ossigeno perché ha
una minore affinità per il BPG (mancano le catene b)
Anemia a cellule falciformi
HbS o emoglobina delle cellule falciformi
clinicamente:
-episodi intermittenti di crisi emolitiche
e vaso-occlusive
-dolore alle ossa, al torace e all’addome
-ritardo della crescita
-maggiore suscettibilità alle infezioni
-danni a diversi organi
Struttura della fibra di deossiemoglobina S
- presenza di valina al posto di acido glutammico
nelle catene b dell’Hb
-le catene laterali dei residui di valina creano delle
sporgenze idrofobiche (zone appiccicose) sulla
superficie della molecola, alle quali si vanno a
legare molecole vicine di HbS
lunghi polimeri a catena insolubili
Formazione dei filamenti di Hb S mediante interazioni tra le catene laterali
idrofobiche dei residui di valina delle catene b e le tasche idrofobiche presenti
nelle catene b delle molecole di Hb adiacenti.
residuo di valina
Fotografia al microscopio elettronico di fibre di deossiemoglobina S
che stanno uscendo da un eritrocita rotto
l’ossigeno entra nei polmoni
con un’elevata pressione
TRASPORTO DELL’ANIDRIDE CARBONICA
L’ anidride carbonica è presente nel sangue in tre forme principali:
1) come CO2 disciolta
2) come HCO3- formata dalla ionizzazione dell’ H2CO3 (prodotto quando la
la CO2 reagisce con l’acqua)
3) come carbamino gruppi, formati quando la CO2 reagisce con gli amminogruppi
dell’emoglobina.
FORMAZIONE DEL BICARBONATO
L’anidride carbonica diffonde all’interno degli eritrociti dove viene trasformata
in acido carbonico che, in maniera rapida e spontaneamente ionizza:
CO2 + H2O
anidrasi
carbonica
H2CO3
H+ + HCO3-
Formazione della carbaminoemoglobina (trasporto della CO2)
L’anidride carbonica reagisce con gli amminogruppi della desossiemoglobina,
formando carbaminoemoglobina:
R-N
H
H
+ CO2
R-N
Questo processo libera ioni H+
H
C
O-
+ H+
O
Poiché gli amminogruppi N-terminali delle catene della globina formano parte del
sito di legame del BPG, si verifica una competizione tra CO2 e BPG:
il BPG diminuisce la capacità dell’Hb di formare carbamino Hb
L’ Hb, oltre ad essere il principale trasportatore dell’ossigeno è un importante
trasportatore dell’anidride carbonica sotto forma di gruppi carbamino legati
covalentemente e gioca il ruolo principale nel controllo degli idrogenioni
prodotti dal trasporto della CO2
Il potere tampone dell’emoglobina è dovuto a:
-4 a-amminogruppi degli amminoacidi N-terminali
- catene laterali imidazoliche dei residui di istidina
L’emoglobina possiede 38 istidine per tetramero che sono responsabili
della maggior parte del potere tampone di questa proteina.
L’emoglobina rappresenta il principale sistema tampone del sangue dopo
quello del bicarbonato.
Nel sangue intero, l’azione tampone assorbe circa il 60% dell’acido prodotto
nel normale trasporto dell’anidride carbonica.
TRASPORTO ISOIDRICO DELLA CO2
La parte rimanente dell’acido che proviene dall’anidride carbonica viene assorbita
dall’Hb tramite questo meccanismo.
1
All’atmosfera
Il sistema isoidrico può assorbire gli ioni H+
derivanti dall’anidride carbonica
impedendo così variazioni del pH.
Eventi che si verificano sul gruppo NH2 terminale delle catene a e b dell’Hb
Evento
NH2 terminali
catene a
catene b
Formazione di gruppi carbamino
si
si
Legame del DPG
no
si
Legame di H+ nell’effetto Bohr
si
no
Il controllo del pH del sangue è importante perché eventuali variazioni
determinano modificazioni del pH intracellulare che, a loro volta, possono
alterare profondamente il metabolismo.
Il pH normale del sangue arterioso è 7,40 + 0,05
L’intervallo compatibile con la vita è circa 7,8 – 6,8
Il pH dell’eritrocita è prossimo a 7,2 (nelle altre cellule è 7,0)
Il sistema tampone del bicarbonato è il tampone principale del plasma e del
liquido interstiziale
CO2 + H2O
anidrasi
carbonica
H2CO3
H+ + HCO3-
CO2 + H2O
anidrasi
carbonica
H2CO3
H+ + HCO3-
Il tampone biossido di carbonio-bicarbonato è un sistema aperto
Come funziona?
Quando il pH del sangue scende per la produzione metabolica di H+, l’equilibrio si
sposta verso sn con accumulo di acido carbonico. Allo stesso tempo l’acido
carbonico si scinde e l’anidride carbonica viene eliminata dai polmoni con
l’espirazione.
Quando il pH del sangue aumenta si forma più HCO3- . La respirazione viene
adattata in modo che la quantità di CO2 aumentata nei polmoni possa essere
reintrodotta nel sangue e, per conversione ad acido carbonico, fornisce gli ioni H+
necessari a controbilanciare l’aumento di HCO3-
Acidosi: il pH del sangue si abbassa a valori di 7,1
-patologie ostruttive del polmone che impediscono una normale eliminazione
della CO2 determinano una acidosi respiratoria
-l’improvviso aumento dei livelli di acido lattico durante uno sforzo fisico
possono provocare un’acidosi metabolica
Alcalosi: il pH del sangue tende a salire oltre 7,6
-l’iperventilazione accelera la perdita di CO2 e porta ad un’alcalosi respiratoria
Trattamento dell’acidosi: somministrazione intravenosa di NaHCO3
Trattamento dell’alcalosi: quella respiratoria viene migliorata dalla
respirazione di un’atmosfera ricca di CO2