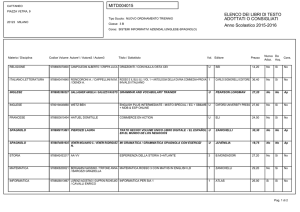
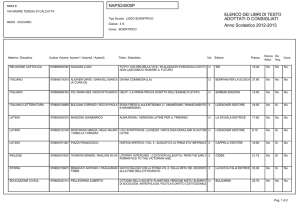
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
1
1.Trasformazioni
chimiche della
materia
4.1 La materia
subisce trasformazioni
chimiche e fisiche
Trasformazioni fisiche • 1
Le trasformazioni fisiche provocano un cambiamento fisico
della materia e non producono nuove sostanze.
In figura: il ghiaccio, l’acqua liquida e le nubi.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
4
Trasformazioni fisiche • 2
•
Sono trasformazioni fisiche ad
esempio i mutamenti dello stato di
aggregazione (solido, liquido,
gassoso), l’espansione o
contrazione per effetto di variazioni di
temperatura o pressione esterna.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
5
Reazioni chimiche • 1
•
Le reazioni chimiche invece
comportano una variazione della
composizione chimica: le sostanze
originarie (reagenti) si trasformano in
nuove sostanze (prodotti).
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
6
Reazioni chimiche • 2
La luce di una lampadina a incandescenza deriva da una
trasformazione fisica (il filamento di tungsteno diventa
incandescente); la luce di una candela che brucia deriva
da una trasformazione chimica.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
7
Reazioni chimiche • 3
Se riscaldiamo su una
fiamma una striscia metallica
magnesio e
ossigeno
di magnesio, essa si
incendia e produce una luce
bianca intensissima
ossido di
magnesio
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
(reazione di combustione).
8
Reazioni chimiche • 4
Quando la benzina brucia nel motore a scoppio, si
combina con l’ossigeno dell’aria (combustione)
trasformandosi in diossido di carbonio e vapore
acqueo.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
9
Reazioni chimiche • 5
•
Per rappresentare una reazione
chimica si scrivono a sinistra i reagenti
e a destra i prodotti, collegati da una
freccia:
reagenti → prodotti
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
10
Reazioni chimiche • 6
•
Molte reazioni sono accompagnate da
cambiamenti caratteristici come:
–
la formazione di bollicine,
–
la variazione di colore,
–
la formazione o scomparsa di un solido,
–
la liberazione di prodotti gassosi,
–
l’aumento o diminuzione della temperatura,
–
l’emissione di luce.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
11
Alcuni esempi • 1
Non sempre è facile riconoscere a vista se una
trasformazione è chimica o fisica.
Trasformazioni fisiche
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
Trasformazioni chimiche
12
Alcuni esempi • 2
Trasformazioni fisiche
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
Trasformazioni chimiche
13
Alcuni esempi • 3
Trasformazioni fisiche
Trasformazioni chimiche
Per riconoscere la natura della trasformazione si deve
far ricorso all’analisi chimica, che permette di determinare
con notevole sicurezza la composizione delle sostanze.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
14
Alcuni esempi • 4
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
15
4.2 Le sostanze pure
si dividono in elementi
e composti
Elementi e composti • 1
•
Un elemento è una sostanza pura che
non può essere trasformata in sostanze
più semplici.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
17
Elementi e composti • 2
•
L’analisi chimica di un oggetto di ferro
rivela che esso è costituito solo da Fe.
•
Altri elementi sono ad esempio
ossigeno, azoto, oro, argento.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
18
Elementi e composti • 3
•
Le sostanze più numerose sulla Terra
sono i composti.
•
Attualmente ne esistono più di 10
milioni (es. H2O, zucchero, NaCl).
•
Possono essere di origine naturale o
sintetica.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
19
Elementi e composti • 4
•
Un composto è una sostanza pura che
può essere decomposta, con gli
ordinari mezzi chimici, in sostanze pure
più semplici.
•
I composti hanno una composizione
ben definita e costante.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
20
Elementi e composti • 5
•
L’acqua è un composto. È formata
dagli elementi idrogeno e ossigeno.
•
L’acqua può essere decomposta negli
elementi per elettrolisi:
acqua (l) → idrogeno (g) + ossigeno (g)
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
21
Elementi e composti • 6
I materiali
Possono essere separati con mezzi fisici?
NO
SI
Sostanze pure
Miscugli
Possono essere decomposte
per via chimica?
SI
NO
Sono
omogenei?
Elementi:
carbonio, oro,
ossigeno
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
Composti:
acqua,
zucchero. sale
SI
Soluzioni:
acqua potabile,
aria, bronzo
NO
Miscugli
eterogenei:
legno,sangue
22
4.3 La tavola
periodica permette di
classificare gli
elementi
Gli elementi • 1
•
Nel 1869 il chimico russo Mendeleev
scoprì che gli elementi potevano
essere classificati in base alle loro
proprietà chimiche e fisiche.
•
Il risultato del suo lavoro fu la tavola
periodica degli elementi.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
24
Gli elementi • 2
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
25
Gli elementi • 3
•
Dei 118 elementi presenti sulla tavola
periodica attuale solo 89 esistono in
natura, principalmente in composti.
•
Gli altri elementi sono ottenuti con
reazioni nucleari e hanno vita breve.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
26
Gli elementi • 4
Abbondanza relativa degli elementi sulla crosta terrestre
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
27
Gli elementi • 5
•
Quasi il 99% in peso della crosta
terrestre è costituito da soli nove
elementi (elencati nella tabella).
•
L’ossigeno e il silicio costituiscono più
del 70% in peso degli elementi presenti
sulla crosta terrestre.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
28
I metalli • 1
Molti utensili da cucina sono fatti di metalli puri come rame
o di alluminio (elementi), oppure di leghe metalliche come
ghisa o di acciaio inossidabile (soluzioni solide).
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
29
I metalli • 2
•
A temperatura ambiente (20°C) tutti i
metalli sono solidi eccetto il mercurio.
•
Molti metalli sono duttili, cioè si
possono ridurre in fili.
•
Molti metalli sono malleabili, cioè si
possono modellare facilmente.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
30
I metalli • 3
•
I metalli puri di solito sono lucenti
(riflettono la luce).
•
I metalli puri sono buoni conduttori del
calore e dell’elettricità. I fili elettrici ad
esempio sono di rame o di alluminio.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
31
I non metalli • 1
•
I non metalli a condizioni ambiente
possono essere
–
Gassosi (ossigeno, azoto, fluoro, cloro)
–
Liquidi (bromo)
–
Solidi (carbonio, zolfo)
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
32
I non metalli • 2
•
I non metalli solidi non sono né duttili
né malleabili, e si frantumano
facilmente.
•
I non metalli possono essere colorati: lo
zolfo è giallo, il cloro è verde pallido, il
bromo è rosso…
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
33
I non metalli • 3
•
Tutti i non metalli, eccetto il carbonio,
sono cattivi conduttori del calore e
dell’elettricità.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
34
I non metalli • 4
Il carbonio ha un comportamento unico nel sistema
periodico:
La grafite è un buon
conduttore di corrente
elettrica ma non di calore.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
Il diamante è un ottimo
conduttore di calore ma
non di corrente elettrica.
35
I gas nobili
•
Gli elementi nell’ultima colonna della
tavola periodica sono i gas nobili.
•
Hanno una bassissima reattività.
•
L’elio può essere usato per creare un
ambiente inerte.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
36
I semimetalli • 1
•
I semimetalli (ad es. germanio e silicio)
sono solidi a temperatura ambiente.
•
Non sono né conduttori né isolanti.
•
Sono eccellenti semiconduttori, in
particolare quando contengono
impurezze di altri elementi vicini.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
37
I semimetalli • 2
Germanio e
silicio impuri
sono solitamente
impiegati nei
transistor e nei
circuiti integrati.
Autore, Autore, AutoreTitolo © Zanichelli editore 2009
38