Slides 1 2014-15
UNIVERSO
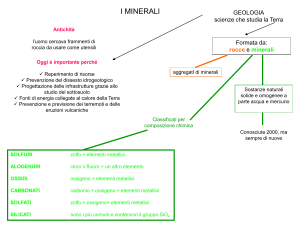
I minerali sono le sostanze “solide”
naturali che costituiscono la
porzione “solida” dell’Universo
I minerali sono il prodotto di processi terrestri
e planetari più o meno complessi che
avvengono in un ampio intervallo di pressioni e
temperature.
La Terra è costituita da materiali “solidi” detti
rocce costituiti di aggregati di più minerali
(es.graniti ) o aggregati in cui domina un solo
minerale (es quarziti).
ll loro studio consente di comprendere l’origine
e l’evoluzione della Terra.
La scienza che studia i minerali è la
mineralogia
ed ha un ruolo centrale nelle Scienze della Terra in
quanto i minerali sono i costituenti principali del
substrato Terrestre.
Esempi
I minerali e la materia organica sono i principali
costituenti dei suoli
Le pietre preziose sono minerali
I minerali sono le materie prime di base sulle quali si
fonda lo sviluppo tecnologico e la produttività
economica della nostra società
Esempio
Il Coltan è una miscela di due minerali che molto raramente si
rinvengono puri
columbite (Fe, Mn)Nb2O6 e tantalite (Fe, Mn)Ta2O6
Il Coltan è molto resistente al calore e alla corrosione, è
utilizzato per la produzione dei condensatori di computer
portatili, telefoni cellulari, dispositivi video, dispositivi audio
digitali, console giochi e sistemi di localizzazione satellitare.
È utilizzato anche nel settore aerospaziale e nella tecnologia
militare.
Serve a ottimizzare il consumo della corrente elettrica nei chip
di nuovissima generazione.
Purtroppo, essendo così prezioso è causa della guerra che
sta devastando il Congo e di spregevole sfruttamento dei
bambini.
Bambini sfruttati come
mano d’opera nelle miniere
Obiettivi formativi del corso di mineralogia
A) Comprendere il ruolo dei minerali come componenti
fondamentali della litosfera.
B) Acquisire i concetti di base della simmetria nello stato
cristallino, con particolare riferimento alla simmetria
morfologica.
C) Imparare come si riconosce e si studia un minerale
sulla base delle sue proprietà 1) morfologiche, 2) fisiche
(principalmente interazioni con la luce e con i raggi X) e
3) cristallochimiche (relazioni tra struttura e legami
chimici, isomorfismo, polimorfismo) per poi utilizzare
questi concetti per classificare e descrivere i minerali più
importanti.
F.C. HAWTHORNE
Il miglior studioso delle Scienze della Terra,
a prescindere dalla propria
specializzazione individuale, è colui che
ha maggiori conoscenze nel settore della
Mineralogia
La mineralogia
• La mineralogia ha un ruolo centrale in tutte le
Scienze della Terra: Petrografia, Geochimica,
Geologia, Strutturale, Metallogenesi, Geofisica
• Rischi: ruolo di strumento al servizio dei fisici,
chimici, petrografi, geochimici, geologi etc
• Difficoltà tecniche insegnamento
• Assurge a scienza alla fine XVIII secolo
• Notevole sviluppo a partire dall’inizio del XX
secolo con la scoperta dei Raggi X e la
diffrazione dei raggi X da parte dei cristalli
Perché studiare la mineralogia
1) per conoscere le caratteristiche dei minerali
sostenze naturali costituenti delle rocce;
2) per lo studio dei minerali consente di ricostruire
gli ambienti geologici definendone le condizioni di
T, P e ambiente chimico;
3) per avere informazioni su regioni del pianeta
Terra non accessibili all’uomo e di cui si hanno solo
notizie indirette
4) per lo studio dei minerali che hanno contribuito e
contribuiscono al progresso umano per il loro uso e
le applicazioni tecnologiche
IL
P
I
A
N
E
T
A
T
E
R
R
A
Geofisici, Geochimici, Mineralisti
Km
Le discontinuità sono caratterizzate da
trasformazioni strutturali dei minerali
f
1000°
140-170 kbar
l’olivina (D 3.2- 4.4 gcm-3) si
trasforma in olivina β e olivina con
struttura tipo spinello (D>10%)
Minerali e Rocce
• I minerali sono i costituenti delle rocce
unitamente a sostanze amorfe (es vetro
vulcanico)
• Le roccie sono ,quindi , aggregati naturali
di uno o più minerali
• Processi minerogenetici e petrogeneticici
• I minerali presenti nelle rocce si dividono
in essenziali, accessori, accidentali
ESEMPIO
Graniti: rocce
magmatiche intrusive o
plutoniche a chimismo
sialico
Minerali essenziali: quarzo (SiO2), feldspato potassico K [AlSi3O8],
plagioclasi (Na, Ca) [Al(Al,Si)Si2O8], albite Na[AlSi3O8] anortite
Ca[Al2Si2O8]), mica biotite [K(Mg,Fe)3(Si3Al)O10] (OH)2
Minerali accessori: magnetite (FeFe2O4), apatite, pirite (FeS2)
zircone (ZrSiO4), ortite (o allanite), titanite, epidoto, tormalina
Minerali accidentali: mica muscovite [K2Al4(Si6Al2O20)(OH)4],
orneblenda, pirosseno, granato
Peridotiti
Peridotiti: rocce plutoniche
ultrafemiche.
La peridotite (lherzolite)
rappresenta il 95% delle rocce
del mantello superiore.
La roccia è costituita da: olivina
verde chiaro (60%); pirosseno
verde erba ( monoclino ~15%,
rombico ~20%); ~5% granato
(piropo) rosso-violetto o
plagioclasio calcico o spinello
di Mg e Cr
Eclogiti
Eclogiti: rocce metamorfiche
si formano ad alte o altissime P
e T da materiali magmatici
basici.
L’eclogite, in ordine di
abbondanza (il 5%), è la
seconda roccia del mantello
superiore terrestre.
La roccia è costituita da due
soli minerali: il pirosseno
verde (onfacite) e il granato
rosso ferromagnesiaco
Aggregazione di minerali
Le specie mineralogiche sono
circa 4000, ma i minerali più
diffusi sono un centinaio e,
variamente associati anche con
fasi amorfe, formano le rocce
ovvero corpi disomogenei
Specie e Varietà
Berillo
Corindone
Quarzo α
rubino
Ametista
smeraldo
zaffiro
acquamarina
Tormalina dravite
Tormalina sciorlo
Definizione di minerale
I minerali sono sostanze naturali
inorganiche generalmente allo stato
cristallino i cui atomi, ioni o
molecole sono disposti
tridimensionalmente e si ripetono
in maniera ordinata e periodica.
I minerali presentano una
composizione chimica definita ed
omogenea.
I minerali presentano un
comportamento anisotropo rispetto
ad almeno una proprietà fisica
Il tutto o una parte piccolissima
presentano la stessa composizione
Microtuboli spiraliformi– ordine ma non
periodicità
disposizione tridimensionale, ordinata, periodica
1 vettore di traslazione
piano reticolare
filare
maglia maglia
a
filare
c
Reticolo cristallino
cella
elementare
b
Cella elementare 3
a
2
1
reticolo cristallino
Stati di aggregazione della materia
Gli stati di aggregazione della materia sono tre: gassoso, liquido, cristallino
Una stessa sostanza in funzione delle condizioni chimico-fisiche può assumere
l’uno o l’altro stato di aggregazione
Esaminiamo in modo quantitativo i tre stati della materia
Consideriamo un cubetto di 1cm3 di Ossigeno gassoso
L’Ossigeno a 25°C e alla pressione 1 atmosfera è allo stato gassoso
Assimilandolo ad un gas perfetto, dall’equazione di stato dei gas ideali pV=nRT si
ricava che:
1cm3 di Ossigeno pesa 1.31 x 10-6 Kg; contiene 2.46 x 1019 molecole; una
distanza media è 34 Å; urti/ sec = 6.7 x 109 ; velocità media di 450 m/sec
Questa situazione corrisponde ad uno stato di disordine totale (gas = caos)
Stati di aggregazione della materia
Un cubetto di 1cm3 di Ossigeno liquido pesa 1.14 x 10-3 Kg; la distanza
media tra le molecole è 3.6 Å; La velocità media di spostamento delle
molecole è ~10 m/sec
Un cubetto di 1cm3 di Ossigeno cristallino pesa 1.36 x 10-3 Kg; la distanza
media tra le molecole è 3.39 Å che corrisponde a condizioni di contatto
reciproco
Le molecole non sono più libere di spostarsi ma solo di vibrare intorno al
baricentro della molecola e lungo il legame tra i due atomi
Negli stati fluidi della materia le molecole sono mobili; nello stato cristallino
le molecole sono vincolate. Questi dati però non illustrano i rapporti spaziali
tra le molecole.
• Per i fisici dello stato solido sono veri solidi solo i corpi
che hanno una struttura cristallina, caratteristica che
impedisce ogni moto traslazionale alle particelle, gli altri
solidi possono considerarsi liquidi a viscosità
elevatissima.
N.B.
• Il riconoscimento dello stato strutturale dei corpi è di
estrema importanza poiché ad ogni stato strutturale
corrispondono proprietà fisiche specifiche
Il controllo della struttura è un fattore determinante per un
gran numero di proprietà fisiche e quindi per le possibili
applicazioni
Proiezione sul piano delle strutture :
a) quarzo: struttura ordinata; b) vetro di silice struttura disordinata
● ioni silicio ○ ioni ossigeno
Distribuzione disordinata con
indicazione dei primi vicini
Cristalli e Sostanze amorfe
Struttura ordinata e periodica = struttura cristallina
Le strutture cristalline sono caratterizzate
da un ordine a lungo raggio
I minerali assumono spontaneamente
forme poliedriche definite cristalli
Struttura disordinata = solido
Cristalli di quarzo
Le sostanze solide sono caratterizzate
solo da un ordine a corto raggio
Un solido è privo di forma propria
ovvero è amorfo, esempio il vetro vulcanico
Pomice
Esistono strutture intermedie in cui coesistono
configurazioni ordinate accanto a situazioni disordinate
Es. materie plastiche, materiali ceramici, leghe, cristalli liquidi
I cristalli liquidi godono delle proprietà meccaniche
dello stato liquido ma anche una spiccata anisotropia
delle proprietà ottiche come nei cristalli
(detto stato mesomorfico, Friedel 1922)
Applicazioni: schermi, termometri, circuiti elettrici, memorie nei
computer
Sono stati identificati cristalli liquidi
formati spontaneamente da molecole di
DNA immerse in acqua. Ciò apre un nuovo
possibile scenario sull'origine della vita sul
nostro pianeta. Scoperta in parte italiana.
a) Curva di raffreddamento di una sostanza cristallina.
b) curva di raffreddamento di una sostanza amorfa
b) Non essendo una struttura ordinata e periodica non è necessario
raggiungere una ben precisa T di fusione per distruggere la struttura, si
ha una T di rammollimento
• RICAPITOLANDO
• Una struttura cristallina consiste nella
ripetizione tridimensionale ordinata e
periodica delle unità costitutive (atomi, ioni,
molecole)
• La struttura è quindi omogenea
• Tutte le direzioni parallele sono equivalenti
Struttura cristallina di NaCl
Na+ r = 0.97 Å Cl- r =1.81Å
NaCl: 1 cristallo reale ; 2 rappresentazione strutturale
La disposizione spaziale dei suoi ioni è stata
dimostrata con i raggi x
Na+ r = 0.97 Å Cl- r =1.81 Å
2
1
Proiezione sul piano di una faccia del cristallo cubico
a periodo di identità lungo i filari // OA
e periodo di identità lungo i filari // OE
(10-9m)
Distribuzione
(10-10 m)
omogenea
A
Periodo di
identità
La definizione di omogeneità comporta che
il cristallo debba considerarsi infinito,
diversamente le particelle superficiali non
godrebbero delle stesse proprietà di quelle
interne
Perché considerare il cristallo è legittimo
Un cristallo di 1 mm3, presenta 107 atomi lungo lo spigolo
Il rapporto tra gli atomi superficiali e quelli contenuti nel volume è
pari a 6 x10-17
Quindi, gli atomi della superficie sono decisamente trascurabili
rispetto al volume pertanto la struttura può considerarsi
omogenea