SICSI VIII CICLO
CHIMICA DEGLI ELEMENTI
NELL’AMBIENTE
ALLUMINIO
Docente
prof. Salvatore ANDINI
•DESTINATARI.
Studenti di un ITIS ad indirizzo chimico
•PREREQUISITI.
Tavola periodica legami chimici
•OBIETTIVI.
Conoscere le principali caratteristiche e
gli utilizzi dell’alluminio
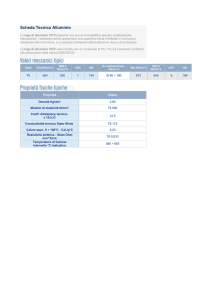
Alcune caratteristiche dell’alluminio
•L’alluminio è un metallo leggero con un aspetto
grigio argenteo a causa del leggero strato di ossido.
• Il suo peso specifico è circa un terzo dell’acciaio o
del rame è duttile e malleabile e di facile lavorazione
presenta una eccellente resistenza alla corrosione.
•L’alluminio è uno degli elementi più diffusi sulla terra
secondo solo a ossigeno e silicio si trova sempre
combinato con altri elementi; è presente in numerosi
minerali.
•Dal punto di vista industriale viene prodotto a
partire dalla bauxite roccia rosso bruno o gialla
diffusa soprattutto in USA, Russia, Guyana, Ungheria,
ex Jugoslavia.
Proprietà
•Chimicamente reattivo, è un forte agente riducente Riduce vari composti
metallici allo stato fondamentale, e questa proprietà è sfruttata in alcuni
processi industriali tra i quali, ad esempio, il processo Thermit per la
saldatura del ferro
• Tra i più importanti composti dell'alluminio sono da citare l'ossido, noto
come allumina, l'idrossido, un precipitato bianco che manifesta proprietà
anfotere, il solfato, detto anche allume, e alcune miscele di composti di zolfo.
•L'alluminio è il più abbondante costituente metallico delle rocce terrestri; si
ritrova generalmente come silicato, sia solo sia mescolato con altri metalli
come il sodio, il potassio, il ferro, il calcio e il magnesio, ma mai allo stato
libero.
•Il processo di estrazione dai silicati è tuttavia complesso ed estremamente
costoso, pertanto la bauxite, un ossido di alluminio idrato e impuro,
rappresenta la più importante fonte commerciale del metallo e dei suoi
composti.
Il rubino è la più nobile varietà
monocristallina dell' ossido di
alluminio (Al2O3), un minerale
noto come corindone, sostanza
naturale di durezza 9 nella
Scala di Mohs.
Lo zaffiro è una
varietà nobile
monocristallina
dell'ossido di
alluminio (Al2O3),
un minerale noto
come corindone,
sostanza naturale
di durezza 9 nella
Scala di Mohs.
Il colore bluazzurro tipico della
gemma deriva da
inclusioni di
ematite e rutilo.
La bauxite è una roccia sedimentaria che costituisce la principale fonte per
la produzione dell'alluminio. La sua composizione è caratterizzata dalla
presenza di diverse specie mineralogiche tra cui prevalgono gli ossidi e gli
idrossidi di alluminio e di ferro. La quantità di idrossido di alluminio varia
nei differenti depositi tra il 30 e il 75%, Il colore della bauxite è in genere
rosso cupo con irregolari macchie biancastre.
IL PROCESSO DI ESTRAZIONE
DA BAUXITE AD ALLUMINA
DA ALLUMINA AD ALLUMINIO
(CICLO BAYER)
(CICLO HALL-HEROULT)
ດIl processo Bayer
Dal processo Bayer si ottiene l’idrossido di alluminio che viene trattato
per l’ottenimento di allumina pura o alluminio metallico.
Questo processo consiste nella lisciviazione della bauxite a pressione e
temperatura elevate (140 – 250 °C, 15bar) con soda caustica in soluzione
(15%NaOH) per estrarre l’allumina presente nella bauxite in forma idrata,
portandola in soluzione come alluminato di sodio nella liscivia di attacco.
L’allumina contenuta nella bauxite in quantità superiori al 50% va in soluzione mentre restano
in sospensione tutti gli altri componenti della bauxite (Al2O3, Fe2O3, TiO2, SiO2, CaO, Na2O
combinato e altri). Le sostanze insolute vengono separate per decantazione e filtrazione,
costituendo dei fanghi chiamati “fanghi rossi” (colorazione dovuta all’elevato contenuto di
ossido di ferro) che dopo lavaggio in controcorrente a 5 stadi vengono inviati al bacino fanghi
.
Una volta separati dal processo i fanghi rossi, la soluzione di alluminato di sodio viene
raffreddata ed inviata in appositi serbatoi di precipitazione, o cristallizzazione, dove riceve
l’aggiunta di idrato di alluminio che ha la funzione di innesco germinativo. Durante questo
processo l’alluminato di sodio si decompone portando alla cristallizzazione di allumina idrata
(Al2O3 ∙3H2O) che viene in parte riciclata come innesco germinativo e in parte come prodotto.
L’allumina idrata dopo essere sottoposta a lavaggio e filtrazione viene calcinata in forni
rotativi o a letto fluido a 1000 – 1100°C ottenendo così allumina idrata di elevata purezza
(Al2O3 99%, 0.01-0.03% Fe2O3, 0.01-0.02% SiO2 e 0.3-0.6% Na2O ) in forma di solido
cristallino bianco di granulometria pari a circa 90 micron.
SCHEMA a BLOCCHI del PROCESSO
EURALLUMINA
navi bauxite
e soda
combustibile
CENTRALE
CENTRALE
---TERMICA
TERMICA
PORTO
PORTO
Stocc.
Stocc.bauxite
bauxite
Stocc.
Stocc.combustibile
combustibile
bauxite
vapore
soda
macinazione
macinazione
evaporazione
evaporazione
Liscivia
carica +
fango
ATTACCO
ATTACCO
Recupero
Recuperovapore
vapore di
diflash
flash
Spegnim.
Spegnim.calce
calce
Separaz.
Separaz.sabbie
sabbie
Liscivia
scarica
acqua +
condensato
CHIARIFICAZ.
CHIARIFICAZ.
filtrazione
filtrazioneliscivia
liscivia
Lav.
Lav.Filtr.fanghi
Filtr.fanghi
Scambio
Scambiocalore
calore
soda
PRECIPITAZIONE
PRECIPITAZIONE
classificaz-.
classificaz-.idrato
idrato
lav.
lav.ossalato
ossalato
combustibile
Liscivia
carica
fango
Idrato di alluminio
Lav./filtraz.
Lav./filtraz.idrato
idrato
CALCINAZIONE
CALCINAZIONE
ALLUMINA
Acqua +
condensato
Elettrolisi di allumina fusa in criolite
• Si esegue la riduzione del metallo in cella elettrolitica utilizzando
come elettrolita una miscela di criolite 80% / allumina 10% più altri
fondenti (fluoruro di calcio, carbonato di litio), necessari a causa
dell'alto punto di fusione dell'allumina, oltre 2 000 °C. Grazie a questi
additivi la miscela ha punto di fusione di circa 900 °C,
•Gli elettrodi usati nell'elettrolisi della bauxite sono entrambi di
carbonio: la reazione al catodo è
Al3+ + 3e− → Al
Qui gli ioni di alluminio vengono ridotti, l'alluminio metallico affonda
nella miscela fusa e può esser separato.
• All'anodo si ha invece l'ossidazione dell'elettrodo di carbonio per
formare anidride carbonica:
2O2− + C → CO2 + 4e−
all'anodo si ha pertanto il consumo di carbone per l'elettrodo, che si
trasforma in anidride carbonica.
Questo processo richiede, per una tonnellata di alluminio, 1,89 t di
allumina, 0,07 t di criolite, 0,45 t di C per gli elettrodi e 15 000 kWh
di energia elettrica: il costo dell'energia è il fattore critico di tale
processo.
Composti dell’alluminio
•L' alluminato di sodio è il sale di sodio dell'acido alluminico.
È un importante composto chimico inorganico che viene prodotto
principalmente dall'idrossido di alluminio.
Nella tecnologia edilizia, l'alluminato sodico viene addizionato al cemento
per accelerare la sua solidificazione. È anche utilizzato nella produzione
della carta.
•L'alluminato di potassio KAlO2 è il sale di potassio dell'acido
alluminico.
È un sale alcalino utilizzato, come l'alluminato di sodio, come
acceleratore nella solidificazione del cemento.
Composti dell’alluminio
•Il clorato di alluminio AlClO4 è il sale di alluminio
dell'acido clorico. È fotosensibile, quindi viene conservato
generalmente in recipienti di vetro ambrato. Come tutti i
clorati, è un forte ossidante solubile in acqua.
•Il cloruro di alluminio è il sale dell'alluminio con l'acido
cloridrico. Può essere anidro (AlCl3) o esaidrato (AlCl3 ·
6H2O).
Il prodotto anidro è una polvere gialla corrosiva e
dall'odore irritante che in presenza di acqua subisce idrolisi
liberando acido cloridrico.
•La criolite Na3AlF6 è un sale complesso di alluminio, fluoro e
sodio.
A temperatura ambiente si presenta come un solido grigiobianco inodore. È un composto tossico, pericoloso per
l'ambiente.
In forma liquida è utilizzata per la produzione industriale
dell'alluminio.
•Il nitrato di alluminio Al(NO3)3 è un nitrato con formula Al(NO3)3.
•È un sale che si ottiene dalla reazione dell'alluminio con l'acido nitrico, dalla struttura
normale di idrato cristallino. La sua forma più comune è il nitrato di alluminio
nonaidrato (Al(NO3)3·9H2O).
Il nitrato di alluminio è un forte ossidante, usato per la tintura del cuoio, la produzione
di antitraspiranti e inibitori di corrosione, per l'estrazione dell'uranio, la raffinazione del
petrolio e per la nitrurazione di componenti chimici
•Il solfato di alluminio e potassio dodecaidrato (o allume potassico) KAl(SO4)2
· 12H2O è un sale misto di alluminio e potassio dell'acido solforico.
A temperatura ambiente si presenta come un solido incolore inodore.
Sin dall'antichità era usato in numerose attività produttive, in vari settori.
Nelle industrie tessili era usato come fissante per colori, il suo uso era quindi basilare
nella tintura della lana, nella realizzazione delle miniature su pergamena e nella
concia delle pelli. Serviva poi alla produzione del vetro ed in medicina era usato come
emostatico.
Il nitruro di alluminio è il composto binario formato da alluminio e azoto,
La principale applicazione del nitruro di alluminio è definita nel campo della conduttività elettrica
La ceramica AlN ha un'ottima conducibilità termica, pari a 180 W/mK, che lo rendono
un substrato dalle elevate prestazioni in elettronica (come isolante elettrico, ma
conduttore di calore)..
Le ceramiche di Nitruro di alluminio in atmosfera normale vengono sinterizzate a
pressione, ad una temperatura di circa 1800 °C. Con l'aiuto di opportuni
sinterizzatori giunge alla fase di sinterizzazione fluida.
Leghe di alluminio