Asse diencefalo-ipofisi-ovaio: il ciclo
mestruale e le amenorree
Prof. Guido Ambrosini
Università degli Studi di Padova
Ormoni coinvolti nel controllo della
funzione riproduttiva
La funzione riproduttiva nella donna è regolata
dall’asse IPOTALAMO-IPOFISI-OVAIO, pertanto le
sostanze chiamate in causa in tale regolazione
sono:
ORMONI IPOFISARI
ORMONI OVARICI
Def. di ormone: sostanza chimica prodotta da ghiandole a secrezione
interna che viene riversata nel sangue e agisce influenzando e
comandando l’attività funzionale di organi e tessuti bersaglio.
Asse ipotalamo-ipofisi-ovaio
ORMONI IPOFISARI
Le gonadotropine ipofisarie sono 2: FSH ed LH
Sono glicoproteine dotate di due subunità:
• la subunità α è aspecifica e comune anche
all’hCG e al TSH
• la subunità β è ormono-specifica
Questi ormoni sono secreti con pattern pulsatile:
le pulsazioni dell’LH mutano a seconda della
fase del ciclo: in fase follicolare la frequenza è di
un ‘pulse’ ogni 60-80 min., mentre in fase
luteinica
la
frequenza
si
riduce
progressivamente.
• Durante la vita fetale FSH ed LH sono molto
elevati e raggiungono un apice verso la 20° s.g.
• Alla nascita si elevano transitoriamente per poi
ridiscendere l’LH verso il 4° mese e l’FSH verso
il 4° anno di vita
• Per tutta l’età infantile le gonadotropine sono
molto basse
• Alla pubertà i valori di gonadotropine si elevano,
dapprima soltanto durante le ore di sonno. Nel
corso della vita riproduttiva i valori oscillano
ciclicamente
• In menopausa entrambe le gonadotropine
aumentano: l’FSH mostra elevazioni superiori
rispetto all’LH
ORMONI IPOFISARI
Un altro ormone ipofisario è la prolattina: la sua
secrezione segue un ritmo pulsatile sincrono
con quello dell’LH.
La sua azione si esplica sull’ovaio e sulla
mammella:
sull’ovaio ha effetto luteotropo, mantenendo i
recettori per l’LH sulle cellule
a livello della mammella induce la trascrizione
dei geni della caseina e dell’ α-lattalbumina
La PRL ha effetti fisiologici sull’ovaio;
paradossalmente
l’iperprolattinemia
ha
un’azione deleteria sulla funzione ovarica:
• in una prima fase blocca la sintesi di
progesterone, causando ipoluteinismo
• successivamente inibisce l’azione dell’FSH
sulle cellule della granulosa, inibendo la
steroidogenesi e quindi prevenendo
l’ovulazione
• infine produce amenorrea
La produzione di PRL dipende da numerosi
fattori:
dopamina
ormoni tiroidei
FATTORI INIBENTI
androgeni
glucocorticoidi
FATTORI STIMOLANTI
serotonina
TRH
oppioidi endogeni
estrogeni
ORMONI OVARICI
Nella donna l’ovaio è la principale ghiandola
endocrina deputata alla sintesi degli steroidi
sessuali.
La steroidogenesi si svolge nelle cellule della
granulosa, nelle cellule della teca interna e nelle
cellule interstiziali.
Gli ormoni prodotti sono estrogeni, androgeni e
progestinici.
Tutte e tre le classi ormonali prodotte dall’ovaio
condividono la stessa struttura biochimica: l’anello
ciclopentanoperidrofenantrenico (dal colesterolo).
La principale differenza chimica che permette di
raggruppare questi ormoni in tre classi distinte è il
numero di atomi di carbonio che li costituisce:
•
21 atomi di carbonio (C21) progestinici
•
19 atomi di carbonio (C19) androgeni
•
18 atomi di carbonio (C18) estrogeni
La tappa principale della steroidogenesi ovarica è la
trasformazione del colesterolo in pregnenolone.
A partire da questo ormone, la steroidogenesi può
proseguire attraverso due vie diverse: Δ4 e Δ5.
Androstenedione
e
testosterone, prodotti
ultimi rispettivamente
della via Δ4 e Δ5
vengono
convertiti
rapidamente in estrone
ed
estradiolo,
attraverso un processo
detto aromatizzazione.
Meccanismo d’azione degli ormoni
steroidei
gli steroidi sessuali penetrano nelle cellule
bersaglio
contraggono un legame reversibile con recettori
specifici localizzati nel nucleo
il recettore dopo il legame con l’ormone ha una
più alta affinità per siti nucleari chiamati
‘estrogen response elements’
la doppia elica del DNA si svolge rendendo
disponibile la trascrizione dei geni
Effetti degli ormoni sessuali
ESTROGENI
ESTRADIOLO:
è il principale estrogeno sintetizzato ed escreto
dall’ovaio.
La sua sintesi deriva dal sinergismo tra cellule tecali e
cellule della granulosa: in sede tecale sono infatti
prodotti i precursori androgenici che verranno
successivamente aromatizzati nella granulosa.
I suoi effetti a livello cellulare sono di tipo metabolico e
mitogenico, inducendo da un lato vie enzimatiche
specifiche e dall’altro proliferazione cellulare.
ESTRONE:
è il principale estrogeno in età menopausale
ESTRIOLO:
è l’estrogeno presente in maggior quantità nell’urina, in
quanto è uno dei prodotti del metabolismo epatico di
estradiolo ed estrone. La sua attività biologica è limitata
dalla breve durata del legame estriolo-recettore, per cui
svolgerebbe piuttosto un’azione anti-estrogenica (che lo
renderebbe protettivo nei confronti di alcune patologie
ormono-dipendenti, come il carcinoma mammario), tuttavia
le sue elevate concentrazioni gli conferiscono un’azione
estrogenica sovrapponibile agli altri ormoni della stessa
classe.
Effetti degli ormoni sessuali
PROGESTERONE
E’ secreto dall’ovaio durante tutto il ciclo, ma la
sua produzione e quindi la sua concentrazione
rimangono basse fino a dopo l’ovulazione.
La luteinizzazione delle cellule della granulosa
comporta la formazione di elementi cellulari
deputati espressamente alla sintesi del
progesterone.
Effetti degli ormoni sessuali
ANDROGENI
TESTOSTERONE:
è l’androgeno per antonomasia. Nella donna viene prodotto
per il 25% dall’ovaio, per il 25% dal surrene e per il 50%
dalla conversione periferica dell’androstenedione.
Il testosterone come tale è attivo soltanto per la
differenziazione in senso maschile delle vie genitali
nell’organogenesi (differenziazione dei dotti di Wolff).
Per tutte le altre azioni necessita della trasformazione nel
suo metabolita più attivo, il diidrotestosterone (DHT) tramite
la 5α-reduttasi.
ANDROSTENEDIONE:
è prodotto in ugual misura dall’ovaio e dal surrene. A livello
ovarico sembra essere sintetizzato soprattutto a livello
delle cellule tecali, in quanto in menopausa, condizione in
cui prevalgono le cellule stromali rispetto a quelle corticali,
la sua produzione si riduce.
DEIDROEPIANDROSTERONE (DEA)
DEIDROEPIANDROSTERONE SOLFATO (DEAS):
il DEAS è lo steroide maggiormente rappresentato nel
plasma umano ed è prodotto per il 90% dal surrene. Il
principale metabolita del DEA e del DEAS è
l’androstenediolo, che compete con l’estradiolo per il
legame ai recettori estrogenici, per i quali ha spiccata
affinità.
Controllo della funzione riproduttiva
La funzione riproduttiva è condizionata dal
SISTEMA NERVOSO
e
dal
SISTEMA
ENDOCRINO.
Il sistema nervoso opera in tempi ridottissimi
(millisecondi), mentre il sistema endocrino può
impiegare ore, giorni o settimane.
Ciò che colpisce è la modalità con cui
l’organismo mette in contatto due assi
completamente diversi nella loro funzione e nei
loro meccanismi d’azione.
•
•
•
•
Il cardine su cui convergono gli stimoli nervosi è
l’IPOTALAMO, la cui azione consiste nel sintetizzare e
secernere il GnRH (Gonadotropin Releasing Hormone).
La sua peculiarità è quella di operare in modo pulsatile.
Le strutture cerebrali che condizionano l’ipotalamo sono:
sistema limbico: ha azioni di controllo della vita
vegetativa, del comportamento emotivo e dell’affettività.
Tramite ippocampo e amigdala ha rispettivamente effetto
stimolante e inibente la secrezione di GnRH
corteccia cerebrale: integra stimoli visivi, uditivi e tutte le
informazioni provenienti dall’esterno. Agisce tramite
segnali inviati al sistema limbico
epifisi: produce melatonina modulandola in relazione al
ciclo luce-buio. Ha effetto anti-riproduttivo
tronco cerebrale: agisce tramite fasci noradrenergici e
serotoninergici, con effetto sia stimolante che inibente
GnRH
I recettori per il GnRH si trovano in numerosi tessuti, tra cui le
gonadi, la mammella e la placenta, ma soprattutto nelle cellule
gonadotrope dell’ipofisi.
Questi recettori sono soggetti a fenomeni di desensibilizzazione e di
‘down regulation’ quando vengono stimolati per molto tempo. Su
questo fenomeno si basa l’impiego di farmaci agonisti del GnRH allo
scopo di inibire la funzione riproduttiva.
Proprio per evitare il fenomeno della down regulation, il GnRH viene
secreto in modo pulsatile:
durante la fase folicolare iniziale i pulses hanno bassa ampiezza e
frequenza
durante la fase follicolare intermedia e tardiva la frequenza di
scarica aumenta
durante la fase luteinica la frequenza di scarica decresce
A questa pulsatilità corrisponde poi quella della secrezione di FSH e
LH.
Controllo endocrino della funzione
riproduttiva
La secrezione delle gonadotropine è regolata, oltre che
da segnali nervosi, anche da un sistema di feedback, o
retroazione. Si possono distinguere:
feedback ultracorto: il GnRH controlla la sua stessa
sintesi e secrezione
feedback corto: FSH ed LH esercitano un’azione
frenante
la
loro
stessa
secrezione
e
raggiungerebbero l’ipotalamo mediante un flusso
retrogrado attraverso il circolo portale ipofisario
feedback lungo: gli ormoni ovarici regolano la loro
stessa secrezione *
*Le peculiarità del feedback lungo sono date dal fatto
che gli ormoni ovarici sono due (estradiolo e
progesterone) e che l’azione del feedback è duplice: a
livello ipotalamico e ipofisario. Inoltre il feedback può
essere sia negativo che positivo.
il feedbck negativo degli estrogeni è sovrapponibile a
quello di molti altri sistemi (cortisoloACTH, ormoni
tiroideiTSH)
il feedback positivo degli estrogeni è responsabile del
picco di gonadotropine che permette l’ovulazione: è
necessario che le concentrazioni di estradiolo si
mantengano al di sopra di una certa soglia (150-200
pg/l) per un tempo sufficiente (36-48 h) perché il
feedback inverta il suo meccanismo
Controllo ovarico dell’FSH
Sebbene le due gonadotropine (FSH ed LH) siano
controllate dagli stessi fattori endocrini e siano prodotte
dalle stesse cellule ipofisarie, il loro andamento non è
parallelo:
•
•
•
•
•
nel periodo follicolare il rapporto FSH/LH è circa =1
in fase preovulatoria si abbassa
resta <1 nella fase luteinica
il rapporto FSH/LH inoltre è alto prima della pubertà, nel
post-partum, nella disgenesia gonadica e in menopausa
i livelli di LH superano invece quelli dell’FSH in alcune
condizioni, come la PCOS
L’FSH infatti dipende da altri sistemi di controllo, oltre
quelli precedentemente descritti: uno di questi è
l’INIBINA.
L’inibina viene prodotta dalle cellule della granulosa in
risposta all’azione dell’FSH e si accumula nel fluido
follicolare. La sua azione consiste nel blocco selettivo
della secrezione dell’FSH e in un effetto paracrino
sull’ovaio frenando la produzione di estrogeni e
favorendo quella di androgeni.
Altri ormoni deputati alla regolazione dell’FSH sono
l’ACTIVINA, prodotta dalla dimerizzazione delle
molecole di inibina e la FOLLISTATINA, i cui effetti sulla
sintesi e secrezione dell’FSH non sono però conosciuti
nei dettagli.
Ovogenesi
In un ovaio alla nascita vi
sono circa 2 milioni di
ovociti primari, ma molti
regrediscono durante l’
infanzia e in adolescenza
se ne ritrovano non più di
40 mila. Di questi solo
400
circa
diventano
ovociti
secondari
e
vengono
emessi
all’ovulazione nel periodo
fertile.
Maturazione dell’ovocita
Durante il primo periodo della vita fetale, l’ovogonio prolifera per
divisione mitotica.
L’ovogonio si ingrandisce (auxocitosi) per formare l’ovocita
primario prima della nascita; non appena questo si forma, cellule
stromali dell’ovaio lo circondano, costituendo il follicolo primordiale.
N.B. L’auxocitosi negli ovociti è incomparabilmente più pronunciata che
negli spermatociti, ed ha come conseguenza l’enorme
accrescimento della cellula uovo, che può raggiungere dimensioni
gigantesche rispetto alle altre cellule dell’organismo.
Durante l’auxocitosi il nucleo aumenta considerevolmente di
dimensione e i cromosomi si despiralizzano.
Crescita e maturazione del follicolo
Il patrimonio ovocitario e follicolare della donna si forma,
durante la quale gli ovociti si circondano di cellule di
origine mesodermica che costituiscono la granulosa
follicolo primordiale.
Durante la seconda metà della vita intrauterina e per tutto
il periodo pre-puberale un certo numero di follicoli inizia il
processo di crescita con la formazione di due o più strati
di cellule della granulosa follicolo primario.
I cicli maturativi che in tal modo si avviano restano
costantemente incompleti e si concludono invariabilmente
con l’atresia in questo modo il numero di follicoli si
riduce enormemente dalla vita intrauterina alla pubertà.
Nella vita fertile ogni giorno un certo numero di follicoli
inizia a crescere: il primo evento è, come in epoca
prepuberale, la moltiplicazione delle cellule della
granulosa follicolo primario.
A tre cicli di distanza dall’ovulazione si forma la teca
interna follicolo secondario o preantrale.
A due cicli dall’ovulazione, a seguito della coalescenza
di piccole lacune ripiene di liquido sieroso che si
vengono a formare tra le cellule della granulosa si forma
il follicolo terziario o antrale.
Nei primi quattro giorni di ogni ciclo ha luogo il
reclutamento finale, cioè si completa la maturazione di
quei follicoli che hanno raggiunto dimensioni tra i 2 e i 5
mm.
I follicoli reclutati variano da 1 a 5 e si trovano nell’ovaio
controlaterale a quello in cui era presente il corpo luteo
nel ciclo precedente.
Il liquido presente nella cavità follicolare aumenta,
determinando l’espansione dell’antro; inoltre le cellule
della granulosa a ridosso dell’ovocita lo circondano
dando origine al cumulo ooforo follicolo di De Graaf.
Nell’arco dei primi cinque giorni del ciclo un solo follicolo
acquista i caratteri della dominanza.
Selezione del follicolo dominante
Nel pool dei follicoli reclutati all’inizio di ogni ciclo solo
uno compie tutte le tappe dello sviluppo fino
all’ovulazione.
Sul piano endocrino la caratteristica principale del
follicolo dominante è la capacità di concentrare nel suo
fluido FSH ed estradiolo.
La presenza di un elevato rapporto tra estrogeni ed
androgeni è condizione indispensabile per proseguire il
processo maturativo ed evitare l’atresia.
REQUISITI PER LA SELEZIONE DEL FOLLICOLO DOMINANTE:
• diametro 5-8 mm
• teca molto vascolarizzata
• molte cellule della granulosa con aspetto ‘normale’
• capacità di concentrare FSH ed E2 nel liquido follicolare
Controllo ormonale della
follicologenesi
FSH: agisce
granulosa:
essenzialmente
sulle
cellule
differenziazione morfologica delle cellule
induzione recettoriale nei confronti di se stesso e dell’LH
secrezione di peptidi come inibina e fattori di crescita
stimolazione dell’attività aromatasica
LH: agisce soprattutto sul follicolo preovulatorio:
blocco della mitosi
stimolazione della sintesi del progesterone
dissociazione delle gap junctions tra le varie cellule
stimolazione dell’attivatore del plasminogeno
della
ESTRADIOLO: ha effetti potenzianti l’FSH ed antiatresizzanti:
stimolazione delle cellule della granulosa
costituzione dell’antro
espressione dei recettori per le gonadotropine
inibizione della sintesi di androgeni
stimolazione dell’attività aromatasica
ANDROGENI: hanno comportamento diametralmente
opposto a seconda della presenza o meno di FSH:
essenziali alla crescita del follicolo (substrati dell’aromatasi) se è
presente FSH
inducenti atresia in assenza di FSH
GROWTH FACTORS:
insulina: favorisce le attività generali della cellula, stimola la
funzione aromatasica e la sintesi di androgeni, promuove la
sintesi dei recettori nelle cellule della granulosa
insulin-like growth factor (IGF-1): potenzia gli effetti di FSH ed
estradiolo ed ha azioni sovrapponibili a quelle dell’insulina
INIBINA:
inibisce l’aromatasi
stimola la sintesi del progesterone
ATTIVATORI DEL PLASMINOGENO: sono responsabili
della rottura della parete follicolare durante l’ovulazione
Maturazione dell’ovocita
Quando il follicolo matura, l’ovocita primario,
rimasto fino a questo momento quiescente,
aumenta di volume e completa la I divisione
meiotica poco prima dell’ovulazione: l’ovocita
secondario riceve la maggior parte del
citoplasma, ed una parte minima il primo
corpuscolo polare.
Ovogoni
o
Mitosi- prima della nascita
Ovocito I + cell. del tessuto connettivo
(follicolo primordiale)
profase arrestata fino
alla pubertà
Meiosi I- dalla pubertà
Ovocito II + 1 corpuscolo polare
Meiosi II- si arresta in metafase
Cellula uovo + 1 corpuscolo polare
Ovulazione
Le ultime tappe maturative dell’ovocita vengono
stimolate dal picco di LH:
maturazione della zona pellucida
preparazione della reazione corticale (necessaria per
il blocco della polispermia)
ripresa della meiosi: il picco dell’LH induce il
completamento della I divisione meiotica, l’ estrusione
del primo globulo polare e l’ arresto alla metafase
delle II divisione meiotica
Inoltre il picco di LH induce rapido aumento di volume
del follicolo, protrusione del follicolo sulla superficie
ovarica e infine il suo scoppio.
La rottura del follicolo con estrusione dell’ovocita e del
cumulo ooforo sono conseguenti a importanti
modificazioni della struttura follicolare:
1. indebolimento
della
parete
follicolare
con
dissociazione di fibroblasti e delle cellule tecali:
dovuto soprattutto all’azione del plasminogeno
2. dissociazione delle cellule della granulosa e
aumento della pressione colloidosmotica: l’LH
induce lisi delle gap junctions e depolimerizzazione
dei proteoglicani della matrice
3. disgregazione della teca esterna: la degradazione
del collagene avviene per opera delle collagenasi,
attivate dalla plasmina
4. contrazione delle cellule muscolari lisce della teca
esterna
Maturazione dell’ovocita
All’ovulazione il nucleo dell’ovocita secondario
inizia la II divisione meiotica progredendo solo fino
alla metafase
Solo se uno spermatozoo penetra nell’ ovocita
secondario, viene completata la II divisione
meiotica, determinando la formazione dell’
ovocita fecondato o uovo maturo e del II
corpuscolo polare, che andrà a degenerare.
Corpo luteo
Dopo l’ovulazione le cellule della granulosa si ipertrofizzano ed
assumono aspetto vacuolato. Accumulano inoltre nel loro
citoplasma un pigmento giallo ricco di lipidi e di colesterolo.
Il corpo luteo è composto da due tipi cellulari, derivanti dalla
granulosa e dalla teca: le cellule granulosa luteiniche e le cellule
teca luteiniche. Entrambe partecipano all’attività secretiva
dell’estradiolo e soprattutto del progesterone.
Il controllo ormonale del corpo luteo è affidato all’LH e in caso di
gravidanza all’hCG.
La luteolisi avviene in parte per il venir meno della secrezione di LH,
in parte per l’attività di sostanze ad azione luteolitica:
•
•
•
PGF2α: causa perdita dei recettori per l’LH
ossitocina: riduce la sintesi del progesterone
citochine (soprattutto TNFα): bloccano alcuni enzimi responsabili della
sintesi del progesterone
Atresia follicolare
Il destino opposto all’ovulazione è l’atresia follicolare.
Essa è appannaggio dei follicoli che non hanno
caratteristiche di dominanza, e soprattutto che sono
caratterizzati dalla presenza di alte quantità di
androgeni.
Gli androgeni nella loro forma 5 α ridotta (che prevale
nei follicoli non destinati alla dominanza) inducono la
morte delle cellule della granulosa legandosi a recettori
specifici (purchè il follicolo non concentri elevate quantità
di FSH).
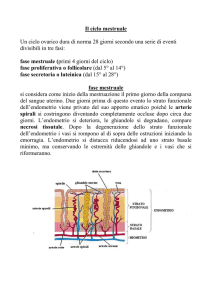
Ciclo mestruale
Per ciclo mestruale si intende il tempo che
intercorre tra il primo giorno di sanguinamento
uterino ed il primo giorno del ciclo successivo.
In condizioni fisiologiche dura 28 giorni.
Nel suo corso si osservano oscillazioni
nell’andamento degli ormoni sessuali, che
consentono di riconoscere fasi diverse del ciclo
ovarico e di quello endometriale.
Ciclo ovarico
E’ suddivisibile in
fase follicolare
fase luteinica
separate da dalla fase ovulatoria.
FASE FOLLICOLARE
iniziale crescita e successiva caduta dell’FSH
(per feedback negativo) e progressivo aumento dell’estradiolo
crescita e maturazione del follicolo ooforo
FASE LUTEINICA
il picco di LH (e di FSH) succede all’acme della
secrezione di estradiolo
FASE OVULATORIA
il corpo luteo produce quantità via via crescenti
di progesterone, i cui livelli poi decrescono progressivamente a
partire dall’8°-9° giorno dall’ovulazione
Ciclo endometriale
L’endometrio è un epitelio costituito da due
diversi strati:
lo strato basale non ormono-sensibile, che
rimane anche dopo lo sfaldamento mestruale
e da cui riparte la proliferazione dello strato
sovrastante
lo strato funzionale, costituito dall’epitelio
superficiale, dalle ghiandole e da un
abbondante tessuto stromale; risente dello
stimolo degli steroidi gonadici
Ciclo endometriale
Il ciclo endometriale si compone di 4 fasi:
1)
2)
3)
4)
fase rigenerativa: nei primissimi giorni del ciclo,
consiste nell’iniziale ma incompleta ricostruzione
dell’epitelio di superficie. Non sembra richiedere
uno stimolo ormonale. Le ghiandole appaiono brevi
e rettilinee
fase proliferativa: si caratterizza per l’aumento di
spessore dell’epitelio, la tortuosità delle ghiandole e
la superficializzazione delle a. spirali; prevale
l’azione degli estrogeni
fase secretiva: le ghiandole appaiono ulteriormente
dilatate ed hanno una forma festonata; prevale
l’azione del progesterone
fase desquamativa: la caduta ormonale provoca la
degenerazione dell’epitelio a partire dalle a. spirali
Nel corso del flusso mestruale si innescano
meccanismi atti a frenarne l’intensità e ad
impedire che si trasformi in una menorragia.
Si formano trombi di piastrine e si accumulano
quantità crescenti di fibrina
Si innesca una vasocostrizione indotta dalla
PGF2α e dal trombossano
La rigenerazione epiteliale è stimolata dagli
estrogeni, che riprendono a salire fin dal primo
giorno della fase desquamativa
Anche la MUCOSA ENDOCERVICALE presenta
variazioni cicliche in risposta alle modificazioni ormonali:
all’inizio della fase estrogenica le ghiandole cervicali
sono modicamente ramificate con un rivestimento
epiteliale basso
più avanti, nella stessa fase, si notano numerose
ramificazioni ghiandolari, l'epitelio di rivestimento si fa
molto alto, con cellule disposte a palizzata; questo
epitelio è ricco di secrezioni di tipo mucoso che si
riversano nel lume ghiandolare
in fase progestinica il lume ghiandolare è più ristretto, si
riducono le ramificazioni delle ghiandole e l'epitelio
mostra una scarsissima secrezione mucosa
Il muco cervicale svolge una duplice funzione,
perché da un lato ha il compito di rappresentare
una ‘barriera biologica’ tra cavità uterina ed
ambiente esterno, ma dall'altro ha quello di
favorire il passaggio degli spermatozoi, e anzi di
proteggerli dalle secrezioni vaginali acide.
Durante la prima fase del ciclo, con l'aumentare dei
tassi di estrogeni circolanti, la produzione giornaliera
di muco cervicale aumenta notevolmente
Durante la fase luteale, sotto l'azione
del
progesterone, il muco cervicale perde tutte le qualità
acquisite durante la stimolazione estrogenica: diviene
scarso, viscoso, opaco e inadatto al passaggio degli
spermatozoi
Le modificazioni ormonali inducono effetti anche a livello
del MIOMETRIO:
durante il periodo follicolare gli estrogeni aumentano
le capacità contrattili del miometrio e inducono
l’espressione dei recettori per l’ossitocina
durante il periodo luteinico il progesterone al contrario
ne riduce il tono basale
l’attività contrattile miometriale risale nel corso della
mestruazione, potendo raggiungere livelli tali da
provocare dolore (dismenorrea)
Allo stesso modo le TUBE sono influenzate dallo stimolo ormonale:
gli estrogeni promuovono lo sviluppo dell’epitelio tubarico che da
piatto diventa alto e spesso. Le ciglia vibratili si allungano ed
iniziano a muoversi in modo sincrono, la muscolatura comincia a
contrarsi
nella fase luteinica aumenta l’attività secretiva (muco), le cellule
ridiventano piatte e l’attività contrattile si attenua.
Nella GHIANDOLA MAMMARIA gli estrogeni determinano la
proliferazione dell’epitelio duttale. Il progesterone potenzia
l’attività proliferativa degli estrogeni, inoltre favorisce la
differenziazione degli acini, induce l’acquisizione di uno stato
secretivo e rende edematoso e lasso il tessuto connetivo.
Parametri del ciclo mestruale
I parametri che concorrono a stabilire se il ciclo
mestruale è fisiologico o patologico sono:
la durata (cioè il tempo che intercorre tra
due cicli successivi)
l’ intensità
il prolungarsi del flusso
DURATA:
si intende come fisiologica una lunghezza di 28 giorni
con variazioni in difetto non superiori a 4 ed in eccesso
non maggiori di 7.
Se l’intervallo tra i cicli è inferiore a 25 giorni si parla di
polimenorrea;
quando le mestruazioni si distanziano per più di 35 giorni
si parla di oligomenorrea.
Per amenorrea si intende l’assenza completa del flusso
mestruale.
In genere la polimenorrea e l’oligomenorrea dipendono
da anticipo o ritardo dell’ovulazione; nel caso
dell’amenorrea, dalla sua assenza.
INTENSITA’ e DURATA DEL FLUSSO:
il flusso mestruale normale in genere dura 3-7 giorni con
perdita di una quantità di sangue tra 30 e 80 ml.
Si parla di ipomenorrea se i flussi sono < 20 ml o < 3
giorni;
si parla di ipermenorrea se i flussi sono > 80 ml o > 7
giorni.
Per menorragia si intende un episodio mestruale più
intenso del normale;
per menometrorragia una perdita abbondante, iniziata
come mestruazione ma estendentesi al periodo
intermestruale;
per metrorragia una perdita ematica uterina avvenuta al
di fuori del ciclo mestruale.
Anomalie del
ciclo mestruale
Sanguinamenti uterini anomali
Con questo termine si possono intendere sia le
anomalie per eccesso della mestruazione
(ipermenorrea, polimenorrea e menorragia) sia
le perdite ematiche intermestruali (metrorragie).
Dal punto di vista clinico è di fondamentale
importanza distinguere le anomalie funzionali
(per lo più ormonali) da quelle su base organica
(che richiedono per lo più un trattamento
chirugico).
Classificazione dei sanguinamenti
uterini anomali
Cause organiche:
• endometriti
• polipi endometriali
• leiomiomi
• endometriosi
• iperplasia endometriale
• neoplasie uterine o
ovariche
• condizioni legate alla
gravidanza
• infezioni
Cause funzionali:
• patologia endocrina
dell’asse ipotalamo-ipofisiovaio
• terapie ormonali
• disturbi della coagulazione
… nella pubertà e adolescenza
In questa fascia d’età la principale
sanguinamento anomalo è l’anovulatorietà.
causa
di
In particolare, nell’adolescente è deficitario il
meccanismo di feedback positivo degli estrogeni, cui
consegue una fase follicolare prolungata ed
eventualmente il mancato prodursi dell’ovulazione.
Le fluttuazioni rapide e casuali dei livelli estrogenici
provocano una stimolazione anomala dell’endometrio
con sfaldamenti da rottura (eccesso di estrogeni) o da
privazione (difetto di estrogeni).
… nell’età fertile e in pre-menopausa
Nelle donne in età premenopausale si producono
alterazioni endocrine che riflettono il progressivo
esaurimento follicolare. Le stesse anomalie ormonali si
rendono responsabili di metrorragie in età fertile,
sebbene compaiano in modo molto più sporadico.
Il primo difetto in ordine di tempo è l’insufficiente
secrezione di inibina, che comporta l’innalzamento dei
livelli di FSH, il cui pattern secretivo assume un
andamento tonico.
Questo comporta anticipazione del reclutamento
follicolare e del picco di LH, con ovulazione precoce.
Spesso il corpo luteo è insufficiente, per cui si verifica
anche un accorciamento del periodo post-ovulatorio, che
contribuisce così alla polimenorrea.
Successivamente si ha irregolarità nella secrezione di
estradiolo: l’FSH elevato induce livelli estrogenici basali
elevati e ciclici bassi.
I follicoli diventano meno efficienti nel rispondere all’LH;
inoltre anche l’LH mostra livelli tonicamente aumentati,
per cui non si verifica il picco di metà ciclo.
La mancata formazione del corpo luteo accresce
l’iperestrogenismo relativo, con comparsa di metrorragie
da ‘rottura’.
Amenorrea
E’ la mancanza totale del flusso mestruale.
Essa è fisiologica:
in gravidanza
nell’età prepuberale
in post-menopausa
Si differenziano:
amenorrea
primaria:
mancata
comparsa
delle
mestruazioni entro i 14 o i 16 anni (in assenza o in
presenza dei caratteri sessuali secondari)
amenorrea secondaria: scomparsa delle mestruazioni in
una donna con precedente menarca
Cause di amenorrea
Ambiente
SNC
4° Compartimento
Nucleo arcuato
3° Compartimento
FSH
2° Compartimento
1° Compartimento
estrogeni
Ipofisi
Ovaie
LH
progesterone
Utero
Mestruazioni
Classificazione eziologica delle amenorree
IPOTALAMICHE
PRIMARIE
- idiopatiche:
difetto dei neuroni GnRH-secernenti
difetto del GnRH pulse generator
SECONDARIE
- funzionali:
anoressia nervosa
da perdita di peso
da stress
delle altlete
postpillola
organiche:
processi espansivi
processi infiammatori
traumi
-
organiche:
processi espansivi
processi infiammatori
traumi
-
Classificazione eziologica delle amenorree
IPOFISARIE
- forme non neoplastiche:
sdr. della sella vuota
iperprl funzionali
sdr. di Sheehan
sdr. di Lawrence-Moon-Biedl
sdr. di Prader-Willi
talassemia major
gomme luetiche
tubercolomi
aneurismi
-
forme neoplastiche:
tumori ipotalamici comprimenti il
peduncolo ipofisario
tumori ipofisari secernenti
Classificazione eziologica delle amenorree (
OVARICHE
- PRIMARIE
sdr. di Turner
disgenesia gonadica
sdr. dell’ovaio resistente (sdr. di
Savage)
DA ANOMALIE DELLE VIE DI
DEFLUSSO
- CONGENITE
agenesia dei dotti di Muller
anomalie ostruttive segmentarie
-
SECONDARIE
menopausa precoce
-
ACQUISITE
sinechie (sdr. di Asherman)
Diagnosi
In primo luogo anamnesi ed esame obiettivo.
Successivamente test dinamico con progestinico:
MAP-test
positivo
negativo
ANOVULARIETA’
Test con EP
(eco TV, dosaggi
ormonali)
negativo
PATOLOGIA UTERINA
(isteroscopia,
isterosalpingografia)
positivo
dosaggio PRL
IPERPRL
(RM encefalo,
dosaggio TSH)
dosaggio FSH ed LH
Gn alte:
PATOL.
OVARICA
Gn basse:
PATOL.
IPOT-IPOF.
Terapia
E’ molto variabile a seconda della patologia che ne è la
causa.
- nei casi di disgenesia gonadica o di menopausa
precoce: terapia ormonale sostitutiva
negli
ipogonadismi
ipogonadotropi:
terapia
estroprogestinica (se non è richiesta una gravidanza),
somministrazione pulsatile di GnRH o gonadotropine
(qualora si ricerchi una gravidanza)
nelle
iperPRL:
trattamento
chirurgico
o
farmacologico
- nelle anomalie delle vie di deflusso: metro- e
colpoplastica
1° COMPARTIMENTO
1- Sindrome di Asherman
2- Anomalie Mülleriane
- imene imperforato
- obliterazione orifizio vaginale
- discontinutà canale vaginale
- assenza del collo o dell’utero
- assenza di cavità uterina
- assenza di endometrio
3- Agenesie Mülleriane
- sindrome di Rokitansky (vagina assente o rudimentale)
SINDROME DI ASHERMAN
CLINICA: Sinechie intra-uterine conseguenti a:
RCU
Endometriti
TC
Miomectomia
Metroplastica
TBC endometriale
DIAGNOSI: HSC
TERAPIA: lisi delle aderenze
SINDROME DI ROKITANSKY
•
Genitali esterni normali
•
Vagina assente o rudimentale
•
Utero ipoplasico o normale non comunicante con l’ostio
•
Funzione ovarica normale
•
Crescita e sviluppo regolari
TERAPIA:
•
Colpoplastica con innesti di tessuto cutaneo
•
Dilatatori vaginali progressivi
•
Intervento di Vecchietti
2° COMPARTIMENTO
1- Sindrome di Turner e mosaicismi
2- Sindromi da inadeguata virilizzazione
3- Sindrome di Swyer
4- Agenesia gonadica
5- Sindrome dell’ovaio resistente
6- Menopausa precoce
7- Policistosi ovarica
SINDROME DI
TURNER
Frank H. Netter, M.D.
The CIBA collection of medical
illustrations
SINDROME DI TURNER
• Cariotipo 45 XO o mosaicismi
• Bassa statura, pterigium colli, torace carenato,
mani tozze,valgismo degli arti superiori …
• Altre anomalie associate: coartazione aortica, rene
a ferro di cavallo …
• Infantilismo sessuale ed amenorrea primaria
• Genitali esterni normali, vagina ipoplasica, utero
ipoplasico e tube normali
• Gonadi a cordoncino fibroso “streack”
•
FSH e LH
Estrogeni e Progesterone
INADEGUATA VIRILIZZAZIONE
1. Alterazioni dello sviluppo gonadico
• Difetto gonadico primario
• Difetto del cromosoma X
2. Alterazioni di endocrinologia fetale
• Difetto dell’ormone antimülleriano
• Difetti enzimatici
• Difetti della biosintesi del testosterone
• Sindromi da insensibilità agli androgeni (MORRIS)
SINDROME DI
MORRIS
Frank H. Netter, M.D.
The CIBA collection of
medical illustrations
SINDROME DI MORRIS
CLINICA
•Cariotipo XY
•Anomalia a carico dei recettori degli androgeni che
causa una insensibilità recettoriale
•Trasmissione con gene recessivo legato al cromosoma X
•Soggetto fenotipicamente femminile
•Presenza di testicoli in genere ritenuti
•Forme complete (CAIS) ed incomplete (PAIS)
SVILUPPO COMPORTAMENTALE
• Le pazienti vengono allevate come femmine
• Il ruolo sociale e l’identità sono femminili
• L’orientamento sessuale è eterosessuale
• Difficoltà alla pubertà ad accettare l’amenorrea,
l’assenza di peli pubici ed ascellari, la necessità di
asportare le gonadi e di dover ricorrere all’uso di
dilatatori vaginali
Sindrome di Morris
TERAPIA
• Gonadectomia bilaterale dopo la pubertà
• Terapia ormonale sostitutiva estrogenica o
estroprogestinica
• Correzione della vagina mediante
l’impiego di dilatatori progressivi o
chirurgia plastica all’inizio del risveglio
sessuale
• Psicoterapia
Sindrome di Morris
SINDROME DI SWYER
CLINICA
• Pseudoermafroditismo maschile (disgenesia
gonadica XY)
• Genitali esterni normali, vagina a fondo
cieco, utero e tube assenti
• Gonadi a cordoncino fibroso (streak)
TERAPIA:
Vedi Morris
SINDROME DELL’OVAIO RESISTENTE
CLINICA
• FSH e LH elevati
• Ipoestrogenismo marcato
ETIOPATOGENESI: anticorpi antirecettori
ovarici per le gonadotropine?
ISTOLOGIA: follicoli primordiali in numero
normale ma senza ulteriore sviluppo
MENOPAUSA PRECOCE
CLINICA
Menopausa prima dei 35 – 40 anni
ETIOPATOGENESI:
• Disordine genetico
• Agenti virali, chimici o fisici
• Autoimmune
ISTOLOGIA: presenza di corpi albicanti ed
assenza di follicoli residui
POLICISTOSI OVARICA
Anovulatorietà persistente
LH
Testosterone
Androstenedione
PATOGENESI
DHA e DHEAS
17-OH Progesterone
E1 e E2 libero
SHBG
E2 coniugato e FSH
CARATTERISTICHE
Policistosi ovarica
Area superficiale raddoppiata e aumento di
volume di 2,8 volte
Stesso numero di follicoli primordiali, doppio
numero di follicoli atresici e da 20 a 100
follicoli cistici
Spessore della tunica aumentato del 50%
Stroma corticale aumentato di 1/3 e subcorticale di 5 volte
Nidi cellulari dell’ilo ovarico quadruplicati
Ovaio
policistic
o
LH
Androstenedione
Estrone
STEROIDOGENESI
Atresia
Testosterone
SHBG
Estradiolo
libero
Testosterone
libero
Policistosi
ovarica
Ciclo normale
LH
FSH
E2
P
Ovaio policistico
CONSEGUENZE
DELL’ANOVULAZIONE
PERSISTENTE
Sterilità
Alterazioni mestruali
Acne ed irsutismo
Aumentato rischio di Ca endometriale e
mammario
Aumentato rischio cardiovascolare
Aumentato rischio di diabete in pazienti con
iperinsulinemia
3° COMPARTIMENTO
1- Adenomi di varia natura
2- Adenomi prolattino-secernenti
3- Sindrome della sella vuota:
Incompleto diaframma sellare con prolasso
dello spazio subaracnoideo nella fossa
ipofisaria
GALATTORREA
Pillola: inibizione ipotalamica, PIF
Suzione prolungata: inibizione ipotalamica, PIF
Toracotomia, Herpes zoster, lesioni spinali:
attivazione neuroni dell’arco afferente
Farmaci. Diazepam, antidepressivi, anfetamine,
oppiacei: blocco recettori dopaminergici PIF
Stress: inibizione del PIF
Lesioni ipotalamiche e tumori ipofisari: Riduzione
del PIF
Ipotiroidismo: eccesso di TRH simile al PRF
Inanition-refeeding syndrome
4° COMPARTIMENTO
1- Amenorrea ipotalamica: stress
2- Anoressia
3- Amenorrea e sport
4- Sindrome di Kallmann: amenorrea e
anosmia
5- Amenorrea post-pillola
ANORESSIA NERVOSA
Frank H. Netter, M.D.
The CIBA collection of medical
illustrations
ANORESSIA NERVOSA
CLINICA
Insorgenza tra i 10 e i 30 anni
Perdita di peso dal 25% in giù
Atteggiamenti particolari
- rifiuto
- distorta immagine corporea
- insolito modo di accaparrarsi il cibo
Amenorrea
INCIDENZA CAUSE DI AMENORREA
Compartimento I
- Sindrome di Asherman
7%
Compartimento II
- Cromosomi anormali
- Cromosomi normali
0,5 %
10 %
Compartimento III
-Adenomi prolattinosecernenti
7,5 %
Compartimento IV
-Anovulazione
-Perdita di peso, anoressia
-Soppressione ipotalamica
-Ipotiroidismo
28 %
10 %
10 %
1 %