Scuola di specializzazione in Beni Culturali
2012
Prof. Marina Brustolon
Introduzione ai metodi spettroscopici
per i Beni Culturali
Riassunto
• Cos’è uno spettroscopio ?
• L’informazione di base per poter comprendere un
esperimento spettroscopico:
– La radiazione = onda elettromagnetica e fotoni
– La materia = l’energia è quantizzata, il concetto di
quanto
– L’interazione tra radiazione e materia
• Vari tipi di spettroscopie
• Le particolarità dell’applicazione ai Beni Culturali
Alcuni concetti importanti sulle
radiazioni elettromagnetiche
• Se un raggio contiene una radiazione con una singola
lunghezza d’onda, si dice che è monocromatico, se
contiene radiazione con più lunghezze d’onda si dice
policromatico.
• La luce bianca è policromatica, contiene radiazioni con
diverse lunghezze d’onda.
• Un modo per separare le componenti monocromatiche
della luce è usare la rifrazione. La rifrazione fa sì che
un raggio che passa da un mezzo ad un altro cambi la sua
direzione. Le direzioni prese da raggi di diversa
lunghezza d’onda sono diverse.
Riflessione e rifrazione
q
Riflessione: angolo
di incidenza e
angolo di
riflessione sono
eguali
q
n1
Rifrazione:
sin( q ' ) sin( q ) n1 n2
q’
n2
n1 , n2
indici di rifrazione, che
dipendono dalla lunghezza
d’onda
La dispersione
La luce bianca come quella emessa dal sole sappiamo che è l’insieme di
radiazioni monocromatiche a diversa lunghezza d’onda.
Se la facciamo passare attraverso un prisma, dal momento che la
rifrazione dipende dalla lunghezza d’onda possiamo separarne le
componenti di diversa lunghezza d’onda:
, angolo di deviazione, dipende dalla l
Dispersione
L’occhio ci dice se una componente
della luce bianca è stata assorbita
• Nella percezione del colore il nostro
occhio funziona come uno spettroscopio.
• Il colore di un oggetto illuminato da luce
bianca ci dice quali componenti
monocromatiche sono state assorbite.
Due modi di vedere il colore di una sostanza
Luce trasmessa
Una parte della luce bianca
viene assorbita, il raggio che
colpisce la retina appare
colorato
Una parte della luce bianca viene
assorbita dalla superficie, la parte
riflessa appare colorata
Luce riflessa
In entrambi i casi la luce bianca (policromatica) ha perso delle
componenti che sono state assorbite dalla materia, e le
componenti residue ci appaiono come colorate.
Lo “spettroscopio umano”
• Il nostro spettroscopio incorporato è l’occhio.
• Il “colore” di un raggio di luce o di un oggetto ci dice
di quali radiazioni potrebbe essere composto il raggio
di luce che colpisce la nostra retina.
• Ma il colore non basta, l’informazione che dà il colore
è ambigua (radiazioni policromatiche diverse possono
dare la stessa sensazione di colore).
• Se vogliamo avere un’informazione sicura delle
radiazioni contenute del nostro raggio di luce, bisogna
usare uno spettroscopio (non umano!).
• Così pure se vogliamo sapere quali radiazioni non
visibili (infrarosse, ultraviolette) sono state
assorbite, l’occhio non ce lo sa dire perché non le
vede.
Cosa bisogna sapere per lo studio
delle spettroscopie?
• Cos’è la radiazione elettromagnetica
• Quali sono i parametri per distinguere le
diverse radiazioni
• Quali sono le proprietà della materia
importanti per l’interazione con la radiazione
• Quali sono le leggi che regolano l’interazione
tra materia e radiazione.
Qualche altra nozione sulle onde
elettromagnetiche
Parametri per caratterizzare un’onda
elettromagnetica, oltre alla lunghezza d’onda:
• La frequenza : numero di creste dell’onda per secondo.
Si esprime in Hertz (Hz), o multipli.
MHz = megahertz = 1 milione di Hz
kHz = kilohertz = 1000 Hz
• Il numero d’onda: inverso della lunghezza d’onda. Si
esprime in cm-1.
Un parametro per
caratterizzare le zone
spettrali è la
frequenza
Un altro parametro
per caratterizzare le
zone spettrali è la
lunghezza d’onda.
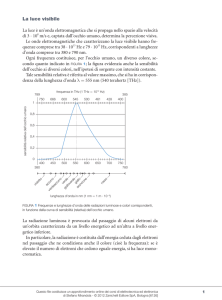
La selezione naturale ci ha dotato di uno spettroscopio
incorporato, che è l’occhio, sensibile a una zona molto
ristretta dello spettro, quella della radiazione visibile.
Parametri per caratterizzare un’onda
elettromagnetica
• La lunghezza d’onda : distanza tra due creste dell’onda,
espressa in metri, o sottomultipli del metro:
nm = nanometro = 10-9 m
m = micrometro = 10-6 m
l
• La frequenza : numero di creste dell’onda per secondo.
Si esprime in Hertz (Hz), o multipli.
MHz = megahertz = 106 Hz
kHz = kilohertz = 103 Hz
• Il numero d’onda: inverso della lunghezza d’onda. Si
esprime in cm-1.
Onde elettromagnetiche e fotoni
• Abbiamo descritto la luce come un’onda
elettromagnetica. Questo modello va bene per
spiegare alcuni comportamenti della luce (per
esempio la diffrazione).
• La luce (e quindi qualunque radiazione
elettromagnetica) trasporta energia e la
trasmette alla materia. Per descrivere questa
trasmissione dobbiamo introdurre un concetto
nuovo, apparentemente in contrasto con la
descrizione dell’onda = il concetto di fotone
I fotoni
I fotoni sono pacchetti di energia
indivisibili. Lo scambio di energia tra
materia e radiazione elettromagnetica
può avvenire solo per numeri interi di
quanti di energia h.
Nota: h è detta “costante di Planck”
Con che modello rappresentare
la luce?
Fino al ‘900 il comportamento della luce
era spiegato con l’ottica classica.
Esperimenti dell’inizio del ‘900 hanno
mostrato che l’ottica classica non spiega
come la luce trasmette energia alla materia.
Bisogna introdurre una nuova teoria, l’ottica
quantistica. Secondo questa teoria la luce è
fatta di particelle di energia che si chiamano
FOTONI
Spettroscopie
• Le spettroscopie permettono di studiare
scientificamente l’interazione delle
radiazioni elettromagnetiche con la
materia. La radiazione più studiata per i
Beni Culturali è la radiazione nel visibile
(la luce). Ma importanti informazioni si
possono ottenere anche studiando
l’interazione con la materia dei raggi
infrarossi e dei raggi ultravioletti.
Radiazione e materia
Per capire come funzionano le spettroscopie
dobbiamo aver un modello per il comportamento
della radiazione elettromagnetica, e uno per le
proprietà dei materiali.
Le proprietà della materia si spiegano basandosi su
pochi e semplici risultati della fisica quantistica,
tra i quali il fondamentale è:
Gli stati stabili degli atomi e delle molecole hanno
energie definite e determinate, dovute sia al
moto degli elettroni che al moto dei nuclei.
Con che modello rappresentare
la materia?
Fino al ‘900 il comportamento della
materia era spiegato con la
meccanica classica.
Esperimenti dell’inizio del ‘900 hanno
indotto a formulare una nuova teoria,
la meccanica quantistica.
Onde e particelle
Il risultato sorprendente delle
teorie quantistiche è che:
la luce si comporta anche come se
fosse composta da “particelle”, i
fotoni
le particelle elementari della materia
(elettroni, protoni, ecc.) si
comportano anche da “onde”
I moti dei corpi di dimensioni
ordinarie
La caratteristica del moto dei corpi di dimensioni
ordinarie è che possono avere qualsiasi velocità, e quindi
qualsiasi energia.
Energia 1
Energia 2
Ma potrebbero
esserci energie
intermedie
Energia 3
Ma potrebbero
esserci energie
intermedie
Energia della
pallina
rotante
Qualunque
energia è
permessa!
Energia 3
Energia 2
Energia 1
I moti delle particelle come
elettroni e nuclei
La caratteristica del moto dei corpi di dimensioni molto
piccole è che non possono avere qualsiasi velocità, e
quindi qualsiasi energia, ma solo energie quantizzate,
che dipendono dal tipo di moto. Per esempio, una
molecola che ruota in un gas può avere solo livelli
energetici come in figura.
Energia
Schema generale di un evento
spettroscopico
Un sistema si trova in uno stato ad energia E1.
Può passare ad un altro stato ad energia E2
assorbendo un fotone con una frequenza e
quindi un’energia h eguale alla differenza di
energia tra i due stati:
E = h
h
E2
E1
I moti delle particelle e le energie
h
E2
E1
Questo è uno schema generale, la distanza in energia tra i due stati è
molto diversa a seconda del moto che stiamo considerando.
Prima di tutto dobbiamo distinguere tra il moto dei nuclei e quello
degli elettroni. Gli elettroni sono molto più veloci dei nuclei, e la loro
energia è molto maggiore. Quindi anche la distanza in energia tra due
livelli sarà molto più grande.
E = h
I fotoni che fanno avvenire transizioni tra i
livelli di energia degli elettroni hanno
frequenze cha vanno dalla zona del visibile
all’ultravioletto.
Zona interessata agli
assorbimenti
elettronici
Moti dei nuclei
I moti dei nuclei coinvolgono energie minori di quelle
del moto degli elettroni:
Moti di vibrazione
Moti di rotazione
Zona interessata agli
assorbimenti
vibrazionali
Zona interessata agli
assorbimenti
rotazionali
I metodi spettroscopici sono metodi di indagine
chimico-fisica usati in molte applicazioni.
Le spettroscopie possono venir usate a scopo
analitico: quali sostanze pure compongono un
materiale?
L’uso analitico interessa tutti i campi: chimica,
fisica, scienza dei materiali, studi ambientali,
astrofisica, e beni culturali.
Le informazioni fornite dai metodi
spettroscopici sono però molte altre, di
interesse specifico per ogni campo di studio.
Informazioni che le spettroscopie possono
fornire per i beni culturali:
I beni culturali sono composti di materiali: quindi scienza
dei materiali e studio scientifico dei beni culturali sono
campi di attività che hanno in comune molti metodi.
Quello che distingue l’applicazione ai beni culturali è lo
scopo dell’indagine.
Beni culturali: cosa si vuol capire?
a. Composizione dei materiali
b. Stato di conservazione
c. Provenienza geografica dei materiali
d. Tecniche di produzione
e. Datazione
Condizioni poste ai metodi di indagine
spettroscopica nel campo dei beni
culturali:
a. Quantità molto piccola (o nulla) di materiale usato
(tecniche microdistruttive o non distruttive)
b. Indagini microscopiche
c. Indagini di superficie
d. Portabilità
e. Metodi statistici per l’uso di database.