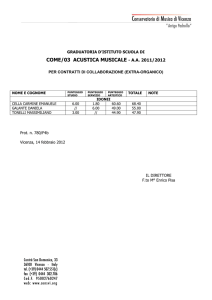
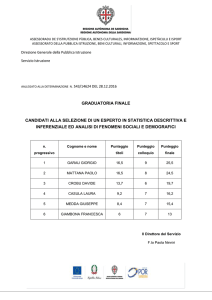
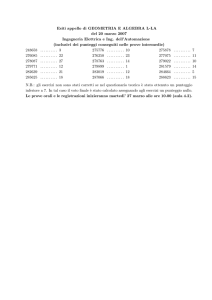
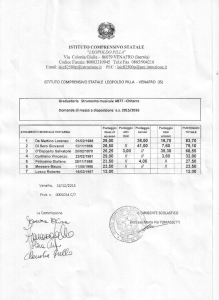
Didattica della Fisica
TERMODINAMICA
Progettazione della verifica relativa all’UD 1: Fenomeni Termici
1. Introduzione
La verifica che viene proposta è stata pensata in relazione ai contenuti di un modulo di
termodinamica, facente parte della programmazione didattica annuale di un corso di fisica
per le classi quarta PNI e Brocca, indirizzo Scientifico e Scientifico Tecnologico. Per questo
occorre innanzitutto introdurre il contesto nel quale la prova si inserisce.
2. Struttura del modulo
Si è ipotizzato di dividere il programma annuale della classe quarta in tre moduli
sequenziali.
Il monte ore annuale (132 ore) è ripartito sui moduli previsti. Ciascun modulo
comprende oltre all'attività didattica due verifiche formative (una per ogni UD), al termine
delle quali segue una verifica sommativa.
Al termine del modulo, se necessaria in base ai risultati della verifica, viene svolta
l'attività di recupero. In ultimo segue la verifica orale finale sui contenuti specifici del
modulo.
I tre moduli previsti sono:
-Termodinamica;
-Conduttori e circuiti;
-Elettromagnetismo.
Qui prenderemo in esame solo il modulo Termodinamica con lo scopo di creare il
contesto sul quale procedere a titolo esemplificativo alla verifica della prima unità didattica.
2.1 Contenuti generali del modulo suddivisi in unità didattiche e temi.
UD_1: Fenomeni termici
-La pressione
-La temperatura
-L'energia interna
-Passaggi di stato
-La conservazione dell'energia
-Trasformazioni reversibili e irreversibili
UD_2: Processi energetici
-Macchine termiche
-Il ciclo di Carnot
-L'entropia
-Il secondo principio
-L'etropia secondo Boltzmann
-Nascita ed evoluzione di una stella
Attività di laboratorio praticabili:
Gas:
- dipendenza pressione-temperatura;
- indipendenza temperatura-volume (esperienza di Jaule)
- dipendenza pressione-volume (legge di Boyle)
- legge di Pascal
- leggi di Gay - Lussac
- Misurazione della costante R dei gas
2
Termometria:
- misurazione della dilatazione linerare dei metalli mediante il dilatometro
- realizzazione di un termometro ad alcool
- costruzione di un termometro a gas (volume costante)
Energia:
- misurazione del calore latente di fusione - evaporazione
- realizzazione di un ciclo mediante trasformazioni reversibili
- uso del calorimetro
Tempo previsto per lo svolgimento del modulo 40 ore, comprensive di alcune attività di
laboratorio, del recupero e delle verifiche.
2.2 Obiettivi specifici in riferimento al modulo
Alla fine del modulo specifico, l'alunno dovrà:
1) individuare i nodi concettuali delle tematiche trattate schematizzandoli in
mappe;
2) riconoscere e utilizzare una terminologia e un linguaggio specifico;
3) progettare ed eseguire semplici esperimenti;
4) ricavare la dipendenza di un fenomeno da osservabili fisiche;
5) conoscere la dipendenza/indipendenza di variabili fisiche;
6) dedurre dalla legge teorica generale i casi particolari;
7) collocare cronologicamente le conoscenze fisiche;
8) operare su semplici modelli con metodi e strumenti matematici opportuni.
2.3 Obiettivi specifici in riferimento all'unità didattica che sarà oggetto di verifica (UD_1)
Alla fine dell'unità didattica l'alunno dovrà, limitatamente agli argomenti trattati:
2a) riconoscere e utilizzare una terminologia specifica1;
4) ricavare la dipendenza di un fenomeno da osservabili fisiche;
5) conoscere la dipendenza/indipendenza di variabili fisiche;
6) dedurre dalla legge teorica generale i casi particolari;
7) operare su semplici modelli con metodi e strumenti matematici opportuni.
3. Griglia di valutazione in base agli obiettivi specifici
La griglia deve consentire la valutazione dell'apprendimento mediante l'attribuzione di un
punteggio ripartito in base agli obiettivi descritti al paragrafo 2.3. La scala di valutazione adottata
è quella consueta che ha punteggio P compreso nell'intervallo [1 , 10].
Per raggiungere la vautazione oggettiva si individuano i seguenti indicatori:
P1- correttezza e proprietà terminologica (per quesiti con numero di righe predeterminato) in
riferimento all'obiettivo 2a;
P2- correttezza metodologica e numerico-formale (per problemi) in riferimento agli obiettivi 6 - 7.
P3- punteggio realizzato nelle prove strutturate in riferimento agli obiettivi 4 - 5.
Ogni indicatore può assumere un punteggio intero compreso nell'intervallo [3,33] (vedi Tab. 1)
. Il punteggio complessivo P, dal quale si ottiene la valutazione finale, è ottenuto sommando 1 ai
punteggi dei tre indicatori: P = P1 +P2 +P3 +1 (vedi Tab. 2).
Livello
grav. insuf.
insufficiente
sufficiente
1Il
Tabella 1
Banda
P1
3 - 13
14 - 18
19 - 22
P2
P3
presente obiettivo rappresenta un primo livello rispetto al raggiungimento dell'obiettivo (2). Infatti solo al
termine delle unità didattiche programmate e comunque dopo un adeguata rimeditazione da parte dell'alunno
degli argomenti oggetto di studio, potrà essere possibile da parte del docente valutare con una verifica orale il
grado di assimilazione del linguaggio specifico.
3
discreto
buono
ottimo
eccellente
23 - 25
26 - 28
29 - 31
32 - 33
P
Tabella 2
Livello
P
grav. insuf.
10 - 40
insufficiente
41 - 55
56 - 67
sufficiente2
discreto
68 - 76
buono
77 - 85
ottimo
86 - 94
eccellente
95 - 100
Valutazione finale in decimi: V
P
.
10
La tabella 1 consente di stabilire il livello di preparazione raggiunto e le eventuali carenze in
riferimento agli indicatori per ciascuna delle tre aree testate; ciò può agevolare recuperi in itinere
mirati al singolo alunno. La tabella 2 individua il livello di apprendimento globale.
4. Scelte, prove e punteggi
Per questa verifica si sono scelte prove con le seguenti tipologie:
a) proposta chiusa e risposta aperta in riferimento agli indicatori P1 e P2; punti 60:
- si propone di descrivere un fenomeno o trattare sinteticamente una legge fisica;
- si propone di rispondere a brevi quesiti per i quali è necessario l'uso di modelli;
b) proposta chiusa e risposta chiusa/semichiusa in riferimento all'indicatore P3; punti 30:
- domande Vero/Falso;
- domande a scelta multipla con più risposte esatte;
- analisi di dipendenze tra varaibili fisiche.
I punteggi vengono assegnati in base alla complessità dei quesiti e comunque nei limiti del
punteggio massimo stabilito.
4.1 Quesiti proponibili per la tipologia (a)
Proposta: tema 1
- Attraverso un rubinetto aperto N molecole passano da un contenitore isolato, inizialmente a
temperatura uniforme, ad un contenitore vuoto a contatto con l'ambiente esterno. Si descriva il
processo che inizia con l'ingresso delle molecole e termina con la condizione di equilibrio del gas
con l'ambiente.
Risposta: le molecole hanno inizialmente tutte la stessa energia media in quanto si trovano in
mutuo equilibrio termico nel primo contenitore. Aperto il rubinetto, man mano che le molecole
effondono nel secondo contenitore a contatto con l'ambiente esterno, tendono a diffondersi in tutto
il contenitore occupando tutto lo spazio disponibile. La diffusione avviene da zone di maggior
concentrazione (densità numerica) a zone di minor concentrazione. L'urto con le pareti consente
loro di assorbire/cedere energia dall'/all'ambiente. Quando il gas nei due contenitori ha raggiunto
uguale pressione, tutto il gas tenderà all'equilibrio termico con l'ambiente esterno in un tempo che
viene definito di rilassamento termico del sistema.
Punteggo massimo P1 + P2 = 16 +16. Tempo 25 minuti.
Proposta: tema 2
2La
sufficienza è raggiunta quando il punteggio complessivo indica il raggiungimento degli obiettivi minimi
connessi ai singoli indicatori utilizzati.
4
- Uguali quantità di uno stesso gas monoatomico, vengono riscaldate rispettivamente a volume e a
pressione costante mediante una stessa sorgente. Durante la trasformazione i gas passano dalla
temperatura ambiente alle temperature finali T e T'. Descrivi le trasformazioni tenendo presente i
seguenti aspetti: il comportamento delle molecole; le variabili di stato; la quantità di calore
necessaria; il tempo necessario.
Risposta: il riscaldamento di uguali quantità di gas in condizioni di pressione e volume costante
comporta a parità di calore assorbito una differente pressione e temperatura finale. Nel caso di
riscaldamento a volume costante, tutta l'energia assorbita sotto forma di calore dalla sorgente
contribuisce ad aumentare l'energia cinetica delle molecole, ovvero l'energia interna. Pressione e
temperatura aumenteranno proporzionalmente all'energia interna. Nel caso di riscaldamento in
condizioni di pressione costante, il gas compie un lavoro di espansione sull'ambiente, necessario a
mantenere costante la pressione. L'espansione trasforma parte del calore assorbito dal gas in
lavoro meccanico, riducendo l'energia disponibile per l'aumento dell'energia interna, quindi della
temperatura. Il calore molare, ovvero la quantità di calore necessaria ad innalzare la temperatura
di una mole di gas di un grado, cambia perciò a secondo che si tratti di una trasformazione a
volume o a pressione costante
QV CV T < QP CP T .
A volume costante, il calore è inferiore a quello necessario a pressione costante. Perciò per
riscaldare due identiche quantità di gas a volume e pressione costante ad uguale temperatura con
una stessa sporgente, occorrerà più calore quindi più tempo nel caso a pressione costante.
Punteggio massimo P1 + P2 =16 + 16. Tempo 25 minuti.
Proposta: sintesi 1
- Si esponga sinteticamente la legge di Pascal.
Risposta: in condizioni di volume e temperatura identiche, gas differenti in quantità uguali
esercitano ovunque la stessa pressione sulle pareti di un contenitore.
Punteggio massimo P1 + P2 = 4 + 4. Tempo 5 minuti.
Proposta: sintesi 2
- Si esponga sinteticamente la legge di Dalton.
Risposta: la pressione esercitata in una miscela gassosa è pari alla somma delle pressioni che i
singoli gas che compongono la miscela eserciterebbero se occupassero da soli l'intero volume.
Punteggio massimo P1 + P2 = 4 + 4. Tempo 5 minuti.
Proposta: sintesi 3
- Si espongano sinteticamente le leggi di Volta e di Gay - Lussac.
Risposta: in un gas perfetto il volume occupato e la pressione dipendono linearmente dalla
temperatura:
1
t)
273,15
1
P P0 (1
t)
273,15
V V0 (1
Punteggio massimo P1 + P2 = 4 + 4 . Tempo 5 minuti.
Proposta: completamento 1
- Si completi la seguente proposizione.
Comprimendo lentamente un gas e contemporaneamente _raffreddandolo_ la pressione rimane
costante.
Punti 5. Tempo1 minuto.
Proposta: completamento 2
- Si completi la seguente proposizione.
Riscaldando lentamente un gas e facendolo _espandere_ la temperatura rimane costante.
5
Punti 5. Tempo 1 minuto.
Proposta: completamento 3
- Si completi la seguente proposizione.
Riscaldando un gas a pressione costante il _volume_ aumenta.
Punti 5. Tempo 1 minuto.
Proposta: problema 1
- In una bombola da 10 l sono contenute 5 moli di una miscela formata da 1.3 moli di idrogeno e il
resto da ossigeno.
(a) Se la pressione esercitata sulle pareti del contenitore è di 2.5 10 5 Pa, quali sono le pressioni
parziali esercitate dall'idrogeno e dall'ossigeno?
m H 2 mO2 m
mH 2
mO2
Modello:
PH 2 m P; PO2 m P
(b) Qual è l'energia cinetica media delle molecole?
2
P 3 n E K
Modello:
mN A
n
V
Soluzione: (a) idrogeno 6.5 104 Pa, ossigeno 18.5 104 Pa; (b) E = 1.2 10-21 J
Punteggio massimo per quesito 5. Tempo 5 minuti.
Proposta: problema 2
- La temperatura di una mole di gas perfetto viene innalzata da 25 a 30 °C.
(a1) Quanto calore è necessario se la trasformazione è isocora?
Modello: Cm,V
Q
T
(b1) Di quanto aumenta la pressione se il volume è 1 litro?
Modello:
P mR
T
V
(a2) Quanto calore è necessario se la trasformazione è isobara?
Modello: Cm, P
Q
T
(b2) Di quanto aumenta il volume se la pressione è 1 atm?
Modello:
V mR
T
P
Soluzione: (a1) Q = 62.3 J; (b1) P = 4.1 104 Pa; (a2) Q = 103.9 J; (b2) V = 4.1 10-4 m3
Punteggio massimo per quesito 5. Tempo 5 minuti.
4.2 Quesiti proponibili per la tipologia (b)
Proposta: analisi fenomeno 1
- Si consideri la seguente situazione: una predeterminata quantità di gas in equilibrio termico con
l'ambiente, viene racchiusa in un contenitore ermetico e posta a contatto con una sorgente di calore
a temperatura T maggiore di quella a cui si trova il gas.
Si esaminino le variabili P, T, U del gas nel contenitore e ogni qual volta compatibilmente alla
situazione fisica ipotizzata le variabili che appaiono in prima riga della tabella variano,
modificando i valori delle variabili riportate in prima colonna, si scriva l'esponente caratteristico
della dipendenza nella casella vuota corrispondente (nel caso di indipendenza si scriva zero).
6
variabili
P
T
U
T
m
U
n
tempo
V
variabili
T
m
U
n
tempo
1
0
1
0
1
P
0
1
0
1
T
1
0
0
1
U
Punti 1 per ogni risposta estta; totale massimo 16. Tempo 21 minuti.
V
0
0
0
Soluzione
Proposta: analisi fenomeno 2
- Si consideri la seguente situazione: una predeterminata quantità di gas in equilibrio termico con
l'ambiente, viene racchiusa in un contenitore munito di rubinetto e posta a contatto con una
sorgente di calore a temperatura T minore di quella a cui si trova il gas. Aprendo il rubinetto il
gas effonde lentamente in un secondo contenitore inizialmente vuoto.
Si esaminino le variabili P, T, n del gas nel secondo contenitore. e ogni qual volta
compatibilmente alla situazione fisica ipotizzata le variabili che appaiono in prima riga della
tabella variano modificando i valori delle variabili riportate in prima colonna, si scriva l'esponente
caratteristico della dipendenza nella casella vuota corrispondente (nel caso di indipendenza si
scriva zero).
variabili
T
m
U
n
tempo
V
P
T
n
Soluzione:
variabili
T
m
U
n
tempo
V
1
1
1
1
1
0
P
-1
1
-1
1
0
T
0
1
0
1
0
n
Punti 1 per ogni risposta esatta; totale massimo 16. Tempo 21 minuti.
Proposta: scelta multipla 1
- Lo stato di una mole di gas è univocamente determinato da due differenti combinazioni delle
seguenti variabili: (1) temperatura; (2) densità numerica; (3) pressione; (4) energia cinetica
molecolare; (5) volume.
Individuare le combinazioni riportando i numeri di riga di ciascuna variabile nello schema
successivo.
PRIMA
SECONDA
Soluzione
PRIMA
SECONDA
1
3
5
2
3
4
Punti 3 per ogni combinazione corretta, punti 1 per ogni combinazione non data, punti 0 per ogni
combinazione errata. Tempo 3 minuti.
Proposta: scelta multipla 2
- Stesse quantità di gas a uguale temperatura sono racchiuse in contenitori di uguale volume e
forma differente. La pressione esercitata sulle pareti dei contenitori è:
(a) differente in ciascun contenitore perché dipendente dalla forma del contenitore.
(b) la stessa in tutti i contenitori purchè abbiano la stessa superficie di base.
7
(c) uguale per tutti i contenitori.
(d) uguale in tutti i contenitori purché le pareti siano piane.
Soluzione (c); punti 4 per risposta esatta, punti 1 per risposta non data, punti 0 per risposta
errata. Tempo 3 minuti.
Proposta: vero/falso 1
- In una trasformazione isobara il/la volume/pressione rimane costante.
V
F
Proposta: vero/falso 2
- Per mantenere costante la pressione in un gas durante una compressione lenta occorre
raffreddarlo/riscaldarlo.
V
F
Proposta: vero/falso 3
- Raffreddando un gas a volume/pressione costante si compie una trasformazione isocora.
V
F
Proposta: vero/falso 4
- Comprimendo/espandenddo rapidamente un gas si compie una trasformazione adiabatica.
V
F
Punti 4 per ogni risposta corretta, punti 1 per ogni risposta non data, punti 0 per ogni risposta
errata. Tempo 1 minuto.
5. Il testo della verifica
Per la verifica degli obiettivi precedentemente idividuati, occorre selezionare tra le tipologie
proposte due sequenze di prove con punteggio totale soddisfacente la griglia di valutazione (cfr.
par. 3). Di seguito si propone una scelta di prove fra quelle esaminate. Diverse scelte, varianti o
disposizioni, potrebbero fornire delle alternative per ridurre il rischio di copiatura. La durata
complessiva della prova è di 70 minuti dei quali 67 minuti per l'esecuzione e 13 minuti per la
revisione.
Verifica di fisica: UD 1/modulo1 "Fenomeni Termici"
1) Uguali quantità di uno stesso gas monoatomico, vengono riscaldate rispettivamente a volume e
a pressione costante mediante una stessa sorgente. Durante la trasformazione i gas passano dalla
8
temperatura ambiente alle temperature finali T e T'. Si descrivano brevemente le trasformazioni
tenendo presente i seguenti aspetti: il comportamento delle molecole; le variabili di stato; la
quantità di calore necessaria; il tempo necessario.
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
______________________________________
2) Si espongano sinteticamente le leggi di Volta e di Gay - Lussac. __________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
______________________________________________________
3) Si completi la seguente proposizione.
Riscaldando lentamente un gas e facendolo ....................... la temperatura rimane costante.
4) Si completi la seguente proposizione.
Comprimendo lentamente un gas e contemporaneamente ....................... la pressione rimane
costante.
5) In una bombola da 10 l sono contenute 5 moli di una miscela formata da 1.3 moli di idrogeno e
il resto da ossigeno. La pressione esercitata sulle pareti del contenitore è di 2.5 10 5 Pa.
(a) Quali sono le pressioni parziali esercitate dall'idrogeno e dall'ossigeno? _____________
9
_________________________________________________________
(b) Qual è l'energia cinetica media delle molecole? ___________________________
_________________________________________________________
6) Si consideri la seguente situazione: una predeterminata quantità di gas in equilibrio termico
con l'ambiente, viene racchiusa in un contenitore munito di rubinetto e posta a contatto con una
sorgente di calore a temperatura T minore di quella a cui si trova il gas. Aprendo il rubinetto il
gas effonde lentamente in un secondo contenitore inizialmente vuoto.
Si esaminino le variabili P, T, n del gas presente nel secondo contenitore e ogni qual volta
compatibilmente alla situazione fisica ipotizzata le variabili che appaiono in prima riga della
tabella variano, modificando i valori delle variabili riportate in prima colonna, si scriva l'esponente
caratteristico della dipendenza nella casella vuota corrispondente (nel caso di indipendenza si
scriva zero).
variabili
T
m
U
n
tempo
V
P
T
n
7) Lo stato di una mole di gas è univocamente determinato da due differenti combinazioni delle
seguenti variabili: (1) temperatura ; (2) densità numerica; (3) pressione; (4) energia cinetica
molecolare; (5) volume.
Individuare le combinazioni riportando i numeri di riga di ciascuna variabile nello schema
successivo.
PRIMA
SECONDA
8) Per mantenere costante la pressione in un gas durante una compressione lenta occorre
riscaldarlo.
V
F
9) Stesse quantità di gas a uguale temperatura sono racchiuse in contenitori di uguale volume e
forma differente. La pressione esercitata sulle pareti dei contenitori è:
(a) differente in ciascun contenitore perché dipendente dalla forma del contenitore.
(b) la stessa in tutti i contenitori purchè abbiano la stessa superficie di base.
(c) uguale per tutti i contenitori.
(d) uguale in tutti i contenitori purché le pareti siano piane.