Ematopoiesi
L’ematopoiesi e la vasculo-angiogenesi [la vasculogenesi è il processo
con il quale i precursori della cellula endoteliale vascolare (angioblasti)
proliferano e differenziano per formare vasi ematici primitivi; la
angiogenesi è la formazione del network vascolare risultante dalla crescita
o dalla ramificazione dei vasi pre-esistenti] iniziano nella vita embrionale
da comuni cellule progenitrici, gli EMANGIOBLASTI, dotati di capacità
proliferativa e differenziativa bilineare.
Lo sviluppo ontogenetico delle linee ematopoietica ed endoteliale origina
nello strato germinale mesodermico da un comune precursore denominato
EMANGIOBLASTO, esprimente il CD41 (GpIIb) che marca
l’emangioblasto emogenico e l’endotelio emogenico.
Fattori di crescita vasculo-endoteliali (VEGFs) e loro specifici recettori
tirosin-kinasici (VEGFR) regolano la differenziazione dell’emangioblasto.
La famiglia VEGF consiste di 6 differenti proteine (VEGF-A, VEGF-B,
VEGF-C, VEGF-D, VEGF-E, PIGF- placental growth factor) e di 3
membri recettoriali (VEGFR-1 o Flt1, VEGFR-2 o KDR/FLK-1,
VEGFR-3 o Flt4). Il VEGF-A si lega ai recettori VEGFR-1 e VEGFR-2,
mentre il VEGF-B si lega al recettore VEGFR-3. Il VEGF-C ed il VEGFD si legano al VEGFR-2 e -3.
In aggiunta alla famiglia VEGF, la famiglia angiopoietina contiene
importanti fattori di crescita denominati angiopoietine (Ang-1 a Ang-4) e
specifici recettori (Tie-1 e Tie-2).
L’EMANGIOBLASTO comprende una sottopopolazione di cellule
staminali ematopoietiche CD34+ ed una sottopopolazione di cellule
staminali CD34+ e VEGFR2+, e costituisce, pertanto, sorgente e riserva di
precursori emopoietici ed endoteliali. Gli angioblasti esprimono, in
aggiunta al VEGFR-2 anche il VEGFR-1 ed il VEGFR-3, quest’ultimo è
strettamente correlato all’endotelio linfatico ed alla linfangiogenesi.
Il subset CD34+ prolifera e differenzia in cellule emopoietiche
(unilineare), il subset CD34+ e VEGFR-2 prolifera e differenzia in cellule
emopoietiche ed endoteliali (bilineare). Pertanto il progenitore endoteliale
ha un potenziale emogenico che è inversamente proporzionale alla
espressività del recettore VEGFR2 o Flk-1 (fetal liver kinase-1), marker di
maturità endoteliale, e direttamente proporzionale alla contemporanea
espressività della vascular endothelial(VE)- cadherin.
Alcune cellule staminali emopoietiche esprimono, in aggiunta al VEGFR2, i recettori Tie-1 e Tie-2, mentre la Ang-1 e la Ang-2 sono espresse sulle
cellule stromali (macrofagi e fibroblasti). Questo suggerisce che le
angiopoietine possono essere importanti nel mantenimento del
microambiente ematopoietico.
Questo rapporto gerarchico persiste nella vita post-natale.
Il modello gerarchico della ematopoiesi riconosce l’esistenza di una
cellula staminale pluripotente quiescente e con capacità di
autorinnovamento (self-renewal) che genera un pool di progenitori
proliferanti che, a loro volta, generano precursori differenziati. Durante
questo processo, il potenziale di autorinnovamento e proliferativo è
perduto, mentre sono acquisite le capacità differenziative.
Il modello flessibile riconosce l’esistenza di una cellula staminale
fluttuante. Infatti, durante il transito nel ciclo cellulare citochina-indotto
(IL-1, IL-3, IL-6, IL-7, IL-11), la cellula staminale subisce modificazioni
della cromatina nucleare modificando genotipo e fenotipo, da qui il
concetto del “chiaroscuro della cellula staminale”. Durante il ciclo
cellulare varia la espressività genica sulla cellula staminale spostando il
fenotipo da quello prevalentemente primitivo/impiantabile a quello
prevalentemente differenziativo e commissionato. La modulazione della
espressione dei geni induce la trascrizione di una varietà di fattori di
crescita stimolanti (EPO, GM-CSF, G-CSF, M-CSF, TGF-β SCF, bFGF,
TPO) ed inibenti (TGF-α, TNF-α, INFs-α,β,γ, βTG, PF4) che regolano la
ematopoiesi.
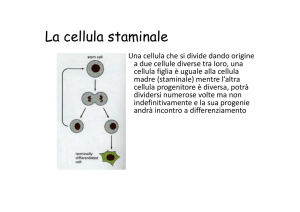
In questo sistema la cellula staminale genera due cellule differenziate
(progenitore 1 e progenitore 2, o cellule figlie). Una delle due cellule figlie
può tornare al fenotipo di cellula staminale, mentre l’altra è commissionata
alla differenziazione o alla morte apoptotica.
Piuttosto che una transizione gerarchica dalla cellula staminale al
progenitore, sembra che esiste un “continuum” fluttuante nel quale il
fenotipo delle cellule staminali primitive si sposta da uno stato ad un
altro e torna indietro.
In questo sistema c’è una inversa correlazione fra cellule staminali e
progenitori. Quando i progenitori aumentano, le cellule
staminali/impiantabili diminuiscono, e questo fenomeno è reversibile.
Il concetto di flessibilità della cellula staminale si associa al concetto di
plasticità, in termini di differenziamento e commissionamento verso
altre linee, cutanea, epatica, renale, polmonare, muscolo-scheletrica,
tratto gastrointestinale, miociti cardiaci, neuroni, cellule pancreatiche
e tessuti mesenchimali (adipe, osso e cartilagine).
In definitiva, plasticità significa che la cellula staminale midollare
pluripotente esprime geni ematopoietici e geni non-ematopoietici
determinando un “priming” differenziativo ematopoietico e nonematopoietico.
La plasticità della cellula staminale midollare pluripotente possiede un
fervente potenziale clinico per svariate malattie o danni d’organo
(ischemia renale, ischemia miocardia, danno epatico). Le modalità per
ottenere queste applicazioni cliniche sono: 1) trapianto autologo, 2)
incremento o mobilizzazione endogena di cellule staminali midollari
pluripotenti, 3) trapianto autologo di cellule staminali midollari
pluripotenti geneticamente modificate (sickle cell disease, malattia da
accumulo di glicogeno), 4) trapianto allogenico di cellule staminali
midollari pluripotenti.
Sorgente potenziale di cellule staminali è l’embrione umano da cui
derivano gli embrioblasti dotati di autorinnovamento e capaci di
curare malattie ematologiche e non (m. di Parkinson, diabete ecc.) ed
il sangue periferico dopo mobilizzazione fattore di crescita indotta.
Il microambiente controlla la ematopoiesi mediante vari meccanismi: a)
produzione di fattori di crescita e di proteine di derivazione dalle cellule
stromali (fibroblasti e macrofagi); b) presentazione dei fattori di crescita a
corto raggio d’azione alla cellula staminale nel punto di contatto fra cellula
e cellula in maniera che tali fattori possano agire direttamente anche in
minime quantità; c) diretta comunicazione tra le cellule stromali e le
staminali attraverso particolari molecole di adesione e proteine di matrice
extracellulare.
E’ oggi noto che le cellule che compongono il microambiente
ematopoietico sono capaci di produrre fattori di crescita con funzione
regolatoria positiva [(IL-1, IL-3, IL-6, IL-7, G-CSF, GM-CSF, M-CSF,
stem celll factor (SCF), basic fibriblast growth factor (bFGF) ed il
transforming growth factor-β (TGF-β)] e fattori ad attività regolatoria
negativa (TNF-β, TGF-α, macrophage-inflammatory protein-1α (MIP1α)). Tali fattori hanno l’importante funzione di garantire la stabilità del
numero di cellule staminali all’interno degli organi ematopoietici.
La stretta unione che si stabilisce tra le cellule staminali e le cellule
stromali avviene attraverso specifiche molecole di adesione (L-selectina,
VLA-4, paltelet cell adhesion molecole-1 (PECAM-1)) e proteine adesive
come la fibronectina (molecola di ancoraggio per i precursori eritroidi) e la
emonectina (molecola di ancoraggio per i precursori granulopoietici) che
orientano spazialmente i precursori esponendoli ai messaggi specifici che
ne regolano proliferazione e differenziazione.
Le cellule staminali ematopoietiche sono confinate all’interno delle nicchie
midollari ad opera di molecole chemoattraenti (SDF-1, IL-8, MIP1lafa e
beta) deputate all’homing fisilogico ematopoietico e dopo trapianto per
emopatia e non [tessuti danneggiati (miocardio, rene, fegato) che
rilasciano citochine chemoattratenti che richiamano le cellule staminali
infuse nella zona danneggiata riparandola]. Solo le cellule mature
(eritrociti, globuli bianchi, piastrine) lasciano la “location” midollare
(mobilizzazione fisiologica) per entrare nel circolo ematico. Una piccola
quota di cellule staminali sfugge nel sangue periferico. Una migrazione
forzata di cellule staminali configura il processo della “mobilizzazione
forzata” che trova applicazione clinica per il trapianto autologo o
allogenico di cellule staminali periferiche. Durante la mobilizzazione il
midollo diventa una piattaforma di intergioco tra citochine/chemochine,
molecole di adesione e proteasi.
La mobilizzazione granulocyte colony-stimulating factor (G-CSF)-indotta
induce attivazione neutrofila con rilascio di proteasi (elastasi, catepsina G,
lactoferrina. Metalloproteasi) che proteolizzano le molecole adesive
(VCAM-1) e le chemochine stromal-derived factor 1 (SDF-1), IL-8,
MIP1-alfa e –beta, disancorando le interazioni cellula-cellula e cellulamatrice del microambiente midollare.
Organo emopoietico = Midollo Osseo
Sede = Cavità Ossee (ossa piatte (bacino), ossa lunghe (omero e
femore), ossa corte (vertebre e sterno)
Conponenti = Stromale (connettivale-fibrillare)
Microvascolare (arterie perforanti e sinusoidi)
Parenchimale (tessuto emopoietico e tessuto adiposo)
Le cellule dello stroma comprendono macrofagi e fibroblasti, questi ultimi
sintetizzano il tessuto connettivale che forma le nicchie dove sono
contenute le cellule parenchimali a funzione emopoietica. Le cellule
stromali sintetizzano e rilasciano fattori di crescita emopoietici e pertanto
non costituiscono solamente un tessuto di sostegno, ma partecipano
attivamente alle capacità rigenerative e proliferative del tessuto
emopoietico.
Il parenchima cellulare comprende cellule staminali e precursori
emopoietici. Il raggiungimento di un determinato grado di maturazione
comporta i seguenti fenomeni: a) differenziazione (fenomeno che
comporta la comparsa di caratteristiche specifiche); b) commissionamento
(la cellula commissionata è una cellula immatura orientata verso una
specifica linea ematopoietica, eritroide, granulocitica, o piastrinica); c)
maturazione (fenomeno che consegue al commissionamento); d)
amplificazione (divisione cellulare che si verifica contemporaneamente
alla maturazione).
Tecniche di prelievo del tessuto emopoietico
Aspirato midollare (esame di tipo morfologico): aspirazione di sangue
midollare, colorazione dei vetrini mediante tecnica di May GrunvaldGiemsa ed esame al microscopio ottico).
Biopsia ostemidollare (esame di tipo quantitativo): prelievo di un
frustolo di tessuto osseo, conservazione in liquido di Zencher ed esame
istologico (per valutare la componente stromale e parenchimale).