TERMODINAMICA
Il Primo Principio
Indice degli argomenti
1. Crisi del concetto di calore come "fluido" invisibile
2. Il principio di equivalenza di Mayer
3. Joule: L'equivalente meccanico della caloria
4. Calore e lavoro come forme di trasferimento dell'energia
5. Le Trasformazioni termodinamiche
6. Il Primo Principio della Termodinamica
7. Le macchine termiche
Il calore come fluido invisibile
Fino alla metà dell’800, i fenomeni riguardanti il calore erano spiegati
attraverso la teoria del calorico che considerava il calore come un fluido
invisibile che passava da un corpo all’altro, dal più freddo al più caldo
Analogia idraulica
con i vasi
comunicanti
Crisi della teoria del calorico
Benjamin Thompson fu tra i primi a compiere studi
sistematici sulle relazioni tra energia meccanica e calore,
evidenziando fenomeni inspiegabili con la teoria del calorico,
come l’aumento di temperatura per attrito
Thompson in un ritratto d’epoca
mentre controlla le operazioni di
costruzione di cannoni: durante il
lavoro di foratura si sviluppavano
grandi quantità di calore
La teoria cinetico molecolare
Dalla metà dell’800 incomincia a svilupparsi la teoria cinetico
molecolare, basata su nuovi principi:
nega l’esistenza del fluido
calorico.
I corpi materiali sono composti di
minuscole particelle dotate di un
movimento e quindi di energia
cinetica.
La temperatura è una misura
dell’energia cinetica media delle
particelle
Si
Modello di un gas
Energia interna
La somma di tutte le energie cinetiche delle particelle che compongono
un corpo è chiamata Energia Interna del corpo ed è proporzionale alla
temperatura .
Una palla da tennis in
movimento possiede
un’energia
esterna
macroscopica
data
dalla
somma
dell’energia cinetica e
potenziale e un energia interna microscopica data dalla
somma delle energie cinetiche delle particelle
La conduzione del calore
La conduzione di calore tra due corpi
a contatto è un trasferimento
dell'energia cinetica attraverso gli
urti tra le particelle, le più veloci
cedono parte del loro moto a quelle
più lente.
Alla fine si raggiunge un
equilibrio e le energie cinetiche
medie e le temperature dei due
corpi sono uguali
I cambiamenti di stato
Le molle rappresentano le forze
interatomiche, le sfere gli atomi o le
molecole
All’aumentare della temperatura i
legami si rompono e le particelle si
liberano.
Avviene la fusione del solido
Modello di un solido
Il principio di equivalenza di Mayer
Il medico tedesco Julius Mayer intuisce che le leggi della meccanica
possono applicarsi anche nell’ambito della teoria del calore tra cui
quella fondamentale della conservazione dell’energia. Nel 1842
formula il principio generale per cui
L’energia non può essere generata, ma solamente convertita da
una forma a un’altra
L’equivalente meccanico della caloria
L'inglese Joule, da cui prende il
nome
l'unità
di
misura
dell'energia,
realizzò
un
esperimento
per
misurare
quantitativamente la relazione
tra energia meccanica e energia
termica.
Nella figura vediamo un mulinello immerso nell’acqua, messo in
rotazione da un peso. L’acqua si riscalda per effetto dell’attrito del
mulinello. Sapendo l’energia iniziale fornita (l’energia potenziale del
peso) e misurando l'innalzamento della temperatura Joule trovò così
l'equivalente meccanico della caloria che risulta essere 4,186 Joule.
Calore e lavoro come forme di trasferimento dell'energia
Il lavoro meccanico può dunque essere trasformato in calore e
viceversa. Entrambe sono forme di trasferimento dell’energia
Le trasformazioni di energia che avvengono in un’automobile
Energia chimica
Energia termica
combustione
Motore
Trasmissioni
ruote
Energia termica
Energia cinetica
freni
Le trasformazioni termodinamiche
Studiamo ora un sistema ideale che trasforma lavoro in calore e viceversa. Esso
è costituito da un gas perfetto racchiuso dentro un cilindro la cui sommità può
scorrere senza attriti
Prendiamo il cilindro e lo isoliamo
termicamente
Diminuendo il peso sul pistone esso si solleva e la temperatura
del gas diminuisce. Parte del energia termica del gas si trasforma
in energia potenziale del peso. Questo è un esempio di
trasformazione adiabatica in cui cioè non c'è scambio di energia
termica con l'esterno
Ripetiamo l'esperimento precedente ma questa volta permettiamo al cilindro di
scambiare calore con l'esterno mettendolo in un "bagno termico” che mantenga la sua
temperatura costante. Durante l'espansione del pistone il gas tenderà a raffreddarsi ma
contemporaneamente assorbirà calore dal bagno termico..
Alla fine del processo il gas ha la stessa temperatura iniziale e quindi anche
la stessa energia interna. Questa trasformazione viene detta isotermica
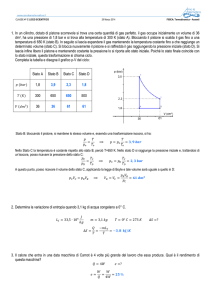
È utile mostrare le trasformazioni sotto forma di grafico. A tale scopo si usa il
diagramma pressione volume (PV). Ogni punto nel diagramma rappresenta uno
stato termodinamico del sistema
i ed f rappresentano lo
stato rispettivamente lo
stato iniziale e finale, i
valori corrispondenti
delle pressioni e dei
volumi Pi,Pf e Vi, Vf
La temperatura per ogni punto del diagramma si ottiene
dalla legge dei gas perfetti
PV=nRT
Le trasformazioni isotermiche nel piano PV hanno
la forma di iperboli.
Questo risulta dall’equazione dei gas perfetti
P=RT/V
con T costante.
anche le adiabatiche assomigliano a di
iperboli ma sono più ripide
Altre due importanti trasformazioni sono le isobare
e le isocore
Nell’isobara la pressione è costante e
variano il volume e la temperatura
[figura: diagramma pv isocora]
[figura: pistone bloccato, isocora]
Nell’isocora il volume è costante e
variano la pressione e la temperatura
In generale una qualsiasi trasformazione è rappresentata da
una curva nel diagramma PV
Il lavoro compiuto dal sistema
durante una trasformazione è
uguale all'area sottesa dalla
curva.
Se passiamo viceversa da B ad
A, il lavoro sarà negativo cioè
compiuto sul sistema
Nel caso di una trasformazione isobara questo
lavoro è facilmente calcolabile.
L= area del rettangolo
P(VB-VA)=PDV
Le trasformazioni cicliche
Una trasformazione
termodinamica che passi da uno
stato A ad uno stato B e poi
attraverso un altro percorso torni
allo stato A è detta
trasformazione ciclica
B
Due isobare e due isocore formano il ciclo nella figura. Il lavoro compiuto dal
sistema è uguale all’area del rettangolo. Se il ciclo viene compiuto in senso
antiorario il lavoro sarà compiuto sul sistema.
Il ciclo in figura è composto da due isobare e due adiabatiche,
chiamato ciclo di Carnot . TH e TC sono le temperature delle sorgenti,
rispettivamente a temperatura più alta e più bassa. Le frecce indicate
con QH e QC rappresentano il calore assorbito dalla sorgente calda e
quello ceduto alla sorgente fredda e W il lavoro compiuto
Il primo principio della termodinamica
La variazione di energia interna del gas DU, il calore Q
fornito al sistema e il lavoro L ricavato sono legate dalla
relazione
DU=Q-L
Questa è la formulazione del primo principio della termodinamica.
Essa ha validità universale essendo conseguenza del principio di
conservazione dell’energia
Casi particolari del primo principio
Il lavoro totale ricavato o compiuto in una trasformazione è nullo
(Es. isocora)
L=0 e DU=Q
Il sistema è isolato termicamente ovvero la somma del calore
assorbito e ceduto è nullo (Es adiabatica)
Q=0 e DU=-L
La variazione di energia interna è nulla (Es trasformazione ciclica)
DU=0 e Q=L
Il funzionamento delle macchine termiche
Per macchina termica intendiamo un dispositivo che
converte calore in lavoro seguendo una trasformazione
ciclica
Esempi
Motore a vapore (locomotive)
Motore a scoppio
Centrale termoelettrica
Il motore a scoppio
Il motore a scoppio o a quattro tempi presenta quattro
fasi di funzionamento.
A. Aspirazione. La miscela aria-benzina,
viene aspirata isobaricamente alla
pressione atmosferica dal pistone.
B. Compressione. La valvola di
aspirazione si chiude e la miscela
viene compressa adiabaticamente dal
pistone
Diagramma PV corrispondente
La fase utile è la fase di espansione in cui viene compiuto lavoro
sul pistone con una trasformazione adiabatica (tratto DE del
diagramma PV)
C. Scoppio e espansione. La miscela viene
accesa dalla candela e avviene lo
scoppio. La pressione del gas spinge il
pistone in basso
D. Scarico. Il gas di scarico viene espulso dal
pistone che ritorna alla posizione iniziale
Diagramma PV corrispondente
Centrale termoelettrica
• Caldaia: conversione energia
chimica del combustibile in calore,
con produzione di vapore acqueo
• Turbina: conversione del calore
in energia meccanica.
• Alternatore: converte l’energia
meccanica della turbina in energia
elettrica
• Condensatore: il vapore viene
raffreddato e condensato in acqua a
temperatura ambiente
• Pompa: trasporta l’acqua nella
caldaia
Limiti nella conversione del calore in lavoro
La macchina termica sfrutta il passaggio di calore tra due sorgenti a diversa
temperatura, parte di questo calore non potrà essere convertito in lavoro ma verrà
rilasciato nell’ambiente o nella sorgente a temperatura più bassa.
tanto più piccolo è il
calore
rilasciato
nell’ambiente
Q1
tanto maggiore sarà il
calore utile netto
convertito in lavoro L
Se Q2 è il calore fornito dalla sorgente calda e Q1 quello ceduto all’ambiente
allora L=Q2-Q1. Il rendimento della macchina è il rapporto tra il lavoro
ricavato e il calore assorbito
r=L/Q2=(Q2-Q1)/Q2=1-Q1/Q2
r esprime l’efficienza della macchina. Valori di r vicini ad 1 indicano un alto
rendimento
È possibile dimostrare che una
macchina termica che lavora tra due
sorgenti a temperatura T2 e T1 ha un
rendimento massimo teorico di
r=1-T1/T2
Nella realizzazioni dei motori o di altre macchine termiche si cerca di
renderle efficienti aumentando r e quindi diminuendo il rapporto T1/T2
quanto più possibile
Il motore a scoppio può essere visto come una macchina termica che lavora
tra le temperature T2 del gas al momento dello scoppio e T1 il gas
raffreddato al momento dello scarico
T2=2300°K, T1=1100°K
rmax=1-T1/T2=0,52 o 52%
Nella pratica i motori a scoppio
hanno rendimenti attorno al 2030%, circa la metà del
rendimento massimo teorico
Rendimenti tipici di macchine termiche reali
Riassumendo
•A metà dell’800 la teoria del calorico viene sostituita dalla teoria
cinetico molecolare che rende conto di fenomeni altrimenti non
spiegabili. Essa permette di collegare i fenomeni meccanici con i
fenomeni termici. Mayer estende il principio di conservazione
dell’energia al calore, Joule misura l’equivalente meccanico della
caloria.
•La termodinamica è lo studio delle leggi di trasformazione del calore
in lavoro e viceversa.
•Un gas perfetto in un cilindro è un esempio di sistema ideale
caratterizzato da uno stato termodinamico definito dalle tre grandezze
Pressione, Volume e Temperatura rappresentabili graficamente sul
diagramma PV. L’energia interna del gas è la somma delle energie
cinetiche delle particelle componenti.
Riassumendo
•Un sistema può compiere delle trasformazioni termodinamiche: abbiamo studiato
le trasformazioni isotermiche, adiabatiche, isobare e isocore. Importanza
particolare rivestono le trasformazioni cicliche.
•Il primo principio della termodinamica è l’estensione del principio di
conservazione dell’energia al calore, lega la variazione di energia interna di un
sistema col calore scambiato e il lavoro compiuto:
DU=Q-L
•Le macchine termiche sono dei dispositivi che convertono calore in lavoro tramite
una trasformazione ciclica, abbiamo studiato in particolare il motore a scoppio. Esse
sono caratterizzate da un rendimento che indica la loro efficienza nella conversione.