
Acidi nucleici - 4
presentazione del prof. Ciro Formica
Duplicazione del DNA. Perché la duplicazione è semiconservativa;
Come lavorano le DNA polimerasi. Errori durante la duplicazione
e modalità di correzione.
Descrivere:
i meccanismi di duplicazione del DNA
il modello a doppia elica di Watson e Crick
correlare la sua struttura con le sue funzioni
Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it,
wikipedia.it, unibs.it, unina.it, uniroma2.it, nih.gov, zanichelli.it, sciencemag.org
Duplicazione del DNA
proprietà
Filamento guida
(leading strand)
Filamento ritardo
(lagging strand)
Aggiunta
nucleotidi
continua
(concorde alla forcella)
discontinua
(opposta alla forcella)
Direzione
5’ 3’
5’ 3’
Okazaki
100-200 nucleotidi
Primer
(innesco)
sintetizzato da RNA
primasi
Punto di
attacco
Telomeri
DNA
polimerasi
5’-TTAGGG3’
SI
SI
SI
unico
numerosi
SI
proofreading
Sul filamento ritardo non si completa l’ultimo frammento di Okazaki, perciò il cromosoma
tende ad accorciarsi, ma i TELOMERI, brevi sequenze alle estremità dei cromosomi 5’TTAGGG3’, proteggono dall’accorciamento, ma solo per 40-50 duplicazioni cellulari,
finché la cellula va in APOPTOSI e muore. L’enzima TELOMERASI sintetizza il DNA
telomerico perso durante la duplicazione.
2
Attività enzimatiche della DNA polimerasi
Attività
Azione svolta
Elicasi
Srotola l'elica e taglia i legami a idrogeno tra le basi complementari.
Primasi
Sintetizza una piccola catena ribonucleotidica (lunghezza 9-10
nucleotidi) -che fa da innesco o primer- necessaria per promuovere
l’aggiunta di altri nucleotidi.
Polimerasi
Aggiunta di 1 nucleotide per volta al 3' OH della catena in
accrescimento
Ligasi
Unisce i frammenti neosintetizzati (dopo la rimozione enzimatica
degli RNA-primer).
Nucleasi
.
Corregge gli eventuali errori nell'aggiunta dei nucleotidi Nelle nostre
cellule la frequenza di errori nell'incorporazione delle basi è minima,
dell'ordine di 10-9 -10-10 (un errore ogni miliardo – uno ogni 10
miliardi di basi),
3
DNA polimerasi
innesco
stampo
allungamento
catena
monomeri
primer
template
5’ 3’
dNTP
4
replicazione
5
replicazione
EDITING: Correzione degli errori
durante la duplicazione.
6
replicazione
7
replicazione
8
Bolla di replicazione
http://apollo11.isto.unibo.it/Tecnicidilaboratorio/lezioni%2020102011/11)%20Duplicazione%20DNA.pdf
9
Meselson e Stahl 1958: Modello semiconservativo
Le molecole di DNA in un gradiente di
densità ottenuto centrifugando a lungo
una soluzione di CsCl (cloruro di cesio)
galleggiano al livello del gradiente che
corrisponde alla loro densità.
Per distinguerle, le eliche nuove
venivano marcate con 14N (azoto
leggero, meno denso), le vecchie con
15N (azoto pesante, più denso).
Dopo la centrifugazione apparivano dei
picchi di densità distinti, che facevano
pensare ad una modalità
semiconservativa, cioè che ogni doppia
elica fosse formata da un’emielica
vecchia e una nuova
10
La replicazione semiconservativa:
A half DNA ladder is a template for copying the whole
1- incubazione dei batteri in 15N
2- trasferimento in 14N: la crescita
prosegue
3- raccolta campioni a 0, 20 (1
replicazione) e 40 minuti (2
replicazioni)
4- si misura la densità delle nuove
molecole di DNA:
0’: tutte catene pesanti (15N)
20’: tutte catene intermedie
40’: metà intermedie, metà leggere
(14N)
Conclusioni: la replicazione non può
essere conservativa (2 catene vecchie
o 2 catene nuove) né dispersiva
(catene miste).
Poiché bastano 2 replicazioni per far sparire le catene pesanti, il quadro è
compatibile con la replicazione semiconservativa: 1 catena vecchia e 1 nuova).11
Matthew Meselson, USA, 1930-vivente
Chimico USA, lavorò con Pauling sulle proteine al Caltech.
Mediante la cristallografia a r.X evidenziò la struttura proteica.
Dimostrò che la ricombinazione dei fagi deriva dallo
splicing del DNA. Nel 1960 François Jacob e Sydney
Brenner ricavarono nel suo lab al Caltech i dati
necessari per dimostrare l’esistenza del mRNA.
Scoprì le basi enzimatiche del riconoscimento del DNA
interno alla cellula e la protezione mediante aggiunta di
gruppi metilici CH3: la metilazione lascia intatto il
proprio DNA, mentre il DNA estraneo viene attaccato
dagli enzimi di restrizione. Scoprì anche il processo del
riparo degli errori di appaiamento del DNA (mismatch
repair), che fa fissare gli errori nel DNA.
Dal 1963, Meselson si occupa delle armi chimiche e biologiche come consulente di
agenzie governative sull’effetto di questi ordigni.
12
Franklin Stahl, USA, 1929-vivente
Conobbe Meselson al corso di biologia
molecolare tenuto da Watson e Crick e
insieme cercarono di dimostrare la
replicazione semiconservativa della DE già
ipotizzata dagli stessi Watson and Crick.
Lavorarono di comune accordo al Caltech e
nel 1957 trovarono le prove sperimentali che
cercavano mediante la centrifugazione in
gradiente di densità. Dopo la pubblicazione
nel ’58 il lavoro fu definito "one of the most
beautiful experiments in biology."
Ancora oggi insegna all’Università dell’Oregon e si interessa di ricombinazione
genetica
13
Arthur Kornberg, USA, 1918-2007
Nacque a Brooklyn da genitori dell’Europa
Orientale. Fu uno studente prodigio e dopo la laurea
in medicina studiò l’ittero epatico, di cui lui stesso
soffriva. Fu assunto al NIH, National Institutes of
Health dove diresse la sezione di enzimologia e
metabolismo, scoprendo un centinaio di enzimi
coinvolti nei processi metabolici. In seguito, come
direttore di Microbiologia a St.Louis, scoprì la DNA
polimerasi I. Fu insignito del Nobel nel ‘59 con
Severo Ochoa — Kornberg for the enzymatic
synthesis of DNA, Ochoa for the enzymatic synthesis
of RNA.
Considerava la scienza un’attività creativa, una forma d’arte e ricavò tanta
soddisfazione dalla ricerca. La moglie Sylvy era anche lei ricercatrice e lavorò nel
suo lab, il figlio Roger anche lui ricercatore isolò la DNA polimerasi III.
14
Sydney Brenner, Sudafrica, 1918-vivente
Per approfondire gli studi di biologia molecolare
dovette trasferirsi negli USA, dove collaborò con
Watson e Crick.
Scoprì l’RNA messaggero e dimostrò in che
modo viene determinato l’ordine degli
amminoacidi nelle proteine. In seguito ha
studiato i geni dei vetrebrati e l’evoluzione del
genoma. I suoi studi hanno permesso di
analizzare la sequenza dei geni e hanno
contribuito alla crescita del Progetto Genoma.
Con le sue ricerche sul vermetto Caenorhabditis
elegans sono stati meglio compresi
l’invecchiamento e la morte cellulare
programmata (apoptosi).
Nobel nel 2002 con Sulston —per gli studi su morte cellulare programmata
e regolazione genica nello sviluppo degli organi
15
Paul Zamecnik, USA, 1913-2009
Medico USA, si interessò alla biosintesi delle proteine
e dimostrò mediante radionuclidi che per la biosintesi
è necessario che gli amminoacidi siano attivati
energicamente dall’ATP. Usò un estratto acellulare di
fegato di ratto, poi nel 1956 scoprì il fattore di
trasporto degli amminoacidi: il tRNA, l’adattatore
che Crick aveva previsto nel Dogma centrale: DNA
RNA PROTEINE.
In seguito purificò i tRNA, mentre Nirenberg e
Matthaei usarono il suo estratto acellulare di E.coli
per ricavare il CODICE GENETICO. Scoprì anche
l’mRNA antisenso che blocca la traduzione proteica.
Dal 1993 studiò nuovi farmaci basati sull’idea dei bloccanti anti-senso.
He passed away in 2009.
16
Marshall Nirenberg, USA, 1927-2010
Zoologo ed ecologista USA, si interessò al CODICE
GENETICO. Insieme a Matthaei sintetizzò il primo
polinucleotide sintetico, il poliU, dal quale ricavò la
fenilalanina: era il primo tassello della decifrazione del
CODICE. In seguito sintetizzarono altri polinucleotidi
omogenei (poli A, poli,C, poli G) e eterogenei (poli
AAG, poli GCC ecc). Scoprì la ridondanza di alcuni
amminoacidi (degenerazione del codice) e I “segni di
punteggiatura” (codoni INIZIO e STOP).
Comprese anche l’universalità del codice per tutte le
specie, tranne poche eccezioni.
Nobel 1968 per la fisiologia e la medicina con Khorana e Holley (il primo a
determinare sequenza e struttura di un tRNA). Studiò anche il sistema
nervoso della Drosophila, il trasporto degli zuccheri nelle cellule tumorali.
17
Har Gobind Khorana, India-USA, 1922-2011
Biochimico, studiò il codice genetico e partendo dal
poli CU ottenne una definitiva dimostrazione del
fatto che il codice fosse a triplette. Abbinò la tripletta
CUC all’aa. Leucina e UCU alla Serina. Poi proseguì
con altre triplette fino alla completa decifrazione del
codice.
Gli fu assegnato il Nobel con Nirenberg e Holley, per
il loro lavoro indipendente "for their interpretation
of the genetic code and its function in protein
synthesis,"
In seguito al MIT di Boston riuscì a produrre il primo gene artificiale in un
batterio, più tardi sintetizzò il gene della rodopsina, una proteina della retina
dell’occhio umano, e a scoprire le mutazioni di questo gene che conducono
alla retinite pigmentosa. Il suo lavoro fu fondamentale per i successivi
sviluppi dell’ingegneria genetica.
18
mRNA e codice genetico
Nirenberg and Khorana did not know the sequence of their
synthetic mRNAs. They deduced the sequence by varying the
amounts of nucleotides added and calculating the probability
of making specific codon sets
Perché esiste la ridondanza nel codice genetico, ossia perché il
codice è degenerato? Non era preferibile che la natura
lasciasse non codificanti i codoni extra? la risposta è più
avanti…
19
Il codice genetico
UUU
UUC
Fenilalanina
PHE
UCU
UCC
UAU
Serina
SER
UAC
UUA
UCA
UUG
UCG
UAG
CCU
CAU
CUU
CUC
Leucina
LEU
CCC
Prolina
PRO
UAA
CAC
CUA
CCA
CUG
CCG
CAG
AUU
ACU
AAU
AUC
Isoleucina
ILE
AUA
AUG
ACA
Codone
inizio
GUU
GUC
GUA
GUG
ACC
Valina
VAL
Treonina
THR
CAA
AAC
AAA
ACG
AAG
GCU
GAU
GCC
GCA
GCG
Alanina
ALA
GAC
GAA
GAG
Tiroxina
TYR
STOP
UGU
UGC
Cisteina
CYS
UGA
STOP
UGG
Triptofano TRP
Istidina
HIS
CGU
Glutammina
GLN
CGA
Asparagina
ASN
Lisina
LYS
CGC
Arginina
ARG
CGG
AGU
AGC
AGA
AGG
Ac.Aspartico
ASP
GGU
Ac.glutammico
GLU
GGA
GGC
GGG
Serina
SER
Arginina
ARG
Glicina
GLY
Ridondanza o degenerazione del codice genetico
Sono codificati da:
6 codoni - arginina, leucina, serina.
4 codoni – alanina, glicina, treonina, prolina, valina
3 codoni – isoleucina
1 codone – metionina (inizio) e triptofano, 2 codoni – tutti gli altri
21
L’elevata degenerazione del codice può essere interpretata come
un meccanismo di protezione contro le mutazioni di singole basi
che fanno assumere ad una tripletta un significato diverso da
quello originario, compreso il significato di stop.
Se una mutazione produce uno stop (probabilità 1/20) è rischioso
perché si interrompe la sintesi della proteina.
Gi aminoacidi più degenerati sono più frequentemente presenti
nelle proteine, quindi più protetti dal rischio di mutazione.
Quelli con uno o pochi codoni sono più rari nelle proteine.
La terza posizione del codone viene detta posizione di “wobble”
(tentenamento). In questa posizione, gli U e le C possono essere
letti come G nell’anticodone nel tRNA. Allo stesso modo, le A e
le G possono essere lette come U o Y (pseudouridina)
nell’anticodone.
22
Se il tRNA contiene una Inosina nell’anticodone in wobble il tRNA
può leggere codoni nel mRNA che hanno A, U oppure C nella
terza posizione. Nella figura è rappresentato l’esempio della
Glicina (Gly)
23
Molecola di tRNA con l’anticodone di riconoscimento del codone
di mRNA nel codice genetico.
24
Non sovrapponibiltà delle triplette del codice genetico.
25
Risposta al quesito sulla degenerazione del codice in una proteina.
Gi aminoacidi più degenerati sono più frequentemente presenti nelle
proteine, quindi più protetti dal rischio di mutazione. Quelli con uno
o pochi codoni sono generalmente più rari nelle proteine.
Ser 3
Leu 6
Arg 1
Ala 1
Gly 4
Thr 2
Pro 1
Val 3
Ile 2
Cys 6
(3 ponti S-S)
Trp
Met
26


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)


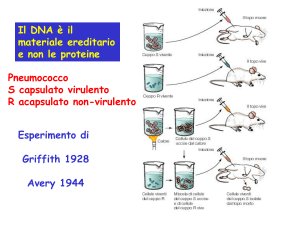






![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)