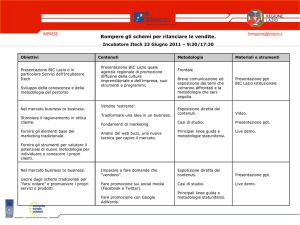
ARGENTO
n.o. = 0, +1
METALLO OSSIDANTE
3 Ag + 4H+ + NO3-
si scioglie in acidi ox. (HNO 3)
3 Ag+ + NO + 2H2O
Forma complessi n.c. = 2
COMPOSTI DI INTERESSE FARMACEUTICO
Ag COLLOIDALE: in disuso, antisettico per ustioni
AgNO3 (FU,BP,USP): “PIETRA INFERNALE”, batteriostatico, per
ustioni
Ag-PROTEINATO (FU): preparazione argento-proteica in H2O
colloidale. Antisettico per mucose (gocce nasali, auricolari,colliri)
[Ag(NH3)]NO3 + HCHO (10%): disinfettante in odontoiatria. HCHO
riduce Ag+
Ag°: film protettivo nella cavità dentale (ATTENZIONE:
caustico ed irritante)
ATTIVITA’ FARMACOLOGICA E TOSSICOLOGICA
Interazione con gruppi sulfidrilici, aminici e carbossilici delle proteine
Interazione con DNA e RNA (basi azotate).
Ag+ + Cl- (nei liq.biologici)
AgCl
Liberazione di Ag +
Azione
antisettica selettiva.
ARGIRISMO: contatto prolungato con Ag + (colorazione grigio-nera
della pelle dovuta a Ag° e Ag 2S), bronchiti, danni renali.
PER INGESTIONE: vomito, gastroenterite, collasso , morte.
DOSE TOSSICA (AgNO3 = 10g)
REAZIONI ANALITICHE
1. (FU, BP, USP): HCl ppt AgCl bianco da sol. di Ag + acide per HNO3.
Ag+ + ClAgCl
AgCl è solubile in NH4OH dil. e/o CO3(NH4)2 formando il
diaminocomplesso incolore e solubile:
2 NH4+ + CO3= 2NH3 + HCO3Ag+ + 2NH3
[Ag(NH3)2]+
Aggiungendo HNO3 dil. si sottrae NH3 e si libera Ag+
H+ + NH3
NH4+
2. (BP): un cromato alcalino ppt Ag 2CrO4 rosso-bruno solubile in
NH4OH e in HNO3 dil.
2Ag+ + CrO4=
Ag2CrO4
CrO4= + 2H+
H2CrO4 in amb.ac. stabile come H2Cr2O7 (arancio)
HNO3
Ka = 22
H2CrO7 Ka = 10-1 viene spostato
3. (USP): in amb. di NH4OH per , HCHO si ossida a formiato riducendo
Ag+ a Ag° (specchio metallico sulle pareti), che si scioglie, per ox, con
HNO3 a :
2[Ag(NH3)2]+ +2OH- +HCHO 2 Ag° +NH4+ + HCOO- +3NH3 +H2O
4. NaOH e KOH ppt Ag+ come AgOH che si stabilizza a Ag 2O bruno
Ag+ + OHAg(OH)
2Ag(OH)
Ag 2O + H2O
5. Un tiosolfato alcalino ppt Ag + come sale bianco solubile in eccesso di
tiosolfato e instabile per :
2Ag++ S2O3=
Ag2S2O3
Ag2S2O3 3S2O3=
2[Ag(S2O3)2]3-
Ag2S2O3 + 3H2O
Ag2S + SO4= + 2H2O +2H+
PIOMBO
n.o. = 0, +2, +4
METALLO DEBOLMENTE RIDUCENTE
Pb+ + 2H+
H2SO4 e HCl non sciolgono Pb
si scioglie in HNO3
Pb++ + H2
PASSIVAZIONE (PbSO 4 e PbCl2
poco solubili)
COMPOSTI DI INTERESSE FARMACEUTICO
Pb(CH3COO)2 (FU): astringente, antinfiammatorio, decongestionante
PbO
(FU):
usato
in
miscela
con
Pb(CH 3COO)2
(“Acque
vegetominerali”)
ATTIVITA’ FARMACOLOGICA E TOSSICOLOGICA
Elemento S e ME a bassissime dosi (poi tossico)
Interazione con enzimi ematopoietici
Pb++ compete con Ca++ fissandosi nelle ossa.
E’ mutageno e teratogeno
SATURNISMO: intossicazione da Pb, astenia, anoressia, anemia,
orletto gengivale nero, accumulo nella milza, fegato, polmoni
(minatori, industrie di vernici, ecc.)
MINIO Pb3O4 antiruggine
Pb(CH2CH3)4 antidetonante
Inquinamento da Pb(CH2CH3)4
PbCl2, PbSO3, PbO e PbBr2.
Dinsintossicazione: fleboclisi di chelato EDTA e dimercaprolo.
REAZIONI ANALITICHE
1. (FU, USP) Pb++ viene ppt con un cromato alcalino a pH = 5
(CH3COOH) come cromato di piombo giallo solubile in HNO 3 dil. e
in NaOH a pH basico per formazione del tetraidrossipiombito solubile
e incolore
Pb++ + CrO4=
PbCrO4
CrO4= + 2H+
H2CrO4 H+
H2Cr2O7
Pb++ + 4OH[Pb(OH)4]22. Pb++ ppt, a freddo, con HCl dil PbCl2 bianco, solubile in H2O bollente
o in NaOH (idrossicomplesso)
Pb++ + 2ClPbCl2
3. (FU) Pb++ ppt a pH 5 (CH3COOH) con I- alcalini, come PbI2 giallo,
solubile in eccesso di I - per complessazione a tetraiodopiombito giallo
solubile
Pb++ + 2IPbI2
PbI2 + 2I[PbI4]24. Pb++ può venir ppt con NaOH come idrossido bianco, solubile in
eccesso di NaOH
Pb++ + 2OHPb(OH)2
Pb(OH)2 + 2OH[Pb(OH)4]25. Pb++ in ambiente acido ppt con H2S il PbS nero
Pb++ + S=
PbS
Se sono presenti ioni Cl - si forma prima il solfocloruro di piombo rossoarancio che in eccesso di S = da PbS solubile in HNO3 dil a
2Pb++ + S= + 2ClPbSCl2 S= PbS + 2Cl3S= + 2NO3- + 8H+
2 NO + 3S + 4H2O
MERCURIO
n.o. = 0, +1, +2
METALLO OSSIDANTE, LIQUIDO, SI SCIOGLIE IN HNO 3 a
Hg + 4H+ + 2NO3Hg2+ + 2NO2 + 2H2O (HNO3 conc)
6Hg + 8H+ + 2NO33Hg22+ + 2NO + 4H2O (HNO3 dil)
Scioglie quasi tutti i metalli dando amalgame
Hg2+ dà complessi a n.c. = 4
COMPOSTI D’INTERESSE FARMACEUTICO
Hg metallico: antidermatitico (unguenti)
HgO (FU): pomata oftalmica (1-5%) giallo; rosso: antivegetativo
HgCl2: “SUBLIMATO CORROSIVO” usato per sterilizzare ferri
chirurgici, tossico, intacca i metalli (in disuso)
HgI2: “ROSSO DI MERCURIO” antibatterico (in disuso)
HgNH2Cl (BO, USP): germicida in dermatologia e per uso oftalmico,
antiparassitario
Derivati organo-mercurici:
Mercuriocromo (FU): disinfettante
Thimerosal (FU): sodioetilmercuriotiosalicilato
Nitrato o borato di fenilmercurio (FU):
conservanti
Diuretici mercuriali: Hg 2+ inibisce il riassorbimento tubulare di Na + e
Cl- legandosi ai gruppi –SH (tossici)
Hg2Cl2: “CALOMELANO” importanza storica quale antisifilitico,
diuretico, purgativo (tossico)
ATTIVITA’ FARMACOLOGICA E TOSSICOLOGICA
Attacca i gruppi polari delle proteine (-SH). Elemento S a bassissime
conc. (0.001g/l). Composti volatili
inalazione diretta tossicità.
Catena alimentare: composti mercuriali degli scarichi industriali
red
a Hg(CH3)2 da parte di microrganismi
Hg(CH 3)2 liposolubile viene
assorbito dai piccoli organismi acquatici
pesce
uomo (GiapponeIraq)
Teratogeno
IDRARGIRISMO: intossicazione cronica.
REAZIONI ANALITICHE (Hg 22+)
1. (FU, USP) Lo ione Hg22+ viene ppt con HCl 6N come calomelano
bianco, che disproporziona in amb. di OH Hg22+ + 2ClHg2Cl2
Hg2Cl2 + 2 NH4OH
Hg + HgNH2Cl + NH4+ + Cl- + 2H2O
nero-grigio
Hg2Cl2 + 2NaOH
Hg + HgO + 2Cl- + 2Na+ + H2O
rosso-marrone-nero
2. (FU, USP) Uno ioduro alcalino ppt Hg 2I2 verde-giallastro, che in
eccesso di I-, disproporziona a Hg° e complesso tetraiodomercurato
Hg22+ + 2IHg2I2
Hg2I2 + 2IHg + [HgI4]23. (FU) Con NaOH, KOH si ottiene un immediato inscurimento
Hg22+ + 2OHHg + HgO + H2O
REAZIONI ANALITICHE (Hg 2+)
1. (FU, USP) Uno ioduro alcalino ppt HgI 2 rosso, che in eccesso di I -,
forma un complesso
Hg2+ + 2IHgI2
HgI2 + 2I[HgI4]22. (FU) Con NaOH o KOH ppt l’ossido giallo-arancio solubile in HCl
Hg2+ + 2OHHgO + H2O
3. (FU) Una soluzione acida di Hg 2+ deposita Hg° su una lamina di Cu:
Hg2+ + Cu
Hg + Cu++
4. Aggiungendo a una sol. di Hg 2+ prima HCl dil e poi NH4OH fino a pH
basico ppt il cloroamiduro mercurico bianco, solubile in acidi forti
(HNO3 o HCl)
Hg2+ + 2Cl- + NH4OH
HgNH2Cl + H2O + ClHgNH2Cl + 2H+
Hg2+ + Cl- + NH4+
5. H2S in amb. acido ppt HgS nero. In difetto di S= si può avere la
precipitazione di solfocloruri di diversa composizione (bianco, giallo,
rosso) che diventano neri per aggiunta di S =. HgS è solubile SOLO in
acqua regia a
Hg2+ + S=
HgS
S= + 2NO3- + 4H+
2NO2 + S + 2H2O
Hg2+ + 4Cl[HgCl4]2-
6. (FU) Da una soluzione acida di Hg 2+, per aggiunta di SnCl2 si ottiene
prima calomelano bianco poi Hg° nero
2Hg2+ + Sn2+ + ClH+
Hg2Cl2 + Sn4+
Hg2Cl2 + Sn2+
H+
2Hg + Sn4+ + 2Cl-