MIOGLOBINA
ed
EMOGLOBINA
• I vertebrati utilizzano le
globine per fornire ai propri
tessuti un costante approvvigionamento di O2.
• Emoglobina e mioglobina sono
proteine globulari contenenti
gruppi eme che sono in grado di
legare l’O2.
Ruolo della mioglobina
• L’O2 può essere immagazzinato mediante il
legame alla mioglobina
• La mioglobina è presente nel muscolo
scheletrico e nel muscolo cardiaco.
• Garantisce un veloce spostamento dell’O2
all’interno delle cellule muscolari.
Ruolo dell’emoglobina
• L’emoglobina trasporta
l’O2 dai polmoni ai
tessuti, dove una parte
di esso può essere
direttamente utilizzata
per il metabolismo nei
mitocondri, e CO2 e ioni
H+, rilasciati dai
processi ossidativi, dai
tessuti ai polmoni.
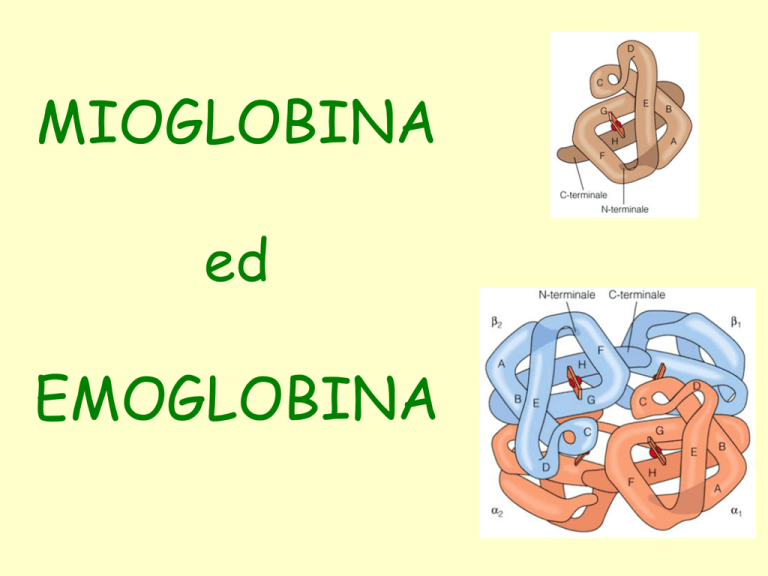
Struttura della mioglobina
• La MIOGLOBINA è una
proteina globulare di
piccole dimensioni
costituita da una singola
catena polipetidica
ripiegata attorno ad un
gruppo prostetico, l’eme,
che contiene il sito di
legame per l’O2.
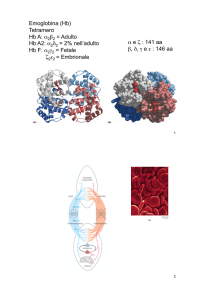
Emoglobina
• L’EMOGLOBINA è una
proteina tetramerica,
formata da 2 subunità
a (141 aa) e 2 subunità
b (146 aa).
• Le catene a e b sono
molto simili tra loro ma
non identiche e
presentano una struttura molto vicina alla cate
na polipetidica della
mioglobina.
• Ciascuna catena contie
ne un gruppo eme.
L’EME
• L’emoglobina e la mioglobina
contengono il gruppo ferroporfirinico EME che conferisce
la colorazione rosso intensa alle
proteine.
• E’ costituito da una complessa
struttura ad anello, la
protoporfirina IX, a cui è legato
un atomo di ferro (Fe2+).
•L’atomo di ferro ha 6 legami
di coordinazione:
- 4 nel piano della porfirina
e impegnati all’interno del
piano.
- 2 perpendicolari a questo
piano, di cui:
•uno dei due legami di coordinazione perpendicolari è impe
gnato con un atomo di azoto
della catena laterale di un
residuo di istidina (His).
•l’altro è libero e serve a
legare una molecola di O2.
Curva di legame dell’ossigeno per la
mioglobina e l’emoglobina
• La mioglobina, proteina di riserva dell’ossigeno, presenta
un sito singolo di legame per l’O2 e la curva che descrive
il legame è di tipo iperbolico: con il crescere dalla PO2, si
tende asintoticamente alla saturazione.
La concentrazione di ossigeno è espressa come PO2 e la quantità di siti
legati è espressa come frazione ( YO2) o come percentuale di saturazione.
• L’emoglobina, proteina di trasporto,
presenta 4 siti di legame per l’O2.
• L’efficienza nel trasporto dell’ossigeno è
ottenuta attraverso il legame cooperativo
positivo da parte dei 4 siti e la curva che
descrive questo tipo di legame è una curva
sigmoide.
• → Cooperatività positiva: il legame di una
molecola di O2 aumenta la probabilità di
legare altro O2 alle altre subunità della
proteina.
• La curva sigmoide di legame riflette la transizione
della proteina da uno stato conformazionale (T) a
bassa affinità (per O2) in corrispondenza di basse
pressioni di O2 (tessuti periferici) a uno stato
conformazionale (R) ad alta affinità in
corrispondenza di elevate pressioni di O2 (polmoni).
•Il passaggio dallo
stato deossi (senza
O2) allo stato ossi
(con O2) provoca un
cambiamento nella
struttura terziaria
e quaternaria.
Cambiamento della struttura quaternaria
dell’emoglobina in seguito all’ossigenazione:
modello più recente
aumento progressivo della PO2
Le subunità deossigenate hanno spigoli quadrati, quelle ossigenate bordi curvi.
La progressiva ossigenazione provoca un cambiamento nella struttura terziaria in
ciascuna subunità.
Quando entrambi i dimeri ab contengono uno o più subunità ossi, ha luogo la
transizione dallo stato T allo stato R.
Effetti di altri ligandi (effettori allosterici) sul
legame dell’emoglobina all’O2
Risposta ai cambiamenti di pH: effetto Bohr:
•
Una caduta di pH a livello dei tessuti, indice di un’alta attività metabolica
e di fabbisogno di O2, determina la protonazione dell’emoglobina e
favorisce la conformazione deossi (quella priva di ossigeno), che promuove
il rilascio di O2.
•
Circa il 40% degli ioni H+ totali si lega alle catene laterali di diversi residui
aminoacidici della proteina (es. istidina) per essere trasportato ai polmoni.
Aumento della concentrazione di
anidride carbonica (CO2)
• Il rilascio di CO2 dai tessuti
riduce l’affinità per l’O2 sia
per una diminuzione del pH
(effetto Bohr) sia per
modificazioni conformazionali
indotte dal legame tra
emoglobina e CO2.
• Il 15-20% della CO2 viene
trasportato verso i polmoni
legato all’emoglobina.
• La CO2 rimanente viene
trasportata sotto forma di
HCO3- o CO2 disciolta.
2,3-Bifosfoglicerato
• E’ un effettore allosterico eterotropico che regola i
cambiamenti a lungo termine dell’affinità di legame per
l’O2.
• Il BFG riduce profondamente l’affinità dell’emoglobina
per l’O2 poiché lega e stabilizza la forma deossi
dell’emoglobina.
• Ha una funzione importante nell’adattamento fisiologico
alla bassa pressione di O2.
Differenze tra
emoglobina
e
mioglobina
• Trasporto di ossigeno dai
polmoni ai tessuti periferici
e di anidride carbonica dai
tessuti periferici ai polmoni
• Struttura quaternaria
• Curva di saturazione
sigmoide ( 4 siti di legame:
legame cooperativo)
• Modulazione da parte di
effettori allosterici
(protoni, anidride carbonica,
bifosfoglicerato)
• Riserva di ossigeno per la
cellula muscolare
• Struttura terziaria
• Curva di saturazione
iperbolica (un sito di
legame)
• Nessuna modulazione
L’anemia falciforme
• L’emoglobina presenta 300
varianti genetiche
(sostituzione di uno o più
residui aminoacidi) che
provocano solo piccoli
effetti strutturali e
funzionali.
• Un’eccezione è la
sostituzione del glutammato
in posizione 6 della catena b
con una valina che
producendo una zona
idrofobica “appiccicosa”
che determina
un’associazione anormale
dell’emoglobina.
L’anemia falciforme
• Quando la concentrazione di
ossigeno cade al di sotto di un certo
livello critico, le subunità
polimerizzano in aggregati fibrosi
lineari che modificano la forma della
cellula.
• Il risultato di questi eventi è
l’assunzione da parte degli eritrociti
di una forma a falce.
Eritrociti sani
Proteine di membrana:
Canali
Pompe
Recettori
Canali, pompe e recettori
• Il doppio strato lipidico delle membrane
biologiche è intrinsecamente impermeabile agli
ioni e alle molecole polari, la permeabilità è
conferita da due classi di proteine:
le pompe ed i canali.
• I recettori sono canali o altre proteine di
membrana che favoriscono il passaggio di segnali
chimici dallo spazio extracellulare al citoplasma.
I CANALI
• I canali ionici sono complessi
macromolecolari costituiti da diverse
subunità proteiche.
• Attraversano, a tutto spessore, una
membrana biologica e consentono il
passaggio di ioni (attraverso il poro),
nella direzione determinata dal loro
gradiente elettrochimico.
• In presenza di un gradiente elettrico
è possibile che non vi sia flusso
transmembrana di ioni, anche in
presenza di un gradiente di
concentrazione.
• Il canale ionico può essere
estremamente selettivo per
particolari ioni.
I CANALI
• Esiste in uno stato chiuso o in uno
stato aperto.
• La transizione tra lo stato aperto e
lo stato chiuso può avvenire:
1. modificando la differenza di
voltaggio ai due lati della membrana
(canali a controllo di potenziale)
2. legando una sostanza chimica ad un
recettore nel canale o nelle sue
vicinanze (canale a controllo di
ligando).
3. per azione dello stiramento
meccanico o dalla pressione
(recettori somatosensitivi o uditivi).
• Lo stato aperto dei canali spesso si
converte in uno stato inattivato.
Es. di canali
• Canali del sodio (Na+) o del potassio
(K+)sulla membrana plasmatica delle cellule
eccitabili.
• Canali del calcio (Ca2+) sul reticolo
sarcopla- smatico.
• Recettore dell’acetilcolina (canale cationico) sulla placca neuromuscolare.
Es. di canali a controllo di potenziale
• Il canale del sodio presente sulle membrane di cellule
eccitabili (neuroni…) è costituito da 4 subunità legate
covalentemente tra loro
• Il canale è aperto dalla depolarizzazione del potenziale di
membrana che determina una variazione di conformazione
delle subunità.
• Favorisce il passaggio di ioni Na+ dallo spazio extracellulare
al citosol.
LE POMPE ATPasi
•
•
Le pompe ATPasi sono una famiglia di proteine di
membrana che utilizza l’idrolisi di ATP per
pompare ioni attraverso le membrane.
Le pompe hanno la funzione di generare gradienti
ionici attraverso le membrane o favorire l’accumulo
di ioni in un compartimento cellulare.
Es. di pompe ATPasi
- pompa Na+/K+-ATPasi sulla membrana plasmatica
che genera un gradiente elettrochimico.
- pompa protonica sulla membrana dei lisosomi.
- Ca2+-ATPasi sulla membrana del reticolo
sarcoplasmatco che determina accumulo di ioni Ca2+
e sulla membrana plasmatica per favorire
l’allontanamento degli ioni Ca2+.
- la pompa H+/K+-ATPasi sulla membrana plasmatica
delle cellule ossintiche, responsabile del pompaggio
nello stomaco di una quantità sufficiente di protoni
per abbassare il pH al di sotto di 1,0.
La pompa Na+/K+
• L’idrolisi dell’ATP operata dalla
pompa fornisce l’energia necessaria
per il trasporto di 3 ioni Na+ da
l’interno all’esterno e di 2 ioni K+ da
l’esterno all’interno della cellula generando il gradiente elettrochimico.
• Il gradiente di concentrazione degli
ioni Na+ e K+ nelle cellule animali
regola il volume cellulare, rende
elettricamente eccitabili i neuroni e i
miociti e favorisce il trasporto di
zuccheri e amminoacidi.
I RECETTORI
• I recettori sono deputati al riconoscimento di
segnali fisici o chimici provenienti dall’ambiente
circostante e alla trasduzione in segnali
intracellulari.
• Si suddividono in
- recettori di membrana
- recettori intracellulari
RECETTORI DI MEMBRANA
• Sono proteine transmembrana con un dominio
extracellulare in grado di legare una molecola segnale
(il ligando) e un dominio intracellulare.
• La proteina quando lega il proprio ligando subisce una
modificazione conformazionale anche nel dominio intracellulare.
• Le informazioni sono trasferite dal complesso ligandorecettore al citoplasma attraverso molecole dette
secondi messaggeri che attivano le cascate di
trasduzione del segnale o attraverso l’apertura di un
canale ionico.
• Sono di due tipi:
- i recettori ionotropici (recettori-canali ionici)
- i recettori metabotropici (regolano la sintesi di secondi
messaggeri).
I recettori 7TM
• I recettori a 7 eliche transmembrana
(recettori 7TM) sono recettori
metabotropici responsabili della
trasmissione delle informazioni indotte
da segnali molto diversi tra loro (fotoni,
ormoni e neurotrasmettitori).
• Il legame di un ligando proveniente
dall’esterno della cellula induce nel
recettore 7TM una modificazione
conformazionale che può essere rilevata
all’interno della cellula e determina
l’attivazione delle proteine G.
• La proteina G è un intermediario
essenziale nella via di trasduzione del
segnale e una volta attivata trasmette
segnali legandosi ad altre proteine.
• I segnali possono essere di tipo
attivatorio o inibitorio
Es. di recettori 7TM
Recettori per:
•
•
•
•
Adrenalina, Noradrenalina
Dopamina
Serotonina
Adenosina
Recettori ionotropici
• Sono recettori canale la
cui apertura determina
un flusso di elettroni verso l’interno della cellula.
• Sono attivati da ligandi
specifici.
• Es: recettore del GABA
(acido g-aminobutirrico) e
dell’acetilcolina.
Quesiti
1)Quali sono le principali differenze struttura-attività tra emoglobina e
mioglobina?
2)Descrivere i legami del Fe2+ all’interno dell’eme.
3)Rappresentare le curve di ossigenazione della Mioglobina e
dell’Emoglobina.
4)Quale è l’effetto della diminuzione del pH sul legame
dell’emoglobina all’ossigeno?
5)Attraverso quale meccanismo il 2,3-bifosfoglicerato diminuisce
l’affinità dell’emoglobina per l’ossigeno?
6)Che funzione hanno le pompe ATPasiche? Fare almeno due
esempi di pompe ATPasiche.
7)Quali sono le principali caratteristiche dei Recettori di Membrana?