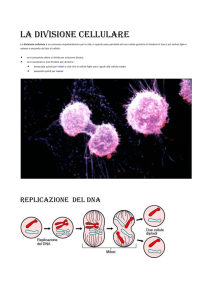
IL CICLO CELLULARE
Chiara Leo
DVM, Resident ACVIM-Oncology
AOI Center, Rothusstrasse 2b, 6331 Hünenberg, CH
[email protected]
Il ciclo cellulare è alla base dell’accrescimento e della sopravvivenza degli organismi pluricellulari.
I difetti nella regolazione delle varie fasi induce la formazione e proliferazione incontrollata delle
cellule neoplastiche, pertanto riuscire a capire e determinare con esattezza i meccanismi e tutte le
molecole coinvolte è di vitale importanza nell’ambito dell’oncologia.
Qui verranno presi in considerazione i meccanismi base del ciclo cellulare di una cellula eucariota
normale, i meccanismi di regolazione ed induzione di tale ciclo e le differenze chiave con la cellula
tumorale.
FASI DEL CICLO CELLULARE IN UNA CELLULA NORMALE:
Le cellule non attive metabolicamente o non richiamate a riparare un danno genetico, permangono
in uno stato di quiescenza chiamato G0: alcune cellule una volta specializzate raramente escono da
questo stato (es. cellule nervose), mentre altre particolarmente attive praticamente non si trovano
mai in G0 (es. cellule del midollo osseo).
Il ciclo è composto fondamentalmente da due principali momenti: l’interfase (essenzialmente un
periodo di preparazione alla mitosi, in cui vengono sintetizzati i componenti cellulari ed il materiale
genetico) e la mitosi (equa e precisa ripartizione del materiale genetico e formazione delle cellule
figlie).
L’INTERFASE impegna il 90% circa del ciclo cellulare ed è a sua volta suddivisa in sottofasi:
G1: G è l'iniziale della parola Gap, intervallo. Questo si riferisce al fatto che in tale fase (come in
G2) non accade nulla di realmente evidente nel nucleo della cellula, anche se di fatto essa è
metabolicamente molto attiva. Questa è una fase di accrescimento e di preparazione alla divisione:
la cellula aumenta di dimensioni e sintetizza una gran quantità di proteine (tra cui DNA) e organuli,
come i mitocondri e i ribosomi. La cromatina si trova svolta nel nucleo in lunghi filamenti non
ancora organizzati. A differenza delle altre fasi del ciclo, che hanno durata costante
indipendentemente dal tipo di cellula madre, la fase G1 può avere durata molto variabile, da poche
ore ad alcuni giorni, mesi, anni, tanto che per alcune cellule altamente differenziate la divisione tra
G1 e G0 non è più riconoscibile.
S: ha luogo la duplicazione del DNA (Sintesi), evento essenziale per garantire che il patrimonio
genetico sia trasmesso interamente e correttamente alla discendenza. In questa fase la cromatina
presente nel nucleo comincia a coartare e spiralizzare su se stessa, formando catene più spesse e
corte: comincia l’organizzazione in cromosomi. Al termine di questa fase i cromosomi sono doppi:
ciascuno di essi è formato da due cromatidi identici. La fase S è estremamente delicata ed
importante: è qui che l’organismo si “accorge” di eventuali errori di duplicazione del DNA e decide
se indurre inviare segnali di induzione all’apoptosi o lasciare la cellula continuare il ciclo.
G2: si ha ancora un'intensa attività metabolica. In particolare, la cellula sintetizza molte proteine
(compreso l’RNA) che sono indispensabili per l'imminente divisione cellulare.
MITOSI: è suddivisa in 6 passaggi
PROFASE: l’apparato mitotico si forma. All’interno del citoplasma si trovano delle piccole
strutture di forma cilindrica chiamate centrioli: sono quattro e si dispongono a coppie formando un
angolo l’una con l’altra in prossimità di un polo del nucleo. Ogni coppia di centrioli, attorno alla
quale è attaccato del materiale pericentriolare, è chiamato centrosoma: il materiale pericentriolare
comincia a crescere a partire dai centrioli e, grazie alla spinta retrograda data dalla crescita, fa
allontanare i centrosomi uno dall’altro. I filamenti a questo punto assomigliano a raggi (aster),
diventano lo scheletro di quello che verrà chiamato fuso mitotico e cominciano a penetrare nella
membrana nucleare per aiutare la separazione. Nel frattempo, all’interno del nucleo, la cromatina
termina il suo avvolgimento e si organizza in cromosomi ben definiti.
PROMETAFASE: I tubuli penetrano talmente la membrana nucleare da frammentarla. Le
digitazioni intranucleolari agganciano i cromosomi e cominciano ad attirarli a sé attraverso la
contrazione del materiale pericentriolare.
METAFASE: il gioco di spinte e contrazioni dei raggi del fuso, spinge i centrioli lontani uno
dall’altro ai poli della cellula e contemporaneamente avvicina i cromatidi l’uno contro l’altro
all’equatore della cellula, a formare la piastra metafasica del fuso mitotico.
ANAFASE: i cromatidi di ogni cromosoma vengono attirati versi i centromeri: le coppie di
cromatidi si separano formando i cromosomi figli.
TELOFASE: Il fuso mitotico scompare e si formano le membrane nucleari che avvolgono i nuovi
gruppi di cromosomi.
CITOCINESI: la membrana cellulare della cellula madre si contrae e si restringe al centro, fino a
dividersi in due nuove cellule.
REGOLAZIONE POSITIVA DEL CICLO CELLULARE:
L’inizio del ciclo cellulare e la progressione attraverso le varie fasi non è però cosi semplice:
avviene attraverso una complicata serie di eventi, reazioni e risposte a stimoli esterni (come ad
esempio stimolatori di crescita). I punti di regolazione del ciclo vengono chiamati “checkpoints” e
si riferiscono a meccanismi con i quali la cellula può attivamente bloccare la sua progressione
attraverso il ciclo per assicurare la trasmissione di informazioni genomiche corrette o, in caso
contrario, per attivare i percorsi di morte cellulare.
La successione tra una fase e l’altra del ciclo cellulare è controllata principalmente da una famiglia
di enzimi detti genericamente chinasi dipendenti da ciclina (CDK) che devono il loro nome al fatto
che si attivano una volta legati a composti regolatori, le cicline, anch’esse di natura proteica. La
sintesi delle cicline è a loro volta sotto il controllo di geni detti cdc (cell division cycle) che
regolano la sintesi delle cicline, qualitativamente e quantitativamente a seconda del momento
cellulare e della richiesta: la loro classificazione è infatti caratteristica dello stadio del ciclo cellulare
in cui vengono espresse (es. ciclina D modula il passaggio G0G1 attraverso l’interazione con
CDK2, CDK4, CDK5, le cicline A ed E si legano a CDK2 e CDK4 per il passaggio tra G1S, le
cicline B1 e B2 si legano a CDK1 per il passaggio G2M). Una normale cellula può interrompere
il suo ciclo in modo permanente o temporaneo in stadio G0; durante questo periodo risente in modo
particolare delle variazioni dell’ambiente esterno (es. diminuzione della concentrazione di nutrienti,
di ossigeno, presenza di fattori di mitosi o di differenziazione…). Se però le condizioni sono
favorevoli e gli stimoli sufficienti al salto in fase attiva, il checkpoint tra G0 e G1 (o tra ogni altra
fase del ciclo) viene superato attraverso l’attivazione di una CDK: quest’ultima si lega ad una
ciclina a formare un complesso ciclina-CDK. Il complesso necessita a questo punto di un secondo
meccanismo di attivazione, rappresentato dalla fosforilazione di uno specifico residuo di treonina o
serina da parte della chinasi CDK-attivante o CAK: il gruppo fosfato è relativamente grande, carico
negativamente e quindi molto idrofilico, perciò, se aggiunto al gruppo –OH della serina o della
treonina modifica radicalmente la distribuzione spaziale degli aminoacidi adiacenti provocando un
cambiamento locale della struttura della proteina che può indurre delle profonde variazioni nella sua
funzione.
Esiste un’altra proteina che riveste un ruolo chiave nel passaggio di una cellula dallo stato di riposo
allo stato replicativo: si tratta di Rb (proteina di retinoblastoma) che, se ipofosforilata, è attiva ed
impedisce la progressione del ciclo cellulare, di fatto congelando la cellula in G0. La sua rifosforilazione significa invece disattivazione di Rb e quindi sblocco del ciclo cellulare.
REGOLAZIONE NEGATIVA DEL CICLO CELLULARE:
Così come induttori, esistono anche inibitori del ciclo cellulare, o meglio meccanismi di blocco
degli induttori stessi. Per esempio la cellula può inattivare i complessi ciclina-CDK tramite
l’intervento di una fosfatasi (CDC25) che rimuove il gruppo fosfato sulla treonina. Oppure può
aggiungere un gruppo fosfato di troppo (questa volta su un residuo di tirosina) per azione di una
chinasi chiamata Wee-1. I complessi ciclina-CDK possono infine essere inibiti dall’interazione con
una seconda classe di proteine: gli inibitori delle chinasi ciclino dipendenti (CKI).
L’importanza di queste piccole proteine diventa chiara: quando una cellula perde questi meccanismi
di regolazione del ciclo, acquista virtualmente la capacità di replicare indefinitivamente, diventa
quindi una cellula tumorale.
Le CKI sono divise in due famiglie in base alle loro caratteristiche strutturali ed alla loro specificità
di legame; la prima famiglia è formata dagli inibitori di CDK4, anche detti INK4 (p16INK4a,
p15INK4b, p18INK4c, p19INK4d). Il secondo gruppo comprende le proteine della famiglia Cip/Kip che
legano ed inibiscono esclusivamente i complessi ciclina-CDK che intervengono in G1 ed S
(p21Cip1/Waf1, p27kip1, p57kip2). Di questo gruppo, la proteina p27 è molto nota, viene espressa in
quasi tutti i tessuti normali e blocca la progressione da G1 a S legandosi ed inibendo il complesso
ciclina/E-CDK2.
I CONTROLLORI DI QUESTI COMPLESSI MECCANISMI: Myc e Ras, p53
Precedentemente sono stati citati i fattori di crescita che interagiscono con la cellula e la guidano
attraverso il ciclo cellulare. Questi fattori (che possono anche essere fattori inibenti o fattori di
differenziazione) “parlano” ai geni della cellula, i quali a loro volta esprimono l’ordine di produrre
fattori di trascrizione che saranno i veri mediatori delle fasi del ciclo cellulare.
I due geni più conosciuti in questo complicato processo sono myc e ras, responsabili di produrre i
due fattori di trascrizione Myc e Ras.
La proteina Myc partecipa alla regolazione di p27 nella fase G1 attraverso diversi percorsi, ma in
sostanza sempre antagonizzandone la funzione inibitoria.
Ras invece è utilizzata come scintilla di accensione per il passaggio da G0/g1 a S: essa interviene
principalmente nella fosforilazione della Rb.
In ultimo ricordiamo il gene p53, un gene oncosoppressore che in presenza di danno al DNA,
arresta la cellula in fase G1.
DIFFERENZE TRA CELLULE NORMALI E CELLULE NEOPLASTICHE
Che cosa fa di una cellula normale una cellula tumorale? La risposta è insieme semplice e
difficilissima: la deregolazione del suo ciclo cellulare.
Tutti i meccanismi che sono stati finora citati (e molto più di questi) possono subire mutazioni,
deplezioni o amplificazioni che portano infine ad una perpetua ed incontrollata replicazione
cellulare. La cellula acquista infine peculiarità chiamate “hallmarks of cancer”:
• Capacità re plicativa illimitata
• Autosufficienza dai segnali di crescita
• Insensibilità ai segnali inibitori
• Fuga dall’apoptosi
• Neoangiogenesi
• Capacità di invasione tissutale e metastatizzazione
BIBLIOGRAFIA:
1. Guyton A., Hall J.E, Textbook Of Medical Physiology,11th Edition, Saunders Eds.
2. Tannock I, Hill R., The Basic Science Of Oncology, 4th Edition, New York Eds.