UNIVA 2014
La Degenerazione Frontotemporale Lobare e
gli aspetti di confine
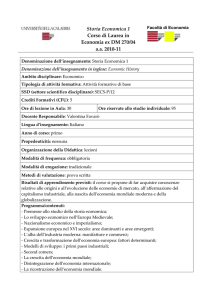
La Demenza Fronto-Temporale: genetica e fenotipi
Journal Club
Maria Anfossi
Una della scoperte più interessanti che riguardano la genetica della FTLD è arrivata da
uno studio di linkage di famiglie affette da FTD-MND che ha portato all’identificazione
di un potenziale locus di suscettibilità sul cromosoma 9p21.22 (Morita et al 2006)
Nel 2011 due gruppi di ricerca hanno identificato, in maniera indipendente, la presenza
di un’espansione di una ripetizione esanucleotidica (GGGGCC) presente in una
porzione non codificante del gene C9orf72 che è proprio posizionato sul cromosoma
9p21 (Rentonet al.2011, De-Jesus Hernadez et al., 2011).
Il gene C9orf72 è costituito da 12 esoni compresi due primi esoni alternativi non codificanti (1a
e 1b), codifica per una proteina la cui funzione non è stata ancora chiarita;
Vengono prodotte tre trascritti differenti:V1,V2,V3.
le varianti V1 e V3 dei trascritti codificano per una proteina di 481 aminoacidi, mentre la V2
codifica per un’isoforma 222 aminoacidi
Nei pre-mRNA la ripetizione esanucleotidica espansa si può localizzare in due siti: a livello
della regione promotrice (V1) oppure nel primo introne (V2 e V3).
Espressa in maniera ubiquitaria nell’organismo. Nel SN è espressa in tutte le regioni con più
alti livelli nel cervelletto
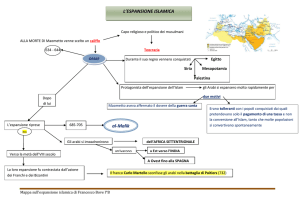
COMPLESSITA’ DEL QUADRO CLINICO
I fenotipi principali associati
all’espansione sono la sclerosi laterale
amiotrofica (SLA) e la demenza
frontotemporale lobare (FTLD).
Nei pazienti affetti da SLA e FTLD con
mutazione C9ORF72 sono descritti
sintomi ‘atipici’:
Sintomi psicotici (allucinazioni e
deliri)
Altri disturbi psichiatrici (es. disturbo
ossessivo compulsivo)
Sintomi parkinsoniani
Non–Motor Phenotypes
Il fenotipo FTLD maggiormente associato alla mutazione C9ORF72
è bvFTD, a seguire afasia non fluente progressiva (PNFA), mentre la
demenza Semantica (SD) risulta essere poco associato.
Con una frequenza inferiore all’1% l’espansione è stata individuata
in AD con autopsia confermata.
All’interno dei casi bvFTD-c9orf72 related c’è un numero
significativo di casi che presentano psicosi.
Motor phenotypes
SLA con onset bulbare è il fenotipo maggiormente
associato all’espansione, inoltre è stata osservata
un incidenza di demenza o una storia familiare per
demenza in pazienti C9ORF72-SLA.
Motor phenotypes
L’espansione C9ORF72 è stata associata ANCHE :
Parkinsonismo in quanto la neuropatologia associata al C9ORF72 colpisce la substantia nigra.
Degenerazione olivopontocerebellare in un paziente con storia familiare positiva per SLA.
«fenocopie» della malattia di Huntington: pazienti con sintomi clinici simili a HD ma senza
mutazioni nel gene HTT.
CBD un solo paziente.
Frequenza dell’espansione di C9ORF72
L’espansione in C9orf72 rappresenta
la causa più comune per SLA, FTLD
e SLA-FTLD familiare oltre a
contribuire alle forme sporadiche di
queste malattie
La più alta frequenza di mutazione è
stata osservata nella popolazione
caucasica del Nord Europa; alcuni
studi suggeriscono che ci possa
essere un comune fondatore
(Smith et al., 2012)
Onset variabile da 30 a 76 anni per
FTLD e da 27 a 83 anni per la SLA
L’elevata variabilità dell’onset e della
durata della malattia suggerisce la
presenza di modificatori genetici o
ambientali
Diversi studi suggeriscono che ci possa
essere stato un fondatore comune per
l’espansione. Infatti lo screening di
numerose popolazioni per C9ORF72
evidenzia un forte LD tra l’ espansione e un
allele di rischio (A-allele rs389942)
all’interno dell’aplotipo al locus 9p21 (Mok
et al.2012).
La questione è:
•tutti i carriers dell’espansione condividono
un comune ancestore
•l’aplotipo con l’allele A conferisce un
maggiore rischio di mutazione.
L’ analisi di 42-SNPs nei carriers
dell’espansione in Europa, USA e Australia
fa ipotizzare che ci sia un comune
ancestore circa 100 generazioni fa nel nord
Europa ( Renton et al.,2012). Uno studio
successivo con 82-SNPs corregge a 250 il
numero di generazioni precedenti al
fondatore (Smith et al.,2013).
Ipotesi effetto fondatore per
l’espansione C9ORF72
DOMANDE ANCORA APERTE
• Qual è la normale funzione di C9ORF72?
• Qual è il numero di ripetizioni che rende patologica l’espansione?
• La ripetizione è stabile o è soggetta ad instabilità causando il fenomeno
dell’anticipazione?
• Che impatto ha la misura della ripetizione sul fenotipo clinico (onset, durata di
malattia, gravità)?
• Qual è il contributo del mosaicismo somatico associato al C9ORF72 sul
fenotipo clinico?
• Qual è il meccanismo patologico associata all’espansione C9ORF72?
• Qual è il ruolo delle inclusioni p62- positive eTDP-43 negative/positive, e qual
è il contributo della patologia cerebellare?
• Qual è il numero di ripetizioni che rende patologica l’espansione?
• Qual è il contributo del mosaicismo somatico associato al C9ORF72 sul fenotipo clinico?
Allele normale C9ORF72 da 2 a 24 G4C2 repeats.
o Cut-off patologico>24 unità (van der Zeen et al, 2012)
o Cut-off >30 unità (Renton et al, 2011).
Entrambi i cut-off vanno utilizzati con cautela in quanto
sono stati individuati in soggetti di controllo (0,17%).
Larghe espansioni (>700 unità) sono soggette ad
instabilità (Buchmanet al, 2013) ciò potrebbe in parte
spiegare l’eterogeneità somatica presente nei vari
tessuti incluso il SN. Nel cervelletto sono state
osservate lunghezze di ripetizione più corte
(1667unità) rispetto alla corteccia frontale (5250unità)
• L’instabilità della ripetizione può causare il fenomeno dell’anticipazione?
Alcuni studi riportano un’anticipazione dell’onset tra genitore e figli; una variabilità
intrafamiliare relativa al fenotipo patologico è stata osservata nei carriers dell’espansione
C9ORF72
• Che impatto ha la misura della ripetizione sul fenotipo clinico (in particolare durata di malattia e
gravità)?
Non esiste nessuna evidenza circa la relazione tra la
lunghezza della ripetizione e la severità del fenotipo
clinico (Chiò et al.,2012)
Altra caratteristica della mutazione nel C9orf72 è
quella della penetranza incompleta-età correlata:
<35 anni bassa penetranza
58 anni penetranza intorno al 50%
80 anni piena penetranza
Associazione dell’espansione C9orf72 con mutazioni nei geni SLA, FTD
Numerosi dati di letteratura mostrano l’associazione dell’espansione C9orf72 sia con mutazioni dal
significato clinico dimostrato e sia con mutazioni dalla patogenicità non chiara:
TDP-43 (Cooper-Knock et al.,2012)
FUS (van Blitterswijk et al.,2012; Millecamps et al., 2012)
SOD1 (van Blitterswijk et al., 2012; Millecamps et al., 2012)
OPTN (Opteneurin) (Millecamps et al., 2012)
ANG (Angiogenin)(Millecamps et al., 2012)
UBQLN2 (Ubiquilin-2) (Millecamps et al., 2012)
DAO (D-amino-acid oxidase) (Millecamps et al., 2012)
GRN (Ferrari et al 2012)
PSEN2 (Ferrari et al 2012)
MAPT (King et al., 2013)
SQSTM1 (Facto et al.,2011;Rubino eta.2012)
Qual è il meccanismo patologico associata all’espansione C9ORF72?
Meccanismi patogenici:
Loss of function:
Gain of function:
1. Aploinsufficienza
2. RAN translation dell'espansione per
formare dipeptide repeat protein
3. Formazione di RNA foci tossica
LOSS-OF-FUCTION: è
stato osservato un
decremento del 50%
(solo per la variante1)
GAIN-OF-FUNCTION: in brain tissue
proveniente da carriers
dell’espansione, sono stati osservati
aggregati nucleari e citoplasmatici
rispettivamente formati da RNA foci e
dipeptidi ripetuti
Loss of function: APLOINSUFFICIENZA
Il meccanismo di APLOINSUFFICIENZA è
supportato dall’osservazione che
l’espansione conduce ad una riduzione di
circa il 50% di C9ORF72 mRNA nella
corteccia frontale e in linfoblasti provenienti
da portatori dell’espansione.
L’ipotesi più accreditata è quella che
l’espansione possa causare una metilazione
aberrante delle isole di CpG nella regione del
promotore di C9ORF72 conducendo ad una
downregulation del suo mRNA .
Del resto questo è un meccanismo comune
anche ad altre malattie causate da
espansioni ripetute.
Gain of function: RNA foci
Il meccanismo associato ad un guadagno di
funzione del RNA prende il nome RNA foci
L’espansione viene trascritta in RNA (G4C2-RNA);
questo mRNA aberrante andrà a sequestrare RNA
binding proteins (hnRNA3) formando una struttura
che prende il nome RNA G-Quadruplex (Reddy et
al.,2013; Fratta et al.,2013).
G-quadruplex sono delle strutture estremamente
stabili che si accumulano nei neuroni come foci
neurotossici.
Foci neurotossici sono stati individuati nei nuclei
dei neuroni della regione corticale frontale e del
midollo spinale in pazienti portatori
dell’espansione.
G-quadruplex si formano da sequenze ricche di guanina
a partire dall’RNA a singolo filamento Quattro guanina
interagire attorno a un ione positivo, facendo un
quadrato chiamato G-quartetto, questi quadrati di
guanina sovrapposti costituiscono un quadruplo. Un
singolo filamento di acido nucleico può formare un
quadruplo.
Gain of function: RAN traslated proteins
Altro meccanismo ipotizzato associato al
guadagno di funzione dell’RNA è la
formazione di una proteina costituita da
dipeptidi ripetuti attraverso un meccanismo
denominato RAN (repeat-associated non–
ATG).
I dipeptidi ripetuti si formano a partire dal
trascritto espanso senso e antisenso, con
formazione di 6 tipi di proteine RAN
(antisenso: Pro-Arg, Pro-Ala, Gly-Pro; senso:
Gly-Ala; Gly-Arg, Gly-Pro) che si accumulano
sottoforma di aggregati citoplasmatici in
diverse regioni del cervello (Zu et al., 2013)
N.B. La caratteristica di questo meccanismo è
la trascrizione bidirezionale e la traduzione di
entrambi i filamenti di RNA.
Questo dato è unico in quanto solitamente
viene trascritto e tradotto solo il filamento
senso.
I risultati fin qui raggiunti, permettono
l’inserimento dei casi di FTD-MND alla
sempre crescente classe di malattie
associate all’espansione di ripetizioni non
codificanti, come la Distrofia miotonica
(DM1 e DM2), la Sindrome dell’X-fragile
associata a tremori ed atassia (FXTAS) e
a molte sindromi di atassia-cerebrospinali
(SCA8, SCA10, SCA31, SCA36).
Tutte queste patologie sono riconducibili ad un meccanismo patologico comune:
accumulo in foci a livello nel nucleo e/o del citoplasma delle cellule interessate a partire da mRNA
abberrante.
Tali depositi a loro volta, sequestrano varie proteine RNA-binding, portando così ad una disregolazione dei
normali processi di splicing alternativo con conseguente morte neuronale.
• Qual è il ruolo delle inclusioni p62-positive eTDP-43 negative/positive?
• Qual è il contributo della patologia cerebellare?
La lesione più caratteristica dei carriers dell’espansione
C9orf72 è rappresentata da inclusioni citoplasmatiche e
nucleari p62+ nel cervelletto e nell’ippocampo; le
inclusioni TDP43 non sono sempre presenti
Marker caratteristico solo dell’espansione C9ORF72
Nelle altre regioni del SN in particolare nella corteccia
cerebrale e nel sistema motorio piramidale sono
presenti inclusioni p62+ e TDP43 + prevalentemente di
tipo B.
Le inclusioni TDP-43 negative contengono proteine
costituite da DPR mentre nelle inclusioni nucleari è
stato osservato accumulo di RNA foci (Mackenie et
al.,2014)
La positività a p62 potrebbe indicare una generale
perturbazione del sistema ubiquitina-proteosoma o un
suo diretto coinvolgimento nel meccanismo patologico.
E’ dibattuto se le inclusioni nel cervelletto possano essere
associate a neurodegenerazione in quanto non tutti i
pazienti manifestano segni clinici tipici della patologia
cerebellare.
CONCLUSIONI
L’ espansione in C9orf72 sembra essere responsabile di un
elevato numero di casi familiari e sporadici di SLA, FTLD e
FTLD-SLA.
Dal punto di vista clinico i portatori dell’espansione
patologica in C9orf72 presentano una grandissima
variabilità fenotipica.
L’espansione C9ORF72 è caratterizzata da diverse
inclusioni nucleari e citoplasmatiche nei neuroni del SN.
Nonostante la scoperta di questo nuovo gene e della sua
elevate frequenza, molte famiglie nello spettro della FTLD/SLA
non sono ancora spiegate geneticamente !!