Gruppo 11
Rame Cu (5000 A.C.)
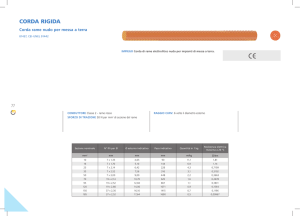
Proprietà
Z
Numero di isotopi
naturali
Massa atomica
Configurazione
elettronica
Aspetto
Elettronegatività
Stati di ossidazione#
Raggio del metallo/pm
p.f./°C
p.e./°C
Hvap(gas
monoatomico)/kJ mol-1
E°M+/M
Densità (25 °C)/ g cm-3
Abbondanza naturale
(e relativa)
Cu
29
2
Ag
47
2
Au
79
1
63.546
[Ar]3d104s1
107.8682
[Kr]4d105s1
196.9665
[Xe]4f145d106s1
Metallo
lucente
rosso
1.9
I, II, (III)
128
1083
2570
307
Metallo
lucente
argenteo
1.9
I, II, (III)
144
961
2155
258
Metallo
lucente giallo
2.4
I, III
144
1064
2808
343
+0.521
8.95
68 ppm
(25°)
+0.799
10.49
0.08 ppm
(66°)
+1.691
19.32
0.004 ppm
(73°)
# I più importanti stati di ossidazione (generalmente i più abbondanti e stabili)
sono riportati in grassetto. Altri stati ben caratterizzati, ma meno importanti,
sono riportati in caratteri normali. Gli stati di ossidazione instabili o in dubbio,
sono riportati in parentesi.
RAME (ARGENTO E ORO)
- Presenti in natura anche allo stato elementare o “nativo” (primi tre
metalli scoperti dall’uomo)
- Metalli nobili (non reattivi);
- Conducono bene la corrente elettrica ed il calore;
- Sono teneri e malleabili;
- Configurazione (n-1)d10ns1;
- Composti in stato di ossidazione +1 (configurazione (n-1)d10):
diamagnetici e spesso incolori (eccezioni per trasferimento di carica
legante-metallo)
- Composti in SO +2 e +3: sottolivello d non riempito.
- Il rame è abbastanza abbondante;
- Argento e oro sono piuttosto rari.
- Il rame e l’argento sono inerti agli acidi non ossidanti, si sciolgono
invece in acidi ossidanti (HNO3, H2SO4 conc. a caldo).
- L’oro ancora più inerte si scioglie solo in acqua regia (che scioglie
metalli preziosi):
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Ag + 2H+ + NO3- → Ag+ + NO2 + H2O
Au + NO3- + 4Cl- + 6H+ → [Au(Cl)4]- + 3NO2 + 3H2O
In soluzione stato di ossidazione più stabile: Cu(II), Ag(I) e Au(III).
IL RAME
Minerali principali:
-
calcopirite CuFeS2 (in apparenza simile alla pirite FeS2)
calcosina Cu2S;
malachite verde CuCO3xCu(OH)2 (rame carbonato basico);
cuprite Cu2O (rosso rubino).
Industrialmente il rame si ottiene per riduzione con carbone
dell’ossido che a sua volta si ottiene per calcinazione del carbonato
CuCO3 → CuO + CO2
2CuO + C → 2Cu + CO2
Oppure dai solfuri per fusione del minerale in presenza di aria
2Cu2S + 3O2 → 2Cu2O + 2SO2
2Cu2O + Cu2S → 6Cu + SO2
Il rame così ottenuto viene purificato per via elettrochimica.
- Cu usato nell’industria elettrica per la sua alta conducibilità;
- per le condotte dell’acqua data la sua scarsa reattività;
- nelle leghe quali ottone (Cu/Zn con il 20-50% di Zn), bronzo
(Cu/Sn con il 15% di Sn) e monel (Cu/Ni con il ca. 41% di Ni):
Nei paesi industrializzati il rame è riciclato ca. per il 30%.
Il rame è ossidato dall’ossigeno dell’aria in
presenza di altri agenti atmosferici come
H2O e CO2 dando un carbonato basico non
stechiometrico di Cu(II) (xCu(OH)2.yCuCO3)
di colore verde (verderame)
Fig. L’ossidazione atmosferica dei manufatti in
rame (grondaie, tetti ecc.) produce uno strato
superficiale di verderame (cupole della sinagoga di
Firenze)
L’ARGENTO
Minerali principali:
- argentite Ag2S;
- associato ai minerali di rame.
La maggior quantità si recupera dai fanghi anodici della raffinazione
elettrolitica del rame.
Si purifica per attacco con CN- e aria
4Ag + CN- + 2H2O + O2 → 4[Ag(CN)2]- + 4OHe per successiva riduzione con zinco
2[Ag(CN)2]- + Zn → 2Ag + [Zn(CN)4]2In soluzione è stabile Ag+ che dà luogo per alcalinizzazione ad
Ag2O insolubile in acqua.
PROPRIETA’ CHIMICHE DELL’ARGENTO
- L’argento è il più attivo dei metalli nobili, ma è molto poco
reattivo a confronto con gli altri elementi
- non si ossida, ma reagisce con i solfuri o H2S annerendosi.
Lo strato annerito può essere rimosso per abrasione (paste di
argento che rimuovono uno strato di metallo) oppure
chimicamente scaldando l’oggetto in una soluzione diluita di
NaCl (sale da cucina) o NaHCO3 (bicarbonato). O ancora
mettendo l’argento a contatto con un metallo più attivo (es: Al)
che reagisce con lo zolfo.
- Non reagisce con acidi non ossidanti diluiti o basi forti.
- Si scioglie in acidi ossidanti (HNO3 H2SO4 conc.) a dare lo ione
Ag+. (facilmente ridotto ad Ag).
L’ORO
- Spesso associato ai minerali di rame e di argento;
- Allo stato nativo nelle rocce quarzifere;
In passato (le pepite d’oro): grani di metallo disseminati nei filoni di
quarzo vengono accumulati per erosione come sedimenti nei letti
dei fiumi.
I grani possono essere separati dalla silice trattando la miscela con
acqua. L’oro è molto denso (19.3 g cm-3) e si deposita rapidamente
sul fondo, SiO2 con una densità di 2.5 gcm-3, si deposita più
lentamente ed è trascinata via dall’acqua.
Attualmente questo metodo è poco usato (riserve esaurite).
Ad oggi come l’argento si estrae con azione combinata di cianuri e
aria:
4Au + 16CN- + 6H2O + 3O2 → 4 [Au(CN)4]- + 12OHE si riduce con zinco
2[Au(CN)4]- + 3Zn + 4 CN- → 2Au + 3[Zn(CN)4]2- In gioielleria (75% della produzione di Au): leghe con Ag e Cu
(mantengono il colore dell’oro ma sono più dure).
- Proporzione di oro nella lega espressa in carati:
- oro puro è 24 carati.
- leghe normalmente usate: 9, 18 e 22 carati e contengono
9/24, 18/24 (750/1000), 22/24 di oro puro rispettivamente.
- Altri usi: applicazioni industriali (elettronica, 10-15%); applicazioni
mediche, uso dentale, conio di monete e lingotti.
PROPRIETA’ CHIMICHE DELL’ORO
- Chimicamente molto inerte (non reagisce con soluzioni alcaline ne
con tutti gli acidi puri eccetto il selenico. Si scioglie in acqua regia
(3:1 HCl e HNO3 conc.) che mette insieme potere ossidante di
HNO3 e complessate di Cl-
GLI STATI DI OSSIDAZIONE DEL RAME IN SOLUZIONE
ACQUOSA
I soli ioni che esistono in soluzione acquosa (esclusi i complessi)
sono di Cu2+.
I potenziali normali di ossidoriduzione sono i seguenti
Cu2+
(verde)
0.153
Cu+
0.521
Cu
(incolore)
0.337
nel mezzo acquoso si ha spontaneamente la reazione di
disproporzione:
2Cu+(aq) → Cu2+(aq) + Cu(s)
ΔE° = 0.521 – 0.153 = 0.37 V
K = 1.6 x106
Lo stato di ossidazione Cu(I) esiste soltanto come complesso o
come composto insolubile.
Come complesso:
- in presenza di ammoniaca i potenziali normali di ossidoriduzione
sono i seguenti:
[Cu(NH3)4]2+
(azzurro)
0.044
[Cu(NH3)4]+
-0.081
Cu
(incolore)
-0.019
In queste condizioni il rame(I) è stabile ed ha luogo la reazione di
comproporzione:
[Cu(NH3)4]2+ + Cu
(azzurro d9)
→ 2[Cu(NH3)2]+
(incolore d10)
ΔE° = 0.044 + 0.081 = 0.125 V
In presenza di etilendiammina NH2CH2CH2NH2 (en) si ha l’effetto
opposto:
2CuCl + 2en → Cu(en)2Cl2 + Cu
ΔE° = 0.295 V
Lo ione monovalente ha un numero di coordinazione 2 (angolo di
180° fra le posizioni di coordinazione – non può ospitare un legante
chelante); lo ione bivalente (NC = 4) può formare legami chelati
Come composto insolubile:
Esempi: CuCl, CuBr, CuI, CuCN e CuSCN.
Cu(I)
Lo ione Cu2+ non è molto ossidante (E°Cu2+/Cu+ = 0.153;
E°Cu2+/Cu = 0.337). Tuttavia, in presenza di anioni capaci di
precipitare lo ione Cu+, il potere ossidante del rame(II) aumenta
notevolmente.
Per esempio in presenza di ioni I-, che precipitano il rame(I) in
forma di CuI (bianco), una parte dello ioduro viene ossidata a iodio
(E°I2/2I- = 0.54 V).
Cu2+ + I- → CuI(s) + I2 [pPs(CuI) = 12] (da bilanciare)
Na2S2O3 + I2 → Na2S4O6 + NaI
(da bilanciare)
Reazione usata per determinare Cu2+ in soluzione mediante analisi
volumetrica: un eccesso di KI è aggiunto e lo I2 prodotto viene
determinato mediante titolazione con tiosolfato di sodio:
Il composto CuI2 non esiste.
EFFETTO JAHN-TELLER
Teorema di Jahn-Teller: per una molecola non lineare in uno stato
elettronicamente degenere deve avvenire una distorsione per
abbassare la simmetria, togliere la degenerazione e abbassare
l’energia.
L’effetto Jahn-Teller nelle strutture dei complessi di rame(II)
I complessi esacoordinati come ad esempio lo ione [Cu(H2O)6]2+
(configurazione d9) sono distorti dalla simmetria ottaedrica per
effetto Jahn-Teller.
La chimica del rame(II) è fortemente influenzata dall’effetto JahnTeller.
Cu(II)
- Lo stato +II è il più stabile ed importante per il rame.
- Lo ione rameico Cu2+ ha la configurazione elettronica d9 ed ha
un elettrone spaiato: i suoi composti sono colorati e
paramagnetici.
- CuSO4x5H2O e molti sali idrati del rame II (sali rameici) sono
di colore blu.
- Lo ione idrato [Cu(H2O)6]2+ (azzurro): si forma per dissoluzione
in acqua di CuSO4 o Cu(NO3)2 o quando l’idrossido o il
carbonato vengono sciolti in un acido.
2+
H2O
H2O
H 2O
Cu
H2O
H 2O
H 2O
Ottaedro molto distorto
L’aggiunta di NaOH ad una soluzione contenente Cu2+ dà un
precipitato blu dell’idrossido Cu(OH)2 (pPs = 20).
Cu2[Fe(CN)6]: bruno (pPs =15.7), insolubile in acidi diluiti, solubile in
ammoniaca per formazione di complessi è ottenuto per aggiunta di
K4[Fe(CN)6] ad una soluzione di Cu2+ è spesso utilizzato per la
ricerca di rame(II).
Complessi di rame
Sia il rame(I) che il rame(II) hanno molta attitudine a formare
complessi stabili.
Cu(CN)43-, pKi = 28.
Complesso planare quadrato stabile: il rame metallico si scioglie
nelle soluzioni di cianuro.
Cu + 4KCN + H2O → K3Cu(CN)4 + ½H2 + KOH.
[Cu(CN)4]2- pKi = 27
Trattando i sali di rame(II) con ammoniaca si ottiene:
[Cu(NH3)4]2+ pKi = 12, azzurro scuro
2+
NH3
H 3N
Cu
H 3N
NH3
Complesso planare quadrato abbastanza stabile, in equilibrio con il
complesso Oh distorto con 2 H2O in posizione assiale.
Per ottenere l’esaammino rame(II) dovrei lavorare in NH3 liquida.
Dal colore di questo complesso è possibile riconoscere il rame(II)
nelle soluzioni (limite di sensibilità 60 ppm.).
Cu2+ (aq) + 2OH- (aq) → Cu(OH)2 (s)
Cu(OH)2 (s) + 4NH3(aq) → [Cu(NH3)4]2+(aq)
+ 2OH- (aq)
(a) (b)
(c)
Quando una soluzione acquosa di Cu(II) (a) viene trattata con
ammoniaca acquosa precipita Cu(OH)2 (b). L’aggiunta di un
eccesso di NH3 provoca il ridiscioglimento per formazione del
complesso [Cu(NH3)4]2+ (c)
Per aggiunta di HCl:
[CuCl4]2- pKi = -2, di colore giallo.
Il riconoscimento del rame(II) si basa generalmente sulla
formazione del complesso [Cu(NH3)4]2+ azzurro o anche sulla
precipitazione del composto Cu2[Fe(CN)6] rosso-bruno.