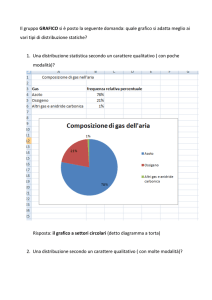
Comportamentro dei gas reali.
Il comportamento dei gas reali è visualizzabile con il diagramma di Andrews nel piano di Clapeyron.
Il diagramma di Andrews è composto dalla campana di Andrews e dalle curve che descrivono il
comportamento del gas alle diverse temperature.
Ogni gas reale ha un suo diagramma di Andrews.
---------------------------------------------------------------La curva a campana non inzia in (0 l,0 atm) poiché nessun esperimento è condotto a volume e pressione
nulli.
I grafici si leggono da destra verso sinistra poiché il gas reale viene compresso .
Ogni curva si riferisce ad una precisa temperatura, mantenuta costante (compressione isoterma del gas
reale).
Gli esperimenti sono condotti partendo dalle basse temperature.
A temperature basse (273 K) diminuendo il volume la pressione aumenta fino a quando inizia la
condensazione (passaggio allo stato liquido).
Nella fase gas + vapore del passaggio di stato la pressione si mantiene costante durante la
compressione, creando il “pianerottolo” isotermico (isobara ed isoterma)
Quando si ha solo liquido, una piccola variazione di volume crea una notevole variazione di
pressione e l’isoterma è quasi verticale.
Ripetendo la compressione del gas per temperature via via crescenti, si osserva lo stesso comportamento,
solo che il “pianerottolo” isotermico inizia dopo ed è più breve (il passaggio di stato inizia per un volume più
piccolo ed una pressione più alta).
Ogni gas ha una temperatura critica, alla quale il passaggio allo stato liquido è istantaneo; ad essa
corrispondono il volume critico e la pressione critica. Il punto critico (pC, VC, TC) è un punto di flesso.
Per temperature superiori a quella critica le isoterme hanno un comportamento analogo a quelle dei gas
perfetti, ossia iperboli. Per temperature superiori a quella critica non c’è condensazione.
All’interno della campana di Andrews coesistono vapore + liquido.
Sopra la T critica l’aeriforme non può condensare per sola compressione: zona del gas.
A sinistra della campana: solo liquido
A destra della campana solo gas, che può condensare per sola compressione.
Diagramma di fase e punto triplo (coesistenza solido + liquido + gas)
Il diagramma di fase è un grafico cartesiano nel piano non di Clapeyron ma nel paino in ciui la pressione è
in funzione della temepratura. La temperatura del punto triplo è sempre inferiore a quella del punto critico.
Disegno “a forcone”.