LA LEZIONE
Evoluzione del Sistema Periodico: “I nuovi elementi superpesanti”
La tavola periodica degli elementi è uno dei capolavori della scienza e nonostante i
suoi 150 anni, è ancora in fase di completamento perché il numero degli elementi
chimici conosciuti continua ad aumentare.
Se una qualche catastrofe universale venisse
a distruggere il mondo e all'umanità fosse
concesso di poter conservare un solo concetto
scientifico per ricostruire la civiltà, quale
sarebbe questo concetto? La risposta del
chimico invariabilmente è : la Tavola Periodica
degli Elementi. (Richard P. Feynman).
La tavola periodica concepita da Dmitrij Mendeleev oltre 150 anni fa deve essere
costantemente aggiornata perché il numero degli elementi chimici continua ad
aumentare. Infatti, mediante gli acceleratori di particelle, in cui si fanno scontrare i
nuclei atomici, è possibile creare nuovi elementi “superpesanti”, nel cui nucleo ci sono
più protoni rispetto a quelli dei 92 elementi che si trovano in natura. Agli inizi del
ventesimo secolo grazie soprattutto al lavoro di Moseley che scoprì nel numero
atomico il principio ordinatore del sistema periodico, fu possibile prevedere
esattamente quanti elementi rimanessero ancora da scoprire essendo ormai chiaro
che fra il primo, l’idrogeno, e l’uranio, dovessero essere presenti soltanto un numero
ben definito di elementi. Un grande impulso alla scoperta di nuovi elementi venne
dalle indagini sul comportamento chimico delle sostanze radioattive. Nel 1896 il
chimico francese Becquerel, durante i suoi studi su sali di uranio, notò casualmente
che questi, posti accanto a lastre fotografiche, chiuse nei loro contenitori a prova di
luce, ne provocavano l'annerimento e ne dedusse che tali sali dovevano emettere dei
raggi molto più penetranti di quelli luminosi. Nel 1898 i coniugi Curie scoprirono il
radio, un nuovo elemento che emetteva delle radiazioni molto più intense di quelle
proprie dell'uranio. Per questa loro proprietà, elementi come l’uranio, il radio e il
polonio vennero denominati “attivi” e il fenomeno di emissione di particelle venne
detto radioattività. In paricolare, il radio, emettendo particelle alfa (nuclei di elio), si
trasforma in piombo. Si realizza spontaneamente la trasmutazione degli elementi:
tutti gli elementi radioattivi, emettendo raggi alfa, beta e gamma, decadono formando
altri elementi. Quindi i loro nuclei sono strutturalmente instabili, e ciò forniva una
indicazione del perché in natura non venissero trovati elementi con numero atomico
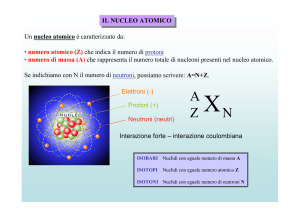
superiore a quello dell'uranio, uguale a 92. I nuclei degli elementi leggeri hanno un
rapporto protoni/neutroni (p/n) tendente ad uno, mentre i nuclei degli elementi
pesanti mostrano tutti un eccesso di neutroni noto come eccesso di massa. Ciascun
nucleone (protone e neutrone) è in grado di stabilire interazioni con altri nucleoni; una
coppia protone-neutrone stabilisce una somma di interazioni stabili e bilanciate
reciprocamente, mentre un eccesso o un difetto di neutroni nel nucleo sbilancia il
numero ed il tipo delle interazioni e pertanto il nucleo risulta instabile. Solo quei nuclei
che possiedono approssimativamente lo stesso numero di protoni e di neutroni risulta
stabile nelle condizioni attuali presenti sulla terra (fig.1).
Quei nuclei che possiedono un rapporto
tra p/n diverso da uno hanno vita media
limitata rispetto ai loro isotopi più stabili.
Dalla scoperta di Becquerel sono state
identificate quasi 2500 specie di nuclei
differenti e di essi solo una piccola
percentuale, circa 280 è stabili. Vari tipi di
decadimenti radioattivi concorrono in
tempi più o meno lunghi alla
trasformazione del nucleo instabile in una
forma più stabile. In pratica ponendo in
fig.1 Mappa di stabilità dei nuclei
un grafico con in ascisse il numero di protoni ed in ordinata il numero di neutroni di un
nucleo per gli elementi della tavola periodica ed i loro vari isotopi otteniamo un grafico
in cui si individuano diverse zone (fig.1). Gli elementi che stanno sulla diagonale nera
hanno tutti una stabilità nucleare elevata, mentre quelli che si trovano sopra la
diagonale (eccesso di neutroni) e sotto (eccesso di protoni) sono instabili e soggetti a
decadimento radioattivo. In particolare si osserva che per il numero di massa A < 40
si ha che N Z; per elementi più pesanti, N aumenta più velocemente del numero
atomico Z. Il motivo è che tutti i nucleoni subiscono indistintamente la forza nucleare
attrattiva, mentre solo i protoni subiscono la forza elettrostatica repulsiva. Quando il
numero d’ordine della tavola periodica cresce, la stabilità del nucleo tende a diminuire
a causa della repulsione coulombiana, le forze nucleari attrattive devono quindi
aumentare ed è necessaria la presenza nel nucleo di una percentuale maggiore del
numero N di neutroni rispetto ai protoni. Il limite di questa stabilità è dato
dall'elemento con Z=92 (uranio, U 238) che possiede 146 neutroni, dopodiché in
natura non esistono nuclei stabili in condizioni normali; gli elementi con Z>92
(transuranici) sono artificiali e sono instabili. I fenomeni radioattivi si possono
realizzare anche artificialmente. Nel 1934 Enrico Fermi e i suoi collaboratori ottennero
una radioattività indotta bombardando i nuclei di molti elementi, tra cui l’uranio, con
neutroni lenti. Questi esperimenti aprirono la strada per le trasmutazioni artificiali di
elementi. Nel 1936 Emilio Segrè e Charles Perrier isolarono un isotopo radioattivo
dell'elemento 43, che chiamarono tecnezio (dal termine greco
τεχνητόςche vuol
artificiale), ottenuto per bombardamento di un campione di molibdeno con un deutone
(il nucleo del deuterio, isotopo dell'idrogeno, costituito da un protone e da un
neutrone) in un ciclotrone. Esso consentiva di accelerare fasci di particelle o
subatomiche (protoni e deutoni), lungo una traiettoria circolare, fino a farli collidere
con diversi materiali, per ottenere isotopi radioattivi e ricavare, di conseguenza,
informazioni sulle reazioni nucleari e le stabilità dei nuclei atomici. Usando il
bombardamento di altri atomi per ottenere elementi radioattivi, si scoprirono ben
presto i restanti elementi che mancavano nel sistema periodico: il francio (1939); il
promezio (1945); l'astato (1947).
Gli esperimenti di Fermi sull’uranio lo
portarono a ipotizzare che fosse possibile
sintetizzare nuovi elementi (chiamati, ausonio
ed esperio) bombardando il nucleo atomico
con i neutroni. In realtà la radioattività
indotta nell’uranio dal gruppo Fermi fu
interpretata nel 1938 come fissione nucleare.
Solo nel 1940 fu sintetizzato il nettunio con
numero atomico 93, il primo elemento al di là
dell’uranio seguendo lo schema rappresentato
nella fig.2.
fig.2 Schema delle reazioni che spiegano l'origine del Nettunio
Successivamente si scoprirono una serie di nuovi elementi transuranici: plutonio
(numero atomico 94), americio (95), curio (96), berkelio (97), californio (98),
einsteinio (99) e fermio (100). Questo procedimento di cattura neutronica termina
con il fermio, in quanto al di là di esso il decadimento beta non avviene e quindi non si
possono produrre nuovi elementi con questa tecnica. Per produrre elementi con
numero atomico superiore a 100, il metodo possibile è quello di fondere i nuclei degli
elementi leggeri aventi Z>2. Lo studio degli elementi transuranici ha dimostrato che i
tempi di dimezzamento e la resistenza alla fissione spontanea diminuiscono
all'aumentare del numero atomi. Sembrava pertanto inutile cercare di sintetizzare
nuovi elementi con numero atomico maggiore di 103, si pensava infatti che il limite
pratico della tavola periodica sarebbe stato raggiunto con l’elemento 108 in quanto i
tempi di semi-vita estrapolati da quelli degli elementi pesanti conosciuti sarebbero
stati estremamente brevi (10-6 s) per permetterne lo studio.
A partire dagli anni ’50 è stato sviluppato un modello del nucleo a gusci, costituito da
particelle che si muovono in un campo di forze nucleari. Analogamente ai gusci
elettronici completi, il modello prevede che, in corrispondenza di gusci nucleari pieni,
contenenti un prestabilito numero di protoni e
neutroni, il sistema sia particolarmente stabile.
Sviluppi successivi di questa teoria hanno
previsto l’esistenza di elementi con numero
atomico intorno al 114 con tempo di
dimezzamento più lungo rispetto ai
predecessori sintetizzati (secondi o minuti). Gli
elementi vicini al 114 sono considerati far parte
di quella che è chiamata “isola di stabilità” in
un “mare” di elementi instabili.
fig.2 Rappresentazione dell’isola di stabilità teorica. Il
tempo di dimezzamento dei nuclidi è riportato come funzione
del numero dei protoni (Z) e dei neutroni (N). il continente
degli elementi stabili termina al capo piombo-bismuto, e una
regione di relativa stabilità appare intorno agli isotopi del
torio e uranio (Z=90,92). Nella regione degli elementi
superpesanti, la teoria prevede un isola di stabilità con un
numero di protoni di 114 e un numero di neutroni di 184
I gusci protonici dell’elio, ossigeno, nickel, stagno e piombo, sono completamente
riempiti e arrangiati in maniera tale che il nucleo ha una stabilità aggiuntiva. I numeri
atomici di questi elementi – 2, 8, 28, 50 e 82 – sono conosciuti come “numeri magici”.
Questi stessi numeri più il 126 sono numeri magici per i neutroni. E’ da notare, che
tutti questi numeri magici sono pari, e che gli elementi con numeri di protoni e
neutroni pari rappresentano il 90% degli elementi presenti nella crosta terrestre. Il
piombo 208, ha 82 protoni e 126 neutroni e il nucleo, “doppiamente magico”, appare
essere virtualmente eterno. Per i protoni il numero magico successivo all’ 82 previsto
è il 114 e non 126, e gli atomi con un doppio numero magico di 114 protoni e 184
neutroni dovrebbe essere quindi il picco dell’isola di stabilità. Lo sviluppo degli
acceleratori di particelle ha permesso di far avvenire collisioni tra ioni di elementi
come il boro (Z=5) con nuclei di elementi di numero atomico compreso tra 94 e 98 in
modo da provocarne la fusione. Per far avvenire questo processo è necessaria una
grande energia in modo che la collisione tra i nuclei sia sufficiente a sovrastare la
forza elettrostatica di repulsione tra i protoni di ciascun nucleo. Questa alta energia
aumenta la probabilità che il nuovo elemento formato vada incontro ad una fissione.
Con questa tecnica sono stati ottenuti gli elementi dal 102 al 106; al di sopra di
questo valore, la fissione ha reso impossibile sintetizzare nuovi elementi. Lo sviluppo
del processo conosciuto come “fusione fredda”, che consiste nel bombardamento di
nuclei mediante fasci di ioni pesanti, ha permesso di ottenere nuclei con energie di
eccitazione più basse che non si disintegravano subito dopo essere stati sintetizzati. Il
sistema ha richiesto un acceleratore capace di produrre intensi fasci di ioni. Durante
gli esperimenti vengono sintetizzati pochissimi nuclei dei nuovi elementi desiderati, e i
nuclei derivanti dal decadimento dei nuovi elementi a loro volta decadono così
rapidamente che devono essere rivelati mentre il processo di sintesi è ancora in corso.
Il processo avviene in due fasi: inizialmente i “proiettili” si combinano con gli atomi del
bersaglio dando origine al nuovo nucleo eccitato, che poi emettendo neutroni perde
energia e si “raffredda”, arrivando allo stato fondamentale, non eccitato. Nella
seconda fase, il fascio dei proiettile e dei nuclidi formati, avendo velocità e masse
diverse, vengono separati utilizzando campi magneti ed elettrici. I due campi tendono
a deflettere in direzione opposta le particelle cariche. Soltanto se un nucleo è in moto
ad una velocità corretta gli effetti si annullano e quindi proseguirà lungo il piano
mediano dell’apparecchiatura. Questi nuclidi arrivano ad un sistema di rilevatori al
silicio. Qui i decadimenti nucleari
vengono associati a posizioni ben
precise
per
determinare
quali
isotopi si siano sintetizzati.
Si
possono così avere i dati necessari
per
costruire
la
catena
di
decadimento dei nuovi nuclidi in
base alla quale se ne può stabilire
numero atomico e massa (fig.3).
fig.3 Schema dell’acceleratore di particelle utilizzato a Dubna per
sintetizzare l’isotopo 114-289
Il sistema ha consentito l'identificazione di nuovi nuclidi, anche se si erano formati
solo pochi atomi (uno per l'elemento 109 e tre per il 108). Aumentando la sensibilità
dei rivelatori e regolando ulteriormente l'intensità del fascio ionico si è riusciti a
ottenere l'elemento 111 e 112. L'elemento 112 ha un tempo di dimezzamento di 240
microsecondi, e in 25 giorni se ne sono riusciti a produrre solo due atomi. Dal 1994,
gruppi di ricerca in Germania, Stati Uniti e Russia, sono riusciti ad ampliare il sistema
periodico con sei nuovi elementi di numero atomico fino a 118. La sintesi più
importante è stata quella degli isotopi dell'elemento 114, che ha costituito la
dimostrazione definitiva dell'esistenza dell'isola di stabilità. Si è scelta una reazione
che introducesse il massimo numero di neutroni nei nuclei: l’irradiazione del plutonio
244 con un fascio di ioni di calcio 48 (che ha un doppio numero magico, 20 protoni e
28 neutroni). Dopo 40 giorni di irradiazione sono stati osservati tre decadimenti
spontanei per fissione. Due di questi erano prodotti
indesiderati dovuti al decadimento del nucleo di
americio 244, mentre il terzo si è impiantato nel
rilevatore seguito da tre decadimenti alfa (cioè la
perdita in successione di due protoni e due
neutroni). Questo isotopo dell’elemento 114 ha un
tempo di dimezzamento di 30,4 secondi. Seguono i
decadimenti successivi negli elementi 112, 110 e
1081 (fig. 4).
fig.4 Rappresentazione schematica della
sequenza di decadimento dell’isotopo 114289
Nel maggio del 2012 la IUPAC (International Union of Pure and Applied Chemistry) ha
ufficializzato il nome di questo elemento in Flerovium (Fl) in onore del Flerov
Laboratory of Nuclear Reactions, dove elementi superpesanti, incluso l’elemento 114,
sono stati sintetizzati. La creazione di questi nuclei e l’osservazione del loro
decadimento costituiscono uno strumento importantissimo per verificare le teorie che
spiegano come si formano gli atomi. Lo studio dei limiti fisici della tavola periodica
permette di rispondere inoltre alla domanda se gli elementi superpesanti continuino ad
esibire le stesse regolarità di comportamento osservate finora con gli elementi più
leggeri e che hanno costituito la grandezza della tavola periodica. Nonostante questi
elementi abbiano vite brevi, è stato possibile in alcuni casi realizzare esperimenti nei
quali le caratteristiche chimiche cominciano a emergere con maggiore chiarezza. I
risultati teorici e sperimentali ottenuti finora, mostrano che non sempre viene
mantenuta la somiglianza chimica degli elementi appartenenti ad un particolare
gruppo. Ciò è dovuto a effetti relativistici degli elettroni che modificano gli stati
energetici quantistici da cui dipendono le proprietà chimiche, e quindi la periodicità.
1
L’isotopo 108 con 169 neutroni si trova nella zona di instabilità e quindi subisce una fissione
spontanea.