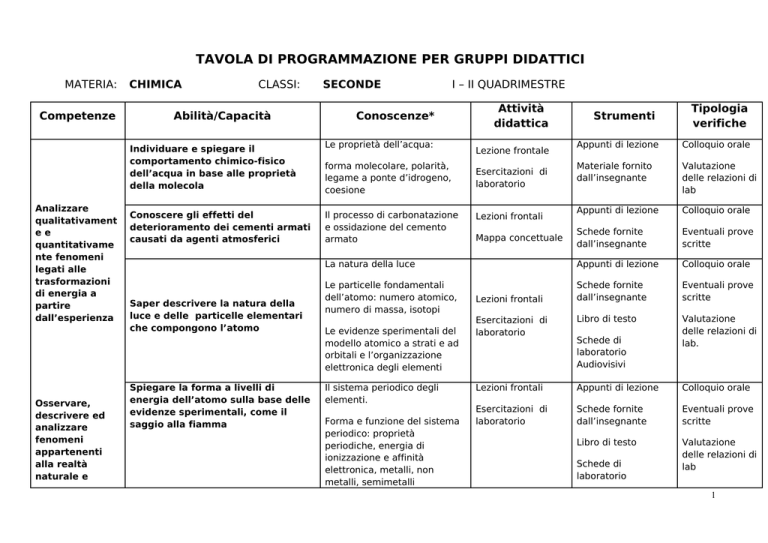
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
MATERIA:
Competenze
Analizzare
qualitativament
ee
quantitativame
nte fenomeni
legati alle
trasformazioni
di energia a
partire
dall’esperienza
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti
alla realtà
naturale e
CHIMICA
CLASSI:
Abilità/Capacità
SECONDE
I – II QUADRIMESTRE
Conoscenze*
Individuare e spiegare il
comportamento chimico-fisico
dell’acqua in base alle proprietà
della molecola
Le proprietà dell’acqua:
Conoscere gli effetti del
deterioramento dei cementi armati
causati da agenti atmosferici
Il processo di carbonatazione
e ossidazione del cemento
armato
forma molecolare, polarità,
legame a ponte d’idrogeno,
coesione
Attività
didattica
Saper descrivere la natura della
luce e delle particelle elementari
che compongono l’atomo
Spiegare la forma a livelli di
energia dell’atomo sulla base delle
evidenze sperimentali, come il
saggio alla fiamma
Le evidenze sperimentali del
modello atomico a strati e ad
orbitali e l’organizzazione
elettronica degli elementi
Il sistema periodico degli
elementi.
Forma e funzione del sistema
periodico: proprietà
periodiche, energia di
ionizzazione e affinità
elettronica, metalli, non
metalli, semimetalli
Tipologia
verifiche
Appunti di lezione
Colloquio orale
Materiale fornito
dall’insegnante
Valutazione
delle relazioni di
lab
Appunti di lezione
Colloquio orale
Schede fornite
dall’insegnante
Eventuali prove
scritte
Appunti di lezione
Colloquio orale
Schede fornite
dall’insegnante
Eventuali prove
scritte
Esercitazioni di
laboratorio
Libro di testo
Valutazione
delle relazioni di
lab.
Lezioni frontali
Appunti di lezione
Colloquio orale
Esercitazioni di
laboratorio
Schede fornite
dall’insegnante
Eventuali prove
scritte
Libro di testo
Valutazione
delle relazioni di
lab
Lezione frontale
Esercitazioni di
laboratorio
Lezioni frontali
Mappa concettuale
La natura della luce
Le particelle fondamentali
dell’atomo: numero atomico,
numero di massa, isotopi
Strumenti
Lezioni frontali
Schede di
laboratorio
Audiovisivi
Schede di
laboratorio
1
Audiovisivi
artificiale e
riconoscere
nelle sue varie
forme i concetti
di sistema e di
complessità
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti
alla realtà
naturale e
artificiale e
riconoscere
nelle sue varie
forme i concetti
di sistema e di
complessità
Analizzare
qualitativament
ee
quantitativame
nte fenomeni
legati alle
Distinguere i tipi di legami chimici
Il legame chimico: regola
dell’ottetto, principali legami
chimici, valenza, numero
ossidazione, scala
elettronegatività.
Forma delle molecole
Spiegare la forma e la polarità delle
molecole.
Forze
intermolecolari,
momento di dipolo
Lezioni frontali
Appunti di lezione
Colloquio orale
Esercitazioni di
Libro di testo
laboratorio
Schede di
laboratorio
Audiovisivi
Eventuali prove
scritte
Valutazione
delle relazioni di
lab.
Lezioni frontali
Appunti di lezione
Colloquio orale
Esercitazioni di
Libro di testo
laboratorio
Schede di
laboratorio
Audiovisivi
Eventuali prove
scritte
Formule di struttura
Valutazione
delle relazioni di
lab.
Preparare soluzioni di data
concentrazione (percento in peso,
percento in volume molarità,)
Le soluzioni
Acidi e basi
Lezioni frontali
Libro di testo
Riconoscere sostanze acide e
basiche tramite indicatori e misure
di pH
pH
Esercitazioni di
laboratorio
Saper eseguire una titolazione
Titolazioni
Schede di
laboratorio
Audiovisivi
Identificare le reazioni di ossido
riduzione.
Numero
di
ossidazione
Reazioni di ossidoriduzione e
loro bilanciamento: potenziali
normali,
pile, corrosione.
Elettrochimica
Lezioni frontali
Appunti di lezione
Colloquio orale
Esercitazioni di
laboratorio
Libro di testo
Eventuali prove
scritte
Bilanciare le reazioni di ossido
riduzione
col
metodo
ionico
elettronico. Costruire una pila
Reazioni di neutralizzazione
Appunti di lezione
Schede di
laboratorio
Colloquio orale
Eventuali prove
scritte
Valutazione
delle relazioni di
lab
Valutazione
2
trasformazioni
di energia a
partire
dall’esperienza
Audiovisivi
chimica.
delle relazioni di
lab
Riconoscere i processi di elettrolisi
e di corrosione
* Macroargomenti previsti nei piani provinciali; il dettaglio e i tempi sono descritti nella tabella
successiva.
3
TAVOLA DI PROGRAMMAZIONE
Contenuti I Quadrimestre
Tempi (in ore)
Le proprietà dell’acqua
Effetti della polarità e del legame a ponte d’idrogeno
2 ore
Il processo di carbonatazione e ossidazione del cemento armato
Esperienze di laboratorio: calcimetro, densità del terreno, preparazione di miscuglio
eterogeneo
La natura della luce, le particelle fondamentali dell’atomo: numero atomico, numero di
massa, isotopi.
2 ore
Le evidenze sperimentali del modello atomico a strati e ad orbitali e l’organizzazione
elettronica degli elementi.
6 ore
10 ore
4 ore
6 ore
Esperienze di laboratorio: Costruzione della retta di taratura, determinazione fotometrica di
alcuni ioni contenuti in campioni di acqua e di alimenti
Il sistema periodico degli elementi. Forma e funzione del sistema periodico: proprietà
periodiche, energia di ionizzazione e affinità elettronica, metalli, non metalli, semimetalli. Il
legame chimico: regola dell’ottetto, principali legami chimici, valenza, numero ossidazione,
scala elettronegatività
6 ore
8 ore
Esperienze di laboratorio: il saggio alla fiamma, analogie degli elementi di uno stesso
gruppo
4
TAVOLA DI PROGRAMMAZIONE
Contenuti II Quadrimestre
Tempi
Forma delle molecole forze intermolecolari, momento di dipolo. Formule di struttura
4 ore
Esperienze di laboratorio: conducibilità elettrica delle soluzioni, verifica della polarità di
liquidi diversi, costruzione modelli molecolari.
8 ore
Le soluzioni, acidi e basi, pH, reazioni di neutralizzazione, titolazioni
9 ore
Esperienze di laboratorio: solubilità e miscibilità, saturazione, preparazione soluzioni
concentrazione nota, misure del pH, indicatori e strumenti, titolazione acido forte/base
forte, costruzione curva di titolazione, determinazione acidità di prodotti alimentari,
determinazione della durezza delle acque
Numero di ossidazione, reazioni di ossido-riduzione e loro bilanciamento: potenziali
normali, pile, corrosione. Elettrochimica
Esperienze di laboratorio: Reazioni di ossido-riduzione, costruzione della pila chimica,
elettrolisi dell’acqua, determinazioni analitiche con kit specifici
16 ore
6 ore
8 ore
5