Lezione di Ginecologia
12 marzo 2003
Prof. Milani
La fisiologia dell’asse ipotalamo-ipofisi dalla vita fetale alla
menopausa.
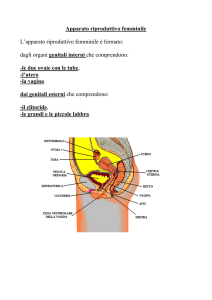
Ipotalamo: ghiandola che secerne neuropeptidi (Realising Hormones: RH) che stimolano l’ipofisi a
produrre tropine per le gonadi, cioè altri ormoni che stimolano la funzione e lo sviluppo delle
gonadi.
L’ipofisi, collocata nella sella turcica, riceve un afflusso ematico dall’ipotalamo attraverso il
sistema portale ipotalamo-ipofisi. Nell’ipofisi riconosciamo una porzione anteriore, adenoipofisi,
che produce LH e FSH che sono gli ormoni gonadotropi, e un’ipofisi posteriore che secerne
l’ormone antidiuretico e l’ossitocina (che entra in gioco soprattutto nel travaglio e nel parto).
Gonadi: organo bersaglio delle gonadotropine (FSH e LH). Hanno la funzione di produrre ormoni
(androgeni ed estrogeni) e i gameti.
Organizzazione
L’ipotalamo ha tre tipologie di secrezione:
- tonica: tipica della vita fetale e regola il feed-back negativo sulla secrezione da parte
dell’ipotalamo dei RH. Il feed-back esercita la sua funzione sull’ipotalamo tramite gli
ormoni circolanti, ed è un feed-back negativo dalla seconda fase della vita fetale fino alla
fase della prepubertà.
- pulsatile: caratteristica proprio del periodo prepuberale, ad un certo intervallo di tempo si ha
la secrezione di gonadotropine; questa secrezione è responsabile dell’inizio della pubertà,
dell’inizio dell’attività ormono-producente delle gonadi e dello sviluppo somatico
dell’individuo.
- ciclica: fa parte di un feed-back positivo regolato sempre dagli ormoni, in particolar dagli
estrogeni. Una dose critica di estrogeni che noi abbiamo all’inizio di ogni ciclo ovarico
esercita un feed-back positivo sia direttamente sull’ipofisi che indirettamente sull’ipotalamo
alla produzione di gonadotropine ipofisarie: cioè una dose minima critica di ormone stimola
l’ipofisi a produrre LH e FSH che promuovono lo sviluppo del follicolo, fino alla fase
maturativa (ovulatoria) e quindi alla produzione di estrogeno e progesterone.
Quindi i tre centri (ipotalamo-ipofisi-gonadi) sono correlati e si regolano a vicenda, con un feedback negativo ed uno positivo: gli ormoni gonadici circolanti esercitano sia una funzione inibitoria
nell’attività ipotalamo-ipofisaria sia un’azione eccitatoria.
Sviluppo della gonade
Nello sviluppo della gonade abbiamo quattro stadi diversi:
1. indifferenziata: abbiamo un abbozzo gonadico in cui non è possibile riconoscere se si tratti
di un testicolo o di un ovaio.
.
2. differenziazione: processo attivo nella differenziazione maschile e quasi un processo
passivo in quella femminile, quando manca la differenziazione maschile il processo di
differenziazione e maturazione prosegue nella linea femminile.
3. maturazione dell’oogonio e dell’oocita:
4. formazione e sviluppo del follicolo ovarico.
1.Indifferenziata
Fino alla VI-VII settimana di gravidanza, quindi nel primo mese e mezzo di vita fetale, la gonade è
una specie di cresta gonadica, o cresta genitale, formata dall’ispessimento dell’epitelio celomatico.
Infatti la gonade indifferenziata contiene:
ß cellule germinali primitive _ precursori dello spermatogone e dell’oogone
ß cellule celomatiche _ il cui ispessimento disegna le prominenze celomatiche
1
ß tessuto mesenchimale midollare
La cresta genitale è sovrapposta al dotto mesonefrico, insieme formano la cresta urogenitale:
l’apparato urinario è quindi strettamente correlato, dal punto di visto embriologico, all’apparato
genitale, molte malformazioni dell’apparato genitale infatti si accompagnano a malformazioni di
quello urinario.
2.Differenziazione
Dopo la VI-VII settimana, se la gonade si differenzia in gonade maschile ciò avviene perché è
presente nel corredo cromosomico il cromosoma Y, e perché sul cromosoma Y è presente un gene
(antigene H-Y ?) che occupa una precisa regione chiamata SRY che è una regione determinante
l’evoluzione testicolare della gonade, che è un gene che determina la differenziazione (fattore di
differenziazione) della gonade in testicolo (TDF: testicular differentiating factor). Quando è
presente il cr Y e questo gene, tra l’VII e IX settimana la gonade si differenzia in testicolo.
Compaiono così le cellule di Sertoli che si aggregano a formare i cordoni testicolari. Nel frattempo
compaiono le cellule di Leydig che sono elementi cellulari che originano dalla differenziazione
delle cellule mesenchimali, e circondano i cordoni testicolari.
Le cellule del Sertoli producono un fattore che inibisce i dotti di Muller (dotti mulleriani_daranno
poi origine all’apparato genitale interno femminile), bloccandone l’evoluzione. Le cellule di Leydig
invece sono deputate alla produzione di testosterone, al quale si deve lo sviluppo del sistema
wolffiano da cui poi originerà l’epididimo, i dotti deferenti e le vescicole seminali, mentre il 5_DHT agisce sul seno urogenitale promuovendo lo sviluppo dei genitali esterni e del tubercolo
urogenitale presente nell’uretra e nella prostata. A livello ipotalamico il testosterone inibisce la
ciclicità che è invece tipica della funzionalità gonadica femminile
Quindi la gonade indifferenziata è sovrastata dal dotto di Wolff (dotto mesonefrico) e dal dotto di
Muller (dotto paramesonefrico), se c’è la differenziazione in testicolo avremo la differenziazione
del sistema interno in epididimo, vasi deferenti, vescicole seminali e l’azione sull’apparato esterno
sul seno urogenitale e sull’uretra. Se invece viene a mancare la differenziazione in senso maschile si
sviluppa il dotto di Muller che darà origine alle tube, al viscere uterino e ai 2/3 superiori della
vagina, mentre i dotti mesonefrici scompariranno. Rimarranno delle vestigia lungo il velo della tuba
dove a volte si formano delle cisti mesonefriche o a lato dell’utero e della vagina (lungo le colonne
laterali della vagina), dove a volte si trovano delle cisti del dotto di Wolff. La differenziazione
avviene singolarmente per ogni gonade che produce la differenziazione del dotto omolaterale, che
va poi a fondersi con il dotto controlaterale.
Quindi il processo di differenziazione “attivo” è rappresentato dalla linea maschile, quando non si
inserisce questo processo la gonade indifferenziata prosegue sulla linea di differenziazione quasi
passiva di tipo femminile, in cui la mancanza di testosterone porta alla regressione del corpo di
Wolff.
3. Maturazione dell’oogonio e dell’oocita
Sempre tra la VI-VIII settimana di vita fetale avviene una rapida moltiplicazione mitotica delle
cellule germinali, in cui arrivano ad essere prodotti fino a 6-7 milioni di oogoni. Gli oogoni vanno
invece incontro alla prima meiosi e danno gli oociti (la cui maturazione sarà descritta più avanti).
4. Formazione follicolare
Si attua intorno alla metà circa della gravidanza (XIV-XX settimana di gestazione) e abbiamo la
delineazione del follicolo nella gonade fetale.
I canali vascolari dalla midollare dell’ovaio vanno a penetrare nella corticale dell’ovaio, la quale
con la presenza di questi vasi assume l’aspetto di cordoni sessuali secondari.
Le cellule mesenchimali presenti nella porzione midollare seguono i vasi e li circondano e vanno a
circondare gli oociti, che sono presenti nella zona corticale: formano il cosiddetto follicolo
primordiale nel quale è presente un oocita ( profase), un unico strato di cellule granulose e la
membrana basale.
2
Nel follicolo primordiale avviene un ingrossamento del citoplasma, la migrazione eccentrica dei
nuclei e proliferano le cellule granulose: quindi da un unico strato di cellule di origine
mesenchimale, abbiamo ora un proliferazione in strati. Si ha così il passaggio dal follicolo
primordiale al follicolo primario.
Nel follicolo primario abbiamo la formazione del corpo di Exner, cioè una specie di
vacuolizzazione delle cellule della granulosa e la formazione di una specie di antro, nel frattempo
compare lo strato interno (strato minore) di cellule tecali, si forma cioè il follicolo preantrale; con
l’ispessimento delle cellule tecali si forma il follicolo antrale. Arriviamo così alla fine della
gravidanza.
RIA: nel mesovaio penetrano arterie e vene con i piccoli rami terminali. Il follicolo primordiale è un
oocita circondato da uno strato semplice di cellule granulose, il follicolo primario, invece, a parte le
modificazioni del citoplasma e del nucleo, è caratterizzato da una proliferazione dello strato di
cellule granulose. Nel frattempo alcuni fenomeni all’interno di questo strato di cellule della
granulosa porta alla formazione di un antro, è una specie di vacuolizzazione e di degenerazione di
queste cellule, e attorno alla membrana delle cellule della granulosa si vanno a differenziare a
partire dalle cellule mesenchimali le cellule tecali (teca interna) con il suo strato di cellule. Alcuni
follicoli però vanno in atresia e questo è uno dei fenomeni che porta alla drastica riduzione degli
oociti e dei follicoli, altri invece maturano fino ad arrivare al follicolo preovulatorio o follicolo di
Graaf.
Ritorniamo ora un po’ indietro per riprendere la parte funzionale.
L’ipotalamo ha una secrezione tonica che è tipica dell’epoca fetale, presente nel maschio e nella
femmina, ed è un feed-back negativo: cioè quando aumenta il livello degli ormoni steroidei sessuali
diminuisce la secrezione di gonadotropine e di realising hormones.
La secrezione pulsatile inizia in epoca peripuberale, in prossimità della pubertà, consente l’avvio
della pubertà con secrezioni episodiche ogni 90-120-min di gonadotropine.
La secrezione ciclica è tipica della femmina e del periodo fertile, esercita un fedd-back positivo: un
aumento degli estrogeni aumenta la secrezione di gonadotropine, in particolare dell’LH, e ciò che
promuoverà poi l’ovulazione.
Feed-back negativo: legato alla secrezione tonica dell’ipotalamo. E’ ancora immaturo fino a metà
della vita fetale, ciò permette la produzione di androgeni e la differenziazione sessuale. Quindi nella
prima metà della gravidanza, quando il SNC è ancora immaturo, è ridotta la sensibilità
dell’ipotalamo alla presenza degli androgeni. Quando matura il SNC, con esso matura anche la
sensibilità al feed-back negativo e il GnRH si mantiene a bassi livelli fino alla pubertà: anche
piccole dosi di ormoni bloccano la funzione ipotalalmica sul GnRH, è quindi bloccato lo stimolo
sull’ipofisi di conseguenza sulla gonade. E’ come se assistessimo ad una fase molto lunga di
gonadostasi, anche se nella gonade avvengono comunque processi di sviluppo del follicolo fino al
follicolo di Graaf. Manca l’ovulazione perché è ferma l’attività ipofisaria di stimolo delle
gonadotropine.
La sensibilità del centro ipotalamico è bassa nella prima fase della gravidanza, poi è molto alta nel
momento in cui matura il centro di sensibilità del feed-back negativo, perciò basse quote di ormoni
bloccano la funzione ipotalamica, durante tutto il periodo che va dalla nascita alla prepubertà. Alla
prepubertà si ha un calo della sensibilità del centro ipotalamico mentre si attiva il meccanismo di
feed-back positivo di stimolo sulla gonade. In questo periodo della pubertà si assiste a dei picchi
irregolari di LH stimolati dalle gonadotropine ipofisarie, ovviamente poi il meccanismo prosegue
fino al processo della menopausa.
Quindi l’andamento dei RH: prenascita _ alto, drastica riduzione alla nascita fino all’età puberale
con ampia fase di quiescenza,
Secrezione pulsatile: siamo nell’età prepuberale, con stimolazione dell’ipofisi alla produzione di
gonadotropine,che stimolino le gonadi alla produzione di ormoni sessuali e quindi allo sviluppo dei
caratteri sessuali secondari.
Che cosa porta il sistema a riacquisire una maggiore sensibilità alla presenza ormonale? Sono vari i
fattori, si parla anche del peso critico (es. ragazze anoressiche), in generale possiamo parlare di vari
3
fattori metabolici che fanno riacquistare sensibilità al centro ipotalamico. Anche qui le
gonadotropine elevate nella seconda metà della gravidanza, calo brusco alla nascita, gonadostasi
fino all’età prepuberale quando si riacquisisce la sensibilità del centro ipotalamico alla produzione
di RH che vanno ad agire sull’ipofisi per produrre LH ed FSH, che stimolano le gonadi a produrre
gli ormoni maschili e femminili.
Quindi la pubertà è caratterizzata da uno sviluppo dell’apparato genitale e dal raggiungimento della
fertilità, comparsa dei caratteri sessuali secondari, massima velocità di crescita e relative
modificazioni dell’apparato osseo, muscolare e adiposo.
[tralascio varie definizioni come menarca, pubarca e altri dati sulla pubertà basta leggerle, le trovate
sui lucidi]
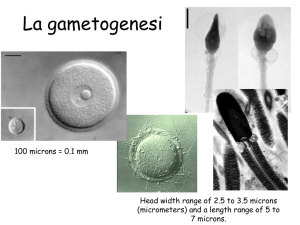
Gametogenesi
Le cellule germinali durante la gravidanza vanno incontro a una mitosi, a metà gravidanza, verso la
40 settimana di gravidanza, si hanno 6-7 milioni di oogoni. Abbiamo poi una fase di meiosi per lo
sviluppo dell’oocita sempre con 46 cromosomi fino alla fase di diplotene: la meiosi si arresta a
questa fase (oocita primario) fino all’ovulazione. A ciò fa seguito una prima divisione meiotica con
l’abbandono del primo corpo polare, quindi metà del patrimonio cromosomico viene eliminato, e la
formazione dell’oocita secondario con 23 coppie di cromosomi. Al momento della fertilizzazione
dell’oocita abbiamo l’espulsione del secondo corpo polare e la formazione con la seconda divisione
meiotica dell’oocita maturo.
Alla nascita abbiamo circa 2-3 milioni di oociti, alla pubertà siamo a 300 mila . Quindi assistiamo
da 6-7 milioni, in un tempo molto breve, ad una drastica distruzione di oociti; poi per ogni oocita
che matura in un follicolo ovulatorio ne abbiamo mille che vanno in atresia: dei follicoli che
sviluppano poi l’ovulazione ce ne sono circa 600 nei vari anni della donna fino alla meno pausa.
Quindi un esaurimento che nell’arco di 50 aa, da 6-7 milioni porta ad una totale scomparsa.
Maturazione del follicolo:
oocita con cumulo ooforo, circondato da cellule della granulosa _ antro ricco di materiale
follicolinico (liquido detto follicolina), cellule granulose e tecali
Ovulazione
E’ dovuta proprio a problemi di ordine meccanico, per la tensione che il follicolo raggiunge
all’interno dell’antro, ed anche alla presenza di cellule muscolari che hanno un’attività contrattile
che porta alla rottura dello strato corticale epiteliale, che nel frattempo si è assottigliato molto, con
fuoriuscita dell’oocita con il cumulo ooforo attorno. Le cellule della granulosa e della teca tendono
a differenziarsi per un processo di luteinizzazione, formando il corpo luteo precoce con all’interno
materiali epiteliali in necrosi frammisti alla follicolina e coaguli di sangue; al completamento di
questo processo si ha la formazione del corpo luteo maturo, che assume un aspetto giallognolo,
può presentare al proprio interno dei residui ematici o dei coaguli e le cellule luteiniche che
proseguono la produzione di progesterone. Nell’arco di 13-14 giorni queste cellule vanno in
regressione per un fenomeno di regressione vascolare che dtermina un’ischemia, una necrosi del
corpo luteo e la sua evoluzione in corpo fibroso detto corpo albicante.
Bisogna pensare che il reclutamento del follicolo non è un reclutamento unico, vengono reclutati
molti follicoli ma solo uno seguirà questo percorso globale della maturazione fino all’ovulazione.
Immagini che illustrano l’evoluzione del follicolo e la sua posizione nell’ovaio: es. quando il
follicolo è antrale diventa quasi midollare, mentre nelle alte fasi è sempre corticale, fino a creare
addirittura una salienza sulla superficie dell’ovaio poco prima dell’ovulazione.
Dimensioni: preovulatorio _ 20 mm, ma parte da 50 µm.
Funzione ormonale
Sotto lo stimolo dell’LH e dell’FSH, dal colesterolo c’è una produzione di androgeni e poi grazie
alla presenza di fenomeni di aromatizzazione la produzione di estradiolo, che è l’estrogeno più
attivo.
4
Quindi gli estrogeni in realtà provengono da un processo metabolico di aromatizzazione degli
androgeni messo in atto dalle cellule della granulosa. Questo spiega perché alcuni difetti recettoriali
per LH o FSH nell’ovaio possono portare allo sviluppo delle cosiddette sindromi dell’ovaio
micropolicistico caratterizzate dalla prevalenza di sostanze di tipo androgeno a scapito di quelle di
tipo estrogenico, e soprattutto con un difetto ovulatorio: sono ovaie che non ovulano e in cui è
prevalente nel siero la componente androgenica per cui queste ragazze sono amenorroiche,
presentano acne e irsutismo, e sono sterili.
Regolazione ormonale dell’ovaio
In un ciclo ideale di 28 giorni, all’inizio abbiamo gli ormoni bassi tranne l’FSH che è alto: questo
rappresenta un meccanismo di feed-back, cioè bassa produzione ormonale _ stimolazione della
gonadotropina.
Proseguendo nei giorni del ciclo ovarico, nel follicolo le cellule della granulosa aumentano la
produzione di estrogeno (in particolare dell’estradiolo) fino a che, dosi critiche di ormone stimolano
la produzione con un vero proprio spike di LH (in particolare) ed FSH. Questo è un meccanismo
con feed-back positivo, in cui si vede che l’aumento degli estrogeni stimola da parte dell’ipofisi la
produzione ulteriore gonadotropine che devono portare alla maturazione del follicolo portandolo
alla fase di ovulazione. Infatti il picco di LH precede di circa 12 ore l’ovulazione. Con l’ovulazione
aumenta significativamente la produzione di progesterone, che sale rapidamente venendo prodotto
da parte del corpo luteo. Salendo la produzione di progesterone e con un secondo picco di estrogeni,
per feed-back negativo, cala la produzione di gonadotropine. Se non avviene la fecondazione e non
si produce il trofoblasto e la gonadotropina corionica, il corpo luteo regredisce, va incontro a
regressione vascolare e di funzione per cui assistiamo ad una caduta drastica del progesterone e
degli estrogeni. La caduta del progesterone attiva la liberazione di prostaglandine presenti nel
corpo luteo, la prostaglandina ha un effetto vasocostrittorio, quindi costringe i vasi che vanno
all’endometrio, per cui si assiste ad un fenomeno di ischemica e necrosi dell’epitelio endometriale e
di distruzione dei rami terminali capillari. Questo prodotto cellulare e vasale di ischemica va a
comporre la cosiddetta mestruazione.
Quando invece avviene l’impianto, la fecondazione, la presenza della gonadotropina corionica
mantiene la funzione del corpo luteo e quindi il livello di progesterone.
Risposta dell’utero
Lo spessore è costituito dal miometrio e da uno strato funzionale (endometrio) in cui identifichiamo
due porzioni: 1/3 di tutto lo spessore che costituisce la zone basale e i 2/3 che costituiscono la zona
funzionale dell’endometrio che è la zona che subisce le modificazione maggiori durante il ciclo
uterino, andando incontro a fenomeni di proliferazione e maturazione della mucosa e sfaldamento
del tessuto a costituire il flusso mestruale. La zona funzionale è costituita da una zona spongiosa e
da una zona compatta.
L’arteria uterina penetra nel miometrio, disegna le arterie arcuate: quella di dx ant si anastomizza
con la sx ant , e quella di dx post si anastomizza con la sx post. Dall’arteria arcuata nasce l’arteria
radiale, che percorre radialmente tutto lo spessore del miometrio fino ad arrivare all’endometrio;
nell’endometrio l’arteria radiale dà un ramo terminale nello strato basale e un ramo spiraliforme: la
porzione terminale non spiraliforme è l’arteria basale che irrora lo strato basale, mentre la porzione
spiraliforme è l’arteria spirale che percorre tutto lo strato funzionale dell’endometrio, fino a
terminare in un plesso capillare che interessa sia lo stroma dell’endometrio (plesso capillare
stromale) che la struttura ghiandolare dell’endometrio (plesso capillare ghiandolare). Da qui
abbiamo la convergenza nel distretto venoso, nel lago venoso che ha architettura speculare a quello
arterioso.
Spessore dell’endometrio.
Lo strato funzionale è quello contenente la differenziazione delle ghiandole endometriali; l’unità
funzionale è lo stroma, tutto l’asse vascolare dell’arteria spirale e la caratterizzazione delle
ghiandole. Se partiamo dall’inizio del flusso noi vediamo che dallo strato basale che si mantiene
immutato, dai monconi delle strutture ghiandolari che si sono sfaldate, avviene un processo di
rigenerazione di tutto questo tessuto endometriale che contiene lo stroma, l’assetto vascolare e la
5
struttura ghiandolare. L’epitelio che riveste sia la superficie endometriale che gli sfondati
ghiandolari è un epitelio di tipo colonnare-cuboide che la funzione fondamentale di secernere una
mucina particolare.
Lo sviluppo nei primi giorni è essenzialmente rappresentato da un aumento di spessore dello
stroma, da uno sviluppo delle ghiandole (che sono ancora molto rettilinee) e dei vasi spiraliformi.
In prossimità del periodo ovulatorio abbiamo lo sviluppo in altezza di questo tessuto e l’inizio dei
fenomeni secretivi da parte delle ghiandole, con la produzione di una mucina particolare ricca in
glicogeno, glicoproteine, lipidi e mucopolisaccaridi, che ha un’azione nutritiva. Nel frattempo lo
stroma, struttura vascolare e struttura ghiandolare, per effetto dello stimolo gonadotropo (LH ed
FSH) continuano a svilupparsi ma essendo costretto in uno spessore oramai definito, lo sviluppo
avviene aumentando al tortuosità delle ghiandole e della porzione spirale dei vasi.
La caduta del progesterone, attiva la produzione di prostaglandine che hanno azione vasocostrittrice
e di stimolo contrattile sul miometrio, che dà la sensazione di fastidio nella fase premestruale.
L’azione della prostaglandina sui vasi ha invece azione ischemizzante per cui si va incontro a
fenomeni di ischemica, necrosi e degradazione del tessuto che insieme ai detriti e ai prodotti dio
degradazione di tutto lo spessore del tessuto e dei vasi va a costituire il flusso mestruale.
N.B. Riguardo la lezione, in fotocopisteria trovate sia i lucidi (ma non so quanto siano utili) e 3
capitoli di un non meglio specificato testo. Inoltre ci sono tutti gli orari degli ambulatori del S.
Gerardo e del Bassini e delle lezioni (formali ed informali).
AVVISI
! Dal momento che le ore della didattica formale non sono sufficienti, parte degli argomenti di
studio verranno trattati durante due seminari e in due incontri con tutori che si terranno a maggio.
Date, sede e argomento degli incontri sono in copisteria.
! Sono previsti cinque incontri tutoriali dedicati alla discussione di casi clinici e degli argomenti
non trattati a lezione, trattandosi di una forma “interattiva” di lezione i ginecologi richiedono
quindi che ci dividiamo in cinque gruppi (ognuno dei quali farà tutti e cinque gli incontri). Le
date però sono ancora tutte da definire, così come la nostra distribuzione nei gruppi: la divisione
nei gruppi è totalmente autogestita, mentre le date saranno da concordare con i vari docenti ( ma
probabilmente saranno di sabato);
! Didattica non formale: Mangioni non vuole studenti fino a Pasqua. Al contrario Milani si è detto
più che disponibile ad accettare studenti nel reparto di Ginecologia del Bassini, dove oltre a tutte
le attività di reparto e ambulatorio si può frequentare la sala operatoria (non aperta agli studenti a
Monza), mentre non c’è la sala parto. L’elenco e gli orari delle attività al Bassini sono in
copisteria, tenete presente che però non sono ammessi più di due studenti per attività, dal reparto
alla sala;
! Resta il problema di coloro che avrebbero dovuto frequentare il reparto di Ginecologia a marzo.
Il consiglio è: arrangiatevi! L’elenco e gli orari degli ambulatori del San Gerardo sono in
copisteria (con quelli del Bassini), il problema maggiore sarà la sala parto: il minimo previsto e
di un giorno dalle 8.00 alle 20.00, ma ancora una volta ce la caveremo in un sabato o in una
domenica;
! Sono disponibili diverse tesi in Ginecologia al Bassini e gli studenti che vogliano svolgere sono i
benvenuti, inoltre, a detta di Milani, svolgerla lì anziché al San Gerardo non penalizza al test per
la specialità;
! Riguardo ad esami, libri di testo e molto altro ancora Dilani mi è sembrato un po’ confuso, ma al
più presto saprà darci informazioni più dettagliate.
6