Carboidrati: zuccheri e polisaccaridi
Legno, carta, fibre di piante e gomme vegetali solubili in acqua usati come adesivi e
leganti sono tutti fatti di composti che provengono da questa categoria.
Originariamente il termine carboidrati in veniva dato a composti di formula empirica
generale Cx (H2O) y poiché venivano pensati come idrati di carbonio.
Questa idea cadde subito e l'espressione divenne meno restrittiva come rapporto di tre
soli elementi, per quanto molti semplici composti con solo carbonio, idrogeno e
ossigeno sono di fatto esclusi. In pratica possiamo prendere questa definizione come
riferimento per gli zuccheri (monosaccaridi) e per i loro polimeri, i polisaccaridi.
Questi sono probabilmente i materiali organici più abbondanti sulla faccia della terra
poiché, nella forma di cellulosa e amido, essi formano una buona proporzione di tutti gli
alberi e le piante. Come si sa, essi sono formati dall'acqua e dall' ossido di carbonio
nell'atmosfera mediante il processo di fotosintesi, dove l'energia della luce del sole viene
utilizzata per questo scopo, mediata da un pigmento verde della pianta chiamato
clorofilla.
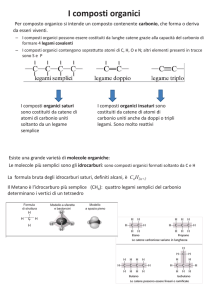
Monosaccaridi.
La chimica dei carboidrati è un soggetto vasto e difficile da condensare in un breve
riassunto. Gli zuccheri stessi sono abbastanza complessi, essi comunemente esistono in
diversi differenti forme chimiche ed essi si combinano l'uno con l'altro in differenti
possibili modi. Questo sarà illustrato da uno zucchero di riferimento, il più comune di
essi: il glucosio. Il glucosio ha una formula molecolare C6H12O6 esso ha cinque gruppi
ossidrilici e un gruppo carbossilico e poiché il primo può essere ossidato ad acido esso
dev'essere collocato su un atomo di carbonio primario piuttosto che secondario, infatti è
una aldeide piuttosto che un chetone. Il glucosio può essere convertito in acido nesanoico e così i carboni devono essere presenti come catena lineare. Queste
caratteristiche sono rappresentate nella seguente struttura:
1
Questa struttura comunque non è la definitiva. I gruppi aldeidici possono reagire,
reversibilmente, con i gruppi ossidrilici per portare composti conosciuti come emiacetali
e successivamente, con un secondo gruppo ossidrilico, per dare acetali:
Se l'aldeide i gruppi alcolici sono presenti nella stessa molecola allora si può formare un
emiacetale ciclico, e questo è di fatto preferito se l'anello risultante è cinque o sei
membri. Si può notare che questo è il caso del glucosio e possono essere formati anelli
emiacetalici sia a cinque che a sei membri:
Le due strutture sono conosciute come furanose (quelli a cinque membri) e piranose ( a
sei membri). Esse sono interconvertibili attraverso la forma a catena aperta. La maggior
parte degli zuccheri nello stato cristallino sono nella forma piranosica, quando questa
alternativa è disponibile.
Si può notare che i quattro atomi di carbonio, che posseggono gruppi ossidrilici
secondari nella struttura a catena aperta sopra, sono asimmetrici, o centri chirali (1.1.1).
I differenti isomeri che si formano da differenti configurazioni a questi centri, e che
corrispondono a zuccheri differenti, sono descritti sotto. Un ulteriore centro asimmetrico
viene fuori quando la catena aperta si converte in ciascuna delle strutture cicliche, dando
così luogo a due possibili isomeri:
2
Le due varianti, conosciute come e glucosio, sono di fatto conosciute e si formano
quando il glucosio è cristallizzato da una soluzione acquosa sotto i 50 °C e quando è
cristallizzato da una soluzione acquosa sopra 95 °C, dove si ottiene il secondo. Quando è
disciolto in acqua risultaalla fine una miscela dei due in equilibrio, poichè essi sono
naturalmente interconvertibili attraverso la forma a catena aperta. Le due forme
epimeriche sono conosciute come anomeri.
I monosaccaridi non sono confinati a composti con 6 atomi di carbonio (esosi). La più
semplice poliidrossialdeide ha tre atomi di carbonio ed è il composto 2,3diidrossipropanale o gliceraldeide.
Poiché questa ha un singolo centro asimmetrico allora esistono due enantiomeri con
uguale e opposta rotazione ottica. I due enantiomeri possano essere descritti come segue:
o usando la cosiddetta convenzione di Fischer, nella quale i legami orizzontali sono
pensati venir fuori dal piano del foglio e quelli verticali penetrare sotto il piano al foglio:
Il + e - nei nomi dei due enantiomeri indicano che gli enantiomeri hanno un segno di
rotazione positiva o negativa. D e L specificano la loro stereochimica assoluta come
indicato. Questi due enantiomeri della gliceraldeide sono i capostipidi di due serie di
zuccheri D zuccheri ed L zuccheri, in cui le stereochimiche dei carboni più distanti dal
gruppo carbossilico sono come nei composti precursori.
La maggior parte, ma non tutti, gli zuccheri naturali appartengono alla famiglia D,
quindi il glucosio è il D-(+)glucosio. Si potrebbe notare che sebbene i simboli D ed L
originariamente derivano da destro e levo (destra e sinistra; positiva e negativa) essi di
fatto non indicano il reale segno di rotazione dei composti a cui sono attaccati.
La gliceraldeide può essere pensata come un trioso. La famiglia dei D aldosi dei quali
può essere considerato il precursore è mostrato in figura 6.1.
3
Ci sono due aldosi con quattro carboni (tetrosi) conosciuti come eritroso e treoso,
quattro con cinque carboni (pentosi) conosciuti come ribosio, arabinosio, Xilosio e
lixsosio, e otto esosi: allosio e altrosio, glucosio e mannosio, gulosio e idosio, galattosio
e talosio (elencate come coppie epimeriche).
Composti in cui il gruppo carbonilico è presente come chetone piuttosto che come
aldeide sono conosciuti come chetosi. Quindi il fruttosio è un chetoso:
Aldosi e chetosi mostrano alcune importanti differenze nelle proprietà chimiche dovute
a differenti reattività dei gruppi aldeidici e chetonici. Siccome le aldeidi vengono
facilmente ossidate ad acidi, esse stesse sono a loro volta riducenti, e la riduzione di
4
soluzioni di nitrato di argento ad argento metallico è un test molto ben conosciuto per
esse. Gli aldosi sono di conseguenza conosciuti come zuccheri riducenti.
Deve anche essere menzionato un ulteriore gruppo di composti derivati dagli zuccheri.
Questi sono gli acidi ironici, che sono i composti in cui il gruppo ossidrilico primario è
stato convertito in acido carbossilico. I loro nomi deriano dagli zuccheri corrispondenti,
per esempio acido glucuronico e acido galacturonico rispettivamente da glucosio e
galattosio.
Questi composti sono importanti componenti di molti polisaccaridi, comprese le gomme
vegetali.
Il sistema di rappresentare le strutture cicliche che è stato usato ampiamente non è
molto soddisfacente, esse sono mostrate più comunemente nelle cosiddette formule di
Haworth come un anello planare con i sostituenti posizionati sopra e sotto, quindi D
glucosio e D glucosio sono rappresentati così:
Come spiegato per gli idrocarburi ciclici (1.1.3) gli anelli a sei membri non sono planari:
per ottenere una conformazione libera da tensioni esse adottano una forma a sedia o a
barca. Gli emiacetali ciclici adottano anche una forma a sedia, ma per convenienza di
rappresentazione noi useremo le formule di Haworth in ciò che segue.
Oligosaccaridi.
I monosaccaridi possono formare legami l'un l'altro per formare molecole più grandi.
L'ambito degli oligosaccaridi (oligo=pochi), piuttosto arbitrariamente, va dai disaccaridi
fino a composti che contengono circa 10 unità di zucchero. I più importanti sono il
disaccaridi, poiché questi includono i comuni zuccheri di origine vegetale e animale
come il sucrosio e il lattosio. Essi sono principalmente composti da esosi.
Il legame tra due monosaccaridi in un disaccaridi, che è conosciuto come legame
glicosidico, prende la forma di un legame acetalico etereo. Cioè a dire il gruppo
ossidrilico del gruppo emiacetalico di uno dei componenti ha reagito con il gruppo
ossidrilico di un secondo componente (che può anche essere l'ossidrile del suo
emiacetale) per formare un'acetale, per esempio:
5
Questa struttura rappresenta quella del maltosio, formata da due unità di glucosio unite
mediante legame dell'emiacetale con un ossidrile C-4 dell'altro. Questa seconda unità
ancora possiede un gruppo emiacetale e quindi, potenzialmente, un gruppo aldeidico. La
molecola quindi ha ancora proprietà riducenti. Il legame glicosidico nel maltosio è
formato da un -anomero. Il -anomero forma un disaccaride differente, il cellobiosio
(vedi sotto):
Il disaccaride sucrosio è quello che noi conosciamo come ordinario zucchero bianco (lo
zucchero marrone è lo stesso composto nella forma impura). Il sucrosio è formato dal
legame del gruppo emiacetalico del glucosio con il gruppo emichetalico del fruttosio.
Esso quindi non possiede gruppi aldeidici potenziali e non è riducente.
Il sucrosio è largamente diffuso nel il regno vegetale. Ed è il principale componente del
nettare delle piante. Il miele quindi consiste principalmente di sucrosio, ma contiene
anche quantità variabili di glucosio e fruttosio, che risultano dall'idrolisi aiutata dagli
enzimi forniti dalle api.
Idrolisi dei glicosidi
Il legame glicosidico, in comune con altri acetali, si può rompere facilmente con un
trattamento di acidi deboli per portare a singoli monosaccaridi. Questo fatto è molto
importante nell'analisi e nella identificazione di oligo e polisaccaridi. La rottura del
legame glicosidico è anche facilmente influenzato dagli enzimi, come avviene nella
digestione, nella fermentazione dei lieviti, e nella degradazione della cellulosa da parte
dei funghi nella putrefazione del legno.
6
Polisaccaridi.
I polisaccaridi importanti includono cellulosa, amido, gomme vegetali e mucillagini.
I primi due di questi sono materiali a peso molecolare molto alto e struttura semplice e
regolare. Le gomme e le mucillagini sono composti più complessi.
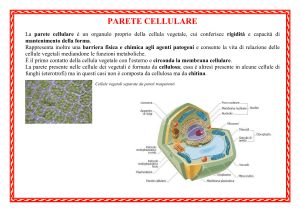
Cellulosa
La cellulosa è la più abbondante di tutti i composti organici ed è naturalmente, un
materiale molto comune nei musei, come legno, carta, tessuti fatti di fibre vegetali. È un
polimero lineare di glucosio in forma di -piranosio e può essere rappresentato così:
È possibile che ci siano occasionali irregolarità in questa struttura, come la presenza di
gruppi carbossilici, legami esterei, legami ad altri zuccheri residui. In ogni caso, questo
può accadere solo per la cellulosa isolata, piuttosto che come materiale puro proveniente
dal mondo vegetale, proprio perché risulta difficile da purificare senza modificazione
della sua composizione, particolarmente per ossidazione.
Il peso molecolare è molto alto, ma il grado di polimerizzazione non è conosciuto
esattamente poiché alcuni fenomeni di riduzione ed estensione del peso molecolare
avviengono normalmente durante estrazione, ma esso può qualche volta superare i
10000 o 15000 unità. Il gran numero di gruppi ossidrilici permette un legame idrogeno
sia inter che intra molecolare. Questo significa che le catene lineari si allineano esse
stesse una accanto all'altra per formare microfibre che si orientano un più o meno lungo
l'asse delle fibre vegetali. Il riarrangiamento delle molecole è sufficientemente ordinato
per la cellulosa per dare come modello di diffrazione a raggi x, essenzialmente lo stesso
per materiale proveniente da tutte le varie sorgenti.
A causa dei suoi numerosi gruppi ossidrilici, la cellulosa ha un'alta affinità per l'acqua
senza essere veramente solubile, per esempio la formazione di legami idrogeno con
l'acqua non è sufficiente per vincere il forte di legame idrogeno tra le molecole. L'acqua
è assorbita dall'atmosfera al punto di equilibrio: al 50% di umidità relativa questo
ammonta a un contenuto di acqua di circa il 6% in peso, al 100% a circa il 22%.
L'assorbimento dell'umidità da parte della cellulosa risulta nel rigonfiamento e
conseguentemente cambiamenti nell'umidità relativa determinano cambiamenti
dimensionali degli oggetti di legno, che rappresentano un pericolo per la loro stabilità.
7
La cellulosa viene gonfiata più fortemente da soluzioni alcaline forti, come l'idrossido di
sodio, e le sue proprietà possono quindi essere modificate. Alcuni trattamenti
costituiscono le basi per la mercerizzazione (c.1850) per la produzione di fibre con
migliori proprietà di tintura ed una maggiore resistenza meccanica, e in una successiva
modificazione, effetti di brillantezza (seta artificiale).
La cellulosa si scioglierà in alcune soluzioni come conseguenza della sua trasformazione
in derivati solubili, e la cellulosa stessa può essere precipitata mediante un'adatto
trattamento. Questo forma la base per la preparazione di varie fibre artificiali e film di
cellulosa. Il materiale preparato per rigenerazione da una soluzione in solfato di
cuproammonio (rayon cuproammonio) è datata circa 1890, mentre il materiale è formato
da un altro processo conosciuto come rayon Viscosa, datato dal 1892. Il processo per la
fabbricazione di film trasparenti sottili di cellulosa conosciuto come cellophane è datato
1924. La storia delle cellulose rigenerate è stata documentata.
Il deterioramento della cellulosa, sia per ossidazione che per processi idrolitici, è un
argomento di grande importanza per la questione della preservazione di libri e
manoscritti. È relativamente stabile alla autoossidazione a una temperatura ordinaria, ma
i gruppi ossidrilici primari possono essere progressivamente ossidati a gruppi
carbossilici acidi, specialmente sotto l'influenza della luce. Come con tutti i polimeri ad
elevato peso molecolare, anche una piccola quantità di ossidazione o idrolisi, che risulta
nella rottura della catena, ha effetti sproporzionati sulle proprietà fisiche, poiché anche
solo una rottura della catena dimezza il peso molecolare medio o il grado di
polimerizzazione (DP). Reagenti ossidativi sbiancanti usati per la carta devono essere
scelti con attenzione poiché alcuni ossidano i gruppi ossidrilici primari a carbonilici o
carbossilici e anche riducono, o potenzialmente riducono, il DP.
Come con altri composti contenenti legami glicosidici, la cellulosa è idrolizzata da acidi
acquosi, prima di tutto in punti casuali lungo la catena, per dare unità di cellulosa più
piccole e per ultimo il glucosio stesso. L'idrolisi è anche indotta da enzimi idrolitici,
chiamati cellulasi, che sono prodotti da molte specie di muffe o altri funghi. Queste
possono conseguentemente rompere la cellulosa e utilizzare i prodotti per la loro stessa
nutrizione, quindi sono un pericolo per legno, carta e fibre tessili in condizioni umide,
che sono necessarie per la crescita di muffe.
I gruppi ossidrilici della cellulosa possono come altri gruppi ossidrilici, essere convertiti
nei loro esteri o eteri e un certo numero di questi prodotti sono stati, e in qualche modo
sono ancora, importanti materiali semi sintetici per plastiche, adesivi e rivestimenti.
Nitrati di cellulosa.
Per trattamento della cellulosa con una miscela di acidi solforico e nitrico i gruppi
ossidrilici sono convertiti nei loro esteri nitrati, ONO2. Scoperto nella 1833 e sviluppato
nel 1840, il prodotto è stato usato come un esplosivo (fulmicotone). Questo materiale è
altamente nitrato. Un prodotto complessivamente meno nitrato (e in qualche modo più
8
stabile), modificato per addizione di pigmenti e plastificanti (inizialmente canfora; con il
30% in peso) ha formato la base, dalla 1850, per è materiali plastici da modellatura usati
come avorio artificiale per manici di coltelli, tasti di pianoforte etc. e anche per fare
gusci di tartaruga artificiali. Esso è diventato un materiale familiare sotto il nome di
celluloide (collari per uomini; piccoli cani; palle da ping-pong) mentre soluzioni in etere
o miscele di etere alcol o altri solventi erano conosciuti sotto il nome di Collodio che è
usato per suturare piccole ferite.
Molte colle brevettate consistono ancora di soluzioni di nitrato di cellulosa. Come
rivestimento superficiale esso ha avuto molte applicazioni, compreso l'utilizzo come
vernice impermeabilizzante per i tessuti di sigillo nei primi aeroplani. Altri utilizzi sono
stati usati come base per le pellicole cinematografiche,; come vetro laminato per i
parabrezza delle macchine; nelle vernici per auto. È stato anche utilizzato come vernice
nell'importante dipinto tedesco che si è scurito moltissimo ed è difficile da rimuovere.
Gli esteri nitrati sono composti fondamentalmente instabili (11.1.2). I nitrati degli alcoli
a basso peso molecolare sono estremamente sensibili e possono esplodere con un
piccolo innesco mentre il glicerolo tri nitrato (nitroglicerina) è solo leggermente meno
sensibile. Il nitrato di cellulosa ha bisogno di essere detonato perché esplode ama è
sempre estremamente infiammabile.
Nel tempo esso può decomporsi spontaneamente anche al buio, in un processo che libera
ossido di azoto altamente acido che è deleterio per altri materiali nelle vicinanze. Per
esempio, strumenti scientifici laccati con esso possono diventare altamente corrosi dalla
formazione di nitrati metallici. Esso si decompone più rapidamente alla luce e vira al
giallo. Questa colorazione gialla è una caratteristica familiare dei vecchi vetri laminati
dei parabrezza delle macchine nominati prima.
La rivista citata sopra riporta una ricerca eseguita sulle variazioni della stabilità al calore
dei differenti campioni commerciali dei prodotti di nitrocellulosa e anche sulla
stabilizzazione degli oggetti di musei o che ha contengono. La decomposizione è
autocatalitica, e viene accelerata come vengono accumulati i prodotti acidi di
decomposizione. Questi non solo aiutano l'idrolisi di ulteriori nitrati ma anche
idrolizzano le catene di cellulosa stessa. La deacidificazione mediante lavaggio con
acqua seguita da un trattamento con deboli alcali aumenta notevolmente la conseguente
stabilità.
In una pubblicazione più recente, uno studio sulla decomposizione termica di un
particolare adesivo di nitrato di cellulosa è stato eseguito per confronto con il nitrato di
cellulosa puro. Le velocità di decomposizione erano più alte in condizioni chiuse, in
opposizione a quelle aperte, nell'adesivo (che conteneva una percentuale considerevole
di plastificante dibutilftalato) aveva una velocità significativamente più bassa di
decomposizione di quella del nitrato di cellulosa puro. Questo adesivo è stato utilizzato a
partire dal 1950 per riparare tavolette cuneiformi di argilla seccata al sole e dalle sue
condizioni fu dedotto che questo particolare adesivo avrebbe avuto una vita utile almeno
un centinaio di anni.
9
Mentre teoricamente il nitrato di cellulosa non dovrebbe mai essere usato nella pratica
moderna della conservazione, se non viene trovato un altro adesivo completamente
adatto può forse essere utilizzato nei casi come in precedenza, dove esso è protetto dalla
luce e dall'aria da un substrato, è esso stesso di natura difficilmente attaccabile e dà
prodotti di decomposizione. Questo ovviamente non è il caso di metalli con materiali
organici.
Oggetti fatti di nitrato di cellulosa sono molto facilmente identificabili come tali, perché
hanno uno spettro infrarosso caratteristico. Riscaldando un piccolo frammento in un
tubo di combustione si induce la decomposizione e lo sviluppo di fumi marroni di ossido
di azoto. Un test colori metrico sensibile è stato anche descritto.
Acetato di cellulosa
Mentre sono più stabili dell'estere nitrato, gli acetati di cellulosa sono materiali meno
stabili di quanto si credesse una volta. Il nitrato è stato in parte utilizzato per vari scopi:
per pellicole di sicurezza (1909)\e vernice impermeabilizzante per aerei (1917).
Materiale altamente acetilato è conosciuto come triacetato e il materiale non
completamente acetilato (formato da parziale idrolisi del primo o mediante un processo
di acetilazione controllata) come acetato secondario. Non bisogna pensare comunque
che a questi corrispondano due composti ben definiti; è solo una questione di
proporzione dei gruppi ossidrilici totali che sono esterificati.
L'acetato secondario è più facilmente solubile ed è stato per primo utilizzato per le fibre
circa nel 1927, mentre il più difficilmente trattabile triacetato fu utilizzato per questo
scopo dopo la seconda guerra mondiale. Materiali intessuti per vestiti e altri scopi sono
realizzati con queste fibre ( rayon acetato).
Molti tipi di oggetti stampati, realizzati per estrusione o fabbricati in altro modo sono
stati prodotti dal materiale grezzo, che comunemente consiste di diacetato.
La pellicola fotografica è fabbricata con triacetato.
La stabilità o l’instabilità dell’acetato di cellulosa è di considerevole importanza, perché
non solo è stato utilizzato come già visto, ma è stato anche impiegato come materiale di
archivio per documenti storici e per la loro laminazione. Un'importante ricerca è stata
fatta sull’argomento negli ultimi anni, in risposta ai casi di ovvio deterioramento.
Sembra ora anche il problema è essenzialmente quello dell'idrolisi dei gruppi acetati e
della liberazione di acido acetico libero. Questo, a turno, catalizza una ulteriore idrolisi
dei gruppi esteri e promuove inoltre l'idrolisi della catena di cellulosa stessa, con una
risultante riduzione nel grado di polimerizzazione. In accordo con questo meccanismo è
il fatto che il degrado è promosso dall'aumento dell'umidità relativa e ogni iniziale
presenza di un acido. Poiché vari meccanismi contribuiscono al deterioramento, effettive
misure di stabilizzazione comportano una combinazione di catturattori acidi,
antiossidanti fenolici e deattivatori di ioni metallici.
10
Il deterioramento dell'acetato di cellulosa è un problema serio nel caso delle sculture
dell'artista Naum Gabo, che lo contengono in varie forme e insieme con nitrato di
cellulosa e, dopo il 1937, con polimetilmetacrilato. Lacido acetico liberatosi è
facilmente rilevabile dal suo odore e da gocce di plastificante che venivano spesso
essudate.
Come il nitrato, l'acetato di cellulosa può essere facilmente identificato dal suo spettro
infrarosso.
Altri derivati della cellulosa
Altri esteri di cellulosa come il propionato, il propionato acetato misto, e il butirrato
acetato sono attualmente fabbricati e utilizzati come materiali oggetti a stampo che sono
insieme più resistenti di quelli fatti in acetato di cellulosa.
Vari sono fatti di etere di cellulosa e questi sono divenuti importanti in diversi modi. In
questi, i gruppi ossidrilici della cellulosa sono parzialmente rimpiazzati da gruppi -OR
dove R= metil (CH3), carbossimetil (-CH2COOH) a, o idrossietil (-CH2CH2OH). La
metil cellulosa è usata come finitura tessile e come colla e sostituta dell'amido, come
adesivo, agente emulsionante e in altri modi.
La carbossimetilcellulosa, generalmente usata come sale di sodio solubile in acqua, ha
usi simili ed è anche valida come additivo ai detergenti di lavanderia per prevenire la
rideposizione di sporco ed aiutare il lavaggio seguente. È anche un comune ingrediente
degli attuali adesivi per manifesti. Sono stati studiati l'applicazione degli etere di
cellulosa nella conservazione della carta e gli effetti dell'invecchiamento artificiale.
La cellulosa può anche essere modificata da un processo conosciuto come
polimerizzazione a innesto, nel quale i polimeri sintetici sono indotti a legarsi
chimicamente essi stessi alla catena della cellulosa, generalmente attraverso reazioni di
radicali liberi. La forza e la resistenza chimica possono essere quindi migliorate e la sua
applicazione alla carta invecchiata è stata studiata.
Amido
Questo abbondante materiale è la principale riserva di carboidrati del regno vegetale, si
presenta come piccoli granuli nelle radici, bulbi, tuberi e semi. Esso è facilmente isolato
da questi in forma abbastanza pura.
Come la cellulosa, l'amido consiste di polimeri di glucosio, ma esso contiene due
differenti tipi di materiali chiamati amilosio e amilopectina. Il primo di questi è un
polimero lineare con legami -glicosidici ( la cellulosa ha la -configurazione). La
amilopectina ha una struttura ramificata con ciascuno dei rami come nell’amilosio (con
circa 25 unità di glucosio), ma la ramificazione avviene attraverso 1, 6 legami, per
esempio al gruppo ossidrilico primario, ma non è certo dove avvenga esattamente questo
legame sulla catena della amilosio. Esso può essere casuale.
11
La proporzione di questi due ingredienti è molto variabile da sorgente a sorgente e
conseguentemente le proprietà negli amidi sono anche variabili. L'amido non è solubile
in acqua fredda i granuli si gonfiano reversibilmente. Quando la sospensione è riscaldata
in granuli si rompono e si forma una spessa dispersione viscosa, la pasta di amido. Più
amilosio significa un gel più spesso e un film più duro, ma l’adesività sembra dipendere
da un certo numero di fattori.
Le proprietà pratiche degli amidi dalle diverse sorgenti sono stati testati, poiché hanno
l’effetto di modificarli chimicamente in diversi differenti modi. È stato trovato che la
parziale idrolisi con acido a temperature al di sotto del punto di gelatinizzazione
migliorava l’adesività. La pasta di amido di grano è molto utilizzata dall'incastonatore
conservatore e una grande cura viene data nella sua preparazione. Una pasta invecchiata
per più di dieci anni (furu-nori) è stata preparata ed è molto più adesiva.
Presumibilmente essa ha subito una parziale idrolisi, probabilmente come risultato
dell'attività enzimatica da parte di muffe che si formano sulla superficie.
Come si sa bene, l'amido è stato a lungo importante per l'incollaggio di carta e come
indurente negli articoli di vestiario. Esso è un materiale permanente per quanto riguarda
la resistenza all'autoossidazione ma è in natura un buon materiale di crescita per muffe
in condizioni umide.
L'amido è stato qualche volta trovato nelle preparazioni dei dipinti ed era una volta un
ingrediente di uso comune come adesivo per le rifoderatura. È stato rilevato mediante
reazioni caratteristiche con ioduro che dà un colore blu (è la componente dell'amilosio
che è la responsabile di questo). È stato inoltre trovato mischiato con pigmenti organici
(indigo, gommagutta, lacca rossa) su stampe giapponesi, e sui intonaci di murali del
XVII secolo in Bulgaria.
12
La destrina, o gomma britannica, è un amido modificato dal calore per renderlo
completamente solubile in acqua fredda. È stato usato come una adesivo per la carta e
per il cartone.
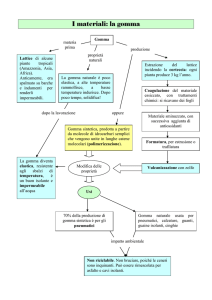
Gomme vegetali e mucillagini
Molti alberi e piante essudano gomme polisaccaridiche quando accidentalmente o
deliberatamente vengono tagliati. Questi sono materiali ad alto peso molecolare,
solubili in acqua o disperdibili in acqua. Alcuni sono di notevole importanza economica
e sono prodotti in grandi quantità, la gomma arabica è l'esempio più famoso.
La chimica delle gomme è particolarmente complessa generalmente per diversi zuccheri,
e acidi derivati da essi, che entrano nella loro composizione, vedere la tabella e 6.1.
I reali modi in cui questi sono legati insieme sono generalmente solo parzialmente
conosciuti e per la maggior parte non ce ne preoccuperemo qui. Le gomme sono state
importanti nell'arte come legante principale per i colori ad acqua, nelle miniature e nella
miniatura di manoscritti. D'altro canto che essi sono importanti come adesivi, per
francobolli della posta e buste (ora rimpiazzate parzialmente dall’alcol polivinilico; vedi
9.2.3 ), essendo commestibile esso può essere leccato senza pericolo: di fatto il loro
utilizzo principale è negli alimenti. I seguenti paragrafi descrivono le gomme più
importanti. Una lista più completa può essere trovata in una recente rivista.
Gomma arabica o gomma acacia
13
La gomma arabica è il prodotto di un numero di specie di acacia delle quali quella del
Senegal è la più importante. La maggior parte del materiale in commercio ha origini dal
Sudan dove questo albero occupa un parte nella foresta selvaggia e viene anche
coltivato. La gomma arabica è stata ampiamente utilizzata nell'antico Egitto ed è restata
un articolo di commercio per migliaia di anni.
La domanda nelle esportazioni è continua, dal Sudan sono state esportate circa 50 mila
60 mila tonnellate all'anno nell'ultimo periodo. Considerevoli quantità vengono anche
prodotte in altre parti della Africa. Altre specie sono le fonti delle gomme di acacia
dell'India, e della Australia dove il materiale è conosciuto come gomma di vimini.
Poiché la gomma arabica contiene l'acido glucuronico è naturalmente acida e infatti
esiste come sale di calcio, magnesio e del catione potassio. Trattamento con acido o
resine a scambio ionico dà l'acido libero conosciuto come acido arabico. Soluzioni di
questo hanno un pH di circa 2, 7 e un peso equivalente di circa 1380.
Gomma adragante
Questo è un altro materiale conosciuto fin dai tempi classici. Ottenuto da specie di
astralagus (leguminosae) che cresce in Asia minore e nel vicino oriente e in particolar
modo in Iran. La sua raccolta è un processo lungo e il materiale di conseguenza è
costoso e probabilmente è stato molto meno usato rispetto la gomma arabica. Esso non è
interamente solubile in acqua; la parte che si discioglie è conosciuta come adragantina
che semplicemente si gonfia.
Gomma di ciliegio
Le gomme essudate da diverse specie di prugni sono state trovate utilizzo in Europa per
secoli, poiché esse erano disponibili da alberi indigeni. La gomma di ciliegio è stata la
più citata, ma le gomme del mandorlo, albicocco susino, pero sono simili e
probabilmente non erano distinte con chiarezza.
Come la adragante, queste gomme sono solo parzialmente solubili e si gonfiano
formando una marmellata con l'acqua. Apparentemente la gomma di ciliegio è stata
anche utilizzata come legante dagli artisti nel XIX secolo. Come menzionato in una
sezione più tardi le gomme dei frutti dell'albero sono state anche molto utilizzate nei
dipinti murali nel centro Asia.
Gomma di carrubo o di robinia
L'albero di carrubo o robinia dell'area del mediterraneo è stato utilizzato fin
dall'antichità. Esso produce una grande quantità di fagioli contenenti il nocciolo che
porta la gomma.
I fagioli sono stati usati come cibo per animali e per le persone e le gomma si dice sia
stata impiegata dagli antichi egizi nel bendaggio delle mummia. Oggi la gomma è
14
ancora largamente utilizzata negli alimenti, ma ancora di più come additivo nella
fabbricazione della carta.
Mucillagini di tamarindo
Il tamarindus indica un grande albero sempreverde comune in India e nel sud est
asiatico che produce larghi baccelli piatti. La polpa di questo baccello è molto utilizzato
nel cibo, mentre i semi, tra i vari utilizzi, forniscono una gomma o mucillagini ora
utilizzata per incollare le fibre e negli alimenti. Si dice che sia stato il principale legante
per i dipinti murali indiani e le miniature.
Altre gomme
Molte altre piante producono gomme e mucillagini che sono state e sono utilizzate.
Nel subcontinente indiano materiali importanti sono la gomma guar; la gomma karaya,
nella quale il polisaccaride è parzialmente acetilato; la gomma ghatti che è presente
come sale di calcio e magnesio dell'acido polisaccaride e viene utilizzata in modo simile
a quello della gomma arabica.
Nel nuovo mondo ci sono anche molte gomme utilizzabili e mucillagini. Nel nord e
nell'Messico la algaroba è una di quelle che stata utilizzata come sostituto della gomma
arabica. Nell'Messico e nel sud degli Stati Uniti la … gap del cactus si dice che produce
una gomma nei caldi periodi secchi. Nell'Africa ovest l'albero africano di mogano
produce la gomma khaya.
Le gomme resine, come mirra e incenso hanno un contenuto di gomma in aggiunta alla
loro resina, come anche la gommagutta, ma poco sembra sia stato riportato sulla chimica
dei carboidrati di quest’ultima. Anche alcune conifere producono gomme resine , è nota
la specie Araucaria, la composizione della quale è stata determinata.
Nella pratica artistica giapponese e di conservazione è stata qualche volta impiegata una
mucillagine ottenuta dalle alghe marine. La sorgente vegetale sono alghe marine
macroscopiche principalmente... e altre specie. La mucillagine, estratta con acqua calda,
è conosciuta come funoran.
Esso è un'polisaccaride composto principalmente da unità di galattosio, parzialmente
esterificato come solfato. Il materiale conosciuto come agar-agar, da un'altra alga rossa,
è simile con una proporzione minore dei gruppi solfati.
Un'altro importante prodotto di alghe marine è l'acido alginico principalmente da... e
Questo è un acido polimannuronico che, come sale di sodio o di calcio, può essere
fabbricato in fibre. Questi possono essere trasformati in tessili o altri artefatti dove
facilmente disponibili e fosse richiesto, essi possono essere sciolti in acqua o in
soluzioni debolmente alcaline.
Identificazione dei olisaccaridi
15
La maggior parte dei lavori analitici sui polisaccaridi del settore museale è diretto verso
la loro rilevazione e la possibile identificazione nei dipinti di vario tipo. La presenza di
materiale saccaridico può generalmente essere rilevato mediante la cosiddetta reazione
furfurale. Riscaldando pentosi con acido i risultati portano per disidratazione al furfurale
mentre altri zuccheri portano ai composti correlati.
Il furfurale e aldeidi simili reagiscono con anilina o altre ammine aromatiche per dare
composti colorati conosciuti come basi di Schiff. Il test è generalmente portato avanti
come segue.
Il campione (sia intero o sia come estratto acquoso) è riscaldato in un piccolo tubo da
test con una goccia di... acido fosforico, mentre una striscia di carta da filtro umidificata
con una soluzione di acetato di anilina è posta nella parte superiore del tubo. Le aldeidi
sono volatilizzate ed danno un colore violetto o rosa con il reagente. Quantità al di sotto
di pochi microgrammi di saccaride può essere determinato. Va ricordato che la cellulosa
stessa reagisce e di conseguenza è necessaria che una particolare cura sia presa quando
si cercano gomme in campioni di dipinti che sono su carta o che possono contenere fibre
vegetali (come con certi dipinti murali).
Gli spettri infrarossi dei saccaridi non sono generalmente molto informativi, ma possono
essere adeguatamente identificati in modo generale o almeno distinti dalle proteine
solubili in acqua. Per quanto riguarda i metodi di analisi dei polisaccaridi, gli spettri
delle più importanti gomme sono state pubblicate, come anche gli spettri degli estratti di
particolari lavori di arte. Piuttosto grandi quantità di campione sono state utilizzate per
ottenere abbastanza estratti per gli infrarossi e risultato non è stato molto informativo.
Un problema che deve necessariamente accompagnare ogni uso di estrazioni in acqua è
che i sali solubili in acqua possono essere presenti nell'estratto e confondere lo spettro se
non sono rimossi. Questo può essere fatto con acido cloridrico metanolico, nel caso di
polisaccaridi mediante dialisi, ma questo è difficile da gestire su piccola scala.
Un'identificazione più precisa delle gomme polisaccaridiche comporta la determinazione
dello zucchero e dell'acido uronico residui dopo idrolisi acida. La pirolisi è piuttosto che
ingannevole e può risultare in una formazione di una considerevole quantità di acido
umico se si è portata avanti in presenza di una grande quantità di materiale inorganico.
L'acido solforico 1 N è comunemente utilizzato con un riscaldamento a 100 °C per 1012 ore. La soluzione è neutralizzata con carbonato di bario, filtrata dal solfato di bario
insolubile ed evaporata a secchezza.
16
Gli zuccheri possono essere separati mediante carta, sostrato sottile o con gas
cromatografia sebbene per l'ultima di queste tecniche sia necessario che siano prima
derivatizzati.
Birstein usò la cromatografia su strato sottile su cellulosa microcristallina usando un
sistema di etileacetato/piridina/acqua. Per evidenziare le macchie il piatto fu trattato con
una soluzione di ftalato di anilina. Per la gas cromatografia egli prima ridusse la miscela
di zucchero con boro idruro di sodio (questo ridurrebbe i gruppi aldeidici ad alcoli ma
non toccherebbe i gruppi degli acidi carbossilici) e il prodotto acetilato con anidride
acetica/piridina.
I risultati di Birstein su dei dipinti murali nel centro Asia sembrano confermare la
tradizione che le gomme vegetali venivano spesso utilizzate come legante. In due casi, i
dipinti di Toprak-Kala (III IV secolo) e un palazzo a Khiva (a XIX secolo) ciò che fu
trovato maggiormente è in accordo con la gomma di ciliegio o di albicocco. Rivedendo
scoperte fatte in precedenza e fonti di letteratura egli affermò che le miscele di gomma e
rosso d'uovo erano qualche volta utilizzate come anche mucillagini estratte dalle radici
del Eremurus . Yarosh applicò vari metodi all'analisi del legante della pittura di Karatepe nell'Asia centrale. Test preliminari e spettri infrarossi suggerirono i polisaccaridi,
mentre confronti cromatografici con campioni di gomma suggerirono la gomma
dell'albero di susino come il più vicino contendente, sebbene esistessero delle differenze.
Sia lo strato sottile che la gas cromatografia sono state usate da Masschelein-Kleiner
Nell'esame di materiali da un sarcofago di legno policromo egizio (XXI dinastia), la
cromatografia su strato sottile fu eseguita su fase stazionaria di allumina silice mischiata
con un'eluente di propanolo/etileacetato/acqua/25%ammoniaca nelle proporzioni
30/5/15/5. L'indicatore colorato era il naftoresorcinolo. La gas cromatografia fu portata
avanti su trimetilsilil derivati degli zuccheri su una colonna al silicone E 301. Una
complicazione qui è dovuta alle differenti forme nelle quali potevano esistere i singoli
zuccheri, venivano ottenuti diversi differenti derivati da ciascun zucchero, rendendo
quindi il gas cromatogramma più difficile da interpretare.
Comunque due campioni del rivestimento della superficie, uno supposto più alterato
dell'altro, furono distinti nella loro composizione. Il primo conteneva glucosio, xilosio,
una quantità minore di fruttosio e probabilmente mannosio. Il secondo conteneva
arabinosio, galattosio e acido galacturonico. Il secondo si è ritenuto fosse in accordo
migliore con la gomma adragante. Il legante pittorico del sarcofago portò solo glucosio e
fruttosio, che concordavano con la presenza di miele.
L'esame della pittura di una stele epitaffio egiziana nel museo di Cracovia porta anche
alla conclusione che il legante della pittura era gomma adragante. L’interpretazione della
composizione (senza ramnosio) come indicatore della gomma adragante dovrebbe forse
essere considerato alla luce delle analisi portate avanti sui leganti facilmente solubili in
acqua dei dipinti nella tomba di Nefertari, nella valle delle regine a Luxor. Mentre tutti
campioni commerciali di gomma arabica provenienti da differenti origini hanno
17
mostrato la presenza di ramnosio, arabinosio, galattosio e acido galacturonico, il legante
dei dipinti mancava di ramnosio. Comunque, un campione locale della gomma da un
albero di acacia che cresce vicino al Ramasseum ugualmente mancava di questo
zucchero e aveva le percentuali dei rimanenti zuccheri praticamente identiche a quelle
del legante pittorico.
Varie forme di cromatografia sono state utilizzate, compresa la gas cromatografia.
Se le investigazioni sui polisaccaridi presenti nei dipinti su muro sono difficili, quelli sui
campioni di pittura da miniature di manoscritti lo sono molto di più, dato la disponibilità
di campioni più piccoli.
Fielder ha portato avanti un accurato studio e migliorato le procedure di idrolisi e
isolamento. Il campione è stato idrolizzato con acido cloridrico al 3% in un tubo sigillato
a 105 °C per 24 ore e la miscela quindi evaporata fino a secchezza a 45 °C in atmosfera
di azoto. Il residuo è stato deacidificato con una resina a scambio ionico (Amberlite
IRA68) evaporata e cromatografata su gel di silice usando come eluente al
butanolo/etanolo/acqua (57/27/16).
Il naftoresorcinolo fu utilizzato come indicatore per gli zuccheri separati. I
cromatogrammi ottenuti non separavano completamente gli zuccheri e gli acidi uronici,
in particolare essi non erano capaci di separare gli acidi glucuronico e galacturonico.
Comunque i risultati apparivano chiari abbastanza positivamente per identificare per la
gomma arabica come il probabile legante delle miniature di manoscritt del XVI secolo.
Altri esami estensivi di metodi analitici per i polisaccaridi sono anche apparsi sui metodi
cromatografici. La pirolisi gascromatografica si è visto che è uno strumento utile.
Cinque differenti gomme hanno dato pirogrammi facilmente distinguibili e sebbene
questi siano soggetti a variazioni in presenza di pigmenti, queste potrebbero essere
minimizzate riducendo la temperatura di pirolisi da 700°C a 400°C. Ottimi risultati sono
stati ottenuti con 20-100 microgrammi di campione, ma dei buoni risultati potrebbero
essere ottenuti anche con 1 g. Un'altra variazione è la pirolisi spettrometria di massa.
Questa può essere applicata all'identificazione di materiali degli involucri delle antiche
mummie egiziane (cartonnages) datate da 2000 a 4000 anni. Qui sono state impiegate sia
cere che resine e l’esame di 50 campioni ha permesso la classificazione del circa il 50%
di essi.
Lignina
Sebbene non sia un carboidrato o correlato comunque alla cellulosa, il polimero naturale
conosciuto come lignina può essere qui discusso in virtù della sua importanza come
componente del legno. È la lignina a dare la necessaria forza alle cellule per permettere
loro di sopportare le tensioni e le forze esercitate isu gli alberi e sulle piante. Essa è stata
anche trovata nelle radici, nel guscio, nell'ossatura.
18
Composizione chimica
La lignina è un polimero costituito da unità che consistono primariamente di alcool di
conifere ma con un numero di composti simili anche incorporati, per esempio
Queste unità sono legate tra di loro, non in modo per regolare come la maggior parte di
polimeri naturali, ma piuttosto il modo casuale attraverso differenti tipi di gruppi: eteri,
acetali, chetali, esteri etc. Nelle piante sembra che i legami possono anche esistere con
molecole di polisaccaride, compresa naturalmente la cellulosa.
Le possibili strutture che possono essere presenti nel polimero sono meglio ipotizzate
con considerazioni del meccanismo di formazione per ossidazione con fenolo. Questo
importante soggetto sarà affrontato successivamente quando verrà spiegato il
meccanismo di essiccamento della lacca giapponese (8.7.2).
L’ossidazione dell’anione fenolato da parte della forma ossidata di un enzima (sia una
perossidasi che una laccasi) dà un radicale fenolo. Nel caso del coniferil alcool questo
radicale è stabilizzato dalla possibilità di diverse forme di risonanza (struttura 6.1):
l'accoppiamento può aver luogo tra due di questi radicali per dare un dimero con legami
C-O e C-C tra differenti posizioni.
19
Ulteriori radicali fenolici possono quindi essere formati dai dimeri
risultanti
nell'accoppiamento per dare trimeri, tetrameri, e infine un polimero ad alto peso
molecolare.
La lignina è un materiale reattivo facilmente ossidabile a composti colorati (giallomarrone) e prodotti acidi. Questa è una delle ragioni per cui la sua presenza nella carta e
nel cartone non è desiderabile, questi prodotti acidi possono catalizzare l'idrolisi della
cellulosa, che provoca una diminuzione nel peso molecolare e conseguente infragili
mento.
La chimica della fabbricazione della carta è un soggetto a se stante e qui è sufficiente
dire che il principale scopo dei diversi processi che trattano la polpa per fabbricare la
carta dal legno è la rimozione della lignina, lasciando la cellulosa in uno stato più puro
possibile. Comunque con le cosiddette procedure di trattamento della polpa ad alto
rendimento, per la fabbricazione di carte economiche, come quelle per i giornali, rimane
molta lignina. Queste carte ingialliscono rapidamente con la luce, come viene osservato
comunemente con i giornali.
La pirolisi del legno dà luogo a prodotti monomerici derivati dalla lignina e 83 di essi
sono stati identificati mediante GLC-MS in uno studio delle varie specie di legno,
essendo stata richiesta una specifica loro caratterizzazione.
Lignani
Questi sono duplicati della lignina a peso molecolare più basso, essendo dimeri di alcoli
fenilpropano/fenoli del tipo indicato nella precedente sezione. Essi sono presenti nella
parte centrale del legno degli alberi, incluse le conifere, e qualche volta essudano come
un tipo di resina dai tronchi tagliati o dei rami, sebbene essi siano abbastanza non
correlati chimicamente alle resine terpenoidi ottenute da spillaggio. I lignani sono poco
significativi per noi qui ma va detto che un tale materiale, almeno, è prodotto in grandi
quantità (oltre 10 mila tonnellate all'anno) e utilizzato per vari scopi come sostituto per
le resine fenoliche. Questo è un materiale solubile in etanolo estratto in Brasile dallei
noci di legno del pino di paranà. Questo è stato visto che consiste di una miscela di
lignani che includono il secoisolariciresinolo e i composti correlati.
formula
20