Reazioni chimiche
OBIETTIVO
Osservare alcuni tipi di reazione chimica
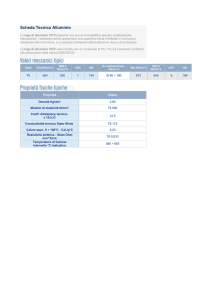
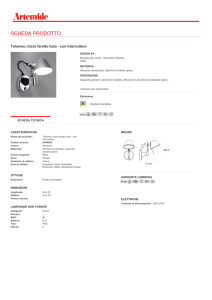
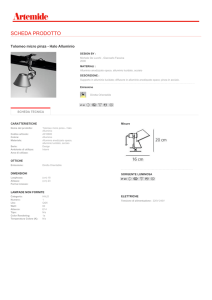
STRUMENTI E MATERIALI bacchetta, becker da 150ml, provette, spatola, spruzzetta, mortaio, fogli di
alluminio per alimenti , CuSO4 per 5 H2O in cristalli , HCl 5M e HCl conc, nastro di Mg
PROCEDIMENTO
PRIMA PARTE
-pestare i cristalli azzurri in un mortaio riducendoli in polvere
-prelevare una piccola quantità di sale con la spatola
-versare in un becker
-aggiungere H2O alla polvere
- mescolare il composto con una bacchetta
-aggiungere il solfato fino a quando la soluzione non è satura
-ripiegare i fogli di alluminio formando delle piccole palline
- aggiungere alla soluzione immergendole con la bacchetta
-aspettare cinque minuti e togliere l alluminio distendendolo nuovamente
OSSERVAZIONE i fogli di alluminio presentano delle sfumature rosso scuro
CONCLUSIONE è avvenuta una reazione di ossido-riduzione in cui il rame ha ossidato l’alluminio
riducendosi.
3CuSO4 + 2Al
Al2 ( SO4 )3 + 3 Cu
Le macchie rosso scuro sono formate da rame metallico mentre gli ioni alluminio sono passati in soluzione.
ANNOTAZIONI Aprendo le palline di alluminio abbiamo notato che erano calde quindi questa reazione è
ESOERGONICA.
SECONDA PARTE
-prendere un frammento di alluminio
-metterlo in una provetta
-aggiungere alcuni ml di HCl 5M fino a coprirlo
OSSERVAZIONI si formano delle bollicine di gas ma l’effervescenza è molto ridotta.
TERZA PARTE
-prendere un frammento di alluminio
-metterlo in una provetta
-aggiungere alcuni ml di HCl conc. fino a coprirlo
OSSERVAZIONI la reazione è molto più rapida perché l’effervescenza è maggiore
CONCLUSIONI è avvenuta la reazione
2Al + 6HCl 2AlCl3 + 3H2
Gli ioni alluminio sono passati in soluzione e il gas che si è sviluppato è l’idrogeno. Con l’acido concentrato
la reazione è più veloce.
QUARTA PARTE
-prendere un frammento di magnesio
-metterlo in una provetta
-aggiungere alcuni ml di HCl 5M fino a coprirlo
OSSERVAZIONI si formano delle bollicine di gas ma l’effervescenza è elevata tanto che la soluzione assume
un colore biancastro.
CONCLUSIONI è avvenuta la reazione di ossido-riduzione Mg + 2HCl MgCl2 + H2
Confrontando questa reazione con quella precedente osserviamo che entrambi i metalli si ossidano ma il
magnesio più velocemente dell’ alluminio.
Soluzione con alluminio e HCl conc.
Soluzione con alluminio e Mg.