Chimica Nucleare
1
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Riassunto
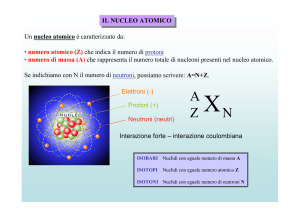
Numero Atomico (Z) = numero di protoni nel nucleo
Numero di Massa (A) = numero di protoni + numero di neutroni
= numero atomico (Z) + numero di neutroni
Numero di Massa
Numero Atomico
protone neutrone
1p
1H
1n
or
0
1
1
A
ZX
Simbolo dell’Elemento
elettrone
0β
0e
or
-1
-1
positrone
0β
0e
or
+1
+1
particella α
4α
4He
or
2
2
A
1
1
0
0
4
Z
1
0
-1
+1
2
2
Il nucleo
nucleo è insieme di nucleoni (protoni, p e
neutroni, n) uniti tra loro.
Il NEUTRONE libero, è una particella
instabile e tende a decadere (td ca.
9x102 s ), liberando un elettrone ed un
protone
Il PROTONE libero, è una particella
stabile (td ca. 1032 s )
La maggior parte (non tutti) dei nuclidi
sono isotopi stabili, ovvero tali che un
consistente numero di protoni e
neutroni si trova in un volume molto
piccolo (il nucleo dell atomo)
Una forza di
attrazione fra i
nucleoni vince la
repulsione
elettrostatica tra i
protoni: FORZA
FORTE
Interazione nucleo-protone
Le forze nucleari, che tengono insieme i nucleoni
dentro un nucleo, sono forze molto forti
fm=10-15 m
n/p too large
beta decay
X
Y
n/p too small
positron decay or electron capture
5
6
Bilanciare le Reazioni Nucleari
1. Conservare il numero di massa (A).
La somma di protoni e neutroni nei prodotti deve essere
uguale alla somma di protoni e neutroni nei reagenti.
235
92 U
+ 10n
138
55 Cs
+
96
37 Rb
+ 2 10n
235 + 1 = 138 + 96 + 2x1
2. Conservare il numero atomico (Z) o la carica nucleare.
La somma delle cariche nucleari nei prodotti deve essere
uguale alla somma delle cariche nucleari nei reagenti.
235
92 U
+ 10n
138
55 Cs
+
96
37 Rb
92 + 0 = 55 + 37 + 2x0
+ 2 10n
7
Disintegrazioni nucleari
• L'emissione di una particella β o α da
un nucleo è il risultato di una
disintegrazione (o decadimento)
nucleare, cioè della parziale rottura dei
nucleo.
• La disintegrazione trasforma il nucleo in
quello di di un altro elemento, figlio
• Quasi sempre le radiazioni β e α sono
accompagnate da radiazioni γ: il nuovo
nucleo è in una situazione di elevato
contenuto energetico e si riassesta
emettendo un fotone di una radiazioni γ
Stabilità Nucleare e Decadimento Radioattivo
Decadimento Beta
14C
6
40K
19
14N
7
+-10β
40Ca
20
Diminuisce # di neutroni di 1
+ -10β
1n
0
Aumenta # di protoni di 1
1p
1
+-10β
Decadimento Positronico
11C
6
38
19K
11B + 0β 5
+1
38Ar
18
Aumenta # di neutroni di 1
++10β 1p
1
Diminuisce # protoni di 1
1n
0
++10β
9
Disintegrazione β
• Quando dal nucleo di un atomo viene emessa una
particella β-, essa priva il nucleo di una carica
negativa
• questa perdita può essere interpretata come la
trasformazione di un neutrone in un protone
• il numero atomico del nuclide prodotto aumenta di 1
(Z+1)
Altre modalità di disintegrazione
Nella cattura elettronica un
nucleo cattura uno dei propri
elettroni e si ha la
diminuzione del numero
atomico di una unità (Z-1)
Nell'emissione di positroni,
viene emesso un positrone
(carica +1), ed il numero
atomico si riduce di una unità
(Z-1)
Stabilità Nucleare e Decadimento Radioattivo
Cattura elettronica
37
18 Ar
+-10e
37Cl 17
55Fe
26
+-10e
55Mn 25
1
1p
Aumenta # di neutroni di 1
+ -10e
Diminuisce # protoni di 1
1n
0
Decadimento Alfa
Diminuisce # di neutroni di 2
212Po
84
4He
2
+ 208
82Pb
Diminuisce # protoni di 2
Fissione Spontanea
252Cf
98
1n
2125
In
+
2
49
0
12
Disintegrazione α
• Quando un nucleo emette una particella α perde
due unità di carica positiva e una massa
equivalente a quella di quattro nucleoni.
• La perdita di due protoni causa una riduzione del
numero atomico di due unità (Z -2)
Stabilità Nucleare
•
Certi numeri di neutroni e protoni possiedono una stabilità
extra
n or p = 2, 8, 20, 50, 82 and 126
− E’ simile alla stabilità extra del numero di elettroni nei
gas nobili (e- = 2, 10, 18, 36, 54 and 86)
•
Nuclei con numero pari sia di protoni che di neutroni sono
più stabili di quelli con numero dispari di neutroni e protoni
•
Tutti gli isotopi degli elementi con numero atomico
maggiore di 83 sono radioattivi
•
Tutti gli isotopi del Tc e del Pm sono radioattivi
14
15
L’energia di legame nucleare è l’energia richiesta per
rompere un nucleo nei suoi componenti protoni e neutroni.
Energia di legame + 19F9
91p1+ 101n0
ΔE = (Δm)c2
Δm = 9 x (p mass) + 10 x (n mass) – 19F mass
Δm= 9 x 1.007825 + 10 x 1.008665 – 18.9984
Δm = 0.1587 amu
ΔE = 0.1587 amu x (3.00 x 108 m/s)2 = -1.43 x 1016 amu m2/s2
Usando i fattori di conversione:
1 kg = 6.022 x 1026 amu
1 J = kg m2/s2
ΔE = 2.37 x 10-11J
16
ΔE = (2.37 x 10-11J) x (6.022 x 1023/mol)
ΔE = -1.43 x 1013J/mol
ΔE = -1.43 x 1010kJ/mol
Energia di legame nucleare= 1.43 x 1010kJ/mol
Energia di legame per nucleone =
Energia di legame
numero di nucleoni
2.37 x 10-11 J
=
19 nucleoni
= 1.25 x 10-12 J/nucleone
17
Energia di legame per nucleone vs numero di massa
Energia di legame
nucleone
stabilità nucleare
18
Cinetica del decadimento radioattivo
N
figlio
velocità = λN
Nt
= -λt
ln
N0
N = il numero di atomi al tempo t
N0 = il numero di atomi al tempo t = 0
λ è la costante di decadimento
0.693
t½ =
λ
19
Semivita di alcuni nuclidi
Radiodatazione al carbonio
14N
7
+ 01n
14C
6
14C
6
14N
7
+ 11H
+ -10β + ν
t½ = 5730 years
Radiodatazione Uranio-238
238U
92
206Pb
82
+ 8 24α + 6-10β
t½ = 4.51 x 109 years
21
Transmutazione Nucleare
14N
7
27Al
13
14N
7
+ 24α
+ 24α
+ 11p
17O
8
+ 11p
30P
15
+ 01n
11C
6
+ 42α
22
Fissione Nucleare
235U
92
+ 10n
90Sr
38
1n + Energia
+ 143
Xe
+
3
0
54
Energia = [mass 235U + mass n – (mass 90Sr + mass 143Xe + 3 x mass n )] x c2
Energia = 3.3 x 10-11J per 235U
= 2.0 x 1013 J per mole 235U
Combustione di 1 ton di carbone = 5 x 107 J
23
Fissione Nucleare
Reazione rappresentativa di fissione
235U
92
+ 10n
90Sr
38
1n + Energia
+ 143
Xe
+
3
0
54
24
Fissione Nucleare
La reazione a catena nucleare è una sequenza di reazioni di
fissione nucleare che si autosostiene.
La minima massa di materiale fissile richiesta per generare
una reazione a catena è la massa critica.
25
Reazioni a catena
L isotopo naturale più abbondante
dell Uranio è
238U che NON è fissile
La fissione nucleare, nell Uranio nella sua
composizione isotopica naturale non avviene
spontaneamente perché si tratta di una reazione
SPORADICA, ed i neutroni che vengono liberati sono
dispersi e NON vanno a colpire altri nuclidi fissili
E dunque necessario arricchire l Uranio rispetto
alla sua composizione isotopica naturale, ovvero
mettere a punto un procedimento per ottenere
quantità di 235 U separato
dagli altri isotopi
Reazioni a catena
Tuttavia anche piccole quantità 235U NON provocano la reazione a
catena, perché i neutroni sono
dispersi verso l esterno
E dunque necessario avere una massa minima, definita MASSA
CRITICA, affinché il numero di neutroni generati dalla fissione che
incontra un altro nuclide fissile sia maggiore del numero di neutroni
che viene dispersi verso l esterno
La velocità della reazione a catena puo essere controllata se si
inseriscono, all interno del materiale fissile, della barre di grafite,
sostanza capace di assorbire neutroni e quindi capace di
rallentare ed, al limite, interrompere,
il processo della reazione a
catena
Schema di una bomba atomica
28
Schema di un Reattore Nucleare
refueling
U3O8
29
Scorie Nucleari Fusione Nucleare
Reazione di Fusione
2
2
3
1
1H + 1H
1 H + 1H
2H
1
+ 13H
4He
2
+ 01n
6Li
3
+ 12H
2 42He
Energia Rilasciata
6.3 x 10-13 J
2.8 x 10-12 J
3.6 x 10-12 J
solar fusion
Tokamak:
confinamento
magnetico del
plasma
35
Radioisotopi in biologia e medicina
• Sono usati come traccianti o come fonti di
energia distruttiva (radioterapia)
• Devono avere semi-vita di giorni o mesi
• Non devono accumularsi nell’organismo
• Si devono trasformare in isotopi stabili
Es. 32P (β, 14 d), 35S (β, 88 d), 125I (β, 60 d),
3H, 14C.
normale
ingrandita
Immagini della
tiroide con un
composto
avente 125I
42
Radioisotopi in Medicina
Produzione di laboratorio di 99Mo
98Mo
42
+ 10n
99Mo
42
Produzione commerciale di 99Mo
235U
92
99Mo
42
99mTc
43
+ 10n
99Mo
42
99mTc
43
99Tc
43
+ altri prodotti di fissione
+ -10β
+ raggi-γ
Ossa scansionate
con 99mTc
t½ = 66 ore
t½ = 6 ore
43
Radiazioni nucleari
Schermatura
Effetti Biologici delle Radiazioni
Radiation absorbed dose (rad)
1 rad = 1 x 10-5 J/g of material
Roentgen equivalent for man (rem)
1 rem = 1 rad x Q
Quality Factor
γ-ray = 1
β=1
α = 20
45
Misura della radioattività
• pellicole fotografiche:
l'intensità della
radiazione è indicata dal
grado di annerimento
della pellicola sviluppata
• contatore Geiger
• Scintillatori