Liceo classico – scientifico statale "Euclide"
Cagliari
Anno scolastico 2011/2012
Programma di Scienze della Terra della classe IV β Ginnasio
Docente Prof. Ernesto Porceddu
A Introduzione alla chimica
Unità 1 : La chimica e il metodo sperimentale
1.
2.
3.
4.
5.
6.
7.
La curiosità: guida della scienza
La chimica: prospettive di sviluppo
Una nuova via: la chimica sostenibile
La chimica è una scienza sperimentale: studio controllato dei fenomeni
Un filtro sui fenomeni: semplificare la complessità
Dal caos all’ordine: il ruolo delle leggi
Una lettura d’insieme: la teoria
Unità 2 : Le grandezze e il Sistema Internazionale
1.
2.
3.
4.
5.
6.
7.
8.
Uniformità delle misure: il Sistema Internazionale
Il Sistema Internazionale: le grandezze fondamentali
Le grandezze derivate: volume, densità, forza energia, pressione
Le quantità dei campioni: grandezze intensive ed estensive
Le cifre significative: esprimere una misura
La notazione scientifica: cifre significative e ordine di grandezza
Calcoli con le misure: come conservare le cifre significative
La valutazione di una misura: precisione e accuratezza
Unità 3 : La materia
1.
2.
3.
4.
Aeriforme, liquido e solido: gli aspetti della materia
I passaggi di stato: gli effetti del calore
Natura corpuscolare della materia: l’interpretazione dei passaggi di stato
L’ebollizione: uno sguardo più attento
5. Le sostanza pure: particelle tutte uguali
6. Miscele omogenee ed eterogenee: da una a più fasi
7. Separazione delle miscele: ottenere sostanze pure
8. Reazioni chimiche: cambia la natura delle sostanze
9. Composti ed elementi: i componenti della materia
10. Formule chimiche: la descrizione delle molecole
11. Atomi, ioni e molecole: le particelle di base
B Elementi, composti e soluzioni
Unità 4 : Le prime leggi della chimica
1. Lavoisier: l’importanza della massa
2. La conservazione dell’energia: un continuo cambiamento di forma
3. La conservazione di massa ed energia: una legge più generale
4. Proust: la costanza della composizione
5. Dalton: la teoria atomica
6. La legge delle proporzioni multiple: gli stessi elementi formano composti diversi
7. Dalton e la massa degli atomi: una legge arbitraria
8. Gay-Lussac: relazioni tra i gas
9. Avogadro: la teoria atomico molecolare
10. Cannizzaro: La differenza tra atomo e molecola
11. Mendeleev: la tavola periodica degli elementi
12. La tavola attuale: ancora proprietà periodiche
Unità 5 : Formule ed equazioni chimiche
1.
2.
3.
4.
Le equazioni chimiche: come scrivere le reazioni
Massa atomica e massa molecolare: l’attuale unità di riferimento
La mole: l’unità del chimico
La massa molare: una quantità di uso pratico
B Scienze della Terra
Unità 1 : L’ambiente celeste - l’Universo e il Sistema solare
1. Introduzione allo studio del Pianeta Terra
1 Una sfera nello spazio
2 Astronomia e Geologia
2. La Sfera celeste
1 Stelle in rotazione
2 Punti di riferimento sulla Sfera celeste
3. La posizione delle stelle
1 Come determinare la posizione di una stella
2 Le costellazioni
3 Lo Zodiaco
4. I corpi celesti
1 Di che cosa sono fatte le stelle?
2 Radiazioni elettromagnetiche diverse
3 Le reazioni termonucleari
4 Luminosità delle stelle
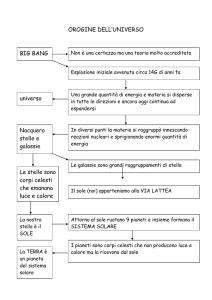
5. Le galassie
1 Le galassie e la loro forma
2 La Galassia
3 Ammassi e superammassi di galassie
4 Radiogalassie e quasar
6. L’origine dell’Universo e il big bang
1 La legge di Hubble e l’espansione dell’Universo
2 Il big bang e il modello dell’Universo inflazionarlo
3 La radiazione cosmica di fondo
7. I corpi del Sistema solare
1 Una stella, 8 pianeti e un gran numero di corpi minori
2 Pianeti terrestri e pianeti gioviani
8. Il Sole
1 L’interno del Sole
2 La superficie e atmosfera del sole.
9. Il moto dei pianeti attorno al sole
1 La prima legge di Keplero
2 La seconda legge di Keplero
3 La terza legge di Keplero
4 La legge della gravitazione universale
Cagliari, 9 giugno 2012
L’insegnante
Gli alunni