Stato fisico
Colore
Odore
Presenza di eteroatomi
Solubilità
Punto di fusione
ANALISI QUALITATIVA ORGANICA
1
RICONOSCIMENTO
DEI GRUPPI FUNZIONALI
Gruppo funzionale
atomo o gruppo di atomi che conferisce proprietà
fisiche e reattività chimica caratteristiche alla molecola
che lo contiene
2
1
REAZIONI DI:
1)) FORMAZIONE DI COMPOSTI SOLIDI
NO2
O
R
H
+
NO2
H2NHN
R
N
HN
NO2
NO2
2) FORMAZIONE O SCOMPARSA DI UNA
COLORAZIONE O DI UNA FLUORESCENZA
((reazioni cromogeniche)
g
)
OH
Ar-NH2
NaNO2
HCl
Ar-N2+
rosso
OH
N
Ar
N
3
&
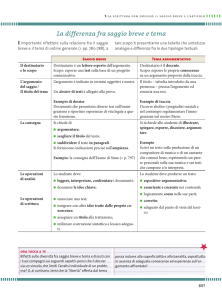
La verifica o l’accertamento della presenza di un
gruppo funzionale va fatta attraverso un saggio il
più possibile specifico per quel gruppo
&
In caso di risultato ambiguo
PROVA IN BIANCO: si esegue la reazione prevista
dal saggio con le stesse modalità, ma senza il composto in esame
PROVA DI CONFRONTO: si esegue il saggio su una
sostanza nota per valutare perfettamente ciò che si
dovrebbe osservare con il composto in esame
4
2
FARMACOPEA UFFICIALE della Repubblica Italiana
X ed. → XI ed. →
Europea IV ed. (versione CD 4.3) (2003) → Europea V ed. (2005)
… OBIETTIVI…
L’obiettivo della Farmacopea Europea è la
promozione della salute pubblica mediante la messa a punto di
norme comunii riconosciute
i
i
e da
d utilizzare
ili
d l personale
dal
l sanitario
i i e
da chi coinvolto con la qualità dei medicamenti. Tali norme o
specifiche debbono essere di qualità appropriata a costituire la
base relativa alla sicurezza d’uso dei medicamenti per i pazienti ed
i consumatori…
E’ rivolto essenzialmente:
-Alle autorità regolatorie
-A chi è coinvolto nel controllo di qualità dei farmaci
-Ai produttori di medicinali e di materie prime per uso
farmaceutico
-Farmacista (supporto)
http://www.pheur.org
5
V ed. Europea (2005)
6
3
CONTENUTO F.E. V Ed.
I Prefazione, etc…
CARATTERI GENERALI
1 Notizie generali
1.
2. Metodi di analisi
2.3. Identificazione
…..
3. MATERIALI
4. REAGENTI
5. TESTI GENERALI
MONOGRAFIE GENERALI
MONOGRAFIE
….
Reazioni di
identificazione
degli ioni e dei
gruppi funzionali
Indice
7
8
4
9
10
5
IDENTIFICAZIONE DI MOLECOLE ORGANICHE ALLO STATO
PURO
RICERCA DEI GRUPPI FUNZIONALI
GENERALI
SPECIFICI
11
1)
Carattere generale
SAGGI
Br
+ Br2
Br
Rosso bruno
incolore
2)
Specifici per un particolare gruppo funzionale
R
3)
N
O
H+
H
Cl
O
S
R
O
N
S
H
O
Specifici per una determinata classe di farmaci
O
R
O
N
N
R'
O
R"
N
R
O
O
N
N
N
R'
O
N
O
N
R'
R
O
12
6
NOTA BENE!!!!
Non tutti i saggi indicati
nell’analisi funzionale organica
sono tra quelli consigliati nelle
Farmacopee!
viceversa, spesso si incontrano
indicati in Farmacopea, saggi
specifici
per
un
gruppo
funzionale
o
una
classe
farmaceutica, nuovi o diversi da
quelli
citati
nell’analisi
funzionale!
13
SAGGI DI CARATTERE GENERALE
Saggio di Bayer
SAGGIO DELL’INSATURAZIONE
Saggio con il bromo
SAGGIO PER LA STRUTTURA AROMATICA
SAGGIO CON FeCl3
1) Sali basici di ferro
2) Prodotti di ossidazione
3) complessi
14
7
SAGGIO DELL’INSATURAZIONE
A) Saggio con il bromo
Si basa sull’addizione elettrofila del bromo
sui sistemi insaturi
R-CH=CH-R'
Br2
R-CH-CH-R'
Rosso
Bruno
Incolore
+
Br Br
Br
R-CH=CH-R'
+
δ−
δ
Br Br
R-CH
R-CH-CHR'
CH-R'
Br
Br
+
Br
-
15
& Olefine altamente coniugate o disattivate per la presenza
di
sostituenti con effetti elettronici - I e - M sommano Br2 con
difficoltà
&Chetoni, enoli, fenoli, ammine
aromatiche, β-chetoesteri,
βdichetoni, etc., reagiscono con il bromo attraverso una reazione di
sostituzione con variazione di colore e sviluppo di vapori di HBr,
HBr se si
lavora in soluzioni idroalcoliche
&Es. E.F. ergometrina maleato, metenammina, cresolo, esilresorcina…
& Gli ALCHINI possono essere identificati come acetiluri di metalli
pesanti
ti del
d l tipo
ti Cu
C ed
d Hg
H
R-CH
CH
+
M+2
Per M+2= Cu2+ solido cristallino rosso-bruno
Per M+2= Hg2+ solido cristallino bianco
R-CH
C-
+2
2M
16
8
B) Saggio di Bayer (KMnO4)
Si basa sulla facile ossidabilità dei sistemi
insaturi
3 R-CH=CH-R
R CH=CH R' + 2 MnO4- + 4 H2O
3 R -CH
CH -- CH -R
R' + 2OH- + MnO2
OH OH
sin-diole
incolore
Violetto
O
O
R-CH=CH-R'
R
CH=CH R
Mn
O
MnO4-
-
O
H2 O
R -CH -- CH -R
-R'
OH
R -CH -- CH -R'
OH
Questo saggio è dato anche da altre sostanze
ossidabili come aldeidi, alcoliI e II, fenoli, ammine…
17
SAGGIO PER LA STRUTTURA AROMATICA
nitrazione
HNO3/H2SO4
ghiaccio
NO2
riduzione
NH3 + Cl-
HCl/H2O
Sn, 10', risc.
diazotazione
NaNO2/H+
O°-10°C
HO
N2+ Cl-
copulazione
OH-
N N
COLORANTE AZOICO
18
9
1)
HNO3/H2SO4
ghiaccio
NITRAZIONE
Olio o precipitato
giallo
R
+
H-O-NO2 + HSO4-
HONO2 + HO--SO3H
H
NO2 + + H3O+ + HSO4-
+
H-O-NO2 + H2SO4
H
Ione nitronio
+
+ O N O
+
NO2
l
lento
NO2
NO2
+
NO2
+
Ione arenio
Intermedio di Wheland
veloce
HSO4-
NO2
+ H2SO4
19
R
Substrati attivati
R forti: -NH2, -NHR, -NR2,
Usare CH3COOH/HNO
/
3
R deboli: Alk, Ph
Substrati disattivati
R forti: -NO2 –CF3, -N(+)R3,
scaldare
OH, OR
-COOH
COOH, -COOR
COOR, -COR
COR, -CN
CN
R deboli: Al
20
10
2)
RIDUZIONE
NO2
NH3 + Cl-
HCl/H2O
Sn, 10', risc.
incolore
solubile
SnCl2 + 2 H +
Sn + 2 HCl
21
3, 4)
DIAZOTAZIONE E COPULAZIONE
NaNO2/ H+Cl-
OH
eccesso
NH3 + Cl-
OH
H+
A
B
-
C
ghiaccio
22
11
3)
DIAZOTAZIONE
NH3 + Cl-
+
+
HONO + H3O+
H2O - N
O + H2O
N
O + 2 H2O
N-ossido
N
ossido
NH2
H
H
+
+
N
O
N+ N
Ar
Ar
O
H
Ione N-nitroso
ammonio
Ar
N
N
H+
OH
diazenolo
+
Ar
N
N
Ar
N
Ar
N
--
NH
N
N
N
O
Ione N-nitroso
ammina
+
OH2
+ 2 H2O
+
SALE DI DIAZONIO
23
• L’eccesso di NaNO2 è necessario per compensare la reazione di
decomposizione dell’acido nitroso
2 HNO2
NO + NO2+ H2O
• e per evitare la formazione di diazoammino derivati
+
+
Ar N N
H2
Ar NH2 + Ar N N
N Ar
Ar N N N Ar
• L’ambiente acido sfavorisce la formazione di diazoammino
derivati perché l’ammina è protonata
• Il raffreddamento (0-10°C) rallenta la decomposizione del sale
di diazonio altamente instabile
+
Ar N N
Ar+ + N2
24
12
4)
COPULAZIONE
O-
HO
N N
N2+ Cl-
OH-
Colorante azoico
25
2) Saggi specifici per un particolare gruppo funzionale
26
13
COMPOSTI CARBONILICI
ALDEIDI
R
H
C
C
O
O
δ+
C
CHETONI
δ−
O
R
R'
C
O
CARATTERISTICHE FISICHE
• punti di ebollizione intermedi tra alcani ed alcoli a pari P.M.
• Solubili in acqua fino a 5 atomi di C
• i primi termini delle aldeidi alifatiche sono gassosi (formalina, acetaldeide)
e sgradevoli, poi diventano liquidi, solidi, solubili in etere, insolubili in acqua e
di odore
d
gradevole;
d
l le
l aldeidi
ld idi aromatiche
ti h sono liquide
li id (benzaldeide),
(b
ld id ) poii
solide, solubili in etere, insolubili in acqua e di odore gradevole (mandorle
amare)
• I chetoni alifatici sono liquidi incolori di odore gradevole (acetone); con il
crescere del PM, diventano solidi, solubili in etere ed insolubili in acqua; i
chetoni aromatici sono tutti solidi (acetofenone, bassofondente), solubili in
27
etere ed insolubili in acqua.
COMPOSTI CARBONILICI
ALDEIDI
R
H
C
O
CHETONI
R
R'
C
O
CARATTERISTICHE CHIMICHE
• Le proprietà chimiche delle aldeidi e dei chetoni sono simili
• Le aldeidi si ossidano più facilmente dei chetoni
• Le aldeidi sono più reattive verso l’addizione nucleofila
• I chetoni aromatici in genere sono meno reattivi di quelli alifatici
28
14
C
O
μ ~ 2.7 D
δ+
C
δ−
O
Reazione caratteristica
..
Nu
C
O
C
O-
H2O
C
Nu
OH
Nu
Ordine di reattività crescente
O
C
O
C
C
O
_
R
C
O
C
_
H
R
N
_
_
_
O
O
O
O
C
_
_
O-
O
C
R
R
H
Cl
29
CARATTERISTICHE CHIMICHE
Attacco elettrofilo
:O :
H
C
C
R
acido
Attacco nucleofilo
30
15
Reazioni comuni per aldeidi e chetoni
Formazione di OSSIME
F
Formazione
i
di 2
2,4-DINITROFENILIDRAZONI
4 DINITROFENILIDRAZONI
Formazione di COMPOSTI BISOLFITICI
Reazioni distintive tra aldeidi e chetoni
Saggio di Tollens
Saggio di Shiff
Saggio di Feheling
Saggio di Angeli e Rimini
Formazione di DIMEDON DERIVATI
31
Reazioni comuni per aldeidi e chetoni
CONDENSAZIONI
R
(H)R1
C
O
R
+ H2N-R
NH2OH
H2N-NH-Ph
H2N-NH2
R
R
R
R
R
R
R
C
N
C
N
OH
C
N
NH-Ph
C
N
NH2
R
R
R
C
N
N C
R
R
32
16
Formazione di OSSIME
R
(H)R1
O
C
R
+ NH2-OH . HCl
R
C
N
OH + H2O + HCl
Viraggio del
METILARANCIO
Giallo (OH-)
Rosso (H+)
MECCANISMO DI REAZIONE:
(-)
:NHOH + H2O
NH2-OH . HCl + OHR
R
H2O
R
(-)
:NHOH
O
C
(H)R1
(H)R1
R
R
O-
N(-)OH
R
NHOH
OH2+
H+
OH-
N-OH
C
33
Formazione di 2,4-DINITROFENILIDRAZONI
R
O + H2N HN
C
(H)R1
R
H+
NO2
(H)R1
N HN
O2N
NO2
O2N
Il reattivo può dare complessi a trasferimento
di carica poco solubili con fenoli, idrocarburi,
alogeno derivati, eteri…
MECCANISMO DI REAZIONE:
R
O
H+
(H )R
R
(H )R
H+
R
R
(+ )
OH2
NHR
(+ )
R (+ )
OH
OH
H 2N -R
R
OH
R
(H )R
R (+ )
(H )R
R
N H -R
H+
(H )R 1
NHR
N
R
34
17
Perché si usa la 2,4-dinitrofenilidrazina e non l’idrazina semplice?
R
R
NH2 + O
O + H2N
C
C
R
R
R
R
C
N
N
R
R
35
Formazione di COMPOSTI BISOLFITICI
R
(A)
(H)R1
(H)
(B)
C
O + NaHSO3
difetto
SO3-- + I2 + H2O
Iodio-salda
I
di s ld d’
d’amido
id
blu
1.
R
(H)R1
SO3Na
OH
Addotto di Bertagnini
SO4-- + 2I- + 2H+
decolorazione
Il saggio è dato solo dalle aldeidi e dai metilchetoni
36
18
Reazioni distintive tra aldeidi e chetoni
AgNO3 5%
NaOH 2N
NH4OH 2N
Saggio di TOLLENS
AgO
O
R
H
1.
2.
C
+ 2 Ag(NH3)2OH
O
R
O-Na+
+ 2 H2O + 3 NH3 + 2Ag0
Il saggio non è dato dai chetoni ma da altre sostanze riducenti:
zuccheri riducenti, α-idrossichetoni, poliidrossifenoli, amminofenoli
Il reattivo va preparato prima dell’uso e non deve essere conservato a
lungo perché può contenere AgO-NC esplosivo!!!!
37
Saggio di SHIFF
H2N
NH2+Cl-
3H
H22SO
SO43
HO2SHN
- 2 H2O
I
Fucsina
(cloridrato di p-rosanilina)
ROSA
H2N
OH
NHSO2 HC
2
R
H
C
SO3H
NH3+Cl-
NHSO2H
II
Acido fucsinsolfonico
INCOLORE
R
O
NH3+Cl-
OH
NHSO2 HC
R
III
Colorante chinoide
Rosso-viola
38
19
Saggio di SHIFF
1Questo saggio non è dato da alcune aldeidi
aromatiche
(vanillina,
p-ammino
e
pdi til
dimetilamminobenzaldeide
i b
ld id ).
)
Alcuni
chetoni
(metilchetoni,
ciclopentanone,
cicloesanone) danno leggera colorazione
2-
3Il saggio deve essere eseguito A FREDDO per
evitare la perdita di SO2 e comparsa di colorazione
già dal composto II
39
Feheling A: CuSO4/H2O
Saggio di FEHLING
Feheling B: Na/K Tartrato
R
H
1.
C
O
+ 2 Cu++ + 4OH-
R-COOH
R
COOH + 2 H2O + Cu2O
Questo saggio è negativo per alcune aldeidi aromatiche ma è positiva per
alcune sostanze riducenti
-
O
O
O Cu
O
O
O
HO
O
O
OH
O
O-
Complesso chelato cuprotartarico
40
20
Saggio di ANGELI e RIMINI
SO2NHOH + R-CHO + 2 KOH
O
NHO-K+
R
SO2-K+ + 2 H2O
+
O
3 KCl +
FeCl3
R
NHO-
Fe3+
3
MECCANISMO DI REAZIONE
(-)
SO2NOH
H
R
O
R
O-
H
N OH
SO2Ar
idrossammato ferrico
R
HOHN
FeCl3
E’ dato anche da
benzilchetoni
ma
non
da
alcune
aldeidi aromatiche
(-)
O + ArSO2
R
HON
OH
41
Formazione di DIMEDON DERIVATI
O
O
R
+
O
H
O
R
O
O
O
42
21
Saggio dello IODOFORMIO (Lieben) dei METILCHETONI
(NaOH 2N/ I2 20 % / H2O 10%)
O
R
OH-
H
C
H2
R
CH2
-
O
+ H2O
I I
O
R
C
H2
OH-
I
R
CH-I + H2O
-
O
I I
O
R
C
I3
OH-
I I
O
R
C
H
I2
+ H2O
43
O
R
C
I3
-
+ OH
OR C CI3
OH
O
R
OH
+ -:CI3
O
R
O-
+ HCI
HC 3
-Saggio dato da tutti i composti facilmente ossidati dallo iodio per dare
metilchetoni. Es: α-alcoli
- La reazione non è data da composti del tipo CH3COCH2X,
COOR
X= -NO2, -CN,
→ Perché si usa l’ipoiodito e non ipoclorito o l’ipobromito di sodio?
La reazione avviene ugualmente ma il prodotto finale, cloroformio e
bromoformio rispettivamente, sono liquidi incolori e non facilmente
caratterizzabili.
44
22
Derivati degli ACIDI CARBOSSILICI:
ANIDRIDI
O
R
Composti neutri, particolarmente
reattivi, scarsamente solubili in
acqua danno idrolisi ad acidi
acqua,
carbossilici.
O
O
R
Saggi di riconoscimento:
1. Saggio di ANGELI e RIMINI
2. Riconoscimento dei prodotti di idrolisi
3. IR
O
R
O
O
+ H2 O
R
OH -
O-
OH
O
R C O
R
OH2
(+)
OH
2.
Le ammidi sono generalmente solide e a carattere neutro;
sono in genere solubili in etere etilico ed i primi termini
della serie alifatica sono solubili in acqua
3.
Le ammidi non sostituite hanno un debolissimo carattere
acido (pKa ~16), attribuibile alla stabilizzazione per
risonanza dell’anione ammidico (evidenziabile solo mediante
basi forti, es metanoato di sodio, sodio ammide…) in
solventi apolari; le ammidi presentano anche un debolissimo
carattere basico (pKb ~15), inferiore
alle ammine
alifatiche a causa dalla minore disponibilità del lone pair
dell’N
NH
O
O
O
pf. 82°C
O
Le ammidi non sostituite presentano forti legami idrogeno
intermolecolari; ciò si riflette sulle proprietà fisiche,
facendo variare il pf, il pe e la solubilità in base al grado di
sostituzione
O
H3C
+ R
O
2 R
-
1.
O
NH2
O
O
O
R
R
OH
R
AMMIDI
O
R C O
NH2
H3C
NH CH3
p.f. 28 °C
H3C
N
CH3
CH3
p.eb. 165 °C
23
Saggi di riconoscimento:
1. Saggio di ANGELI e RIMINI
2. Riconoscimento dei prodotti di idrolisi
3. IR
O
R
O-
+ OH-
NH2
R
OH
Idrolisi
basica
O
O-
R
+O H
O
R
O
R C NH2
+
+ H+
NH2
R C NH2
H + NH2
O
+ NH3
O
+ H+
R
OH
H
O
- H+
R
NH2
OH2
H
NH2
OH
+
Idrolisi
acida
O
+
+H
R
+O H
H
+
OH2
NH
R
NH3
OH
O
+ NH3
R
+ NH4+
OH
NITRILI
Saggi di riconoscimento:
1. Saggio di ANGELI e RIMINI
2. Riconoscimento dei prodotti di idrolisi
3. IR
R
C
N:
MECCANISMO DI IDROLISI ACIDA
Acido solforico 70 % a caldo
R
C
OH
R
..
NH
N:
+ H+
R
- H+
+ H+
- H+
C
+
N
R
H
+NH2
R
OH
NH2
R
OH
+
+
C
N:
- H+
+ H+ R
H
:O:
..
+ H2O
- H2O
+ OH2
- H+
..
+ H+
R
NH
+ H+ + H2O RCOOH + NH +
4
NH2
24
MECCANISMO DI IDROLISI BASICA
N-
-
R
C
N:
+ OH
- OH
-
R
N
+ H2O
OH
R
NH2
+ H2O
R
O
H
O
- H2O
+ OH-
H
+ H2O
+ OH
R
H
H
-
N
O-
R
O
O
+ H+
-
N
+ NH3
O-
R
Saggio di ANGELI E RIMINI
R
O
R
N
R1
R2
N
O
.
+ NH2OH HCl
R
FeCl3
O
HO
NHOH
R
OH
Fe
N
O O
H
N
R
R
N
R
C
N
NH
.
+ NH2OH HCl
R
N OH
NH
O
FeCl3
N
R
N
H
NH
F
Fe
O
NH
O N
H
R
25
ALCOLI
Composti neutri, polari, fortemente associati
R
−
+ Oδ
δH
H
O
R
H
R
R
O
O
H
O
R
H
H
O
R
La solubilità in acqua diminuisce con ll’aumentare
aumentare del peso molecolare ed
aumenta con l’aumentare della ramificazione della catena idrocarbonica.
Gli alcoli inferiori sono miscibili con l’acqua in tutte le proporzioni. Gli alcoli
sono solubili in etere etilico.
Gli alcoli polivalenti sono solubili in acqua se n°C/n° OH < 3-4, hanno
elevati p.e. e scarsa solubilità in etere etilico.
& Gli alcoli sono amfoteri: essi sono acidi deboli (pKa˜ 15) in
virtù dell’elettronegatività dell’ossigeno,
e
basi
molto
deboli (pKa˜ -2,2, ione ossonio) a causa della presenza delle
due coppie di elettroni non condivisi.
Forma basica
Forma acida
H acido forte
base forte
+
R-O-H
R-O R O
acido debole
H base debole
In soluzione (solventi polari), l’impedimento sterico
dovuto alla ramificazione inibisce la solvatazione e causa un
aumento di valori di pKa (meno acidi).
acidi)
&
I sostituenti elettron-attrattori situati in prossimità
del gruppo funzionale abbassano i valori del pKa.
&
26
Progressione pKa degli alcoli in soluzione
CH3OH < primario < secondario < terziario
OH
OH
OH
OH
Cl
<
<
<
Cl
Cl
ALCOLI
Formazione di alcolati
Saggio di ANGELI e RIMINI
Reazione con cerio ammonio nitrato
Saggio di Denigès
Formazione di alchilxantogenati
Ossidazione a composti carbonilici
Reazione di Lucas
27
Formazione di alcolati
R-O-Na+ + 1/2 H2
R-OH + Na
anidro
Il saggio non è specifico perché può essere dato da tutti i composti contenenti
idrogeni acidi (acqua, fenoli, acidi carbossilici, enoli…); questo saggio va bene per
alcoli con 3 > C > 8.
Saggio di ANGELI e RIMINI
O
H3C
R1 OH
+
Cll
or
O
H3 C
R
O
O
O
O
NH2OH . HCl
R1
OR1
NHOH
FeCl3
CH3
→ Per evitare che
Complesso rosso-viola
gli alcoli terziari vengano idrolizzati dall’acido cloridrico che si libera
nel mezzo di reazione, il saggio si esegue in presenza di N,N-dimetilanilina
Reazione con cerio ammonio nitrato
R-OH + (NH4)2 Ce(NO3)6
(NH4)2 Ce(OR)(NO3)5 + HNO3
1- La reazione è positiva con certezza solo per gli alcoli con
meno di 10 atomi di carbonio
2- I fenoli danno colorazione giallo-bruna in soluzione e rosso
scura in diossano
3- Le ammine aromatiche possono essere ossidate dal reattivo
28
Saggio di Denigès
(per alcoli terziari)
R1
R2
R3
R2
R3
OH
R1
R1
H+
OH2
H 2O
+
R1
+
R2
R3
R2
H
H
H
R1
R2
H
Hg0
HgO
1- Gli alcoli 1ri e 2ri sono meno reattivi e formano precipitati incolori
2- Gli esteri di alcoli 3ri possono idrolizzarsi e dare risultato positivo
Formazione di alchil xantogenati
R-OH + CS2 + NaOH
S
C
OR
SNa
Δ
+ (NH4)2MoO4
H+
S
C
S
OR
SNa
C
OR
SH
+ H2O
.
MoO3
1- Il saggio non è dato dagli alcoli 3ri
2- Gli esteri idrolizzabili possono dare risultato positivo
29
Ossidazione a composti carbonilici
3 RCH2OH + 4 CrO3 + 6 H2SO4
3 RCOOH + 2 Cr2(SO4)3 + 9 H2O
3 R2CHOH + 2 CrO3 + 3 H2SO4
3 R2CO + Cr2(SO4)3 + 6 H2O
1.
Questo saggio permette di distinguere gli alcoli I e II, facilmente
ossidabili in ambiente acquoso dall’anidride cromica, da quelli III che
non reagiscono in queste condizioni
2.
3.
Il saggio è positivo se dopo pochi secondi (5-10) la soluzione da
limpida ed arancione passa ad opaca e verdastra (sali di Cr+++)
Possono interferire altre sostanze ossidabili come aldeidi, fenoli,
enoli...
Reazione di Lucas
R-Cl + H2O
R-OH + ZnCl2/HClc.
(+)
ZnCl3 + H+
ZnCl2 + HCl
(+)
Alcoli R-OH2
2ri e 3ri ((+))
R + CllSN1
(+)
Alcoli 1ri
R-OH2 + ClSN2
(+)
R
+ H2O
R-O
R-Cll
δ−
ZnCl2
R+
RCl
H
δ+
Cl.....R.....OH2
R-Cl + H2O
30
Selettività tra alcoli 1ri, 2ri e 3ri in base alla velocità di reazione
(stabilità del carbocatione intermedio)
Alcoli 2ri
Alcoli 1ri
Reagiscono
con
difficoltà
C<6
Si sciolgono
imbruniscono
la soluzione
Reagiscono
in 3’-5’
Stratificano
dopo 1 h
C>6
NON si
sciolgono
Alcoli 3ri
Allilico
Benzilico
Cinnamico
Separazione
di fase
Reagiscono
SUBITO
e
Stratificano
FENOLI
H+ +
O
O
O
:
_
_
:
O-
OH
:
_
1.
Liquidi (Punti di ebollizione elevati)
sono poco indicativi
o solidi bassofondente; i p.f.
2.
Odore caratteristico
3
3.
Solubili in etere e insolubili in acqua (sol.
(sol in NaOH 2N)
4.
Hanno carattere acido: pKa˜ 10
5.
Incolori ma ossidabili all’aria
6.
Elevata reattività dell’anello aromatico verso la sostituzione
elettrofila
31
OH
OH
R
R
R elettronattrattore:
Aumento di acidità
R: NO2, COOH, COR….
R elettrondonatore:
Diminuzione di acidità
R: CH3, C2H5….
1.
L’ossigeno dei fenoli e dei derivati eterei è solo
debolmente basico (pKa˜ -6,7,
6 7 ione fenilossonio) perché le coppie
di elettroni solitarie si delocalizzano sull’anello benzenico
2.
La protonazione dell’ossigeno favorisce la rottura del
legame etereo ma non la formazione del catione fenile altamente
reattivo
FENOLI
Reazioni cromatiche con FeCl3
S
Saggio
i d
dell carattere
tt
acido
id
Reazione di LIEBERMAN
Formazione di FTALEINE
Reazione di MILLON
N.B. Possono dare i saggi del doppio legame, positivi; i polifenoli hanno maggiore attitudine
riducente, dunque possono dare saggio di Tollens e Feheling positivi;con i sali di diazonio
possono dare azocoloranti (saggio della struttura aromatica)
32
Colorazione con FeCl3
F l3 + ArOH
FeCl
H
1
1.
Il saggio è positivo per enoli,
enoli acidi idrossammici
idrossammici, ossiacidi
ossiacidi, ossime
ossime,
acidi solfonici.
2.
3.
- -3
Fe(ArO
F
(
) 3
Il saggio è negativo per molti nitrofenoli ed il guaiacolo
Per l’idrochinone il saggio è poco indicativo per la facile ossidabilità
del composto con tricloruro ferrico
REAZIONI CROMATICHE DEI FENOLI CON FeCl3
NB Per una stessa sostanza la tonalità del colore dipende dal solvente
usato (piridina, cloroformio…) e dalla concentrazione del reattivo e può
variare nel tempo
Fenolo
Resorcina
p-idrossibenzaldeide
m-Cresolo
o-Cresolo
p-Cresolo
Floroglucina
catecolo
VIOLA
BLU
β-naftolo
VERDE
Acidi nitrosalicilici
ROSSO
Acido 3,4-diidrossi-benzoico
33
Reazione di LIEBERMAN
(per fenoli con la posizione para libera)
OH
NaNO2/H2SO4
ON
HON
OH
(+)N=O
O
p-nitrosofenolo
OH
HON
H+
O
+
HON
O +
O
N
H
+
HO
OH
indofenolo
N
O
OH
O-Na+
N
In NaOH
In H2SO4
N.B. gruppi disattivanti possono indurre saggio negativo
Formazione di FTALEINE
HO
OH
OH
O
O
+
H+ or ZnCl2
O
fusione
O
O
NaOH
-
O
HO
O-
OHO
OH
COO-
INCOLORE
COONa
ROSSO INTENSO
34
O
O
O
O
O
O
+ ZnCl
n 2
O
O
(+)
( )
(+)
O
Zn(-)Cl2
Zn(-)Cl2
OH
O
+ ZnCl2 + OH-
O
(+)
OH
O
HO
OH
OH
O
O
Reazione di MILLON
(fenoli con almeno una posizione orto libera)
OH
1)) Nitrosazione
in posizione orto
O
O
OH
Hg/HNO3
H
O
N
N
Forma tautomera o-chinonmonossima
+
O
2)) Formazione del sale
complesso con il
mercurio
Hg
O
N
or
N
O
O
O
Hg+
O
N
Sali complessi di mercurio
di intensa colorazione rossa
35
AMMINE
(Ar)R
NH2
1.
Sono polari, danno legami idrogeno intermolecolari meno
forti rispetto agli alcoli di PM simile (l’azoto è meno
elettronegativo
g
dell’ossigeno),
g
) dunque
q ip
p.f. sono intermedi tra g
gli
alcoli e gli idrocarburi
2.
Lo stato fisico delle ammine alifatiche cambia con il
crescere del PM (gassoso→ liquido → solido); le ammine aromatiche
sono liquidi altobollenti (anilina p.f. 182°C) e poi solidi
3.
Le ammine alifatiche sono solubili in acqua fino ad un
numero di atomi di C di 5-6
5 6 (la solubilità aumenta con ll’aumentare
aumentare
dei gruppi amminici presenti) ed in etere; le ammine aromatiche
sono solubili in etere e normalmente insolubili in acqua
4.
Le ammine sono tutte solubili in HCl, dunque non possono
essere discriminate
5.
Le ammine alifatiche a basso PM hanno odore di
ammoniaca; l’odore di pesce putrido diminuisce con il
crescere del PM; le ammine aromatiche sono generalmente
incolori ma facilmente ossidabili; le ammine aromatiche
sono tossiche !
6.
Le ammine trisostituite (R diversi) sono chirali,
funzionando la coppia di elettroni solitari da quarto
sostituente; le ammine non sono configurazionalmente
stabili all’azoto, a causa della veloce isomerizzazione
dovuta al processo di inversione (N: sp3 → sp2 → sp3)
7.
Le ammine sono basiche, per la disponibilità del
doppietto elettronico dell’atomo di azoto
RNH2 + H2O
+
RNH3 + OH-
pKb ~ 4
36
8. Le ammine alifatiche sono basi più forti dell’ammoniaca (pKb ~
5) per la presenza di gruppi alchilici elettrondonatori che
aumentano la densità elettronica sull’N rendendolo più basico
(effetto elettronico).
NH2R > NH3 > ArNH2
pKb
3.3
4.75
10
In acqua, la solvatazione stabilizza il catione ammonio attraverso
leg. H, quindi la basicità diminuisce passando dall’ammina I alla
III.
In solventi aprotici la basicità cresce aumentando il numero degli
alchili per il solo effetto induttivo.
induttivo
9. Le ammine aromatiche sono meno basiche delle alifatiche (pKb ~
10) in quanto i gruppi arilici diminuiscono la disponibilità del
doppietto elettronico sull’azoto (effetti elettronici e di
solvatazione)
10.
Il numero, la natura e la posizione dei sostituenti hanno
effetti sulla basicità delle ammine aromatiche
NH2
NH2
R
R elettron-donatore:
Aumento di basicità
R: CH3, C2H5….
R
R elettron-attrattore
(-I, -M):
Diminuzione di basicità
R: NO2, CN, CHO….
11. R con almeno un doppietto elettronico disponibile (OH,
OCH3, NH2, SH…) hanno sia un effetto induttivo elettronattrattore (para < orto) che un effetto coniugativo
elettron-donatore (para, orto). In posizione meta agiscono
per effetto induttivo diminuendo la basicità. Gruppi
aromatici non direttamente legati alla funzione amminica,
non alterano il carattere basico dell’ammina
12. Le ammine si comportano da acidi debolissimi (pKa ~ 35), in
presenza di basi molto forti
37
AMMINE
Ricerca del carattere basico
Comportamento con acido nitroso
Saggio di diazotazione e copulazione
Reazione di HINSBERG
Ricerca del carattere basico
Uso di indicatori di basicità
• Cartina al tornasole
pH<4.5
rosso
pH>8.3
bl
blu
•Cartina universale
pH=1
rosso
pH=11
blu
•Cartina al rosso Congo:
azzurro
ΔpH= 3-5
rosso
Solubilità in HCl conc.
RNH2 + HCl
(+)
RNH3 Cl-
38
Comportamento con acido nitroso
NaNO2 + HCl
HNO2 + NaCl
(+)
HNO2 + H+
NO
+ H2O
AMMINE PRIMARIE ALIFATICHE
R CH2-NH
R-CH
NH2 + +N=O
N O
(+)
R-CH=CH2 or R-CH2-OH
R CH2-N
R-CH
N2
N2
AMMINE PRIMARIE AROMATICHE
(+) N
NH2
2
(+)
+ NO
Es. benzocaina, lidocaina, ac. p-amminosalicilico…
OH
N
N
OH
COLORANTE AZOICO
39
AMMINE SECONDARIE ALIFATICHE E AROMATICHE
N
H
((+))
+ NO
((+)) H
N
N
N
O
NO
N-nitroso derivati
N-nitroso ammine
Poco solubili
Conferma con il saggio di LIEBERMAN
OH
N
N
O
H2SO4
R2NH2 + HO-N=O
HO
NO
OH
HO
N
O
indofenolo
Es. ac. mefenamico, propranololo…
AMMINE TERZIARIE ALIFATICHE
NON REAGISCONO !
Es. promazina, prometazina….
AMMINE TERZIARIE AROMATICHE
N
(+)
+ NO
HCl
ON
(+)
Cl- + H2O
NH
p-nitroso derivato
rosso
NaOH
ON
N
+ NaCl + H2O
p-nitroso derivato
verde
40
Reazione di HINSBERG
O
S
Cl
O
R-NH2
S
O
O
O
S
R
NH
Cl
O
R2-NH
S
O
N
O
O
S
R3-N
Cl
Insolubile in acidi
Solubile in basi
Insolubile in acidi
insolubile in basi
R
R
Solubile in acidi
insolubile in basi
R3-N
O
Ammina
III
O
Miscela di tre
ammine
I, II, III
S
O
etere
Cl
HCl dil.
etere
Ammina
II
NaOH dil.
Ammina
I
41
AMMINOACIDI
R
CH
R
COOH
CH
NH3
+
NH2
zwitterioni
itt i ni
α-amminoacidi
mmin
idi
R
CH
NH2
1.
2.
3.
4.
COO-
H3O+
COO-
R
CH
OH-
NH3
+
COO-
H 3O +
OH-
R
CH
COOH
NH3
+
Solidi cristallini incolori; sapore dolciastro
Abbastanza solubili in acqua ed insolubili in etere; al punto
isoelettrico presentano il minimo di solubilità
Punti di fusione superiori di 200°C; fondono con decomposizione
(intervallo di decomposizione poco decisivo)
Gli α-amminoacidi sono otticamente attivi (misura del potere
rotatorio specifico a scopo identificativo); gli aa naturali hanno
configurazione assoluta L
AMMINOACIDI
Saggio con la ninidrina
Formazione di complessi con il rame
42
O
Saggio con la ninidrina
C
O
OH
C
OH
O
O
C
R
H
COOH
+ H2N
C
H2 O
O
O
C
CO2
N
O
O
R
O
O
O
N
HO
H
O
O
H
C
R
H2O
-RCHO
OH
O
C
NH2
OH
O
N
blu
OH
O
+
O
OH
+
OH
O
HN
COOH
prolina
O
O
O
N
H
+ CO + 4 H2O
O
Prodotto colorato giallo-rosso
giallo rosso
NB L’ottenimento di una colorazione diversa da quella indicata
(arancione, gialla, rossa) deve far considerare saggio negativo
43
Formazione di complessi con il rame
1.
α-Amminoacidi formano complessi con solfato di rame
2.
Gli α-amminoacidi non solubili in acqua danno saggio
positivo a seguito
p
g
di riscaldamento
3.
Ammine alifatiche danno precipitati blu; le aniline
danno colorazioni marroni o verdi, ma altre ammine aromatiche
danno colorazioni blu-porpora.
O
R
ONH3
+
+ Cu2+
R
O
NH2 O
Cu
O H 2N
O
R
NB sono possibili numerosi test specifici per un gruppo ristretto di
amminoacidi
NITRO-COMPOSTI
• Sono poco frequenti; es. F.U. Nitrofurantoina, cloramfenicolo
•Il nitro gruppo è un efficace cromoforo ed i nitrocomposti
assorbono radiazioni nell’UV o nel VIS; sono dunque spesso
colorati ( es. nitrofurantoina, nitrofurazone..)
• I nitrocomposti alifatici sono liquidi stabili di odore gradevole,
poco solubili in acqua
•I p
primi termini della serie dei nitrocomposti
p
aromatici sono
liquidi, i successivi solidi, tutti insolubili in acqua
• I polinitrofenoli sono solidi spesso odorosi, per lo più esplosivi
44
Saggi di riconoscimento (A-E):
A) I nitrocomposti si sciolgono, seppure lentamente, in soluzione di idrossido di
sodio, dando in genere colorazione gialla (pKa ˜ 11) per la presenza di acidi nitronici
(forme aci), forme tautomeriche instabili molto più acide (pKa ˜ 4)
R
C
H2
+
N
O
O-
OH- R C-
+
N
H
H+
veloce
R
C
H
O
C
H
lento
O-
+
N
-
R
O
-
OH
+
N
O-
R
O
C
H
+
N
OO-
RCH2NO2
B) Riduzione con Zn/(NH4)Cl
I nitrocomposti alifatici terziari e aromatici vengono ridotti da
Zn/(NH4)Cl ad idrossilammine (R-NHOH); queste ultime sono rivelate per il loro
potere riducente sulla soluzione di Tollens
C) Riduzione con Sn/HCl
Il nitro gruppo legato ad un anello aromatico può essere ridotto ad ammino
derivato (Ar-NH2) con Sn/HCl; quest’ultimo può essere messo in evidenza, a seguito
di diazotazione e copulazione (vedi saggio struttura aromatica), con formazione di
coloranti azoici
D) Distinzione tra nitrocomposti alifatici I, II e III
(NaNO2/H2SO4)
Nitrocomposti primari
R
CH
N
O
O
: ((-))
O N(+)
R
CH2 NO2
N
R
C
N
O
Acido nitrolico
NO2
OH
colore rosso
Nitrocomposti secondari
R
R
O
C
N(+)
N
O
R
O
: (-)
R
C
NO
NO2
Pseudonitrolo
Blu-verde
Solubile in cloroformio
Nitrocomposti terziari: nessuna colorazione
45
E) reazione di Konowalov
I nitrocomposti alifatici I, II danno in soluzioni acquose
basiche i sali dei corrispondenti acidi nitronici (pKa ˜ 4) che
in presenza di Fe3+ danno complessi intensamente colorati
in rosso bruno
R
C
H2
Forma neutra
NO2 + OHFe3+
R
R
CH
CH
N
+ O
N
O
OO
Forma aci
(acido nitronico)
Fe3+
3
La colorazione è fugace per la precipitazione di Fe(OH)3
NITROSO-COMPOSTI
In acido solforico conc. i nitroso derivati liberano acido nitroso
evidenziabile con il saggio di Lieberman (vedi saggio per le ammine
secondarie)
46
IDROCARBURI
+ CHCl3
O2
AlCl3
C
OH
CH
+ HCl
C
O
H2O
HO
1.
I colori prodotti dalla reazione con cloroformio e cloruro di
alluminio sono molto caratteristici (i
composti alifatici non danno
colorazione) :
Composto
Benzene ed omologhi
Al
Alogenuri
n i arilici
ili i
Naftalene
Bifenili
Fenantrene
Antracene
Colore
arancio-rosso
arancio-rosso
n i
ss
blu
porpora
porpora
verde
2.
2
Con il tempo il colore cambia a varie sfumature del marrone; simili
colori sono ottenuti con tetracloruro di carbonio.
3.
Esteri aromatici, chetoni, ammine, ed altri composti contenenti O
ed N danno colorazioni blu o verde
47
ALOGENO DERIVATI
1.
I composti organici alogenati appartengono principalmente
alle seguenti classi:
Sali di acidi alogenidrici di basi organiche o di ioni ossonio
O
&
Alogenuri acilici
&
Alogenuri alchilici ed arilici
R
R:O:R + XR'
RNH3 + X-
:
&
X
X
R
X
La presenza dell’alogeno è messa in evidenza dai saggi
preliminari di Lassaigne e del Balstein; i saggi specifici riportati di
seguito sono complementari ed utili nel definire la struttura
2.
chimica dell’alogenuro
Sali di acidi alogenidrici di basi organiche o di ioni ossonio
&
Sono solidi cristallini, solubili in acqua ed altofondenti spesso
con decomposizione; contengono X in forma ionica
&
L’identificazione dell’alogeno si effettua per aggiunta di una
soluzione acquosa o alcolica di AgNO3 alla soluzione acidificata
dell’alogeno; si ha immediata formazione di un precipitato il cui colore
dipende dal tipo di alogenuro (vedi “saggio di Lassaigne”)
I generale:
In
l
L reattività
La
tti ità dell’alogenuro
d ll’ l
con il reattivo
tti
è
funzione della stabilità del carbocatione che si forma durante la
reazione (SN1): più è stabile il carbocatione, più veloce risulterà la
reazione; la forma più reattiva è quella in cui X è ionico
&
Ag+
R
X
δ+
R
δ−
X
δ+
Ag
AgX + R+
48
Alogenuri acilici
Sono molto reattivi nei confronti della SN per l’estrema
mobilità dell’atomo di alogeno; reagiscono facilmente con acqua (anche
l’umidità dell’aria!),
), alcoli ed ammine p
per dare i derivati degli
g acidi
carbossilici.
&
L’identificazione si effettua mediante il saggio di Angeli e
Rimini (vedi “saggi per gli acidi carbossilici”)
&
&
L’id
L
identificazione
ntifi
i n
d ll’alogeno
dell
l
n
avviene
i n
attraverso
tt
s
l
la
precipitazione dell’alogenuro di argento mediante aggiunta di una
soluzione acquosa o alcolica di AgNO3 alla soluzione acidificata
dell’alogeno
Alogenuri alchilici ed arilici
Sono composti neutri a peso molecolare e densità elevate,
solubili in solventi organici apolari; il colore può dipendere dalla
presenza di alogeni allo stato elementare che si originano per
decomposizione; i primi termini della serie alifatica hanno odore
dolciastro, quelli della serie aromatica odore pungente
&
&
Si riconoscono mediante:
A) Saggio con nitrato d’argento alcolico
Ag+
A
R
X
AgX + R+
RONO2
Il saggio permette di distinguere gli alogenuri alchilici ed arilici,
in base alla diversa velocità di formazione degli alogenuri
d’argento
49
&
Nelle condizioni del saggio (elevata polarità del solvente,
bassa nucleofilia dell’anione nitrato, tendenza alla ionizzazione del
legame C - X per la presenza dell’acido di Lewis Ag+) prevale un
meccanismo SN1 e dunque
q
la velocità di reazione è correlata alla
stabilità del carbocatione:
Allilico, benzilico > terziario > secondario > primario
& La scala di reattività (tendenza a distaccarsi come nucleofugi)
degli alogenuri, a parità di radicale alchilico, è:
I- > Br- > Cl- > F-
alogenuri allilici, benzilici, di trifenilmetile, ioduri e bromuri
alchilici, cloruri alchilici terziari, alogenuri acilici
reagiscono immediatamente a freddo
Cloruri alchilici secondari e primari, alogenuri arilici attivati
(secondari, primari), aromatici con sostituenti elettron-attrattori
(es. -NO2 in o/p)
reagiscono a caldo
Alogenuri vinilici ed aromatici non attivati, CHCl3
NON reagiscono
50
B) Saggio con ioduro sodico in acetone
Il saggio è limitato a cloruri e bromuri; si formano i
corrispondenti ioduri alchilici e bromuro di sodio (in pochi
minuti a t.a.) o cloruro di sodio (dopo riscaldamento), insolubili
in acetone anidro
RCl + NaI
RI + NaCl
2°
RBr + NaI
RI + NaBr
1°
Poiché lo ioduro è un buon nucleofilo e l’acetone un
solvente con scarse proprietà ionizzanti, è favorita una SN2
R
X
δ−
I
C
δ+
X
I
R
Dunque, alogenuri primari, non impediti stericamente,
reagiscono più rapidamente dei secondari, mentre i terziari non
reagiscono.
Primario > secondario > terziario
L’ ordine di reattività per gli alogeni è:
Br > Cl
Per cui:
I bromuri primari ( e gli alogenuri benzilici ed allilici)
reagiscono a t.a. entro pochi minuti
&
I bromuri secondari e terziari ed i cloruri primari
reagiscono dopo riscaldamento a 50 °C
C
&
I cloruri terziari non reagiscono 8richiedono tempi molto
lunghi, anche 2 giorni!)
&
51
ETERI
Hanno p.eb. più bassi dei corrispondenti alcoli isomeri; solo i primi due
termini sono solubili i acqua; sono poco reattivi e dunque buoni solventi .
A) Saggio con lo iodio
Etere
I2 in CS2
→
colore bruno scuro
Idrocarburo aromatico
→
colore violetto
Idrocarburo alifatico
→
colore bruno chiaro
B) Solubilità in H2SO4 conc.
Gli eteri alchilici si sciolgono per formazione di Sali di ossonio R2O+H HSO4gli eteri aromatici vengono solfonati
OH
CARBOIDRATI
HO
HO
O
OH
OH
1.
I carboidrati (poliidrossialdeidi e poliidrossi chetoni) non
hanno proprietà uniformemente riconosciute
2.
2
Sono solidi
lidi bianchi
bi
hi o liquidi
li idi sciropposi,
i
i con sapore dolce,
d l
hanno carattere neutro e sono dotati di attività ottica
3.
I monosaccarridi ed i disaccaridi sono molto solubili in
acqua e poco in alcol, insolubili in etere e nei comuni solventi
organici
4.
4
I polisaccaridi hanno
generalmente insolubili in acqua
proprietà
simili
ma
sono
5.
I carboidrati fondono con decomposizione ed
imbrunimento (i termini più semplici bruciano con il
caratteristico odore di caramello) ed il pf varia molto con il
grado di idratazione della molecola
52
Esempio
ANIDRO
p.f. (°C)
MONOIDRATO
p.f. (°C)
FRUTTOSIO
120
105
GLUCOSIO
146
83
LATTOSIO
220
201
AMIDO
dec.
β-CICLODESTRINA
dec.
CELLULOSA
dec.
F.U.: amido, cellulosa β-ciclodestrina, glucosio,
fruttosio, lattosio, saccarosio, amminoglicosidi….
MONOSACCARIDI
ESOSI
CHO
OH
OH
HO
O
HO
OH
HO
OH
OH
Anomero α
OH
OH
OH
glucosio
HO
HO
OH
OH
R
O
Anomero β
OH
OR
R
H
OR
EMIACETALE
riducente
H
OR
ACETALE
NON riducente
53
MONOSACCARIDI
PENTOSI
OH
HO
HO
HO
HO
Anomero α
OH
Forma furanosica
OH
HO
OH
fruttosio
OH
O
O
HO
OH
OH
O
OH
OH
+
Forma piranosica
lattosio
OH
Galattosio
Anomero β
OH
OH
Anomero α
HO
Anomero β
OH
OH
O
OH
OH
OH
O
HO
Anomero β
OH
HO
O
HO
OH
OH
O
POLISACCARIDI
OH
HO
HO
O
emiacetale
Glucosio
Anomero α
saccarosio
HO
O
O
OH O
HO
HO
Glucosio
Anomero α +
HO
HO
OH
OH
acetale
Fruttosio
Anomero β
54
SAGGI
CARBOIDRATI
SAGGIO DI MOLISH
SAGGIO DI SELIWANOFF
SAGGIO DI BARFOED
SAGGIO DI FEHLING
SAGGIO DI MOLIS H e SELIWANOFF
OH
OH
HOH2C
CHO
OH
H2SO4
OH
OH
HOH2C
OH
CHO
OH
Glucosio
esoso
OH
HOH2C
O
CHO
OH
O
CHO
HOH2C
CHO
OH
OH
O
OH
OH
O
CHO
Ossimetilfurfurolo
Furfurolo
R= H, fruttosio
55
R
O
CHO
HO
OH
OH
α−naftolo/H2SO4
Resorcina/HCl
O
O
CH
O
VIOLA
CH2
OH
R
O
OH
ROSSO
56
Seliwanoff’s test is utilized for the differentiation of aldose and ketose
sugars.Reagents consist of resorcinol with Conc. HCl, acid hyrdolysis the
polysacchardies and oligosaccharides thus yielding simpler sugars.A ketose is
said to be present if the mixture turns red. For a general preview, one way to
differentiate ketoses from aldoses is to look for the functional group
attached to it. When a ketone is attached to it, it is a ketose; however, if an
aldehyde is attached to it, it is an aldose. Ketoses are more rapidly
dehydrated than aldoses when heated. The dehydrated ketose then reacts
with the resorcinol to produce a deep cherry red color. Aldoses may react
slightly to produce a faint pink color. Fructose and Sucrose are the two
common sugars which give positive test. Sucrose, a disaccharide consisting of
Fructose and Glucose also gives positive test. The reason behind this is the
presence of Concentrated HCl which hydrolysis Sucrose into its
Components.Thus Fructose being a keto sugar give positive seliwanoff's test.
SAGGIO DI MOLISCH
Caratteristico per esosi, pentosi
e disaccaridi
SAGGIO DI SELIWANOFF
Distingue
g tra chetosi ((reagiscono
g
entro 2 minuti) ed aldosi
(reagiscono
in
un
tempo
maggiore)
a negative test
(left) and a positive
test (right)
57
HO
OH
O
HO
OH
O
HO
OH
HO
HO
OH
HO
O
O
O
HO
OH O
HO
HO
HO
OH
Fruttosio
OH
O
OH
Glucosio-fruttosio
Saccarosio
SAGGIO DI FEHELING
R
C
O
+ 2 Cu++ + 4OH-
OH
OH
OH
H
OH
Glucosio
Galattosio-Glucosio
Lattosio
HO
O
HO
OH
OH
Feheling A: CuSO4/H2O
Fehing B: Na/K Tartrato
R-COOH + 2 H2O + Cu2O
Il saggio è positivo per i monosaccaridi (aldosi, chetosi e funzioni αidrossichetoniche libere o emiacetaliche) e per i disaccaridi riducenti. Il saggio è
dato dalle aldeidi alifatiche, α-ossichetoni, idrazine, poliidrossifenoli ed in genere
composti riducenti.
SAGGIO DI BARFOED
R
H
C
O
+ 2 Cu++ + 4OH-
(CH3CO)2Cu/CH3COOH 1%
R-COOH + 2 H2O + Cu2O
L’acetato di rame viene ridotto a caldo dai monosaccaridi entro due minuiti. I
disaccaridi danno reazione in un tempo più lungo (10 min).
58
Saggio
Molish
Barfoed
Saliwanoff
Felhing
Fruttosio
+
+
+
+
Glucosio
+
+
-
+
Lattosio
+
-
-
+
Saccarosio
+
-
-
-
chetoso
Saggio di
Selivanoff
Saggio di
Molish
Campione
incognito
Saggio di
Barfoed
Monosaccaridi
Carboidrato
Disaccaridi
Saggio di
Felhing
Zucchero
riducente
59
RICONOSCIMENTO DELLE SOSTANZE
ISCRITTE NELLA F.U.I. X ed.
PROCEDIMENTO ANALITICO
Metodo “Livi-Balsamo”
Il riconoscimento di una sostanza iscritta nella FUI attraverso
operazioni chimiche semplici, richiede l’impiego di tabelle supportate
dalle monografie della FU stessa.
TABELLE
“LIVI-BALSAMO”
Tab. I
composti inorganici
Tab. II
composti organometallici
T b III
Tab.
composti
sti organici
i i contenenti
t
ti C
C, H
H, (O)
Tab. IV
composti organici contenenti C, H, (O), N
Tab. V
composti organici contenenti C, H, (O), N, S
Tab. VI
composti organici contenenti C, H, (O), N, Alogeni
Tab VII
Tab.
composti organici contenenti C,
C H,
H (O),
(O) N,
N S,
S Alogeni
Tab. VIII
composti organici contenenti C, H, (O), Alogeni
Tab. IX
composti organici contenenti C, H, (O), S
Tab. X
composti organici contenenti C, H, (O), N, P o As, Al
60
Ricerca di cationi presenti
Distinzione tra composti organici,
inorganici ed organometallici
(Saggio al coccio)
(Saggio alla fiamma o reazione di
identificazione cationi/anioni
FU)
MA COME SI
ESEGUE
UN’ANALISI
INCOGNITA?
Ricerca degli elementi presenti
(Saggo di Lassaigne)
IDENTIFICATO!!!!!
Collocazione del composto in
esame tra quelli appartenenti ad
una delle 10 tabelle del L.-B.
Saggi specifici di riconoscimento
((FU))
Saggio di solubilità
Stato fisico (pf. e p.eb)
Caratteristiche organolettiche
Proprietà chimico-fisiche
Tabella II
N.
nome
Caratteristiche acido-base e pH
Composti organometallici
formula
elementi
a
solubilità
b
pH
H2O EtOH
proprietà
ch.-fis.
A) Composti contenenti sodio
25
ampicillina
sodica
C16H18N3O4SNa
Na
N,S
+
8-10
IR,[α]
61
SAGGI SPECIFICI PER ALCUNI
ANIONI
iscritti nella FU X ed.
BENZOATI
SODIO BENZOATO
Natrium benzoicum
IDENTIFICAZIONE
A. Dà le reazioni caratteristiche (b) e (c) dei
benzoati
B Dà le
B.
l reazioni
i i caratteristiche
i i h del
d l sodio
di
COONa
Benzocarbossilato di sodio
C7H5NaO2
Mr 144.1
Titolo…..
CARATTERI
Polvere granulare cristallina, bianca o lamelle
leggermente igroscopiche
Cap. 2.3. IDENTIFICAZIONE
BENZOATI
a) Aggiungere 0.5 ml di ferro (-ico) cloruro
soluzione R1 a 1 ml di soluzione in esame. Si
forma un precipitato giallo-pallido, solubile in
etere.
b) ….Acido solforico
R e scaldare
leggermente in fondo alla provetta. Sulla
parete interna si deposita un sublimato
bianco.
c)
…..Acido cloridrico R. Il precipitato
ottenuto, ricristallizzato da acqua R calda e
seccato nel vuoto, fondo (2.2.14) fra 120 °C e
124 °C.
62
BENZOATI
COO-
COO(+)
7
+3 Fe3+ + 2 OH-
Fe3(PhCOO)6(OH)2
COO-
+
COOH
+ HCl c.
Cristallizza da H2O
pf 120-124°C
SALICILATI
COO-
COO-
OH
+ FeCl3
OH
Fe
3
COOOH
+ HCl c.
COOH
OH
Cristallizza da H2O
pf 156°C
63
CITRATI
-
OOC
HO
Δ
COOCOO-
O
OH-
O 4-
O 3-
H+
(CN)5Fe
OH-
O-
NO-
--
(CN)5FeNO
(-)
HNO2 +
HgSO4
.......
N
.
COO-
OOC
O
2 Na+
H+
OH-
O
-
Sale di mercurio
dell’acido
dell
acido chetoglutarico
H2SO4 + NH2SO3H
H2C
(CN)5Fe.......N
MnO4-
COO-
OOC
OH
O
Δ
-
O 3(CN)5Fe.......N
O-
NO2-
H2N-SO2-OH
H2SO4
+
N2
+ H2O
LATTATI
OH
Br2, H
COO-
+
O
O
Δ
COO-
H
Acido piruvico
O
OHH2C
(-)
4
O 4-
(CN)5Fe.......N
NO2 - +
O
-
H
NH4+
(NH4)2SO4
H
(CN)5FeNO --
.
2 Na+
O
+
H
OH-
(CN)5Fe
H2SO4
.......
N
O
+
N2
H
33
O 33
H+
OH- (CN)5Fe.......N
O-
H
+ 2 H2O
64
TARTRATI
1) REAZIONE DI FENTON (FeSO4 10%, H2O2 dil)
OH
OH
HOOC
COO
OH
-
.
HOOC
OH
.
OH
H2O
H2O2 + Fe2+
COO-
.
HO
OH
H2O
HOOC
COOH
+ Fe2+
OH
Complesso blu
Fe3+ + OH- + .OH
2) REAZIONE DI PESEZ (H2SO4 , resorcina 2 %, KBr 10 %)
OH
COO-
Br
Br
OH
HOOC
KBr
Resorcina HO
O
H2SO4
H
COOH
Acido gliossilico
b.m.
5-10’
O
Br
OH
O
O
Br
blu
SAGGI SPECIFICI PER ALCUNE
CLASSI DI FARMACI
iscritti nella FU X ed.
65
STEROIDI
BETAMETASONE DIPROPRIONATO
Betamethasoni dipropionas
IDENTIFICAZIONE
A. Disciogliere 10.0 mg in etanolo R e diluire
a 100.0 ml con lo stesso solvente. Introdurre
2 0 mll della
2.0
d ll soluzione
l i
i una provetta con
in
tappo a smeriglio, aggiungere 10.0 ml di
fenilidrazina soluzione solforica R, mescolare
e scaldare a b.m. a 60 °C per 20 min.
Raffreddare immediatamente. L’assorbanza
della soluzione misurata a 419 nm non è
superiore a 0.10.
O
O
HO
CH3
F
CH3
O
O
C
O
CH3
O
C28H37FO7
Mr 504.6
DEFINIZIONE…..
CARATTERI
Polvere cristallina bianca, praticamente
insolubile in acqua, molto solubile in acetone
ed in diclorometano, moderatamente solubile
in alcol.
B…..
C….
D….
E. Aggiungere circa 2 mg della sostanza in
esame a 2 ml di acido solforico R e agitare
per disciogliere. Entro 5 min si sviluppa
un’intensa
colorazione bruno-rossastra.
Aggiungere la soluzione a 10 ml di acqua R e
mescolare. La colorazione scompare e rimane
una soluzione limpida.
F….
Saggio di identificazione A.
O
OH
H2SO4
O
OH
CHO
Ph-NH-NH2
H
C17
H
N N
O
H
H+
HO
+
N N
H H
66
Saggio di identificazione E.
ALOCROMIA e ALOFLUORIA
Composto
Reattivo
Colorazione
PREDNISONE
H2SO4
giallo-arancio
-
PREDNISOLONE
“
rosso-vino
-
DESAMETASONE
“
rosso-bruno
-
rosso-arancio
ss
n i
verde
d
“
ETINILESTRADIOLO
Fluorescenza
TESTOSTERONE
H2SO4
verde
verde
IDROCORTISONE
H2SO4-EtOH
giallo
verde
BARBITURICI
BARBITAL
Barbitalum
IDENTIFICAZIONE
R3
O
C 2H 5
C2H 5
C8H12N2O3
N
O (S)
……
D.
Dà la reazione caratteristica
b bi i i non sostituiti
barbiturici
i i i all’azoto
ll’
(2.3.1
2 3 1)
dei
NH
O
Cap. 2.3. IDENTIFICAZIONE
Mr 184.2
DEFINIZIONE…..
CARATTERI
Cristalli incolori o polvere cristallina bianca,
moderatamente solubili in acqua, sol. In acqua
bollente, in alcol ed in etere. Forma con gli
idrossidi, con i carbonati alcalini e con
ammoniaca composti solubili in acqua.
BARBITURICI
ALL’AZOTO
NON
SOSTITUITI
Discioglire circa 5 mg della sostanza in esame
in 3 ml di metanolo R, aggiungere 0.1 ml di una
soluzione contenente 100 g/l di cobalto
nitrato R e 100 g/l di calcio cloruro R.
Mescolare, agitando, aggiungere 0.1 ml di
sodio idrossido soluzione diluita R. si forma
una colorazione ed un precipitato bluviolaceo.
67
R3
O
BARBITURICI
R1
N
O (S)
NH
R2
O
Solubili in soluzioni acquose di carbonato
R3
O
R1
N
O
NH
R2
H+
O
R3
O
R1
N
R1
N
O
R2
O
R1
O
N
O
N
R2
O-
H
O
O
NH
R2
N
-
N
R1
O
R3
R3
O
NR2
H
O
O
O
H+
R1
N
-
O
O
N
R2
R1
-
O
H
O (3)N
R1
X
R1
N
O
O
N
R2
R1
-
O
O-
N
N
R2
O
-
O (S)
NH
R2
(1)
O
R2
R3
pKa1
pKa2
NH(1)
NH(3)
Barbital
O
Et
Et
H
7.9
12.3
Pentobarbital
O
Et
i-Pent
H
8.0
12.0
Fenobarbital
O
Et
Ph
H
7.3
11.8
Esobarbital
O
Me
Me
8.2
-
68
Reazione di Parri
CoNO3/CaCl2/NaOH sol.acq.dil.
L
L
Co
Barb
L : solvente
L
Barb
L
Complesso ottaedrico blu-violaceo
Formazione di Sali di Hg
(barbiturici disostituiti in 5)
HgCl2/ OH-
Distinzione tra barbiturici
N3-metilati e non
H
O
H
3N
2 O
O
R1
R2
NH
1
O
R1
N
O
-
N
R2
H
O
O
Na+
H+
H
O
R1
R1
O-
N
O
N
N
R2
Precipitato
bianco
HgCl
O
N
R2
O
O
R1
O-
N
N
R2
NH4+
HgOH
O
69
CAFFEINA
Coffeinum
IDENTIFICAZIONE
…….
Dà la reazione caratteristica delle
F.
xantine (2.3.1).
O
N
N
O
N
N
Cap. 2.3. IDENTIFICAZIONE
XANTINE
C8H10N4O2
0.1 ml di acqua ossigenata
soluzione R e 0.3 ml di acido cloridrico diluito
R a pochi mg della sostanza in esame o alla
quantità prescritta. Evaporare a secco a b.m.
fino ad ottenere un residuo rosso-giallastro.
Aggiungere 0.1 ml di ammoniaca diluita R 2. il
colore del residuo vira al rosso-violetto.
Aggiungere
Mr 194.2
DEFINIZIONE…..
CARATTERI
Polvere cristallina bianca o cristalli bianchi
sericei,
che
sublimano
facilmente,
moderatamente solubili in acqua, molto
solubili in acqua bollente, poco solubili in
etanolo ed etere. Si scioglie nelle soluzioni
concentrate di benzoati o salicilati alcalini.
XANTINE
O
R1
N
O
R2
N
N
N
CH3
R1
R2
solubilità
in H2O (ml)
p.f.
Caffeina
CH3
CH3
1:60
sublima a 178°C
pf ~ 235 °C
Teofillina
CH3
H
1:120
pf = 270-274 °C
Teobromina
H
CH3
1:3000
sublima a 290-295°C
pf ~ 350 °C
70
CH3
N
N
N
H
O
CH3
O
O
H3C
O
N
H
H3C
ON
N
N
N
N
O
H
CH3
N
N
N
N
N
O NN
H3C
CH3
O
CH3
H
Saggio della Muresside
O
R1
O
O
R2
H+/H2O2
N
N
N
R1
N
O
O
OH
N
OH +
N
HO
R1
O
OH
N
N
O
N
O
R1
O
Acido dialurico
O
O
N
O
O
Allossana
O
N
N
R1
O
Alloxantina
O
NH3
R1
O
N
N
O
O
N
O
N
O
N
R1
R1
O
O
violetto
O
N
N
N
O-
N
O
N
R1
O
NH4+
71
Esempi di monografie V Ed.
72
73
Cap. 2.3. IDENTIFICAZIONE
74
DERIVATI CRISTALLINI
A
B
Caratterizzazione di B
Uso di tabelle
CRITERI DI SCELTA DEL DERIVATO CRISTALLINO
REQUISITI DEL DERIVATO CRISTALLINO
IMPORTANTE
P.f. diverso dal p
prodotto di partenza
p
P.f. netto
Pf compreso tra 50° e 250 °C
Pf confrontabile con la letteratura
Pf diverso dal pf di derivati di altri eventuali pdts incogniti
Facilmente isolabile, purificabile, stabile
REQUISITI DELLA REAZIONE DI FORMAZIONE DEL DERIVATO
Reazione ben definita
Carattere generale
Buone rese
Breve durata
Non sottoprodotti
Basso costo
Facile reperibilità dei sintoni
75
ESECUZIONE PRATICA DELLA REAZIONE
Eseguire scrupolosamente la metodica
L quantità
Le
i à vanno misurate
i
attentamente
Molta attenzione alle apparecchiature di sintesi
Il prodotto finale deve essere isolato per cristallizzazione
Il pdt finale deve essere secco prima di determinare il p.f.
pf
ESEMPIO:
Dati ottenuti:
- p.f. 184-186 °C
- Presenza di N
- Carattere basico molto debole
- Presenza di un gruppo amminico primario aromatico
- Presenza di nitrogruppo
Consultazione tabelle:
DERIVATI POSSIBILI
Sostanza
p.f.
AcAm
BzAm
BSAm
TsAm
2.4-dinitro-anilina
180 °C
120°
220 °
-
219 °
2.4.6-trinitro-anilina
190 °C
230 °
196 °
211°
-
76
COMPOSTI CONTENENTI DUE O PIU’ GRUPPI FUNZIONALI
CLASSE B
Aldeide/Chetone
Alcol
Ammina I
Ammide o Immide
Ammina II
Ac. Carb./Anidride
Ac. Solfonico
Fenolo
Reattivvità crescente
CLASSE A
Estere
Alogenuro alchilico
Nitrili
Nitroderivato
Ammina III
Alogenuro arilico
DERIVATI CARATTERISTICI DI
ALDEIDI e CHETONI
ALCOLI
Idrazoni
Ossime
Di d d i ti
Dimedonderivati
Semicarbazoni
Tiosemicarbazoni
Esteri
(acetati e benzoati)
ariluretani
il
t i
CARBOIDRATI
Acetati e benzoati
Fenilidrazoni
Osazoni
Esteri
(acetati e benzoati)
Ariluretani
Ac. Arilossiacetici
Picrati
FENOLI
Ac. CARBOSSILICI
Derivati ammidici: ammidi, anilidi, p-toluiditi
Derivati esterei: Metilici, p-nitrobenzilesteri,
Idrazidi, altro….
77
AMMINE
Ammidi: benzammidi, acetammidi, ftalimmidi
Sali: picrati, cloridrati
U
Uree:
naftiluree,
ftil
f
feniltiouree
ilti
AMMINOACIDI
Benzammidi
Acetammidi
N-ureidoderivati
2.4-dinitrofenilderivati
Etc………
DERIVATI DEGLI ACIDI CARBOSSILICI
Esempio: Ammidi, anilidi, p-toluiditi
CaCl2
(A) R-CO2H + SOCl2→R-COCl + SO2 + HCl
(B) R-COCl
R COCl + NH3 → R-CONH
R CONH2 + NH4Cl
R-COCl + 2 R1NH2 → R-CONHR1 + R1-NH2 · HCl
78
P.f. dei derivati cristallini (°C)
Composto incognito
p.f.(°C)
p.f. (°C)
derivato
FENILIDRAZONE
4-clorobenzaldeide
4-idrossibenzaldeide
3-idrossibenzaldeide
2-nitrobenzaldeide
4-bromobenzaldeide
Benzofenone
4-idrossiacetofenone
4
idrossiacetofenone
Acido antranilico
4-bromoanilina
2.4-dicloroanilina
1.2-fenilendiammina
4-toluidina
Composto incognito
45-47
117-119
100-102
41-44
67
48-49
104-108
104
108
PICRATI
144-146
66
61-65
101-103
44-46
127
184
131
120
113
138
104
180
106
208
182
p.f.(°C)
p.f. (°C)
derivato
OSAZONE
α-D-glucosio
D glucosio anidro
α-D-glucosio idrato
β-D-glucosio anidro
146
90
150
210
“
“
D-fruttosio
103
“
α-lattosio anidro
α-lattosio monoidrato
β-lattosio
lattosio anidro
223
201
252
200
200
ESEMPI
79
PICRATI
O--
OH
O 2N
NO2
+
NR3
EtOH O2N
+
R3NH
NO2
Δ
NO2
NO2
Acido picrico
P.f. 122°C
pKa = 1
Picrati
Cristalli gialli
FENILIDRAZONI
O
R
C
NH-NH3+Cl-
+
R'(H)
R
Fenilidrazina
pH ottimale
4-6
NH-N=C
R
R'(H)
R
Fenilidrazone
80
OSAZONI
CHO
CHOH
CH2OH
C O
(CHOH)y
CH2OH
C=O
CHOH
(CHOH)x
CH2OH
CH=N-NH-Ar
CH=N-NH-Ar
(CHOH)x
(CHOH)x
+ArNH-NH2
-C6H5NH2
-NH2
NH-Ar
CH2OH
CH2OH
H
+ eccesso ArNH-NH2
+ riscaldamento
CH2OH
C=N-NH-Ar
(CHOH)y
N
C=N
H
N-Ar
(CHOH)x/y
CHO
C=N-NH-Ar
((CHOH))y
CH2OH
C
CH2OH
CH2OH
OSAZONE
Cristallo giallo
Poco sol. in acqua
IMPORTANTE
Ï
Gli zuccheri che differiscono nei primi due termini della catena
danno lo stesso osazone; es. glucosio-fruttosio-mannosio
Ï
I p.f. possono essere poco indicativi del composto sintetizzato
Ï
Il tempo di formazione dell’osazone è spesso diagnostico, in
condizioni operative standardizzate
- MONOSACCARIDI
100 °C
- DISACCARIDI(lattosio e maltosio) 100 °C
20’
2h→10’+raffreddamento!
81
Glucosazone (x 250)
Galactosazone (x 160)
Maltosazone (x 250)
Lactosazone (x 250)
82
COME SI FA LA CRISTALLIZZAZIONE?
SCEGLIERE IL SOLVENTE!
Il solvente per la cristallizzazione deve essere inerte chimicamente;
Il soluto vi deve essere molto solubile a caldo e molto poco a freddo;
Non deve avere una alta volatilità
SOLVENTE
Etere di petrolio
Esano
Benzene
A t t di etile
Acetato
til
Etanolo
Acqua
p.eb (°C)
30-50
69
80
77
78
MISCELE DI SOLVENTI
100
Benzene-etere di petrolio
Etanolo-acqua
Acetone-etere di petrolio
Metanolo-cloroformio
FASI della CRISTALLIZZAZIONE
(1)
(4)
(2)
(5)
(3)
(6)
83
(7)
(8)
(9)
(10)
(11)
p.f.
84