Elettrolisi del solfato di rame
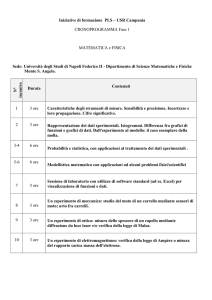
Calcolo dell’
dell’equivalente elettrochimico del rame
Calcolo del valore della carica elementare
Un po’ di storia
1800 - Invenzione della pila di Volta
1807 - Davy,
Davy, studiando gli effetti della corrente sulla soda e
sulla potassa, isola i metalli alcalini Na e K
1808÷
1808÷1810 – Teoria atomica di Dalton,
Dalton, prima determinazione
delle masse relative degli atomi (dalla legge delle proporzioni
definite e dai dati sperimentali delle reazioni chimiche)
1
Un po’ di storia
1834 – Faraday determina sperimentalmente ed enuncia le
leggi dell’
dell’elettrolisi:
1.
La massa di un elemento liberata a un elettrodo
durante l’l’elettrolisi è proporzionale alla quantità
quantità di
carica passata attraverso la soluzione
Se A è la massa atomica di un elemento e v la sua
valenza, il passaggio di 96540 C di carica elettrica
libera A/v grammi dell’
dell’elemento
2.
Un po’ di storia
1897 - Thomson dimostra che i raggi catodici sono particelle
di carica negativa e ne determina il rapporto q/m
1909 – Millikan misura la carica dell’
dell’elettrone
1913 – Thomson scopre, con lo spettrografo di massa,
l’esistenza degli isotopi 20 e 22 del Ne
2
Esperimento sull’elettrolisi di CuSO4
L’apparato sperimentale consiste in:
una vaschetta di vetro contenente una soluzione al
10%
10%di CuSO4
due elettrodi,
elettrodi, uno di rame e uno di ottone
un alimentatore a corrente continua e tensione variabile
un amperometro per misurare l’intensità
intensità di corrente
un cronometro.
cronometro.
Schema del circuito
A
Cu
ottone
R≅5Ω
Alimentatore a c.c.
+
-
Soluzione di
CuSO4
3
Esperimento sull’elettrolisi di CuSO4
1.
Si prepara la soluzione acqua + solfato di rame ( nella
soluzione alcune molecole del sale si dissociano in ioni
Cu++ e SO4-- ).
2.
Si immergono i due elettrodi di rame e di ottone,
collegandoli elettricamente rispettivamente al polo positivo
e negativo dell’
dell’alimentatore.
3.
Si inserisce in serie nel circuito l’l’amperometro e una
resistenza limitatrice di 5 Ω
4.
Si regola l’l’intensità
intensità di corrente al valore di ≈ 1 A.
Esperimento sull’elettrolisi di CuSO4
A questo punto si interrompe il circuito, si estrae
l’elettrodo di ottone, lo si asciuga, lo si carteggia e lo si
pesa sulla bilancia.
Si ricolloca l’l’elettrodo al suo posto, si chiude il circuito e
contemporaneamente si inizia a misurare il tempo.
Dopo il tempo prefissato (15÷
(15÷20 minuti) si interrompe il
circuito, si estrae l’l’elettrodo, lo si sciacqua e lo si
asciuga con il phon, poi lo si pesa nuovamente.
4
Esperimento sull’elettrolisi di CuSO4
Che cosa avviene in soluzione durante il passaggio di
corrente?
1.
Gli ioni Cu++ si depositano sul catodo di ottone
2.
Gli ioni SO4-- si depositano sull’
sull’anodo, reagiscono con il
rame e formano CuSO4 che torna in soluzione.
Elaborazione dei dati sperimentali
I dati ottenuti alla fine dell’
dell’esperimento sono i seguenti:
∆m = massa depositata sul catodo nel tempo ∆t
I = intensità
intensità di corrente in ampè
ampère
∆t = durata dell’
dell’esperimento in secondi
5
Elaborazione dei dati sperimentali
Con questi dati è possibile calcolare l’l’equivalente
elettrochimico del rame:
E = ∆m
I ⋅ ∆t
Elaborazione dei dati sperimentali
L‘equivalente elettrochimico di un metallo dipende
soltanto, per le leggi di Faraday sull’
sull’elettrolisi, dal
metallo stesso e dalla sua valenza nel composto
disciolto nell’
nell’acqua.
Nel caso del rame il suo valore risulta
E = 3,29·
3,29·10-4 g/C
6
Elaborazione dei dati sperimentali
La massa atomica del rame è A = 63,5
La massa di un atomo di rame è A · UMA
con UMA = unità
unità di massa atomica = 1,66·
1,66·10-24g
quindi:
massa atomo di Cu ≅ 1,05·
1,05·10-22 g
Elaborazione dei dati sperimentali
Il numero di atomi depositati sul catodo si ottiene
dividendone l’l’aumento di massa per la massa di un
atomo di rame:
n=
∆m
(m atomo Cu )
7
Elaborazione dei dati sperimentali
Sapendo che durante il passaggio di corrente ogni ione Cu++
trasporta due cariche elementari è facile calcolare il numero di
cariche elementari che sono passate nel circuito durante
l’esperimento:
No cariche elementari = 2·
2·n
Elaborazione dei dati sperimentali
La carica passata nel circuito nel tempo ∆t è data dal
prodotto
q =I·
=I·∆t
Siccome i portatori di carica sono gli ioni Cu++ si ottiene, per
il valore della carica elementare :
e = q/2n
8
Applicazioni dell’elettrolisi
nella protezione dei metalli dall’
dall’ossidazione con procedimenti di
cromatura, nichelatura, ossidazione anodica dell’
dell’alluminio ecc.
nei procedimenti di argentatura, doratura, ramatura
nella produzione dell’
dell’alluminio e nella purificazione del rame
nella produzione di idrogeno e ossigeno attraverso l’l’elettrolisi
dell’
dell’acqua
9