FISIOLOGIA CELLULARE E MOLECOLARE
Microelettrodo
da patch
Patch clamp di una cellula nervosa, simultaneamente caricata
con un fluoroforo per la misura del Ca2+. L'inserto riporta
l'ingrandimento di una porzione di dendrite.
Elettrofisiologia
e
Misura della [Ca2+] intracellulare
Elettrofisiologia
Introduzione
L'elettrofisiologia studia i segnali elettrici presenti negli organismi animali e vegetali (segnali
detti bioelettrici), presenti in tutti gli organismi viventi ed in numerosissimi meccanismi biologici.
Possiamo citare l'insorgenza e la propagazione dei potenziali d'azione delle fibre nervose e
muscolari, sia scheletriche che cardiache. In particolare, meccanismi elettrici controllano l'ingresso
nella cellula dello ione Ca2+; questo è un messaggero universale, coinvolto nei processi di
contrazione muscolare, esocitosi, trascrizione genica, proliferazione cellulare. Sebbene di interesse
generale, sono soprattutto i Fisiologi a sviluppare ed utilizzare le tecniche di misura dei segnali
elettrici negli organismi, onde il nome di elettrofisiologia.
Quali sono i segnali bioelettrici?
I segnali bioelettrici sono generalmente correlati al movimento di molecole cariche attraverso la
membrana cellulare. Di fatto, si misurano
1) la differenza di potenziale tra l'inteno e l'esterno della cellula; è questo il potenziale di
membrana, detto Vm
2) la corrente che attraversa la membrana cellulare
3) la differenza di potenziale tra due punti posti extracellularmente (come
nell'elettrocardiogramma e nell'elettroencefalogramma); questo tipo di misura, la prima ad
essere stata effettuata , è largamente utilizzata in ambito medico.
Le leggi fondamentali dell'elettrofisiologia
Gran parte dei principi teorici utilizzati in elettrofisiologia originano da 3 leggi fondamentali:
1) la legge di Ohm
2) la carica di un condensatore
3) l'equazione di Nerst
La legge di Ohm
La legge di Ohm esprime una relazione tra la differenza di potenziale V (tensione elettrica) ai
capi di un conduttore elettrico e l'intensità di corrente elettrica che lo attraversa. Gli elementi
elettrici per i quali la legge è soddisfatta sono detti resistori (o resistenze) ideali o ohmici. Si noti
che la legge di Ohm esprime unicamente la relazione di linearità fra la corrente elettrica I e la
differenza di potenziale V applicata. L'equazione indicata è semplicemente una forma
dell'espressione che definisce il concetto di resistenza ed è valida per tutti i dispositivi conduttori.
La legge deve il proprio nome a quello del fisico tedesco Georg Simon Ohm. È descritta dalla
relazione matematica:
In Fig. 1 è mostrato il simbolo della resistenza ed una resistenza utilizzata nei circuiti elettrici.
Fig. 1. Simbolo della resistenza elettrica e,
in basso, una resistenza reale, il cui valore
è indicato tramite un codice a colori
riportato sulla resistenza.
La legge di Ohm stabilisce una possibile relazione tra V ed I. Un filo elettrico obbedisce molto
fedelmente a questa legge. La membrana cellulare in parte obbedisce alla legge di Ohm, molto
spesso la relazione V/I è tutt'altro che lineare.
Esiste poi la seconda legge di Ohm, che permette di calcolare la resistenza di un materiale a
partire dalle sue caratteristiche fisiche e geometriche:
dove
è la resistività del materiale, l la Lunghezza ed S la Sezione.
Voltaggio e corrente
Si genera una differenza di potenziale quando vi è una distribuzione spaziale di cariche
elettriche non uniforme (le comuni batterie effettuano questa separazione di cariche). L'unità di
misura è il Volt (V) e la differenza di potenziale è misurata dal voltmetro.
La corrente I è il numero di cariche che attraversano il resistore nell'unità di tempo (il secondo).
L'unità di misura è l'Ampere (A) e la corrente viene misurata dall'amperometro. Scorre una
corrente di 1 A se, in un s, il resistore è attraversato da una carica di 1 coulomb (circa 6,24×10 18
la carica di un elettrone). Per convenzione, I è costituita da cariche positive che vanno dal + al -.
La batteria fornisce lavoro, spostando le cariche + dal - al +.
R, G
(1/R)
I
+
-
V batteria
V= R x I = - V batteria
Il condensatore
In Fig. 2 è rappresentato il simbolo del condensatore ed una foto di alcuni tipi di condensatori
utilizzati nei circuiti elettrici.
V
+
+
-
+
+
-
Fig. 2. A sinistra, simbolo del condensatore, sulle cui due facce sono presente 4 cariche Q. A
destra, una foto di condensatori utilizzati nei circuiti elettrici.
Il condensatore è costituito da 2 superfici di materiale conduttore (le armature) separate da un
isolante (il dielettrico). Per un condensatore valgono le relazioni
Q= C x V
V= Q/C
dove V è la differenza di potenziale tra le due superfici conduttive, Q è il numero di cariche
presenti sulle due armature (le cariche sono di egual numero e di segno opposto) e C è è la Capacità
del condensatore. C dipende prevalentemente dalla geometria del condensatore e si misura in
Faraday.
La membrana cellulare è un condensatore
Il doppio strato lipidico della membrana plasmatica non consente il passaggio degli ioni: è
quindi un isolante (o un dielettrico). E' in contatto con la soluzione extra- ed intracellulare, che sono
conduttori. La membrana cellulare è quindi un condensatore, con una sua capacità Cm ed una
differenza di potenziale (Vm), e vale la relazione
Vm= Q/Cm
Nota la superficie di una cellula, è possibile stimare la sua capacità. Se Vm è noto, è quindi
possibile calcolare quante cariche sono necessarie per generare una V pari a Vm.
La membrana cellulare è anche un conduttore
La membrana plasmatica ha anche una sua conduttanza, costituita dai canali ionici aperti
disposti sulla membrana. Tali canali sono disposti in parallelo.
La membrana plasmatica è quindi sia un condensatore (sono necessarie delle cariche ai lati
della membrana che determinano Vm) che un conduttore.
Fig. 3, in alto. La cellula può essere
considerata un condensatore con una
resistenza in parallelo.
Fig.3, in basso. La resistenza in parallelo è
costituita dai canali ionici aperti , disposti in
paralleo tra di loro ed in parallelo con la
porzione lipidica della membrana.
Questo modello è però incompleto. Le resistenze non discriminano tra i vari tipi di ioni e così la
batteria, che spinge in modo identico gli ioni. Sappiamo infatti che la "forza" che pilota ciascuno
ione è data dalla differenza tra Vm (potenziale di membrana) ed il potenziale di equilibrio dello ione
e che i canali ionici sono in genere selettivi per i vari ioni. In basso è riportato un modello più
completo ed utile anche dal punto di vista didattico.
++
- -
Vm
GNa è costituita dai canali permeabili al Na+, e la corrente è pilotata dalla differenza tra Vm e
VNa, il potenziale di equilibrio del Na+; GK è costituita dai canali permeabili al K+, e la corrente e
pilotata dalla differenza tra Vm e VK; etc.
La legge di Nerst
Nella Fig. 4 si mostrano alcuni concetti correlati alla legge di Nerst e la si definisce
matematicamente.
Fig. 4. Esemplificazione della legge di Nerst. R è la costante dei gas, T la temperatura assoluta,
F la costante di Faraday e Z la valenza dello ione.
A 37 °C l'equazione di Nerst può essere così scritta:
VE=(0.061/Z) * Log(C1/C2)
La legge di Nerst ci consente di sapere in quale direzione uno ione si muove (se entra nella
cellula, se esce, se è in equilibrio). Se il potenziale di membrana Vm è differente da E, ci sarà un
flusso dello ione tale da pilotare Vm verso E.
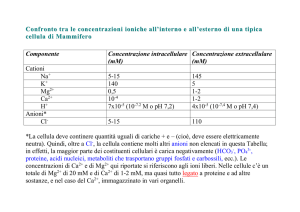
Nella tabella sono riportate le concentrazioni ioniche intracellulari ed extracellulari di una
cellula "tipo"
Na+
K+
Ca2+
ClATP
Interno
(mM)
5
140
0.1( M)
20
2
Esterno
(mM)
140
3
2
130
tracce
Tramite l'equazione di Nerst è possibile calcolare i potenziali di equilibrio E per ciascuno ione:
ENa+ =
EK+ =
ECl- =
ECa2+ =
(gli studenti calcolino i vari E a 37 °C).
La driving force
Nella legge di Ohm le cariche si muovono unicamente per effetto di V, mentre attraverso la
membrana si muovono anche per effetto di una differenza di concentrazione. Il potenziale di
equilibrio E è la differenza di potenziale V che bilancia la differenza di concentrazione: la
differenza tra Vm ed E (Vm-E), detta driving force ( F), sarà il potenziale netto che muove gli ioni
attraverso la membrana
La legge di Ohm per la cellula vale quindi
F= Vm-E= RI
Tale legge deve essere applicata ai singoli ioni. Per il Na+, per esempio
FNa= Vm- ENa = RNa* INa
La corrente globale cha attraversa la cellula sarà la somma algebrica delle correnti portate dai
singoli ioni. Per convenzione, possiamo ritenere che una corrente uscente dalla cellula sia positiva.
Per esempio
FNa= -80 mV - 60 mV= RNa* INa
per cui per Vm=- 80 mV la corrente è negativa e quindi entrante, come effettivamente avviene.
Come misurare Vm con i microelettrodi convenzionali
Il Voltmetro (Fig. 5) misura la ddp (differenza di potenziale) tra due punti, che devono sempre
essere connessi con una resistenza molto piccola (almeno 1/1000) rispetto alla resistenza d'ingresso
Ri del voltmetro (la Ri è un parametro funzionale del voltmetro riportato nel manuale d'uso).
Fig. 5. Un voltmetro con i due ingressi,
ciascuno collegato ad un filo a bassa
resistenza elettrica. I fili terminano con un
puntale.
Di regola (ma non nel voltmetro della figura), uno degli ingressi è connesso "a terra" (è cioè al
potenziale del terreno, che è costante) e si misura la differenza di potenziale tra il punto di interesse
(per esempio, l'interno della cellula) e "la terra".
Volendo misurare il Vm della cellula, si pone il problema di collegare elettricamente l'esterno e
l'interno della cellula ai due ingressi del voltmetro. L'esterno della cellula (costituito da una
soluzione ionica appropriata) è conduttivo e si collega all'ingresso " a terra" del voltmetro tramite
un filo di Ag immerso nella soluzione extracellulare (il filo metallico di Ag può essere sostituito da
conduttori particolari, per esempio un filo costituito da un miscuglio di Ag e di AgC, che evitano
alcuni problemi relativi all'instaurarsi di un potenziale di contatto tra l'Ag e la soluzione).
Quest'ingresso è connesso "a terra", per cui anche la soluzione extracellulare è connessa "a terra".
Per connettere elettricamente l'interno della cellula al voltmetro dobbiamo utilizzare un conduttore
che attraversa la membrana ed entra in contatto con l'interno della cellula senza distruggerla. Si usa
perciò un microelettrodo, solitamente una pipetta di vetro (Fig. 6), con la punta molto fine, ma
aperta, riempita da una soluzione ionica (solitamente KCl 3 M). Vi è quindi continuità elettrica tra
la soluzione all'interno della cellula e la soluzione all'interno della pipetta. La soluzione all'interno
della pipetta viene poi connessa tramite un filo di Ag (od un suo più adatto sostituto) all'altro
ingresso del voltmetro, consentendo la misura di Vm. Sebbene la punta del microelettrodo sia molto
piccola, la lacerazione della membrana prodotta dal microelettrodo apre una conduttanaza che
consente il passaggio non selettivo degli ioni. La corrente che attraversa tale conduttanza ha un
E=0 mV, e tende a depolarizzare la cellula. L’entità della depolarizzazione è variabile: può essere
trascurabile o invece modificare le proprietà della cellula.
Fig. 6. Microfotografia di un
microelettrodo di vetro.
Resistenza del microelettrodo e resistenza d’ingresso del
voltmetro
Come si diceva, tra le caratteristiche funzionali del voltmetro, vi è la resistenza d'ingresso Ri,
che deve essere almeno 1000 volte maggiore della resistenza del microelettrodo. I microelettrodi
convenzionali hanno una resistenza di circa 20-50 M .
Come cambiare Vm
Se si desidera cambiare Vm, è necessario introdurre delle cariche elettriche, che
modificheranno Vm in funzione della capacità della cellula. Se Qm erano le cariche già presenti
nella cellula e Qi le cariche introdotte
Qm = C x Vm
Qi = C x V
Qm + Qi =C x (Vm + V)
dove Vm+ V è il nuovo potenziale di membrana
Ricordiamo però che per V=Vm la corrente I netta che attraversa la cellula è 0 (e quindi il
potenziale di equilibrio Etotale della somma delle correnti che attraversano la membrana è uguale a
Vm). Se mi sposto da Vm si genera una corrente di direzione tale che tende a portare il nuovo
potenziale di membrana verso Vm. Perciò,
se voglio mantenere nel tempo questo nuovo potenziale di membrana,
devo portare all’interno della cellula lo stesso numero di cariche che stanno uscendo, o rimuovere
dall’interno della cellula lo stesso numero di cariche che stanno entrando. Matematicamente, se Gm
è la conduttanza della membrana (che supponiamo costante), per V= Vm la driving force è
F= Vm -Etotale = 0
Se Vm viene modificato, diventando V, avremo una I pari a
I= Gm ( V-Etotale)
che piloterà V verso Vm.
Dal punto di vista sperimentale, se si desidera modificare Vm devo introdurre un microelettrodo
nella cellula e connettere il filo d’argento della micropipetta ad una sorgente di potenziale, per
esempio + 20 mV. Se Vm= –80 mV, scorrerà una corrente I (cariche positive verso l’interno della
cellula o cariche negative rimosse dalla cellula), che tenderà a portare Vm verso + 20 mV. Di fatto,
il potenziale alla punta della pipetta sarà 20 mV- I x Rmicroelettrodo, dove Rmicroelettrodo è la
resistenza del microelettrodo, per cui non so di quanto Vm si differenzia da +20 mV (Fig. 7). Se
però conosco I e Rmicroelettrodo, posso calcolare di quanto Vm si differenzia da +20 mV.
Alternativamente, posso introdurre o togliere delle cariche con un elettrodo e misurare Vm con un
altro elettrodo.
Il problema di mantenere la cellula ad un potenziale desiderato e di misurare la corrente necessaria
per mantenerlo viene risolto dal voltage clamp ("to clamp" significa appunto "mantenere fermo").
Fig. 7. Caduta di potenziale
causata dalla corrente I e dalla
R del microelettrodo (vedi
testo).
Voltmetro
Vm
Il voltage clamp con 2 microelettrodi
Il voltage clamp, come appena detto, consente di mantenere la cellula ad un potenziale
desiderato e di misurare la corrente necessaria per mantenerlo ed è utilizzabile solo con cellule
relativamente grandi, quali l'assone gigante del calamaro (dove è stato utilizzato originariamente),
le cellule muscolari scheletriche e gli oociti.
La figura 8 illustra lo schema di funzionamento del voltage clamp con due elettrodi.
Fig. 8. Schema di funzionamento del voltage
clamp. Un ingresso dell'amplificatore 1
(quello positivo) è messo a terra.
L'amplificatore 1 (per amplificatore qui si intende, genericamente, un dispositivo elettronico che
esegue quanto descritto nel testo) misura Vm e lo manda all’ingresso negativo dell’amplificatore 2,
mentre all’ingresso positivo viene mandato il potenziale Vclamp che si vuole mantenere nella
cellula. L’amplificatore 2 fa la diffenza tra Vm-Vclamp ed applica al filo d’argento della pipetta 2
questa differenza (opportunamente amplificata) che fa scorrere una corrente di segno tale che porta
Vm verso Vclamp. Tanto più Vm sarà simile a Vclamp, tanto minore sarà la corrente. Riferendosi
al precedente esempio, con Vm=-80 mV e quindi Etotale=-80 mV, la corrente che attraversa la
menbrana per Vclamp= 20 mv sarà
I= (Etotale – 20) x Gm
I= (-80 –20) x Gm
I=-100 x Gm
La circuiteria è tale che basta una minima differenza tra Vm e Vclamp per generare la corrente
necessaria I=-100 x Gm per mantenere Vm praticamente identico a Vclamp. Naturalmente,
inizialmente abbiamo anche fornito le cariche Q per spostare Vm verso + 20 mV.
Il voltage clamp consente quindi di fissare V e di misurare la corrente necessaria per mantenere
costante V. E' così possibile tracciare la relazione corrente-voltaggioVclamp/I. Se è noto il
potenziale di equilibrio E della corrente è possibile tracciare la relazione corrente-driving force
F= Rm x I
e calcolare la resistenza della membrana Rm o la conduttanza della membrana Gm.
L'utilizzo del voltage clamp nello studio delle correnti ioniche che attraversano la membrana
plasmatica nell'assone gigante del calamaro consentì ad Alan Hodgkin e Andrew Huxley di
vincere il premio Nobel nel 1963, insieme a John Eccles, un neurofisiologo australiano. Andrew
Huxley, successivamente, formulò l'ipotesi che la contrazione muscolare era dovuta
all'interdigitazione dei filamenti di actina e miosina.
Il voltage clamp con due elettrodi viene oggi principalmente utilizzato per studiare le proprietà
di canali ionici wild o mutati, fatti esprimere in oociti di Xenopus.
Andrew Huxley
Alan Hodgkin
Il singolo canale ed il patch clamp
L'esistenza di canali ionici era stata ipotizzata sin dagli anni 40, ma per vedere un singolo canale al
lavoro si è dovuto aspettare sino alla fine degli anni 70, grazie all'invenzione del patch clamp da
parte di E. Neher e B. Sakmann (Fig. 9).
Fig. 9. E. Neher (sinistra) e B.
Sakmann (destra), premi Nobel
per la Fisiologia nel 1991.
In Fig. 10 si può osservare il tipico comportamento di un singolo canale. Questo si apre e si chiude
in modo probabilistico e la probalità di essere nello stato aperte può essere funzione di Vm (si parla
allora di canali voltaggio-dipendenti), del legame con una molecola (canali chemio-dipendenti) o
della tensione applicata alla membrana (canali meccano-dipendenti). Inoltre, una volta aperto, la
corrente che lo attraversa è costante.
Fig. 10. Canali aperti dall'acetilcolina (sinistra) e canali al Ca2+ aperti dalla depolarizzazione
(destra).
Il patch clamp è un voltage clamp con un singolo microelettrodo dalle proprietà particolari. Questo
ha una punta relativamente ampia (nell'ambito del micron) ed una R bassa (inferiore, in genere, a 10
M ). Inoltre la punta del microelettrodo viene fusa avvicinandola ad una resistenza incadescente, in
modo da renderla perfettamente liscia. In Fig. 11 è mostrato un microelettrodo da patch che tocca
(delicatamente) una cellula in coltura.
Fig. 11. Si può osservare un
microelettrodo da patch (nella parte
sinistra della figura) che tocca una
cellula in coltura (un neurone).
In Fig. 12 è mostrato uno schema del patch clamp. Il potenziale a cui si vuol "clampare" la cellula
(Vclamp) viene applicato all'ingresso positivo dell'amplicatore. Questo funziona in modo tale che
anche l'ingresso negativo assume il valoreVclamp. Il sistema funziona come già descritto alla fine
del paragrafo "Come cambiare il Vm". Se Vclamp è 20 mV, il potenziale alla punta della pipetta
sarà 20 mV- I x Rpipetta, per cui non so di quanto Vm si differenzia da +20 mV (Fig. 7). Il sistema
consente di misurare I e Rpipetta, per cui posso calcolare di quanto Vm si differenzia da Vclamp.
Esiste inoltre qualche accorgimento elettronico che consente di rendere Vm molto simile a Vclamp,
anche se I x Rpipetta non è trascurabile.
Fig. 12. Rappresentazione schematica di un sistema di patch clamp.
Senza entrare nel dettaglio della circuiteria elettrica ed elettronica del patch clamp, la speciale
pipetta ideata da Neher e Sakmann ha sia una bassa resistenza sia la capacità di limitare
notevolmente la corrente I, cosicche Vm è molto simile a Vclamp, ed è possibile misurare la
relazione I/V delle correnti che attraversano la membrana. Esiste inoltre un accorgimento
elettronico che consente di rendere Vm molto simile a Vclamp, anche se I x Rpipetta non è
trascurabile.
Le configurazioni del patch clamp.
Il patch clamp era stato disegnato al fine di consentire lo studio dei singoli canali ionici. Il suo nome
riflette questa idea di base: "patch" significa "piccola superficie" di membrana, contenente
possibilmente un unico canale ionico. Questo utilizzo del patch clamp è schematizzato nelle Figg.
13, 14 e 15.
Fig. 13. Configurazione cell-attache (sinistra). A destra, aperture e chiusure di un canale ionico. I
voltaggi a sinistra delle tracce indicano Vclamp. A +30 mV il canale è quasi sempre aperto.
Il vetro della pipetta tocca la membrana e la Rseal è bassa (circa 50 M . Si applica una leggera
suzione e la punta del microelettrodo, avendo una superficie liscia e pulita, interagisce con la
membrana, formando numerosi legami deboli. Si forma così il Giga-seal: la R elettrica tra l'interno
e l'esterno della pipetta (Rseal) è dell'ordine deli G (Fig. 14). Vclamp è applicato sul versante
extracellulare del patch di membrana delimitato dalla pipetta e la differenza di potenziale ai lati
della membrana è Vclamp - Vm.
Fig. 14. Viene indicara la
resistenza di seal (Rseal).
Vm
Questo approccio sperimentale ha poi fornito degli ulteriori sviluppi, che hanno costituito la
principale potenza innovativa della tecnica. Partendo dalla configurazione ora illustrata (detta cellattached) ed applicando una leggera suzione al microelettrodo, la membrana si deforma e si rompe,
fornendo la configurazione whole-cell (Fig. 15). L'whole-cell è equivalente al voltage-clamp con 2
microelettrodi e consente lo studio delle conduttanze di membrane in una grandissima varietà di
cellule, anche molto piccole. Di fatto, il patch clamp "ama" le cellule piccole, ed è poco adatto per
le cellule grandi: per gli oociti di Xenopus, infatti, viene utilizzato il voltage clamp con 2
microelettrodi.
Nella configurazione whole-cell i soluti della pipetta diffondono nella cellula, sostituendo il liquido
intracellulare fisiologico. Di questo si tiene conto utilizzando, per riempire la pipetta, la soluzione
più adatta agli scopi della sperimentazione. Di fatto la dialisi del liquido intracellulare è sia un
problema (attenzione: sto modificando il normale contenuto della cellula!) che un'opportunità
(attenzione: sono in grado di modificare con cognizione il normale contenuto della cellula!).
Il patch clamp consente altre due configurazioni, utilizzabili per lo studio dei singoli canali.
Dalla configurazione cell attached posso allontanare la pipetta dalla cellula; si forma una vescicola
che, se esposta brevemente all'aria, si rompe, lasciando il patch di membrana attaccato alla pipetta.
In questo caso la faccia citoplasmatica della membrana è rivolta all'esterno della pipetta
(configurazione inside-out) (Fig.15). Se si allontana la pipetta partendo dalla configurazione wholecell, il patch di membrana resta attaccato alla membrana con la superficie extracellulare rivolta
verso l'esterno (configurazione outside-out) (Fig.15). La configurazione outside-out facilita lo
studio, a livello di singolo canale, dell'attività di molecole extracellulari, quali gli agonisti che
causano l'apertura dei canali ionici, poichè queste possono con facilità essere disciolte nel liquido
che bagna la cellule. Analogamente, la configurazione inside-out consente lo studio, a livello di
singolo canale, dell'applicazione di molecole sulla superficie intracellulare della cellula.
Fig. 15. Sono illustrate le diverse configurazioni del patch clamp e le modalità per raggiungerle.
MISURA DELLA CONCENTRAZIONE INTRACELLULARE DI CA2+ IN VIVO
INTRODUZIONE
Per effettuare la misura della concentrazione intracellulare di Ca 2+ ([Ca2+]i) in cellule vitali vengono
utilizzati a) un microscopio a fluorescenza, una telecamera ad alta sensibilità, strumentazione elettronica di
controllo e misura, e b) molecole che, interagendo con il Ca2+, modificano le loro proprietà fluorescenti
(per esempio, aumentano l'emissione di luce fluorescente).
LA LUCE
La luce è una forma di energia avente sia le caratteristiche di un’onda elettromagnetica sia quelle di un
fenomeno discreto (il fotone). Una caratteristica della luce è la sua lunghezza d’onda : la luce visibile ha
una
variabile tra i 400 nm (violetto) ed i 650 nm (rosso), le
degli altri colori essendo comprese tra
questi 2 estremi (Fig. 3.1). L’ultravioletto e l’infrarosso hanno, rispettivamente, una
di circa 350 nm e di
750 nm. Minore è , maggiore è l’energia dell’onda.
Fig. 1.1. Lunghezza d’onda di varie forme di radiazioni elettromagnetiche. Sono indicati in
basso i colori associati all’intervallo 400 nm-700nm. Il blu ha intorno ai 450 nm, il verde 540 nm,
il rosso 650 nm.
IL FENOMENO DELLA FLUORESCENZA
Si parla di “emissione” quando da un corpo proviene un flusso di energia sotto forma di
suono od onde elettromagnetiche, oppure un flusso di materia sotto forma di elettroni o altre particelle.
Quando viene emessa luce, si parla di “luminescenza”. Se l’emissione cessa entro 10- 8 s dopo
l’eccitazione si parla di fluorescenza; se si mantiene per un tempo più lungo dopo il cessare
dell’eccitazione, anche per molti minuti, si parla di “fosforescenza”.
Quando gli atomi riemettono fotoni di energia inferiore a quella della radiazione
eccitante, la radiazione emessa è di lunghezza d’onda maggiore. È questa la fluorescenza propriamente
detta, ed il fenomeno per cui la radiazione riemessa abbia lunghezza d’onda maggiore di quella
d’eccitazione è decritto dalla “legge di Stokes”.
Osservando la fig. 1, se la molecola fluorescente viene eccitata nell'UV, emetterà luce nel blu e/o a
maggiore lunghezza d'onda (nel verde, per esempio). Se eccitiamo nel blu, emetterà luce nel verde e/o
a maggiore lunghezza d'onda.
IL MICROSCOPIO A FLUORESCENZA
In Fig. 2 è schematizzato il cammino ottico di un microscopio a fluorescenza (o epi-fluorescenza).
sensore
(occchio,
telecamera)
oculare
Filtro di
emissione
Lampada
al mercurio
Filtro di
eccitamento
specchio
dicroico
Collettore
obiettivo
Campione
Fig. 2. Descrizione schematica del sistema ottico di un microscopio a fluorescenza.
La lampada a mercurio emette luce negli UV, nel visibile e nell'infrarosso. Mediante il filtro di
eccitamento si seleziona la di eccitamento (per esempio, intorno a 380 nm, una luce UV) (Fig. 3). Lo
specchio dicroico riflette la luce di eccitamento, che viene concentrata dall'obiettivo sul campione. Se
esistono molecole fluorescenti eccitate dalla luce a 380 nm, queste emetteranno luce con maggiore,
per esempio maggiori di 500 nm ( verde e rosso). Lo specchio dicroico è costruito in modo tale che
riflette i 380 nm ma lascia passare le maggiori di 500 nm (Fig.3). Se di questa luce interessa
selezionare il verde (per esempio) ci sarà un filtro (detto di emissione) che selezionerà il verde. La luce
raggiungerà quindi il sensore.
Fig. 3. Curva di trasmissione di un filtro di eccitamento, con trasparenza massima intorno a 380 nm,
di un filtro dicroico (detto filtro di arresto) che riflette sotto i 450 nm ed è trasparente sopra i 500 nm
(è un filtro passa-alto). La luce fluorescente ha un'ampio spettro (dai 470 nm ai 650 nm). Un filtro di
emissione (non indicato in figura) selezionerà il colore desiderato.
LE MOLECOLE FLUORESCENTI UTILIZZATE PER VALUTARE LA [CA2+]I
Le molecole fluorescenti utilizzate per la misura della [Ca2+]i sono state sviluppate grazie a
Roger Y. Tsien, premio Nobel nel 2008 per la Chimica.
Roger Y. Tsien
Al fine di valutare la [Ca2+]i in cellule vitali, si utilizzano molecole che, legandosi al Ca 2+, modificano
le loro proprietà di fluorescenza (per esempio, aumenta la luce emessa nel verde). E' necessario che il
legame sia reversibile e che la molecola leghi specificamente lo ione interessato.
Se F è la molecola fluorescente, vi sarà il seguente equilibrio
F + Ca2+
F-Ca2+
La luce emessa sarà la somma della luce emessa da F (Fluce) e della luce emessa dal complesso F-Ca2+
(F-Ca2+luce).
Luce emessa = Fluce + F-Ca2+luce
All'aumentare della [Ca2+]i l'equilibrio si sposta verso destra: aumenterà F-Ca2+luce e diminuirà Fluce. Il
caso più semplice è che F non emetta luce: all'aumentare della [Ca2+]i aumenterà la luce che arriva al
sensore (Fig.4).
Un caso appena più complesso è quello in cui F è fluorescente ma F luce<F-Ca2+luce. All'aumentare della
[Ca2+]i diminuisce il numero di F ed aumenta in ugual misura quello di
F-Ca2+: anche in questo caso la luce emessa aumenterà.
Fig. 4. Spettri di emissione del FLUO-3 in funzione della [Ca2+]. La di eccitamento è 488 nm e di
emissione 530 nm. L'intensità della luce emessa aumenta con l'aumentare della [Ca2+]. In assenza di
Ca2+ la fluorescenza è praticamente nulla.
I FLUOROCROMI RAZIOMETRICI: IL FURA-2
Il Fura-2 è un fluorocromo ampiamente usato per la misura della [Ca2+]i. In figura 5 è riportata la
struttura del Fura-2, nella sua forma ionica, chelante il Ca2+ ed otticamente attivo, e nella forma
esterificata (FURA-2 AM).
Fura-2 AM
Non polare,
permeabile
Esterasi
Polare,
otticamente
attivo,
impermeabile
Figura 5. Struttura del Fura-2 e del fura-2 AM.
Il Fura-2 viene sequenzialmente eccitato con 2
nel verde (intorno a 510 nm).
(340 nm e 380 nm) e viene misurata la luce emessa
Il legame con il Fura-2 è reversibile, per cui vi sarà il seguente equilibrio
Fura + Ca2+
Fura-Ca2+
La luce emessa sarà la somma della luce emessa dal Fura-2 libero (Fluce) e della luce emessa dal
complesso Fura-Ca2+ (Fura-Ca2+luce). All'aumentare della [Ca2+]i l'equilibrio si sposta verso destra:
aumenterà Fura-Ca2+luce e diminuirà Furaluce.
Le proprietà del Fura-2 sono tali che il Fura (libero) emette più luce quando è eccitato a 380 nm,
rispetto a quando è eccitato a 340 nm:
Luce_Fura380>Luce_Fura340
mentre il complesso Fura-Ca2+ si comporta in modo opposto
Luce_Fura-Ca2+380< Luce_Fura-Ca2+340.
Intensità dell'eccitamento,
intensità dell'emissione
In figura 6 è riportata l'intensità della luce emessa a 510 nm in funzione della
[Ca2+].
di eccitamento e della
[Ca2+]i
Lunghezza d'onda
Fig. 6. Intensità dell'eccitamento (e quindi intensità della luce emessa) del Fura-2 in funzione della
di eccitamento e della [Ca2+].
All'aumentare della [Ca2+]i diminuisce il numero di molecole di Fura libero ed aumenta in ugual
misura quello di Fura-Ca2+: la luce emessa quando si eccita a 380 nm diminuisce e quella emessa
quando si eccita a 340 nm aumenta. Si calcola quindi il rapporto dell'intensità della luce emessa (nel
verde) eccitando a 340 (Luce_340) e 380 nm (Luce_380), ripettivamente
Luce_340/Luce_380
Se aumenta la [Ca2+]i aumenta il numeratore e diminuisce il denominatore ed il rapporto aumenta.
Il metodo raziometrico presenta il vantaggio di essere meno sensibile agli artefatti. Alcuni Autori
ritengono che, utilizzando un fluorocromo raziometrico quale il Fura-2, sia possibile calcolare le
effettive [Ca2+]i, ma la procedura proposta non sembra sufficientemente affidabile.
I FILTRI NECESSARI PER UTILIZZARE IL FURA-2
Trasmissione (%)
In Figura 7 sono riportate le caratteristiche (trasmissione percentuale della luce in funzione di ) dei
filtri utilizzati con il Fura-2
Lunghezza d'onda (nm)
Lunghezza d'onda (nm)
Fig. 7. Filtri per il Fura-2: percentuale della luce trasmessa dai filtri di eccitamento (viola=340 nm;
blu=380 nm), dallo specchio dicroico (verde) e dal filtro di emissione (rosso)a diverse lunghezza
d'onda.
A sinistra vediamo le caratteristiche del filtro di eccitamento a 340 nm(violetto) , che seleziona la
banda intorno a 340 nm, dello specchio dicroico(verde), che riflette sino a 410 nm, ed è trasparente
sopra i 420 nm (fino a 570 nm), e del filtro di emissione (rosso), che seleziona il verde. Nella figura di
destra è cambiato il filtro di eccitamento, che seleziona la banda intorno a 380 nm.
COME FAR ENTRARE LE MOLECOLE FLUORESCENTI NELLE CELLULE
Il metodo più semplice è illustrato in figura 8. Le cellule vengono incubate con una soluzione di Fura2 esterificato, quindi permeabile. L'estere viene idrolizzato dalle esterasi intracellulari, divenendo
polare, in grado di legare il Ca2+ ed otticamente attivo; inoltre, essendo polare, esce dalla cellula con
difficoltà.
Se il fluorocromo è disponibile solo in forma polare, può essere caricato tramite liposomi o mediante
una pipetta di patch.
Fura-2 in forma
estere
Caricament
o
Cellul
e
Esperimen
to
Tempo di attesa
per la
de-esterificazione
Fig. 8. Procedura di caricamento del Fura-2.
Lavaggi
o
SPECIFICITÀ ED AFFINITÀ DEL FLUOROCROMO
Nella tabella 1 sono riportati i fluorocromi utilizzati per valutare le concentrazioni di alcuni ioni, con
le rispettive di eccitamento e di emissione (la lista dei fluorocromi disponibili è in costante
aggiornamento).
Fluorocromi per la valutazione di alcuni ioni di interesse biologico
Ione
Colorante
di eccitazione (nm)
di emissione (nm)
----------------------
---------------------
1
Coloranti a
doppia eccitazione
Ca2+
H+ (pH)
Na+
K+
Mg2+
Coloranti a
Doppia emissione
Ca2+
H+
Na+
Coloranti a
singola
Ca2+
Cl-
2
380
380
425-450
490
560
560
380
380
380 510
1
Fura-2
Fura-5
Fura red
BCECF
SNARF-6
SNAFL-1
SBFI
PBFI
Mag-fura-2
340
340
480-500
440
500
500
340
340
340
Indo-1
SNAFL-1
SNARF-2
DCH
FCRYP-2
350
500
500
405
350
405
540
550
435
405
Fluo-3
Calcium green
Calcium orange
Calcium Crimsom
SPQ
505
505
550
590
350
530
530
530
610
440
Fluorescina
Rodamina
495
550
535
595
2
510
510
660
530
610
600
510
510
480
635
640
520
480
Tabella 1. Fluorocromi disponibili per valutare la concentrazione di alcuni ioni di interesse biologico.
Occorre considerare, oltre alla specificità, anche l'affinità del fluorocromo. Nella figura 9 è riportata la
curva di associazione del Fura-2 con il Ca2+. Si può osservare che ad una [Ca2+]i di 20 nM il Fura-2 è
tutto nello stato libero, mentre ad una [Ca2+]i di 2 M il Fura-2 è tutto nello stato legato. Ne risulta che
il Fura-2 è in grado di valutare variazioni della [Ca 2+]i entro questo ambito di concentrazioni. Sono
disponibili fluorocromi con minore affinità per il Ca2+, utilizzabili per valutare concentrazioni più
elevate (per esempio, il Mag-Fura).
100
%
Fig. 9. Curva di saturazione del
Fura-2 in funzione della
[Ca2+]i.
0%
Nella figura 10 è riportato uno schema di un sistema di imaging. I filtri di eccitamento sono
alloggiati in una ruota porta-filtri pilotata da un computer, che seleziona il filtro da utilizzare. Il
computer controlla anche la telecamera, acquisisce le immagini e ne esegue l'analisi, eventualmente on
line.
alla ruota
portafiltri
Computer
Immagini
Lampad
a
Filtri
eccit.
Campion
e
Telecamer
a
Filtro
emissione
Fig. 10. Schema funzionale di un sistema di imaging.
Specchio
dicroico
DA QUALE PORZIONE DELLA CELLULA PROVIENE IL SEGNALE
LUMINOSO?
Il sistema illustrato, che utilizza il FURA-2 ed un microscopio convenzionale, ha una
limitata capacità di localizzare, a livello intracellulare, la provenienza del segnale
fluorescente. Misure della [Ca2+]i possono però essere effettuate utilizzando la microscopia
confocale, che consente una localizzazione tridimensionale del segnale; è inoltre possibile
indirizzare i fluorocromi in specifiche parti della cellula, quali i mitocondri, il reticolo
endoplasmatico e la membrana plasmatica.
NOTE INTRODUTTIVE
Le malattie cardiovascolari rappresentano la principale causa di morte nell'UE e sono una delle
principali cause di infermità di lunga durata e di abbandono del mercato del lavoro: insieme alle
patologie tumorali e neurodegenerative, rappresentano infatti il più importante obiettivo della
ricerca biomedica. Di fatto, la patologia cardiaca origina in larghissima misura da disfunzioni
vasali, causa anche di ictus cerebrale. E' dunque il vaso sanguigno l'anello debole tra i vari organi e
sistemi che costituiscono il corpo umano.
I principali costituenti del vaso sanguigno sono le cellule endoteliali (CE) e le cellule muscolari
liscie (CML). La patologia aterosclerotica, la principale patologia vascolare, sembra aver inizio da
un danno endoteliale, al quale si accompagnano processi infiammatori che coinvolgono anche le
CML, che acquistano un fenotipo proliferativo. CE e CML hanno dunque un ruolo fisio-patologico
di eccezionale rilevanza.
Il grande sviluppo che sta attualmente vivendo la ricerca sulle cellule staminali coinvolge anche
le cellule precursori delle CE, dette EPC (endothelial precursor cell). Sono cellule circolanti,
mobilizzate dal midollo osseo, che favoriscono i processi di riparazione della parete vasale e di
angiogenesi. Potrebbero quindi essere utilizzate per la terapia cellulare dei tessuti ischemici e di
vaste lesioni della parete vascolare, quali originano dagli interventi di angioplastica. Le EPC, nel
favorire i processi di angiogenesi, sembrano svolgere un ruolo rilevante anche nei processi di
angiogenesi tumorale, limitando l'efficacia dei trattamenti farmacologici volti a limitare
l'angiogenesi pilotata dalle CE mature. Tanto gli studi rivolti a favorire la proliferazione delle EPC
da utilizzare per la terapia cellulare, quanto quelli rivolti ad inibire la funzione delle EPC, al fine di
limitare l'angiogenesi tumorale, sono un importante obiettivo della ricerca biomedica.
Nel corso di Fisiologia Cellulare e Molecolare vengono descritte le proprietà funzionali delle
EPC, delle CE e delle CML e vengono studiati in dettaglio i meccanismi di controllo del Ca 2+
intracellulare, un messaggero intracellulare universale che controlla i meccanismi proliferativi delle
CE e delle EPC. Vengono inoltre descritte le tecniche di misura dei flussi transmembranari di Ca 2+
e della concentrazione intracellulare di Ca2+. Queste metodologie, insieme a tecniche
microscopiche, biochimiche e di biologia molecolare, vengono utilizzate nell'attività di ricerca del
nostro laboratorio, volta ad individuare meccanismi di proliferazione Ca 2+-dipendenti nelle EPC e
nelle CE e ad individure possibili strategie in grado di modulare i processi proliferativi.
LA STRUTTURA E LA FUNZIONE DEI VASI
Allontanandoci dal cuore, troviamo differenti tipi di vasi, disposti in serie: le arterie, le arteriole, i
capillari, le venule e le vene. Questi vasi hanno diversa funzione ed una struttura adeguata alla loro
funzione: tutti hanno però un rivestimento della superficie interna (detta superficie luminale)
costituita da un monostrato di cellule endoteliali. Queste sono le uniche cellule che possono entrare
in contatto con il sangue senza attivare le piastrine ematiche e la coagulazione del sangue stesso.
La parete delle arterie e delle vene consiste di tre strati (Fig. 1):
- la tonaca intima è lo strato più interno della parete del vaso, ed è costituita principalmente da un
monostrato di cellule endoteliali
- la tonaca media è la parte centrale della parete vasale, nella quale sono presenti CML e fibre
elastiche e di collageno;
- la tonaca avventizia, lo strato più esterno, un compatto tessuto fibro-elastico che conferisce
resistenza meccanica al vaso e lo connette ai tessuti circostanti.
Fig. 1. Struttura delle arterie e delle vene.
Il sistema vasale è chiuso: i vasi si continuano sempre uno nell’altro, nè esistono fori macroscopici.
Lo scambio di molecole tra sangue e tessuti avviene principalmente a livello dei capillari.
LA CELLULA MUSCOLARE LISCIA
I tre tipi di fibre muscolari
Esistono tre tipi di cellule muscolari:
1) le cellule muscolari striate scheletriche, cellule giganti, lunghe anche qualche cm, con i
miofilamenti organizzati in sarcomeri
2) Le cellule muscolari striate cardiache, cellule di dimensioni "normali", con i miofilamenti
organizzati in sarcomeri
3) le CML, cellule di dimensioni "normali", con i miofilamenti non organizzati in sarcomeri
I due fenotipi di CML
La CML può assumere due fenotipi, uno avente funzione contrattile, l'altro con funzione sintetica
e proliferativa; sono differenti per morfologia, velocità di proliferazione e di migrazione e
caratterizzabili mediante alcune proteine marker, parzialmente specifiche per i due stati.
La funzione del fenotipo contrattile consiste nel controllare il diametro dei vasi, principalmente
delle arteriole e delle grosse vene. Il fenotipo sintetico consente adattamenti a lungo termine della
parete vasale, quali la modifica della matrice extracellulare e del numero di CML della parete, e
l'instaurarsi dei processi di riparazione e di angiogenesi. E' coinvolto nelle risposte infiammatorie,
ed in particolare nell'aterosclerosi, che si accompagna alla proliferazione ed alla migrazione
nell'intima delle CML. Nella parete vascolare, anche in condizioni fisiologiche, troviamo cellule
con fenotipo sia sintetico che contrattile, assieme a cellule con fenotipo intermedio.
IL FENOTIPO CONTRATTILE
Le CML differenziate in fenotipo contattile controllano la motilità di numerosi apparati, quali, per
esempio, nel tratto gastro-intestinale, nelle vie respiratorie e nelle pareti dei vasi sanguigni (con
l'esclusione dei capillari e delle venule). Nei vasi la muscolatura liscia è disposta ad anello intorno
al lume del vaso e ne controlla, in misura particolarmente rilevante nelle arteriole e nelle vene cave,
il calibro (Fig. 2, A). La costrizione arteriolare controlla il flusso sanguigno a valle dei tessuti, e la
costrizione delle vene cave ha un ruolo importante in caso di emorragia e di passaggio dalla
posizione orizzontale a quella eretta. Dal punto di vista fisiopatologico, un'eccessiva costrizione
arteriolare può essere causa di ipertensione. Nelle pareti di altri organi le CML hanno un
orientamento variabile, consentendo movimenti più complessi (Fig. 2 B). La contrazione delle
CML è completamente indipendente dalla volontà.
A
B
Fig.2.
La struttura delle CML
Le CML hanno una struttura fusiforme, con un diametro da 2 a 10
raggiungere i 400 ; il nucleo è in posizione centrale (Fig. 3).
ed una lunghezza che può
Fig. 3
In fig. 4 sono illustrate alcune strutture della CML.
Filamenti intermedi
Filamenti spessi
Filamenti sottili
Aree dense (adherens juntion)
Corpi densi
Caveole
Aree dense (adherens juntion)
Gap juntion
Reticolo
endoplasmatico
Fig. 4. Struttura schematica della cellula muscolare liscia.
In primo luogo troviamo i filamenti spessi di miosina interdigitati con i filamenti sottili di actina.
Questi si inseriscono nei corpi densi, una struttura con funzione analoga alle linee Z dei sarcomeri,
contenente infatti -actinina, una proteina presente nella linea Z dei sarcomeri. Corpi densi e
miofilamenti non costituiscono una struttura geometricamente ordinata come il sarcomero. I
filamenti di actina si inseriscono poi sulla membrana tramite le placche (od aree) dense, di fatto
adherens juntion. La membrana presenta caveole (Fig. 4, B), nelle cui vicinanze troviamo alcune
cisterne del reticolo endoplasmatico. Le CML delle pareti dei vasi sono connesse da gap junction,
che conferiscono parzialmente alle CML le proprietà di un sincizio funzionale (le gap junction sono
permeate da molecole sino ad 1 KD), e da adherens junction, che connettono le cellule tra di loro ed
al connettivo circostante, conferendo resistenza meccanica al tessuto.
I filamenti intermedi connettono i corpi densi e le aree dense, costituendo il citoscheletro delle
CML.
La contrazione delle CML
La contrazione delle CML viene evocata da un aumento della [Ca2+]i: tutti gli stimoli in grado di
aumentare la [Ca2+]i sono perciò in grado di far contrarre le CML. Di fatto, stimoli elettrici (la
depolarizzazione), meccanici, chimici (nervosi, endocrini o paracrini) possono aumentare la
[Ca2+]i. In fig. 5 sono riportati i meccanismi che modulano la [Ca2+]i.
Distensione
SOC, TRPC
Fig. 5
Le CML hanno canali al Ca2+(V), per cui tutti gli stimoli in grado di depolarizzare la cellula
attivano questi canali e causano indirettamente un aumento della [Ca 2+]i. Il Vm delle CML è
relativamente basso (-60 mV) e la depolarizzazione delle CML può generare un PdA portato dai
canali del Ca2+, un segnale abbastanza lento, della durata di circa 50 ms. Le CML sembrano poter
avere delle depolarizzazioni spontanee cicliche, su cui si innescano i PdA.
Numerose molecole extracelullari, quali l'ATP e la serotina possono aprire canali cationici
permeabili anche al Ca2+; in particolare, la distensione della fibra apre canali cationici (stretch
channel) permeabili al Na+ ed al K che depolarizzano la fibra; questi canali possono altresì essere
anche permeabili al Ca2+. Le CML posseggono poi i canali SOC, aperti dallo svuotamento degli
store, canali TRP. Numerose molecole, quali l'ATP, la serotonina e l'adrenalina, attivano la proteina
Gq, che porta alla produzione di IP3 e DAG. L'IP3 provoca la liberazione di Ca2+ dagli store ed il
DAG può interagire con recettori posti sulla faccia interna della membrana, aprendo canali cationici
(come è noto, lo svuotamento degli store apre i SOC). Anche l'AA agisce intracellularmente
aprendo canali cationici.Le CML possono poi avere canali al K+(Ca2+), cosicchè un aumento della
[Ca2+]i attiva questi canali, iperpolarizzando la cellula ed eventualmente chiudendo i canali al
Ca2+(V).
Il meccanismo della contrazione
La contrazione delle CML utilizza il processo di interdigitazione tra actina e miosina, ma esistono
importanti differenze con i meccanismi utilizzati dalle cellule muscolari scheletriche e cardiache.
La struttura della miosina è rappresentata in Fig. 6. Ciascuna molecola è formata da 2 sottounità
identiche, contenete 1 catena pesante e 2 catene leggere (differenti tra loro). Le catene pesanti
contengono un lungo dominio ad elica (1500 aminoacidi) ed una porzione globulare terminale (800
amino acidi), alla quale sono associate le 2 catene leggere. I due domini ad -elica sono intrecciati,
dando origine ad una superelica rigida . Una delle due catene leggere, denominata in figura 6 LC 20,
contiene un sito di fosforilazione.
La miosina presenta alcune zone sensibili al trattamento proteolitico. Un sito è sensibile alla
digestione proteolitica con tripsina, che la spezza in 2 porzioni, la meromiosina pesante (HMM),
contenente la parte globulare, e la meromiosina leggera (LMM), formata da parte della superelica.
La sensibità alla tripsina sembra riflettere una locale interruzione della rigidità della superelica.
Questa zona costituisce una prima "cerniera" (hinge region) che consente la flessione della miosina
richiesta dal meccanismo di contrazione muscolare. Un secondo punto, vicino alla parte globulare, è
sensibile alla papaina (head-tail junction). Questo sarebbe la seconda "cerniera" coinvolta
nell'interazione actina-miosina.
Fig. 6.
Il filamento sottile (F-actina) è costituito da due filamenti di actina globulare (G-actina)
polimerizzata, avvolti tra di loro a formare un'elica, e dalla tropomiosina, inserita nell'incavatura
dell'elica, che maschera i siti di legame tra actina e miosina. Nelle CML non troviamo la troponina,
ma il caldesmone, che potrebbe sostituirla funzionalmente.
L'aumento della [Ca2+]i aumenta la concentrazione del complesso Ca2+-Cal (Fig. 7A). Questo attiva
la contrazione della CML con due meccanismi:
1) attiva la kinasi della catena leggera della miosina (MLCK), che fosforila le due catene leggere
della miosina, dando inizio alla contrazione;
2) lega il caldesmone, che si stacca dall'actina, forse smascherando i siti di legame con la miosina;
come già riportato, la funzione del caldesmone è incerta..
L'interazione actina-miosina procede secondo il ciclo già descritto per le cellule muscolari striate.
La contrazione della CML è inibita dalla fosfatasi della MLC (MLCP): di fatto, vi è un equilibrio
tra l'attività della MLCK e della MLCP; se aumenta la [Ca 2+]i prevale l'attività chinasica e la CML
si contrae; per concentrazioni basali di Ca2+ prevale l'attività fosfatasica, e la CML è rilasciata.
La velocità di contrazione è decisamente minore rispetto alle cellule muscolari striate. Inoltre, la
CML sembra essere in grado di sviluppare forza anche entrando in uno stato nel quale viene
prolungato il tempo per il quale la testa di miosina resta attaccata all'actina (stato "latch",
catenaccio). Questa duratura interazione tra actina e testa della miosina sembra intervenire se la
MLC della miosina viene defosforilata quando la testa della miosina è attaccata all'actina:
potremmo considerare questo stato come una contrazione isometrica a basso consumo di ATP
(Fig.7B).
Latch
A
Fig. 7.
B
L'azione della proteina RhoA
Un importante meccanismo di modulazione della contrazione della CML è operato dalla proteina
RhoA (Fig. 8). Questa è una small GTP-binding protein, che risiede nel citoplasma, legata al GDP
ed ad una proteina che inibisce la dissociazione del GDP (RhoGDI, cioè Rho GDP dissociation
inhibitor). Gli agonisti che attivano la contrazione della CML tramite la proteina Gq, che attiva la
via della PLC, possonono attivare anche una proteina G12/13 che attiva il Rho GEF (GTP Exchange
Factor della proteina Rho). Il GEF innesca lo scambio GDP/GTP; la RhoA-GTP trasloca quindi
sulla membrana ed attiva la Rho-dependent chinasi (ROK). Pone termine all'attività chinasica la
Rho GAP (Rho GTPase activating protein) che favorisce la scissionte del GTP a GDP+Pi.
Fig. 8.
Come già riportato, gli agonisti che attivano la contrazione della CML tramite la proteina Gq, che
attiva la via della PLC, possonono attivare anche una proteina G 12/13 che attiva il Rho GEF (Fig. 9).
La Rho chinasi favorisce lo stato contrattile con 3 meccanismi:
1) fosforila la MLCP (fosfatasi della MLC), inibendola;
2) fosforila la MLC, potenziando la contrazione della CML
3) fosforila il CPI-17, che fosforila la Myosin Binding Subunit (MBS) della fosfatasi della MLC (in
figura 8 denominata MP). Questa fosforilazione inibisce la MLCP.
In fig. 8 viene anche riportato un inibitore farmacologico della Rho chinasi, l'Y27632.
Fig. 8.
Cenni di farmacologia della CML
- Recettori adrenergici
I recettori adrenergici sono operati dall'adrenalina e dalla noradrenalina. I recettori 1 attivano la
PLC ed i recettori 2 inibiscono l'adenilato ciclasi. Tanto gli 1 che gli 2 favoriscono la
contrazione della CML. I recettori adrenergici attivano l'adenilato ciclasi ed inducono il
rilasciamento della CML (si ricordi che la PKA tende a diminuire l'affinità della MLCK per la
Calmodulina). I recettori 1 ed 2 sono classicamente attivati dalla noradrenalina, che ha un netto
effetto vasocostrittore. L'adrenalina, a basse concentrazioni, attiva i recettori adrenergici,
producendo vasodilatazione, ma ad alte concentrazioni attiva i recettori , e l'effetto vasocostrittore
prevale. Entrambe le catecolamine aumentano l'attività cardiaca.
- Recettori per i nucleotidi/nucleosidi
I recettori per l'adenosina sono di diversi tipi e possono aumentare o diminuire l'attività
dell'adenilato ciclasi o attivare la proteina Gq e quindi la PLC. Nel circolo coronarico attivano la
Gs, con conseguente vasodilatazione.
I recettori per l'ATP e la serotonina costituiscono una complessa famiglia. Interagendo con le
CML, ne attivano la contrazione.
- Recettori colinergici
L'acetilcolina può attivare 1) dei recettori-canale (i recettori nicotinici), o 2) dei recettori
muscarinici, attivando, a seconda del tipo di recettore, la Gi o la Gq. Nelle CML attiva la Gq,
innescando la contrazione.
Si ricordi che l'ATP e l'Ach, nel vaso integro, attivano la produzione endoteliale di NO, la cui
azione vasodilatatrice prevale sull'effetto vasocostrittore diretto. Di fatto, la scoperta che l'Ach ha
effetto vasodilatatore nel vaso integro e vasocostrittore nel vaso privo di endotelio ha portato alla
scoperta dell'NO.
LA CELLULA MUSCOLARE LISCIA: IL FENOTIPO SINTETICO
I due fenotipi di cellula muscolare liscia
Come già sottolineato, la cellula muscolare liscia (CML) può assumere due fenotipi, uno avente
funzione contrattile, l'altro con funzione sintetica e proliferativa. Il fenotipo sintetico consente
adattamenti a lungo termine della parete vasale, quali la modifica della matrice extracellulare e del
numero di CML della parete, e l'instaurarsi dei processi di riparazione e di angiogenesi. E' coinvolto
nelle risposte infiammatorie ed in particolare nell'aterosclerosi, nella quale si osserva la
proliferazione e la migrazione nell'intima delle CML.
Morfologia e struttura del fenotipo sintetico
Il fenotipo sintetico ha una forma cuboide, e presenta un alto numero di organelli coinvolti nella
sintesi di proteine, mentre i filamenti contrattili, i corpi densi e le placche dense sono presenti in
misura limitata (Fig. 1).
Sintetico
Contrattile
Fig. 1. Caratterestiche strutturali dei fenotipi sintetico e contrattile.
Proteine marker dei due fenotipi
Nella tabella 1 sono riportate alcune proteine espresse in modo differenziale nei due fenotipi.
Tab. 1. Espressione differenziale di alcune proteine nel fenotipo contrattile e sintetico; c =
contrattile; s = sintetico.
Le proteine che meglio differenziano i due fenotipi sono H-caldesmon e Smoothelin, presenti
unicamente nel fenotipo contrattile, e CRBP-1 e Smemb, espresse in misura assai rilevante nel
fenotipo sintetico. Anche la figura 2 illustra l'espressione differenziale di alcuni geni nei due
fenotipi.
Fig. 2. Livelli di espressione di alcuni geni nei due fenotipi. Alcune delle proteine indicate
non sono specifiche delle CML.
Fenotipi presenti nella parete vascolare.
Di fatto, le CML non presentano unicamente i due fenotipi sintetici e contrattili, ma anche fenotipi
con caratteristiche intermedie tra questi due estremi.Dopo digestine enzimatica della parete vasale,
le singole CML esprimono quantità variabili di proteine marker, incluse le connessine e le caderine
(Fig. 3). Si possono riconoscere 5 sottotipi, ciascuno con un suo insieme di proteine marker, le cui
caratteristiche vanno da un fenotipo completamente contrattile (f), a fenotipi sintetici (b ed e), e a
fenotipi intermedi (a e d).
Fig. 3. Caratterizzazione
fenotipica di CML isolate dalla
parete vasale.
Programmazione genetica versus fattori esterni
Tanto i fattori genetici quanto gli stimoli ambientali concorrono a determinare il fenotipo delle
CML. L'esistenza di CML con differenti spettri fenotipici, quali quelli esemplificati in figura 3, è
stata evidenziata nel bue, nel ratto, nel maiale e nell'uomo. Queste differene fenotipiche si
mantengono in coltura, suggerendo che siano geneticamente dipendenti. D'altra parte, specifici
stimoli, come la concentrazione di siero, possono influenzare il fenotipo delle cellule in coltura,
suggerendo che il fenotipo è controllato anche dagli stimoli ambientali. L'importanza relativa dei
due meccanismi è difficile da valutare. La programmazione epigenetica potrebbe definire gli
estremi della variazione fenotipica che un gruppo di cellule può raggiungere; all'interno di questi
limiti, le variazioni del fenotipo dipenderebbero dagli stimoli ambientali.
Fattori esterni influenzanti il fenotipo.
Biomolecole e stimoli meccanici influenzano, in modo complesso, il fenotipo delle CML (Fig. 4).
L'eparina, il collagene ed il TGF favoriscono il fenotipo contrattile. Anche l'acido retinoico
favorisce la differenziazione verso il fenotipo contrattile, ma applicato a cellule adulte può
promuovere entrambi i fenotipi; un effetto analogo è riportato per il PDGF.
Le CML sono poi sottoposte a stimoli meccanici: la distensione prodotta dalla pressione sanguigna
e, indirettamente, lo shear stress, che agisce sull'endotelio inducendo la produzione di NO. I dati
disponibili suggeriscono che stimoli meccanici di intensità fisiologica promuovono il fenotipo
contrattili, mentre stimoli con intensità maggiore o minore favoriscono il fenotipo sintetico.
Fig. 4. Alcuni fattori in grado di modulare il fenotipo delle CML (vedi testo).
L'ENDOTELIO VASCOLARE
Struttura dell’endotelio vascolare
L’endotelio (E) ha le caratteristiche morfologiche di un epitelio pavimentoso semplice e ricopre
la superficie interna dell’intero albero vascolare e delle cavità cardiache, dove prende il nome di
endocardio. Ha un’estesissima superficie (600 m2) e un peso di 1,5 Kg, un valore comparabile a
quelli di altri organi vitali dell’organismo (l’endotelio può essere considerato un organo diffuso). E’
in contatto con due differenti ambienti: la superficie luminale è direttamente esposta ai costituenti
ematici e alle cellule circolanti, mentre la superficie abluminale è separata dai tessuti da una
membrana basale glicoproteica, la matrice sotto-endoteliale, prodotta dalle stesse cellule endoteliali.
Le cellule endoteliali (CE) sono molto sottili (hanno uno spessore inferiore ad 1 , con
l’eccezione della zona nucleare, più spessa) e allungate in direzione del flusso sanguigno, in
particolare nelle arterie, mentre nelle vene possono avere forma poligonale e spessore maggiore.
Contengono numerose vescicole pinocitotiche, per il trasporto di sostanze attraverso la parete
vasale, e i caratteristici granuli di Weibel-Palade, contenenti alcune molecole vaso-attive. In
coltura le CE hanno forma poligonale ma, sottoposte ad un flusso di liquido extracellulare, si
orientano in direzione del flusso.
Fig. 1.
Le CE sono connesse da adherens juntion e da gap juntion. Nel SNC le CE dei capillari sono
connesse anche da tight junction, che impediscono il passaggio paracellulare delle molecole.
La superficie luminale è coperta dal glicocalice, un intreccio di proteoglicani e glicoproteine
ancorati alla membrana endoteliale, nel quale sono contenute molecole solubile sia plasmatiche che
prodotte dall'endotelio (Fig. 2). E' carico negativamente, ed ha così la tendenza a respingere le
cellule, e può limitare l'accesso delle macromolecole alla superficie endoteliale.
La rimozione del glicocalice favorisce l'interazione dei globuli rossi, delle piastrine e dei
neutrofili con l'endotelio, ed inibisce la produzione di NO operata dallo sheer-stress plasmatico. Il
glicocalice ha quindi un rilevante ruolo nella funzione endoteliale.
-
Fig. 2.
La funzione di barriera
L'endotelio separa il sangue dai tessuti circostanti e forma una barriera semi-permeabile che
controlla il passaggio di molecole tra i due distretti. Il passaggio di molecole può avvenire per via
paracellulare o per via transcellulare; per via paracellulare le molecole passano tra cellule contigue,
pilotate da forze passive, ed è controllato dalle giunzioni, adherens junction (AJ) e tight junctions
(TJ) che connettono le cellule endoteliali (CE). Nella via transcellulare devono attraversare la
membrana luminale ed abluminale della cellula ed intervengono meccanismi attivi, quali la
transcitosi ed i meccanismi di trasporto già incontrati nel rene e nell'intestino, quali l'asimmetrica
distribuzione della pompa Na+/K+, e del cotrasporto glucoso(aminoacidi e trasporto facilitato di
glucoso. In relazione alle caratteristiche di permeabilità, l'endotelio può essere distinto in
- endotelio continuo
- endotelio fenestrato e formante sinusoii
- endotelio della barriera emato-encefalica
L'endotelio continuo
L'endotelio continuo, presente nel circolo polmonare, coronarico, scheletrico e splancnico,
consente il passaggio paracellulare di molecole fino a 3 nm di raggio, cosicchè possono passare
acqua, ioni fisiologici, gli esosi, gli amminoacidi e l'urea (le proteine devono usare la via
transcellulare). Le CE sono connesse da AJ e TJ, quest'ultime preferenzialmente distribuite presso
la superficie apicale delle CE. La AJ mantengono l'integrità strutturale dell'endotelio (funzione
meccanica) e ne modulano la permeabilità paracellulare (funzione di barriera al passaggio per
diffusione), mentre le TJ hanno una funzione molto rilevante solo nei capillari del SNC, dove
costituiscono la base strutturale della barriera emato encefalica.
La struttura delle AJ è mostrata in Fig. 3.
-catenina Cterminale
VE-cadherin
Fig. 3.
L'adesione tra CE è assicurata da un'interazione Ca2+-dipente tra molecole di VE-caderina
(vascular-endothelium caderina) inserite nella membrana di CE adiacenti. L'estremità
citoplasmatica C-terminale dell VE-caderina interagisce, tramite proteine intermedie , con l'Factina intracellulare. L'espressione di VE-caderina è specifica ed esclusiva dell'endotelio. Processi
patologici quali l'infiammazione e la tumorigenesi sono associati con l'attivazione di mediatori e
citochine che inducono un prolungato aumento della permeabilità paracelluare.
Meccanismi che inducono un aumento della permeabilità paracellulare
La permeabilità paracellulare può aumentare o diminuire, a seconda del tipo di stimolo. La VEcaderina e la -catenina sono soggette a processi di fosforilazione-defosforilazione, che controllano
la stabilità della giunzione e quindi la permeabilità. Un aumento della permeabilità paracellulare
può avvenire anche per attivazione dell'apparato contrattile acto-miosinico, accompagnato dalla
riorganizzazione del citoscheletro, che generano una forza che tende ad allontanare le cellule
adiacenti. L'effetto può essere transiente, come nel caso di mediatori pro-inflammatori (istamina,
trombina) o prolungato, se operata da citochine o dal VEGF.
Il FGF ha un ruolo rilevante nel mantenere la stabilità della barriera endoteliale. Legandosi al suo
recettore, una tirosina kinasi, stabilizza la VE-caderina.
I principali segnali intracellulari reclutati nei processi di modulazione della permeabilità cellulare
sono attivati da c-Src e dal Ca2+.
La permeabilità transcellulare
Nell'epitelio continuo la permeabiltà transcellulare consente il passaggio selettivo di molecole di
piccole dimensioni (ioni, aminoacidi, glucoso) e di macromolecole. I meccanismi responsabili del
passaggio di piccole molecole sono già stati oggetto di trattazione in altri corsi. Qui esamineremo
brevemente il trasportoattraverso l'endotelio dell'albumina, e di molecole legate all'albumina, quali i
lipidi, l'insulina e gli ormoni. E' questo un trasporto mediato dall'interzione delle molecole con
recettori presenti nelle caveole, che effettueranno la transcitosi.
Le caveole sono invaginazioni della membrana a forma di fiasco, prive di clatrina, costituenti circa
il 20% del volume endoteliale. Le caveole originano dall'unione di microdomini di membrana,
ricchi di colesterolo e di sfingolipidi, con la caveolina-1.
La transcitosi è costituita da una serie di eventi (Fig. 4) che iniziano con l'interazione dell'albumina
con il suo recettore, la ABP (albumin binding protein, o gp60) . Il legame albumina-ABP induce la
clusterizzazione dei complessi Albumina-gp60, e la sua interazione con la caveolina; questa può ora
attivare un proteina G, di tipo inibitorio (Gi) , che attiva c-SRC (una tirosina chinasi non
recettoriale). Viene fosforilata sia la caveolina-1 che la dinamina, che forma un collare che chiude
la vescicola, consentendo il successivo distacco della vescicola dalla membrana, detto scissione.
dynamin
Fig. 4. Endocitosi di una caveola deputata al trasporto di albumina.
La vescicola viene quindi trasportata alla faccia abluminale, dove avviene l'esocitosi tramite il
complesso t-SNARE (sintaxina e SNAP-23/25).
Il trasporto di albumina è esclusivo delle caveole, così come il cotrasporto dell'albumina con
colesterolo, ormoni e acidi grassi. E' ovviamente coinvolta anche nel controllare lo scambio di
acqua dovuto alle "forze" oncotiche. La transcitosi è attiva in condizioni basali e può essere
aumentata stimolando l'incorporazione di gp60.
Endotelio fenestrato e sinusoidi.
I capillari fenestrati presentano nella loro parete dei pori o fenestrae, forniti di diaframma, che
permettono a molecole delle dimensioni di peptidi e proteine di entrare ed uscire dal circolo. Questi
tipi di capillari consentono scambi molto rapidi di fluidi e soluti. Sono fenestrati i capillari di vari
ghiandole endocrine come l’ipotalamo, l’ipofisi, l’epifisi, i surreni e la tiroide.
I capillari dei sinusoidi hanno pori più grandi e membrana basale più sottile. I sinusoidi seguono i
contorni interni delle tessuto ed hanno forma irregolare, non cilindrica. Permettono uno scambio
esteso di fluidi e soluti fra il sangue e il liquido interstiziale. Il sangue si muove poi piuttosto
lentamente, aumentando il tempo a disposizione per lo scambio di molecole. I sinusoidi si trovano
nel fegato, nel midollo osseo e nei surreni.
La barriera emato-encefalica
La barriera emato-encefalica (BEE) è una unità anatomo-funzionale realizzata dalle particolari
caratteristiche delle cellule endoteliali che compongono i vasi del SNC e ha principalmente la
funzione di controllare strettamente la composizione del liquido extracellulare, pur permettendo il
passaggio di sostanze necessarie alle funzioni metaboliche. Protegge poi il tessuto cerebrale da dalle
infezioni batteriche e da alcune tossine, come la tossina botulinica.
È composta da un endotelio continuo le cellule endoteliali sono poi unite da tight junction. Un
ulteriore fattore che contribuisce alla formazione di questa unità anatomo-funzionale è costituito
dalle proiezioni delle cellule astrocitarie, chiamati peduncoli astrocitari che circondano le cellule
endoteliali, formando un'ulteriore "barriera". Questa organizzazione strutturale limita fortemente il
passaggio paracellulare di tutte le molecole idrofile o di grosso peso molecolare. Tramite la via
transcellulare passano invece sostanze lipofile come l’ossigeno, l'anidride carbonica, l’etanolo e gli
ormoni steroidi, e quelle che possono entrare per mezzo di specifici mezzi di trasporto (pompe,
scambiatori, trasporto facilitato, transcitosi). Anche la migrazione dei globuli bianchi sembra possa
avvenire per via transcellulare.
La BEE protegge il SNC ma limita l'ingresso dei farmaci, rendendo complesso il problema di
somministrare farmaci diretti al SNC.
Le Gap Junction
Le CE sono connesse da gap junction (GJ), o giunzioni comunicanti. Queste sono canali a bassa
resistenza, che connettono il citoplasma di due cellule, consentendo il passaggio di ioni (per es., Na
+
, K+, Ca2+, H+) e metaboliti a basso peso molecolare (come i nucleotidi ciclici e l'inositolo 1,4,5trifosfato) tra cellule vicine. Un segnale può quindi passare da una cellula a quella successiva,
viaggiando per diffusione e/o differenza di potenziale senza essere esposto al medium extracellulare
Le GJ sono formate da un insieme di canali presenti sulla superficie di contatto di due cellule (Fig.
5). Questi canali sono costituiti dall’unione di due emicanali, chiamati connessoni, inseriti sulle due
membrane plasmatiche delle cellule adiacenti. Ogni connessone è formato dall’assemblaggio di sei
subunità proteiche, chiamate connessine.
Fig. 5. Struttura delle gap junction.
GJ composte da connessine di differenti tipi mostrano diversa selettività e permeabilità ai secondi
messaggeri, quali l’inositolo 1,4,5-trifosfato e i nucleotidi ciclici. Differenze nella selettività,
permeabilità e conduttanza delle GJ possono giocare un ruolo importante nella funzione di un
tessuto, giustificando funzionalmente la presenza di un’ampia varietà di geni Cx e la loro
differenziale distribuzione nei tessuti.
La permeabilità delle Gj è regolata dal PH citosolico e dalla [Ca 2+]: un pH acido ed alte [Ca2+]
causano la chiusura delle GJ. E' ovvio come la chiusura delle GJ sia necessaria per isolare le cellule
danneggiate dalle cellule vicine sane.
E’ possibile che la comunicazione tramite GJ non sia richiesta per la sopravvivenza a breve termine
della cellula ma l’assenza a lungo termine delle GJ è letale per il tessuto.
La matrice extracellulare
L’endotelio è in grado di sintetizzare e di organizzare la sua matrice extracellulare, una struttura
molto complessa, formata da una rete di diverse proteine ad alto peso molecolare (come
fibronettina, laminina, collagene, trombospondina, fattore von Willebrand) e di glicosaminoglicani
(come eparan-solfato e dermatan-solfato). La matrice extracellulare 1) è necessaria dal punto di
vista meccanico, come base di aggancio delle cellule endoteliali alla parete vascolare e, nel caso dei
capillari, come aggancio al connettivo circostante, ma 2) influenza anche le attività funzionali delle
CE. Nella matrice extracellulare sono infatti immagazzinati fattori di crescita (come il FGF ed il
PDGF), ed i componenti della matrice sono in grado di generare segnali intracellulari cruciali per la
funzione endoteliale, prevalentemente tramite l'interazione tra molecole della matrice e le integrine
presenti sulle cellule endoteliali. Di fatto, l'interazione dell’endotelio con la matrice extracellulare
gioca un ruolo fondamentale nel mantenimento dell’integrità vascolare e nella formazione di nuovi
vasi.
Attività antitrombotica ed anticoagulante
In condizioni fisiologiche, l'endotelio ha un’attività antitrombotica, poichè inibisce l'attivazione
delle piastrine e la coagulazione, attivando di converso la fibrinolisi. Tuttavia, in condizioni patologiche
(in particolare in risposta all'endotossina batterica ed alle citochine infiammatorie), l'endotelio può
esercitare un'attività di tipo protrombotico.
I meccanismi antitrombotici includono
1) la presenza del glicocalice dell'endotelio, una superficie antitrombotica,
2) la produzione di NO e prostaciclina, due antiaggreganti piastrinici,
3) la degradazione, tramite ectonucleotidasi presenti sulla membrana dell'endotelio, dell'ADP, un
potente aggregante piastrinico, ad AMP e P,
4) l'attivazione della fibrinolisi; l'endotelio produce infatti due molecole, il tissue-type Plasminogen
Activator (t-PA) e l'urokinase-type Plasminogen Activator (u-PA), che catalizzano la conversione del
plasminogeno in plasmina.
L'endotelio inibisce la coagulazione del sangue con meccanismi plurimi:
1) produce il Tissue Factor protein inhibitor (TFPI);
2) esprime la trombomodulina, un recettore per la trombina. Il legame trombomodulinatrombina fa sì che la trombina, da procoagulante, acquisti un'attività anticoagulante.
3) lega ed attiva, tramite l'eparan-sulfato, l'antitrombina, che inibisce l'attività della trombina
e del fattore Xa.
Attività protrombotica
Le cellule endoteliali possono produrre
1) un fosfofolipide ad attività proaggregante denominato platelet activating factor (PAF);
2) il fattore von Willebrand, presente anche nella matrice extracellulare
3) Il TF, assente in condizioni fisiologiche.
4) il Plasminogen Activator Inhibitor-1 (PAI-1 ), il principale inibitore dei due attivatori del sistema
del plasminogeno.
L'ENDOTELIO VASCOLARE
LA FUNZIONE SECERNENTE DELL'ENDOTELIO VASCOLARE
La prostaciclina
La prostaciclina (PGI2), una prostaglandina altamente instabile, viene prodotta preferenzialmente,
ma non esclusivamente, dalle cellule endoteliali (CE). La sua sintesi origina dalla liberazione di
acido arachidonico dai fosfolipidi di membrana e dalla sua successiva conversione da parte
dell’enzima ciclossigenasi COX-1. Oltre ad essere un potente vasodilatatore, è anche in grado di
inibire l’aggregazione piastrinica.
L’azione della PGI2 è mediata da un recettore specifico, la cui attivazione porta alla stimolazione
dell’adenilato ciclasi con conseguente aumento della concentrazione intracellulare di cAMP. Essa è
rilasciata dalle cellule endoteliali in risposta alle forza di taglio, all’ipossia e ad altre sostanze che
stimolano anche la produzione di NO. In caso di lesione vascolare, l’azione della prostaciclina è
contrastata prodotta dalle cellule endoteliali ed idal trombossano A2, prodotto dalle piastrine, e
derivante dall’azione sull’acido arachidonicoa partire da un precursore comune, l’acido
arachidonico, lungo la via della cicloossigenasi. E’ rilasciata dalle cellule endoteliali in risposta allo
“shear stress”, all’ipossia e ad altre sostanze che stimolano anche la produzione di NO. della COX-2.
Il trombossano A2 promuove l’aggregazione piastrinica e la vasocostrizione, mentre la prostaciclina
inibisce l’aggregazione piastrinica e favorisce la vasodilatazione. L’interazione fra il trombossano
A2 piastrinico e la prostaciclina e l'NO endoteliale fa sì che prevalga l’aggregazione piastrinica nella
zona lesa, dove l'endotelio è danneggiato, e la conseguente formazione del coagulo, mentre previene
l’eccessiva estensione del coagulo nella zona dove l'endotelio è integro (Fig. 1).
A
B
B
Fig. 1. In A prevale l'azione del trombossano,
in B prevale l'azione della PGI2 e dell'NO (vedi
testo).
L'EDHF
Non tutta la vasodilatazione endotelio-dipendente sembra provocata dall’azione dell’NO e dalla
PGI2. Questa vasodilatazione è dovuta all'EDHF (endothelial derived hyperpolalarization factor),
che sembra possa essere un metabolita dell’acido arachidonico sintetizzato dall’enzima
mitocondriale citocromo P450 mono-ossigenasi. L'EDHF causa iperpolarizzazione endoteliale
tramite l’apertura di canali al K+; questa iperpolarizzazione si propaga, tramite gap junction, alla
muscolatura liscia, che si rilascia. Il rilascio di EDHF viene modulato non solo da agonisti
vasoattivi, ma anche dalla distensione della parete vasale.
La Bradichinina
La bradichinina, un nonapeptide, è un potente vasodilatatore prodotto dalle CE. E' presente nel
corso dell'infiammazione; si lega ai recettori B2 delle cellule endoteliali ed attiva la produzione di
NO (vedi più avanti).
L'ACE
L’enzima di conversione dell’angiotensina I (ACE) è un ecto-enzima presente sulla superficie
dell’endotelio polmonare. La renina prodotta dal rene scinde l'angiotensigeno presente nel plasma in
angiotensina I. L'ACE converte l’angiotensina I in angiotensina II, un potente vasocostrittore.
L’angiotensina II stimola anche la produzione di Aldosterone.
Le Endoteline
Le endoteline sono una famiglia di potenti peptidi ipertensivi, con azione prolungata nel tempo.
Esistono tre isoforme di endotelina: ET-1, ET-2, ET-3, ma le CE producono essenzialmente l’ET-1.
La sintesi di endotelina da parte delle cellule endoteliali è regolato largamente da uno step
trascrizionale, e viene secreta immediatamente. L’espressione genica dell’endotelina uno è
stimolata da numerosi fattori : la trombina, l’angiotensina II, la vasopressina, l’epinefrina,
fattori di crescita e citochine
Esistono poi due tipi di recettori per le endoteline: ET A ed ETB. Entrambi sono accoppiati a
proteine G trimeriche che attivano la fosfolipasi C. Agiscono aumentando la [Ca 2+]i nelle
cellule muscolari lisce, grazie al rilascio di Ca2+ dagli stores intracellulari e all’ingresso di tale
ione dall’esterno attraverso canali di membrana. L’ET-1, a basse concentrazioni, causa
vasodilatazione. Nelle CE, infatti, l’attivazione autocrina dei recettori ET B da parte della ET1 favorisce la sintesi e il rilascio di NO.
L'acido sulfidrico (H2S)
L'endotelio è in grado di produrre l’acido sulfidrico (H 2S), l’ultimo arrivato all’interno della
famiglia dei cosiddetti gasotrasmettitori, insieme al monossido di azoto ed al monossido di
carbonio. Inizialmente etichettato come inquinante ambientale e potenzialmente tossico, l’H2S è ora
conosciuto per la sua capacità di regolare diverse funzioni del sistema cardiovascolare. L’H 2S viene
sintetizzato a partire dalla L-cisteina. Può indurre vasodilatazione, principalmente grazie
all’apertura di canali al potassio attivati dall’ATP (KATP) nelle fibre muscolari lisce, che
iperpolarizzano le cellule e quindi chiuduno i canalii al Ca2+(V). L’H2S può fungere anche da antiinfiammatorio, grazie alla sua capacità di inibire l’adesione dei leucociti all’endotelio vascolare, ed
è un potente stimolatore dell’angiogenesi. l'H2S può reclutare la vie della PI3K/Akt, delle MAP
chinasi ed aumentare la [Ca2+]i.
Il monossido di Azoto
Il monossido di Azoto (NO), impropriamente chiamato ossido nitrico, è stato considerato per
decenni unicamente un gas altamente inquinante – responsabile, tra l’altro, del cosiddetto “buco
dell’ozono”. Sorprendentemente, è anche un universale messaggero biologico, alla cui scoperta è
legato il premio Nobel 1998 per la Medicina e la Fisiologia.
L'NO è un radicale libero, che attraversa facilmente la membrana plasmatica, con azione
potenzialmente tossica ed emivita di circa 3-5 secondi. L’NO è sintetizzato non solo dalle cellule
endoteliali, ma anche da molti altri tipi cellulari, quali le cellule muscolari liscie, le piastrine, i
leucociti, i neuroni. L’NO viene prodotto da tre isoenzimi, la NO sintasi (NOS) endoteliale
(eNOS), presente anche nei cardiociti, la NOS neuronale (nNOS) e la NOS inducibile (iNOS) ).
Una NOS è detta costitutiva quando è presente nelle cellule in condizioni normali, per cui la
produzione di NO dipende dai meccanismi che attivano la NOS (i livelli di espressione della NOS
costitutiva sono però soggetti a modulazione). La NOS costitutiva viene classicamente attivata dal
complesso Ca2+/calmodulina o tramite la via PI3K/akt/PKB. La iNOS si trova nei
polimorfonucleati, nei macrofagi e nelle cellule muscolari liscie, dopo attivazione con stimoli
infiammatori, come l'interleuchina-1 (IL-1), il “tumor necrosis factor” (TNF) o le endotossine
batteriche. La iNOS può effettuare una sintesi massiccia e duratura nel tempo di NO. Per esempio,
lo shock setticemico è causato da un’eccessiva quantità di NO prodotta dalla iNOS delle cellule
muscolari liscie, la cui espressione viene indotta dalle endotossine batteriche.
La sintesi dell’NO
L’NO è biosintetizzato a partire dall’amminoacido L-arginina, presente in alte concentrazioni nel
sangue (60 – 80 M) e nei fluidi extracellulari. Nella reazione di formazione dell’NO la L-arginina
è trasformata in L-citrullina (Fig. 2). La sintesi è catalizzata dalla eNOS dimerizzata ma il processo,
nella sua completezza, è il risultato di una sequenza di ossido – riduzioni, che coinvolgono una
grande numero di cofattori (quali FMN, FAD e la tetraidrobiopterina BH4) per i quali le NOS
hanno specifici siti di legame. Il deficit di BH4 porterebbe alla formazione di molecole reattive
come H2O2 , l'anione superossido (O2-) e altri radicali liberi.
Fig. 2. Sintesi dell'NO
(vedi testo).
La eNOS
Facendo riferimento alla eNOS, questa è acilata dal miristato e dal palmilato, che pilotano la
localizzazione della eNOS nelle caveole. Qui l'attività della eNOS è inibita dall'associazione con la
caveolina-1, (caveolina-3 nei cardiociti), associazione rimossa dal complesso Ca 2+/Calmodulina.
Accanto all'attivazione operata dal complesso Ca2+/Calmodulina (e quindi dalla modulazione della
[Ca2+]i) la eNOS può essere attivata dalla fosforilazione della Ser1179 dalla protein kinase akt,
attivata dalla PI3K o dalla Hsp90. La eNOS viene inibita dalla fosforilazione di Ser847 da una
kinasi CaM-dipendente e dall'NO stesso, che influisce direttamente sull'attività catalitica
dell'enzima. La produzione di NO è dipendente dalla disponibilità dei cofattori richiesti dalla eNOS
ed è altresì inibita competitivamente da analoghi dell'arginina. La metilazione dell'arginina può
inibire competitivamente la produzione di NO. Due composti di dimetilarginina sono stati
identificati nel sangue: la dimetilarginina asimmetrica (ADMA) e la dimetilarginina simmetrica
(SDMA), ma soltanto la prima inibisce la eNOS.
La iNOS è costituzionalmente attiva ma utilizza gli stessi meccanismi sintetici della eNOS.
Attivazione della guanilato ciclasi
Gran parte (ma non tutti) degli effetti dell'NO sono dovuti alla sua capacità di attivare, per via
paracrina, la guanilato ciclasi solubile (sGC). L'NO prodotto dall'endotelio attraversa facilmente la
membrana plasmatica, per cui può entrare nelle cellule vicine ed attivare la sGC. Questa aumenta la
concentrazione di guanil monofosfato ciclico (cGMP), che attiva poi la protein kinasi G (PKG).
Il cGMP presenta molte analogie con l’cAMP. In primo luogo si forma dal corrispondente
nucleotide trifosfato (GTP) per eliminazione di pirofosfato; anche il cGMP esplica la sua azione
attivatrice principalmente tramite una protein chinasi GMPc-dipendente (PKG), ma, come il cAMP,
può regolare lo stato di apertura dei canali ionici detti appunto nucleotidi ciclici dipendenti (nei
fotorecettori della retina).
Il cGMP viene degradato dalla cGMP-fosfodiesterasi.
Il ruolo biologico dell'NO
L'NO è una molecola pleiotropica, ed è la più importante molecola secreta dall'endotelio. Ha una
vita media di pochi secondi. Questa è prolungata da alcuni radicali liberi come ad esempio la
superossido dismutasi, mentre invece l'NO è inattivato dall’ossigeno dell’emoglobina e dal blu di
metilene. La somministrazione di inibitori della NOS porta ad un significativo aumento della
pressione sanguigna: ciò indica che vi è una continua produzione di NO in condizioni basali, indotta
dal livello basale della [Ca2+]i e dallo sheer stress operato dal sangue sull'endotelio. Un eccesso
nella produzione di NO, specialmente per quanto riguarda l’iNOS, può indurre direttamente
condizioni patologiche. Un esempio è lo shock settico. I lipopolisaccaridi che derivano dai batteri
anaerobici inducono l’iNOS nelle cellule muscolari lisce vascolari, nei macrofagi, e/o nelle cellule
endoteliali, provocando una pericolosissima ipotensione.
Inibizione della contrazione delle CML
L’NO prodotto dalle CE diffonde alle vicine CML e ne induce il rilasciamento, con conseguente
vasodilatazione e aumento del flusso sanguigno a valle della vasodilatazione. I meccanismi
coinvolti sono operati dalla PKG che
inibisce l'influsso di Ca2+
inibisce la liberazione di Ca2+ dagli store
attiva i canali al K+ (Ca2+), con conseguente iperpolarizzazione ed inibizione dell'apertura
dei canali al Ca2+(V)
inibisce l'attività della via attivata dalla RhoK.
Tutti questi meccanismi inducono rilasciamento della cellule muscolari lisce e vasodilatazione
Inibizione dell'aggregazione piastrinica
La prostaciclina e l'NO prodotte dall'endotelio inibiscono fortemente l'attivazione piastrinica,
poichè inducono nelle piastrine la produzione di PKA e PKG, rispettivamente. Queste fosforilano
un largo spettro di proteine, tra cui proteine G della famiglia Rho e Ras. Sembra venga inibito il
rilascio di Ca2+ dagli store, modulando la dinamica citoscheletrica, inibendo l'aggregazione
piastrinica e la liberazione dei granuli piastrinici.
Nitrazione di proteine tioliche
L’NO reagisce con i tioli -SH delle proteine, formando gli S-nitrosotioli (Proteina-S-NO), che
possono modificare la funzione della proteina. La reazione può essere reversibile, per cui i
nitrosotioli, come l’S-nitrocisteina, S-nitroglutatione e S-nitroalbumina, sono capaci di rilasciare
l’NO, esibendo perciò proprietà simili a quelle del NO stess.
Formazione di perossinitriti e la funzione dei macrofagi
L’NO reagisce con i radicali liberi, soprattutto con il superossido, per produrre i perossinitriti,
molecole iper-reattive (O=N-O-OH o O=N-O-O -). I perossinitriti possono reagire con la tirosina
delle proteine cellulari, convertendola in nitroso-tirosina; questa nitrazione porta a modificare la
funzione della proteina.
L’NO fa parte dei meccanismi dell’immunità aspecifica contro l’invasione dei microrganismi.
L’esposizione dei macrofagi ai microorganismi induce la iNOS, che produce sia una grande
quantità di NO sia anioni superossidi. Queste due molecole reagiscono formando perossinitriti che,
insieme all’NO, uccidono i microorganismi. Molti organismi, come Salmonella, hanno sviluppato
sistemi di difesa contro i perossinitriti tramite l’enzima perossinitrito riduttasi che limita gli effetti
dei macrofagi.
NO e proliferazione cellulare
L'NO sembra sia inibire che potenziare la proliferazione cellulare. In particolare, è stata osservata
un'inibizione della proliferazione cellulare nelle cellule muscolari lisce vascolari, nei fibroblasti,
nella retina. Tuttavia sembra stimolare la proliferazione delle CE, sia direttamente che tramite la
stimolazione della sintesi di fattori di crescita, un effetto rilevante nel corso dell'angiogenesi e nella
riparazione delle ferite.
l'NO è un messaggero sinaptico retrogrado
La trasmissione sinaptica può aumentare la [Ca2+]i nell'elemento postsinaptico, attivando la nNOS e
quindi la produzione di NO. Questo può influenzare le cellule vicine, incluso l'elemento
presinaptico, diventando un messaggero sinaptico che si trasmette dall'elemento post-sinaptico a
quello presinaptico.
Aterosclerosi ed NO
Un'alterazione dei meccanismi di produzione dell'NO sembra avere rilevanti implicazioni
fisiopatologiche. Una diminuita produzione di NO, presente per esempio nel diabete di tipo II,
favorisce l'instaurarsi di uno stato pro-infiammatorio vasale che favorisce l'insorgenza della
patologia aterosclerotica.