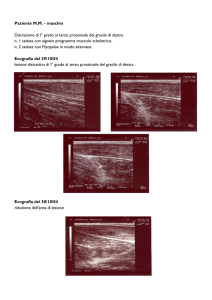
Autore: Mencaroni Spartaco
[email protected]
Diagnostica
per immagini
• Radiologia
• Medicina nucleare
• Radioterapia
• Fisica sanitaria
http://www.hackmed.org
[email protected]
Mencaroni Spartaco
Parte prima
Radiologia
2
Mencaroni Spartaco
CAP 1 TECNICHE
3
DI IMAGING IN RADIOLOGIA (PRINCIPI E APPLICAZIONE)
Tutte le tecniche di imaging che verranno discusse in questi appunti si basano sull’utilizzo dei raggi X, o di
altri tipi di radiazioni elettromagnetiche. In questa parte introduttiva saltiamo la fisica dei raggi, in quanto
parte del programma di fisica sanitaria.
I raggi incidono sui tessuti irraggiati come un fascio conico di fotoni, detto fascio incidente, che segue
quindi tre leggi fondamentali:
• Si attenua di intensità con il quadrato della distanza: per cui, all’aumentare della distanza diviene
necessario aumentare la dose di esposizione.
• Si allarga con la distanza, e quindi i raggi aumentano l’angolo di incidenza diventando sempre più
obliqui ai margini del cono di irraggiamento. Di conseguenza, le immagini radiologiche sono ingrandite
rispetto alla realtà.
• Mantiene un flusso constante: infatti man mano che ci si allontana dalla sorgente di emissione, si ha che
la densità di fotoni diminuisce, ma la sezione del fascio aumenta. Per cui, viene considerato omogeneo, e
quindi ideale per essere modificato dall’attraversamento dell’oggetto esposto e quindi analizzato.
L’oggetto esposto è formato da vari piani sovrapposti, all’interno dei quali vi sono diversi tessuti ognuno
con le sue caratteristiche di assorbimento fotonico. I parametri che definiscono la quantità di assorbimento di
una sostanza sono il numero atomico medio di essa e la sua densità elettronica.
Il fascio emergente viene quindi privato di fotoni a seconda della capacità di assorbimento dei tessuti
attraversati, e quindi viene ad essere disomogeneo o “modulato”.
In realtà non tutti i fotoni incidenti vengono assorbiti e quindi eliminati dal fascio emergenti, ma alcuni
vengono deviati andando a confondere l’immagine emergente, e devono essere filtrati con apposite tecniche.
Una volta ottenuto il fasci emergente, esso deve essere reso visibile (i raggi X non sono visibili). Tutta la
radiologia si basa sulle diverse tecniche di rendere visibile in maniera più dettagliata possibile questo raggio
emergente.
1.1 RADIOSCOPIA
Alcuni materiali, detti “fosfori”, riescono a commutare l’energia dei fotoni emergenti in luce visibile. Uno
schermo fluorescente è una lastra di plastica sulla quale è stratificato il fosforo, a sua volta ricoperto da un
vetro al piombo che protegge l’osservatore dai raggi X. I raggi X del fascio emergente proiettano così una
immagine identica alla proiezione del fascio sullo schermo.
L’immagine che si forma è comunque molto tenue, deve essere guardata al buio.
In questa modalità si ha:
• Scheletro (alto assorbimento di raggi X) → nero/grigio scuro
• Parenchimi (medio assorbimento) → grigio
• Gas e liquidi (basso assorbimento) → bianco
Questo sistema, abbastanza semplice e a basso costo, ha però lo svantaggio di una bassa risoluzione, scarsa
visibilità, e di una dose non indifferente di radiazioni per il paziente e il radiologo.
Esiste anche una così detta radioscopia con intensificatore di luminosità, in cui allo schermo fluorescente
primario (quello colpito dai raggi X) è associato un sistema che proietta su uno schermo fluorescente
secondario un elettrone per ogni fotone che riceve. In questo modo si amplifica la luminosità del segnale di
1000-3000 volte. L’immagine viene poi trasmessa su uno schermo TV.
La dose di radiazione per l’operatore è minore, e anche per il paziente (visto che la luminosità è aumentata).
La visione è agevole e la risoluzione è migliore, inoltre è possibile riprendere le immagini con videocamera e
anche scattare foto istantanee.
1.2 RADIOGRAFIA
Si tratta della classica “lastra” radiografica, che si basa sulla capacità dei raggi X di impressionare la lastra
esattamente come la luce fa con una pellicola fotografica.
http://www.hackmed.org
[email protected]
Mencaroni Spartaco
4
La lastra è composta da granuli di bromuro d’argento dispersi in una matrice di gelatina animale. Il bromuro
d’argento si decompone sotto l’effetto dei raggi, e si libera argento nelle zone esposte. Oggi si utilizzano
lastre speciali, che hanno anteriormente e posteriormente degli schermi fluorescenti che amplificano l’effetto
dei raggi X sulla lastra, rendendo minore la dose necessaria, e aumentano contemporaneamente la
risoluzione (ossisolfuro di gadolinio).
Successivamente la lastra viene sviluppata.
La riproduzione tonale della radiografia è inversa a quella della radioscopia: qui i raggi X che passano
anneriscono la pellicola, là i raggi X che passano liberano fotoni visibili.
La scala è quindi:
• Aria → nero
• Adipe → grigio
• Parenchima → grigio chiaro
• Osso → grigio molto chiaro
• Metallo → bianco
Queste tecniche sono semplici e poco costose, utilissime per operazioni di screening. Il principale difetto
però è la risoluzione, specialmente delle strutture adiacenti a basso contrasto, che le rende di gran lunga
inferiori alla tomografia computerizzata.
Alcuni fattori influenzano la qualità dell’immagine radiografica:
• Macchia focale del tubo a raggi X: minimo 0,3 X 0,3 mm (0,1 X 0,1 mm nei modelli sperimentali)
• Distanza focale
• Tempo di esposizione
• Diaframma del raggio incidente
• Presenza di una griglia antidiffusione (che cattura i fotoni riflessi dalle strutture)
Proiezioni in radiologia
Esistono fondamentalmente tre piani da cui si osserva il corpo umano:
• Piano sagittale
• Piano frontale
• Piano trasversale
Le proiezioni si riferiscono alla direzione lungo la quale provengono i raggi: per cui si parla di
• Proiezione sagittale: i raggi provengono da davanti, il fascio è sul piano sagittale. Si ottengono una serie
di immagini sul piano frontale.
• Proiezione latero laterale: i raggi vengono di lato, si ottengono una serie di immagini sagittali
• Proiezione assiale: i raggi provengono da sopra o da sotto, e si ottengono una serie di immagini sul
piano trasversale.
La lastra è bidimensionale, e contiene la proiezione bidimensionale di tutte le strutture tridimensionali
attraversate (ossia la sommazione di tutti i piani). Questo provoca delle interferenze notevoli fra le immagini;
inoltre si ha una deformazione proiettiva che è tanto maggiore quanto maggiore è l’inclinazione del fascio
incidente.
E’ importante anche sapere che le immagini più lontane dalla sorgente di raggi sono più ingrandite e più
deformate. Ad esempio, il torace viene fatto normalmente in proiezione sagittale postero anteriore, allo scopo
di separare i campi dei due polmoni e di avvicinare il cuore alla sorgente onde evitare la sua deformazione.
1.3 TOMOGRAFIA
Si tratta di una tecnica complessa che permette di osservare una immagine analitica che si riferisce non a tutti
gli strati attraversati dal fascio, ma a quelli selezionati prima dell’irradiazione.
Il principio su cui si basa la tecnica è che quelle strutture che si muovono durante l’irradiazione tendono a
perdere di nitidezza e alla fine scompaiono; movendo il tubo radiogeno, la TC provoca la cancellazione delle
strutture che non interessano.
Questo avviene facendo compiere alla cassetta radiogena e al tessuto da irraggiare dei movimenti
contemporanei, vincolati, che fanno si di mantenere sempre nella stessa posizione reciproca i tessuti da
osservare e la fonte di raggi, mentre gli altri tessuti si muovono invece rispetto all’emittente.
Mencaroni Spartaco
5
Ad esempio, se voglio osservare una zona al centro del torace, devo far ruotare il paziente sull’asse che passa
per quella zona, in modo che essa sia ferma.
Questo permette di esplorare distretti e strutture che non possono essere dimostrati all’indagine radiografica,
fornendo precisazioni istologiche notevolmente definite.
Di solito prima di fare la TC si effettuano due lastre in proiezioni fra loro ortogonali, che permettono di
identificare la zona di intervento da indagare.
Però la risoluzione dei tessuti vicini a basso contrasto è scarsa, e l’immagine, che comunque avviene in
movimento, è sempre un po’ sfumata.
La dose di radiazioni da somministrare al paziente resta alta.
1.4 I MEZZI DI CONTRASTO
Per esame diretto si intende ogni esame che si basa sul solo contrasto naturale per formare l’immagine.
Questo da solo è importantissimo (soprattutto per ossa, mammella, fegato e mediastino), ma spesso può
essere insufficiente per alcune situazioni.
L’utilizzo di una sostanza che, introdotta in maniera appropriata nell’organismo, vada ad aumentare la
densità elettronica e quindi il contrasto selettivamente delle strutture che interessano offre enormi e ovvi
vantaggi, sia per la possibilità di osservare organi del tutto o quasi inesplorabili direttamente (come
l’apparato digerente), sia per evidenziare la presenza di anomalie o lesioni che prendono selettivamente il
mezzo di contrasto (certe neoplasie).
Il mezzo di contrasto è caratteristicamente distinto in:
• Trasparente: serve a diminuire la densità elettronica del tessuto da studiare. Si tratta in genere di gas
respiratori, del tutto privi di effetti collaterali (CO2, N2O, O2), o anche di aria filtrata.
• Opaco: serve ad aumentare la densità elettronica del tessuto.
I mezzi opachi sono moltissimi, a seconda dell’uso che se ne deve fare:
• Per l’apparato digerente: si usa il solfato di bario¸ in sospensione acquosa. Non è assorbito dalle mucose
digestive e transita liberamente fino all’espulsione con le feci. Se si disperde nel peritoneo è
estremamente irritante, ma questo è molto difficile; se ne evita però l’uso in caso di occlusione
intestinale. E si ricorre a mezzo di contrasto iodato solubile.
• Uroangiografia: si usano mezzi di contrasto iodati solubili in acqua, che si iniettano per via
endovenosa e raggiungono i comparti urinari perché subiscono la filtrazione glomerulare. Lo iodio
assorbe i fotoni e funziona da contrasto. Possono essere usati per via venosa, arteriosa, per clisma o per
via orale (per visualizzare l’intestino al posto del bario), ed essere introdotti direttamente ovunque, come
in visceri cavi. Sono però molto attivi osmolarmente, e possono provocare danni agli endoteli,
permeabilizzazione capillare e turbe emodinamiche importanti. Questo viene diminuito dall’uso di mezzo
di contrasto non ionico, che è meno attivo, importante soprattutto per l’uso nel SNC dove la variazione
osmolare è molto mal tollerata (ha un costo comunque di circa 10 volte rispetto al mezzo di contrasto
normale).
• Per uso colangiografico vi sono particolari mezzo di contrasto iodati solubili, studiati apposta per avere
una tollerabilità e una buona cinetica di escrezione biliare. Hanno infatti due anelli benzenici con la
posizione 5 libera, sulla quale viene a legarsi o l’albumina o le globuline plasmatiche, che ne
condizionano l’escrezione biliare.
• Per uso colecistografico orale, invece, si usano dei preparati insolubili in acqua, che si assorbono a
livello intestinale con i sali biliari, vengono assorbiti dal fegato e riescreti a livello biliare.
• Infine, per l’osservazione della linfa, esistono dei particolari mezzo di contrasto oleosi.
Gli effetti collaterali del mezzo di contrasto sono diversi, sia in relazione al loro potere osmotico sia per la
possibilità di creare reazioni di ipersensibilità, che infine per le loro proprietà farmacologiche.
L’uso di mezzo di contrasto non ionico riduce di circa 6 volte l’incidenza di effetti collaterali gravi, in
misura maggiore nei pazienti allergici.
Il mezzo di contrasto spesso si lega alle proteine plasmatiche producendo uno spostamento nel plasma di
sostanze endogene normalmente veicolate dall’albumina. Alcune evidenze cliniche indicano inoltre come
meccanismo probabile la liberazione di istamina e l’irritazione del sistema neurovegetativo.
http://www.hackmed.org
[email protected]
Mencaroni Spartaco
6
Non esiste una prevenzione di questi effetti, se non l’uso, nei soggetti con precedenti allergici, di cortisone e
antistaminici per qualche giorno prima dell’esame.
1.5 LA TC E LE IMMAGINI DIGITALIZZATE
Un’immagine radiografica convenzionale è analogica, ossia è una rappresentazione continua di punti
infinitesimali (risoluzione infinita). Una immagine digitale, invece, è fatta da una serie di punti di
dimensione finita che approssimano la realtà dell’immagine analogica. Alcune tecniche radiografiche
utilizzano immagini digitali, acquisendole primitivamente in questo modo o digitalizzando immagini
analogiche preesistenti, allo scopo di poterle utilizzare per molteplici tipi di elaborazione.
Parametri di questa sono il voxel, ossia le unità di volume che vengono utilizzare in fase di acquisizione
dell’immagine, e il pixel, ossia la dimensione della più piccola unità di spazio bidimensionale che,
nell’immagine finale, ha la stessa tonalità e intensità di colore.
L’immagine è formata da una successione di pixel, come in un mosaico, e quanto più piccoli sono questi
maggiore è la sua risoluzione.
La risoluzione si indica come il numero di pixel che compongono il lato dell’immagine, sempre quadrata.
2562, 5122 sono i formati più comuni. 5122 consente una risoluzione di circa 0,72 mm.
Ogni pixel ha naturalmente la possibilità di essere di più colori, e il numero di colori che può essere assunto
da ogni pixel è detto profondità di colore dell’immagine.
Si hanno varie profondità:
21: bianco o nero (
22: 4 grigi
23: 8 grigi
24: 16 grigi
28: 256 colori
210: 1024 colori (formato standard in radiologia digitale)
212: 4096 colori (formato standard per la TC computerizzata)
216: 65356 colori (formato immagini fotografiche)
224: 16,77 milioni di colori (formato “true color”, in uso in informatica)
TC COMPUTERIZZATA
La tomografia computerizzata (adesso semplicemente TC), è una tecnica di formazione di immagini digitali
estremamente importante. Essa combina la tecnica della semplice tomografia con l’utilizzo del computer, che
esegue una analisi sia nel processo di acquisizione che in quello di ricostruzione dell’immagine stessa.
Questo procedimento consiste a grandi linee nell’irraggiare la superficie corporea interessata da varie
angolazioni, osservando l’attenuazione che il segnale di raggi X subisce. Il computer calcola, attraverso un
complesso algoritmo, l’attenuazione dovuta alle singole regioni di spazio che formeranno poi i pixel
dell’immagine. Maggiore è il numero di queste regioni di spazio considerate, maggiore sarà la risoluzione
dell’immagine.
Il processo avviene con un movimento di rotazione e traslazione contemporaneo della sorgente rispetto
all’immagine; oggi esistono tomografi con processi di movimento molto più complessi.
Il valore di attenuazione è rilevato dal macchinario come u (coefficiente lineare di attenuazione), e viene
convertito in unità Hounsfield, ossia semplicemente in punti permillesimi in più o in meno rispetto a quelli
dell’acqua. Questo valore dipende dalla densità del tessuto attraversato, ed è quindi detto “coefficiente
densitometrico”.
Si ottiene così una scala di lettura di questo tipo:
1000: osso
80: sangue, fegato
40: parenchimi
30: sostanza bianca e grigia
0: acqua
-200: grasso
-400: polmone
-1000: aria
Mencaroni Spartaco
7
La scala comprende quindi 2001 valori possibili, ma negli apparecchi moderni di solito si una profondità di
colore di 212, con quindi 4096 colori.
Il tomografo computerizzato è un apparecchio che ha subito notevoli evoluzioni (ad esempio il tempo
necessario alla scansione è passato da diversi minuti dei primi modelli a pochi secondi dei più recenti). E’
composto da:
• Tavolo porta paziente motorizzato e comandabile a distanza
• Tunnel di scansione, con la sorgente di emissione e i collimatori del fascio
• Cellule di acquisizione dei dati e detettori del fascio emergente
• Computer di calcolo dei dati (acquisizione e ricostruzione dell’immagini procedono simultaneamente)
• Consolle di comando
• Stampante e memoria di massa per riproduzione e archiviazione dell’immagine
Esistono molti tipi di tomografi, che variano nella possibilità, essenzialmente, di ottenere una rotazione
continua attorno al paziente e quindi di effettuare la scansione in tempi minori (magari torace e addome in
una unica apnea).
Esecuzione della tomografia
Si parte sempre da una immagine digitale “panoramica” detta anche immagine guida, ottenuta facendo
scorrere il tavolo sotto il paziente, che permette di definire i limiti della successiva scansione.
Successivamente si esegue la scansione vera e propria, diretta o dopo mezzo di contrasto, con varie tecniche:
• Ricostruzione 3d di singoli strati di tessuto
• Acquisizione di immagini seriate contigue, con ricostruzione 3d successiva: questo processo è più
rapido, e permette di valutare una serie di “fette” in un tempo breve, sfruttando ad esempio la massima
opacizzazione del mezzo di contrasto.
• Acquisizione ripetuta a brevi intervalli di un singolo strato, ad esempio per osservare la diffusione del
mezzo di contrasto nel tempo
• Acquisizione volumetrica con tecnica spirale, molto più rapida, che permette ad esempio la vista di uno
spazio esteso in una singola apnea. La tecnica spirale permette di ricostruire le immagini in qualunque
punto all’interno del volume della singola scansione.
La ricostruzione 3d delle immagini, ottenuta con immagini ad alta risoluzione e tecniche di calcolo
complesse, può ottenere la visualizzazione estremamente precisa delle strutture interne, fino a raggiungere
risultati paragonabili a quelli dell’endoscopia (endoscopia virtuale); importante anche la ricostruzione 3d di
ossa e articolazioni, di vasi utilizzando contemporaneamente la TC e l’angiografia (angiografia TC).
A questo proposito, esiste nella TC un elevato uso di mezzo di contrasto, nonostante la tecnica sia di per sé
ad alta risoluzione.
1.6 ECOGRAFIA
Si tratta della principale di una serie di tecniche che si basano sulla ritrasmissione, da parte dei tessuti, di un
fascio di ultrasuoni.
E’ una tecnica estremamente versatile, semplice e di scarsissimo costo, ma che ha fra gli svantaggi la sua
scarsa risoluzione e soprattutto la necessità di una interpretazione immediata e operatore dipendente del
risultato (l’unico che capisce una ecografia per bene è chi la fa!).
L’assenza di ogni rischio biologico (in pratica) e la validità e rapidità diagnostica la pongono come una
tecnica diagnostica di approccio e di screening indispensabile.
Basi fisiche
Si utilizza un fascio di ultrasuoni variabile a seconda degli strumenti fra 1 e 20 MHzl, prodotti sfruttando le
oscillazioni di alcuni materiali eccitati da frequenze elettriche appropriati.
Ogni mezzo materiale attraversato da questi ultrasuoni (che non si propagano nel vuoto) si oppone al loro
passaggio con un diverso valore di impedenza acustica.
Aria e osso compatto sono i principali ostacoli alla diffusione del fascio: al di sotto di una struttura aerea,
l’attenuazione subita è del 99,9% (scomparsa del fascio), al di sotto dell’osso del 41% (attenuazione del
fascio). Il gel che si spalma sulla cute e su cui si appoggia l’ecografo serve ad eliminare l’aria fra la pelle e la
sonda.
Quando gli ultrasuoni sono riflessi dai tessuti, vengono recepiti dalla stessa sonda (che è un cristallo
piezoelettrico), che subisce il processo inverso: nell’emissione dei raggi, la corrente stimola il cristallo che
http://www.hackmed.org
[email protected]
Mencaroni Spartaco
8
produce ultrasuoni, nella ricezione di essi il cristallo viene stimolato dagli ultrasuoni e produce una corrente
elettrica che viene interpretata come segnale.
Maggiore è la frequenza del fascio, tanta è la risoluzione dell’immagine che viene fuori dall’ecografo: però
alle alte frequenze aumenta anche l’assorbimento, quindi il fascio non può entrare nei tessuti in profondità e
questa tecnica va bene solo per analisi superficiali.
Interpretazione risultati
L’ecografia può essere effettuata in A-mode, in TM-mode o in B-mode:
• Amplitude mode: l’esplorazione è effettuata lungo una sola linea, e risulta appunto una linea come quella
di un tracciato elettrocardiografico. Si ha quindi una linea con dei picchi proporzionali all’intensità del
suono riflesso, e posizione corrispondente alla profondità dal quale si è generato il suono. Questa
modalità è usata per l’analisi ecografica del fondo dell’occhio.
• Time motion mode: sempre una sola linea, ma che si muove scorrendo, e ogni punto viene osservato nel
tempo.
• Brightness mode: rappresentazione elettronica sullo schermo TV dei punti di formazione degli echi di
ritorno. Ogni eco è rappresentato da un punto di luminosità proporzionale alla sua intensità.
L’immagine è quella classica dell’ecografo, e può essere rettangolare, a settore di cerchio (l’apice
rappresenta la sonda).
A seconda delle strutture incontrate, gli echi possono essere di vario tipo:
• Assenza di echi: la struttura esaminata è perfettamente omogenea, il fascio l’attraversa senza incontrare
alcuna interfaccia e quindi subire fenomeni di riflessione che danno origine a echi. Il sangue, una cisti
omogenea, della bile, e tutte le formazioni solide anecogene sono di questo tipo.
• Echi speculari: la struttura contiene delle aree di densità diversa di dimensioni maggiori del fascio
incidente. Vasi, superfici degli organi, cisti, strutture varie danno echi di questo tipo, e possono essere
visualizzate efficacemente all’ecografo come una struttura diversa dal parenchima circostante.
• Echi diffusi: la struttura contiene aree di densità diversa ma piccole, come ad esempio i lobuli epatici,
che danno una eco diffusa. Nel fegato l’aumento dell’intensità di questi echi diffusi è un segno di
modificazione del parenchima.
• Strutture iperecogene con cono d’ombra: alcune strutture, in particolare quelle solide con intensa
calcificazione o gas, danno una totale riflessione del fascio di ultrasuoni, tale da lasciare al di sotto della
struttura una zona conica di vuoto dove gli ultrasuoni non arrivano perché ombreggiati dalla struttura
iperecogena soprastante.
1.7 DOPPLER
La frequenza di un’onda di ultrasuoni che colpisce un struttura in movimento subisce anch’essa, come il
suono normale) una variazione in positivo se la struttura si avvicina, in negativo se si allontana (effetto
doppler).
In clinica questo si usa per il sangue; le frequenze usate sono nell’ordine dei KHz, e possono essere
amplificate e quindi udite; durante l’esame l’operatore (e tutti quelli che gli sono vicino!) ascolta dei suoni
con frequenza variabile in relazione alla velocità del sangue.
Ovviamente esistono apparecchiature che analizzano e graficizzano questo spostamento doppler, restituendo
informazioni su velocità, natura del flusso, direzione e altre informazioni sul flusso ematico analizzato.
Il doppler può essere continuo o pulsato: il primo permette l’analisi del flusso ematico di un singolo vaso,
perché non riesce a riconoscere due o più strutture vascolari sovrapposte, ma è poco costoso e usato per i
grossi vasi arteriosi.
Il secondo, invece, ha risoluzione di profondità ed è parte integrante dei moderni ecografi.
Ci sono vari tipi di doppler pulsati, che si accoppiano a sonde ecografiche normali e possono essere attivati a
piacere: in questo modo si sceglie il vaso sotto guida ecografica e si può osservare solo quello.
• Eco-doppler: mette i valori misurati in una sezione di vaso (volume campioni) in su una linea, con
picchi proporzionali al flusso ottenuto.
Mencaroni Spartaco
9
•
Color doppler: i valori sono sovrapposti all’immagine ecografica: in blu vengono indicati i punti in cui
il flusso si allontana dalla sonda, in rosso quelli in cui si avvicina, con intensità pari all’intensità del
flusso (numero di globuli rossi, che riflettono gli echi, circolanti).
• Power doppler: i valori sono rappresentati sull’immagine ecografica con un colore fisso, di intensità
dipendente soltanto dall’intensità del flusso ematico.
In pratica il color doppler offre una chiara immagine delle direzioni del flusso e della composizione
vascolare della zona interessata, il power doppler una misura dell’intensità del flusso nel tempo, l’eco
doppler una analisi approfondita del flusso e delle sue caratteristiche nel tempo, sottoforma di tracciato
grafico.
Nell’ecografia doppler può essere usato un mezzo di contrasto che aumenti l’ecogenicità del sangue,
abbastanza bassa; esso è una sostanza idrosolubile che contiene all’interne bolle d’aria solubili, di dimensioni
così piccole (< 7 um) da attraversare senza problemi il filtro polmonare. Varie sostanze additive vengono
impiegate per stabilizzare le bolle e farle durare di più.
1.8 TERMOGRAFIA
In alcune patologie, la presenza sottocute di zone parenchimali e vascolari ad alta attività metabolica produce
aree di ipertermia che possono essere messe in evidenza con tecniche particolari.
Il calore di fondo¸ ossia la temperatura della cute nella zona, è tanto minore quanto maggiore è il rapporto
S/V fra la cute e quello che riveste. Ipotermiche sono mani, piedi, capezzoli, orecchie, testicoli.
Sono ipertermiche anche le aree dove il calore si disperde peggio, come le pieghe cutanee (per cui la T
corporea si prende lì o al retto).
Oltre a questo, si evidenzia un disegno vascolare al quale contribuiscono in massima parte le vene, ma
anche grossi tronchi arteriosi che si avvicinano alla superficie (arterie mammarie).
Esistono due tipi di termografia:
• Termografia a contatto: ormai obsoleta
• Teletermografia: di impiego corrente in campo vascolare e reumatologico
Nella teletermografia il paziente è messo in una stanza a 20°C per circa 10-15 minuti, nudo, per
acclimatazione. Dopo questo tempo, viene misurata la radiazione elettromagnetica emessa e quindi (nei
termografi di seconda generazione) elaborata onde meglio evidenziare le differenze fra la radiazione di fondo
e il disegno vascolare o eventuali spot focali.
Le massime applicazioni si hanno in ortopedia, reumatologia e patologia vascolare
1.9 RISONANZA MAGNETICA NUCLEARE
Si tratta di un insieme di tecniche che utilizzano la risonanza magnetica ai fini di:
• Produrre sezioni come nella tomografia assiale
• Angiografia
• Localizzare aree del SNC attive in risposta a stimoli (neuro RM funzionale)
• Localizzare traccianti o metaboliti particolari
Questa tecnica si basa sul fatto che alcuni nuclei atomici (come l’ H) immersi in un campo magnetico
uniforme sono capaci di assorbire energia elettromagnetica a particolare frequenza (cioè un assorbimento in
risonanza). Quindi risonanza magnetica nucleare, dove il nucleare non ha, come diversi pazienti terrorizzati
credono, nessuna attinenza con sostanze radioattive.
Quando l’irradiazione elettromagnetica cessa, queste sostanze eccitate emettono l’energia assorbita: la
caratteristica peculiare è che non solo analizzando questa energia di ritorno si possono ricavare informazioni
sul tessuto, ma a seconda della durata e dell’intensità dell’energia fornita si riceveranno informazioni su
densità protonica e altri parametri del tessuto.
Il processo schematizzato è il seguente:
1. Le sostanze sensibili all’assorbimento in risonanza si magnetizzano durante la fase di irradiazione
2. Magnetizzandosi, esse emettono un segnale che è ricevibile da una apposita bobina
http://www.hackmed.org
[email protected] 10
Mencaroni Spartaco
3. Al termine dell’irraggiamento, esse si smagnetizzano con una velocità diversa a seconda delle
dimensioni della molecola interessata e di altre caratteristiche che permettono di distinguere diversi
tipi di tessuti.
4. La RMN mette dunque in evidenza il tipo di molecola che compone il tessuto, evidenziando molto
bene ad esempio il tessuto adiposo e quello osseo, quello acquoso eccetera.
Questo ovviamente è molto importante perché con la RMN si mettono in evidenza i tessuti diversi e anche
alcune molecole che sono normalmente invisibili alla radiologia convenzionale.
Inoltre si è detto che a seconda del tipo di impulso elettromagnetico ricevuto, le molecole danno risposte
diverse. Esistono quindi diverse sequenze che sono in grado di fornire risposte di vario tipo.
In RMN esistono anche diversi tipi di mezzo di contrasto, che si basano sul principio solito di legarsi
all’organo o alla lesione che interessa osservare, ma agiscono aumentando o diminuendo il tempo di
magnetizzazione del tessuto (e si chiamano di conseguenza positivi o negativi, a seconda di quale azione
facciano).
Mencaroni Spartaco
CAP 2 RADIOLOGIA
11
INTERVENTISTICA
2.1 ANGIOGRAFIA
Sono una serie di tecniche interventistiche di radiologia che permettono di visualizzare l’interno di arterie e
vene, con le relative lesioni, e contemporaneamente di eseguire manovre e interventi di vario tipo.
Possono essere usate sia tecniche di imaging convenzionali che digitali.
La tecnica è la seguente: si dispone di una agocannula con mandrino, che permette l’inserimento al suo
interno di una guida.
• Si buca un vaso venoso di grosso diametro (arcata inguinale, ascella, vena omerale).
• Si rimuove l’ago osservando se esce sangue
• Si inserisce la guida che, sotto guida ecografica, raggiunge il distretto interessato
• Si rimuove la cannula
• Si introduce il catetere, a doppio lume fino al distretto interessato seguendo la guida
• Si rimuove la guida
Per i le angiografie arteriose si sceglie in genere la femorale, che ha una buona dimensione e facilmente
reperibile. I cateteri sono flessibili, ma a memoria di forma e una volta liberati dalla guida metallica si
mettono da soli nella posizione ideale.
Il mezzo di contrasto viene poi iniettato nelle regioni interessate e si osserva, se iniettato in un vaso arterioso,
tre fasi:
• Fase di diffusione arteriosa
• Fase di diffusione parenchimatosa (il mezzo di contrasto si inserisce nei capillari)
• Fase di diffusione venosa
2.2 INTERVENTISTICA VASCOLARE
TRATTAMENTO DI EMORRAGIE E MALFORMAZIONI
In caso in genere di emorragie o di altre necessità ad esempio chirurgiche può essere effettuata in due modi:
• Infusione endoarteriosa di vasopressina
• Occlusione meccanica
La prima procedura trova impiego di solito nelle emorragie gastrointestinali, per l’effetto spastico sulla
mucosa intestinale oltre che sulla muscolatura arteriosa della vasopressina che potenzia il risultato. Controlla
bene le piccole emorragie, male quelle grandi come ad esempio l’ulcera pilorica.
E’ un trattamento comunque di primo livello, in genere ben tollerato.
L’occlusione meccanica arresta il flusso completamente e solo nel distretto interessato, previo un
cateterismo molto selettivo.
La scelta del materiale per fare l’embolizzazione dipende dalla natura stessa della lesione e del vaso. Si usa
sia per il controllo delle emorragie bronchiali, digestive o traumatiche, che per il trattamento di
malformazioni arteriose di varia natura.
Complicazioni rare ma temibili (infarto / sepsi dell’organo interessato).
L’embolizzazione venosa, meno usata, oggi trova impiego nel trattamento del varicocele maschile e
femminile. Un’altra questione, trattata a sé, è l’impiego di filtri cavali.
OCCLUSIONI ARTERIOSE ACUTE
Le occlusioni arteriose sono acute e croniche. Fra le prime sono frequenti le embolie (su vasi sani) e le
trombosi (su vasi aterosclerotici, su protesi, sui circoli collaterali).
Il trattamento di queste patologie prevede l’impiego di due tecniche fondamentali:
• Angioplastica transluminale percutanea (PTA)
• Trombolisi
http://www.hackmed.org
[email protected] 12
Mencaroni Spartaco
Angioplastica
Costituiscono una indicazione a questa soluzione le stenosi arteriose o le ostruzioni trombotiche brevi (non
oltre 5 cm).
Si procede con una cateterizzazione con guida metallica di piccolo diametro e facile scorrevolezza, che
valica la stenosi o l’ostruzione.
Su questa guida si fa scorrere un catetere particolare, detto di Gruntzig, all’estremità del quale c’è un
palloncino gonfiabile. Questo viene messo in corrispondenza della lesione e gonfiato più volte fino a quando
il vaso non ha ripreso la sua dimensione originaria.
Questa tecnica, sebbene di semplice esecuzione e poco costosa, e sebbene richieda una ospedalizzazione
minima e presenti pochi rischi, non sempre è di efficacia elevata.
Sono frequenti le ristenosi, ed esistono una serie di complicazioni (ematomi, lacerazioni, trombosi nel luogo
dell’applicazione) che possono essere ridotte con l’uso di farmaci anticoagulanti dopo l’intervento e con la
mobilizzazione precoce del paziente (in interventi periferici).
In alternativa, se abbiamo una embolia su vaso sano o una lesione asportabile, si percorre con il catetere tutta
la guida fin oltre la lesione, e da qui si gonfia il palloncino e si tira via l’embolo.
→ Indicazioni
• Lesioni acute e croniche, con o senza fibrinolisi precedente
• Migliori risultati per piccole obliterazioni
• Migliori risultati in assenza di calcificazioni
• Distretto iliaco: si procede a PTA se ci sono sintomi come cl. intermittens, dolore a riposo, ulcere,
malattia ateroembolica (s. delle dita blu)
• Distretto femorale e popliteo: se il paziente è sintomatico e se c’è trombosi, dopo aver effettuato la
trombolisi
• Distretto intrapopliteo: paziente con dolore a riposo, ulcere, quadro clinico severo con il problema del
salvataggio dell’arto. SI valuta la pressione alla caviglia e alle dita del piede (se minore di 30 mmHg la
prognosi è peggiore).
Il protocollo operativo è:
• Trattamento preventivo con acido acetilsalicilico (ASA 33 mg/die) nei giorni precedenti
• Anestesia locale
• Puntura periferica
• Inserimento della guida
• Esecuzione di angiografia diagnostica con mezzo di contrasto
• Attraversamento della stenosi con la guida
• Eparina sistemica 5000 UI
• Catetere a palloncino ed esecuzione dell’intervento
• Trattamento con ASA dopo l’intervento
Controindicazioni all’uso della PTA sono:
• Assolute:
o Occlusione embolica acuta intervenuta
o Trombosi recente (si usa allora la trombolisi e successivamente la PTA)
• Relative:
o Stenosi in contiguità con lesioni aneurismatiche
o Condizioni del letto a valle precarie
Le complicazioni sono:
• Ematomi importanti:
• Embolo distale:
• Dissezione intimale
• Falsi aneurismi
2-4%
2-5%
4%
2%
Mencaroni Spartaco
•
•
•
•
•
•
Rottura arteriosa
Dissezione
Trombosi
Embolia
Aneurismi
Fistole AV
13
3%
Fibrinolisi (o trombolisi)
Si tratta di un protocollo che consiste nell’iniezione diretta all’interno del trombo di sostanze in grado di
accelerare la trasformazione del plasminogeno in plasmina, o di degradare direttamente la fibrina.
Di solito si da:
• Urochinasi in bolo (100.000 UI) seguite da 50.000 UI/h per 24-72h (mai oltre).
• Attivatore del plasminogeno (rtPA) in bolo (0,5 mg/Kg) seguito da 0,2 mg/Kg/h per 4h. Seconda
generazione
L’rtPA funziona meglio in presenza di fibrina, dando migliori risultati a livello dei trombi piuttosto che degli
emboli: una certa quota di plasmina può sfuggire e passare in circolo, ma viene fermata dalle molecole che la
inattivano.
→ Indicazioni
• Arteropatie obliteranti acute (nella forma cronica si usa ma non ha lo stesso effetto. Spesso va associata a
PTA per completare la ricanalizzazione)
• Occlusioni dei bypass precoci (sono meno frequenti perché possono essere derivate da errori tecnici o da
inadeguate indicazioni alla ricostruzione chirurgica) o tardivi (che dipendono dalla lunghezza del bypass,
dal decorso, dal materiale usato, e da varie condizioni patologiche che possono sopravvenire). La
fibrinolisi è più utile in questi casi della trombectomia chirurgica perché è meno traumatica.
• Si preferisce l’infusione regionale di fibrinolitico perché meno costosa e con minor effetti sistemici
Tecnica
• Antiaggreganti 2 giorni prima del trattamento
• Eparina durante il trattamento: 5000 UI in bolo EV + 500 U/h fino al termine (valutando PTT 1,5-2 volte
il basale)
• Antiaggreganti almeno per 6 mesi dopo il trattamento
Si inserisce il catetere e si effettua prima una trombolisi meccanica; il catetere viene infiltrato nel trombo in
senso retrogrado con 100000-200000 UI di urokinasi e la punta del catetere avanza gradualmente. A 12 ore
si valuta se c’è riperfusione, ogni 6 ore si monitorizza il PTT e il PT fibrinogeno e l’antiplasmina.
Questa tecnica viene in genere utilizzata da sola per le lesioni trombotiche arteriose periferiche acute,
nell’occlusione dei bypass, nelle trombosi coronariche o renali.
Si può però anche associare alla PTA, in questa maniera:
• Inserimento della guida e iniziale trombolisi meccanica
• Infusione di trombolitico fino alla creazione di un passaggio
• PTA con catetere a palloncino
Il successo della terapia con trombolisi dipende dalla percentuale di ricanalizzazione dimostrata dopo
l’intervento, dall’efficacia della PTA successivamente eseguita sulle lesioni residue, dallo stato clinico del
paziente, dall’indice di Winson (indice braccio/caviglia che mette a confronto le due pressioni: quella
dell’arto trattato deve essere almeno 0,8 rispetto a quella del braccio non trattato).
Le lesioni residue si trattano sempre con la PTA o, se non è possibile fare altrimenti, si ricorre alla chirurgia.
Dopo una trombolisi, si può avere la completa ricanalizzazione del vaso (evento raro), una apertura parziale,
o un fallimento.
Le controindicazioni al trattamento sono:
• Assolute: emorragie, accidente cardiovascolare da meno di 3 mesi
• Maggiori: emorragie GE gravi, traumi gravi, interventi chirurgici, ipotensione arteriosa grave
http://www.hackmed.org
•
[email protected] 14
Mencaroni Spartaco
Minori: gravidanza, retinopatia diabetica, endocardite batterica, difetti emostatici
→ Oggi assume importanza la tecnica di rimuovere i trombi tramite aspirazione, tramite opportuni cateteri
portati in corrispondenza di essi con guida ecografica. Viene usata per il trattamento delle lesioni vascolari
periferiche e per la ripulitura di bypass.
Tromboaspirazione
Tecnica recente e non sempre ben valutabile, questa è utile sia per trombi organizzati che recenti; serve uno
studio preliminare angiografico e 5000 UI di eparina durante il trattamento.
→ Indicazioni:
• Fibrinolisi locoregionale controindicata o inefficace
• Occlusione acuta trombotica dopo PTA
• Complicazione emboliche della PTA
Viene utilizzata solo agli arti inferiori, in quanto nei superiori la movimentazione del trombo è troppo
rischiosa per le possibili embolie vertebrali o carotidee; è comunque necessaria l’integrità dell’asse aortoiliaco.
OCCLUSIONI ARTERIOSE CRONICHE
In questo tipo di lesione ha maggior risultato la fibrinolisi piuttosto che l’angioplastica, in quanto la
lunghezza dell’occlusione e la presenza di una iperplasia intimale rendono poco adatta quest’ultima tecnica.
Le occlusioni arteriose croniche possono essere classificate in base alla classificazione di Leriche-Fontaine:
• I: asintomatiche. Diminuzione della T alle estremità, vago dolore alla deambulazione con l’uso di scarpe
strette.
• II: claudicatio intermittens.
o IIa: dolore oltre i 100 m di marcia
o IIb: dolore prima di 100 m
• III: dolore anche a riposo, edema, pallore, ipotermia, iniziale diminuzione degli annessi cutanei
• IV: necrosi ischemica → ulcere, gangrena secca o umida
Definizione di ischemia critica: dolore a riposo che richiede analgesia per almeno 2 settimane con pressione
sistolica alla caviglia minore di 50 mmHg e/o alle dita minore di 30 mmHg; ulcere e gangrena delle dita del
piede con pressione alla caviglia/piede minore di 50/30 mmHg.
In tali pazienti spesso l’ossimetria transcutanea è minore di 10 mmHg e non aumenta con l’inalazione di O2
→ La PTA però assume importanza se associata alla fibrinolisi prima (si accorcia la lunghezza delle lesioni)
e al posizionamento dello stent dopo (si impedisce la ristenosi).
I vantaggi della PTA sono infatti quelli di poter:
• Rompere la placca e l’intima
• Distendere e rompere la media
• Distendere l’avventizia
Agisce cioè non solo nella lesione trombotica, ma anche nella parete del vaso: essendo in pratica le lesioni
croniche tutte quelle lesioni di natura aterosclerotica, questo trattamento della parete del vaso è decisamente
importante.
La rottura della placca non ne comporta la totale rimozione, ma soltanto un depezzamento: se però la placca
alla fine resta sempre dov’era, è vero che è tutta la parete che si sposta ripristinando il lume. Questo è alla
fine il meccanismo di intervento, ed è chiaro che in questo modo la funzione del posizionamento di uno stent
è fondamentale.
Rapporto con la classificazione di Leriche:
• Classe 1: efficace
• Classe 2: PTA + bypass se la malattia è polidistrettuale
• Classe 3: PTA solo se non è possibile l’intervento chirurgico
• Classe 4: PTA con scarso successo
Mencaroni Spartaco
15
→ Poco usati, ma esistono anche gli ateromi, divisi in rotazionali e direzionali. Questi strumenti, che
agiscono rispettivamente con una punta rotante o con una ghigliottina tagliente, frammentano la placca in
corpuscoli che vengono aspirati o incorporati in un serbatoio integrato.
Sono poco usati per via delle complicanze a lungo termine, soprattutto della displasia fibro-intimale che si
verifica in maniera più frequente rispetto alla PTA.
→ Lo stent, invece, trova applicazione nel trattamento delle lesioni residue dopo la PTA, o nelle dissezioni
ad essa conseguenti.
Si tratta di protesi rigide costituite da maglie metalliche, che possono essere inseriti in un catetere e
trasportati fino al luogo della lesione; qui esistono dei modelli autoespandibili, altri possono essere espansi
meccanicamente.
I modelli ad espansione automatica comprimono il lume della placca progressivamente, rimodellandola.
Ve ne sono anche a memoria di forma, importanti per la loro stabilità nel tempo.
Gli stent sono fabbricati in vari formati a seconda delle dimensioni e del decorso del vaso (stent dedicati, ad
esempio, alle arterie renali e alle carotidi). I problemi principali sono però il costo elevato e la invasività
nella manovra di posizionamento.
Altre complicanze sono:
• Embolizzazione distale
• Aneurismi
• Fistole AV
• Trombi (soprattutto non ricoperti per adesione, oppure per trauma dell’intima)
• Perforazione e rottura vasale
• Ematomi
Uno stent deve essere:
• Biocompatibile
• Flessibile
• Radiopaco
• Indeformabile
• Facile da posizionare (in genere possono essere ancora mossi fino a metà apertura)
• Facile da togliere
• Con spinta radiale
Una ulteriore evoluzione degli stent sono gli stent ricoperti. Questi hanno un materiale metallico nella
struttura portante, ma sono ricoperti di materiale sintetico che minimizza il rischio di iperplasia intimale, che
provoca spesso l’occlusione degli stent normali. Questi si usano soprattutto per:
• Aneurismi (se si rompe il vaso, lo stent tampona le emorragie)
• Occlusioni aorto-iliache
• Dissezioni periferiche
• Fistole AV
• A livello ileo-femorale se c’è scarso risultato dopo PTA
• Per dissezioni importanti
• Trattamento di lesioni lunghe
• Placche ulcerate sintomatiche
• Ristenosi dopo PTA
• Lesioni complesse
• Placche eccentriche (si dilatano molto male con il palloncino)
Indicazioni per gli stent non ricoperti
• Occlusione acuta subito dopo PTA
http://www.hackmed.org
[email protected] 16
Mencaroni Spartaco
• Stenosi residue maggiori del 30% specie con gradiente pressorio transtenotico maggiore di 10-15 mmHg
• Recidive distrettuali dopo PTA
• Ostruzione dove la sola PTA è poco efficace (come a livello iliaco)
• Ostruzione complessa con altra probabilità di recidiva dopo PTA
In queste due ultime circostanza lo stent viene applicato facilmente, con modesta dilatazione del vaso.
TRATTAMENTO DELLA TROMBOSI VENOSA PROFONDA
Il trattamento delle lesioni venose viene sempre fatto con il cateterismo a monte della lesione, spingendo il
catetere contro il flusso sanguigno.
•
•
•
•
Dolore, edema, iperpigmentazione, ulcere da stasi, ipertensione venosa centrale
Claudicatio
Edema cronico
Insufficienza valvolare
Gli obiettivi della terapia sono:
• Diminuire il disagio del paziente in fase acuta
• Prevenire l’embolia polmonare
• Prevenire la sindrome post flebitica
• Eliminare i sintomi e prevenirne l’accrescimento
La terapia medica è fatta con eparina, che riduce il rischio di embolia polmonare, ma non modifica quello
di sindrome postflebitica.
All’eparina viene quindi associata la terapia trombolitica, sistemica o regionale.
• La trombolisi sistemica viene usata più nelle occlusioni venose che in quelle arteriose, soprattutto se il
trombo è recente. Ha meno rischi di infezione del catetere di quella regionale (sono necessarie molte ore
di terapia), ma ha costi elevati, rischio di sanguinamento, e la lisi del trombo può essere incompleta.
• La trombolisi regionale è importante per ridurre la sindrome postflebitica, provocando la lisi comleta del
trombo. E’ indicata in quei paziente con estesa compromissione dell’arto, edema esteso o TVP massiva.
Oltre all’infusione regionale però è importante fare anche 300 UI di eparina. Le complicazioni
emorragiche ci sono, ma meno che nella terapia sistemica. Ogni otto ore viene fatto il controllo del PTT
e del fibrinogeno.
Nel trattamento della trombosi, onde effettuare una efficace prevenzione dell’embolia, va comunque sempre
fatta eparina.
La terapia chirurgica permette anche la dilatazione della vena e il posizionamento di uno stent.
La percentuale di successo è dell’85%, con il 90% di pervietà del vaso ad un anno di distanza.
Controindicazioni sono:
• Stroke da meno di 1 anno
• Patologia metastatica con interessamento del SNC
• Gravidanza
Filtri cavali
Il posizionamento di filtri cavali è un importante completamento alla terapia della trombosi venosa quando
vi sia:
• Controindicazione, fallimento o complicanze alla terapia anticoagulante
• Embolia polmonare massiva con TVP residua in paziente ad alto rischio per altro episodio
• Trombo fluttuante ileofemorale o cavale (discordanza: è difficile che si stacchi)
• Politraumatismo
o Trauma severo anche senza embolo polmonare documentato
o Trauma cronico chiuso
o Trauma spinale
Mencaroni Spartaco
•
•
17
o Frattura ossa lunghe o bacino
Intervento di protesi all’anca
Pazienti ginecologici (non in gravidanza: il feto può comprimere la cava e dare problemi allo stent)
I filtri possono essere introdotti chiusi, tramite un catetere, nella vena femorale o la vena giugulare interna
destra, e sono portati sotto lo sbocco delle vene renali, aperti e ancorati alle pareti cavali, dove costituiscono
un filtro efficace al passaggio di emboli.
Ce ne sono rimovibili (meno usati) o stabili.
L’embolia polmonare o il suo sospetto clinico costituiscono le indicazioni principali alla instaurazione di
filtri cavali. Oggi la diagnosi di embolia polmonare si fa prima con la scintigrafia polmonare perfusionale e
ventilatoria, (con o senza angio/pneumografia, oggi si tende a non farla più), poi si fa la TC spirale per
dirimere i dubbi.
Complicanze possono essere:
• Migrazione
• Inclinazione
• Perforazione dello stent
• Rottura
• Trombogenicità
2.3 DRENAGGIO DI RACCOLTE FLUIDE
La radiologia interventistica negli ultimi anni ha assunto importanza nel drenaggio delle raccolte sia per una
miglior messa a punto delle tecniche, sia per la presenza di antibiotici che permettono una adeguata copertura
di questi interventi.
Si interviene in quattro fasi:
• Localizzazione della lesione: in genere con ecografia, ma anche con TC che offre vantaggi nelle
raccolte retroperitoneali
• Scelta della via d’accesso: più breve possibile, e con minor interessamento delle strutture vitali: la TC
aiuta molto nella sua definizione
• Aspirazione diagnostica: si inserisce un ago da 20 nella via d’accesso, e aspirando 5 ml di fluido su cui
eseguire le necessarie indagini di laboratorio
• Inserimento del catetere: può essere inserito tramite guida o essere disposto direttamente di ago
perforante. Di solito si usa un 8F. La raccolta viene svuotata il più possibile, poi il catetere viene
ancorato alla cute e lasciato in sede collegato ad un sacchetto di raccolta, fino a normalizzazione del
quadro clinico.
Oltre alle raccolte ascessuali vengono drenate anche le cisti del pancreas, del fegato e dello stomaco.
2.4 INTERVENTISTICA EPATOBILIARE
La colangiografia transepatica rende possibile l’accesso all’albero biliare direttamente dall’esterno, per cui
sono possibili drenaggi e protesi biliari, la dilatazione di stenosi (bilioplastica), e il trattamento di calcoli
intraepatici. Con questa tecnica inoltre è possibile l’irradiazione di tumori maligni delle vie biliari o della
testa del pancreas.
Alcune tecniche importanti sono descritte qui di seguito.
PTC (colangiografia percutanea transepatica)
Si tratta del primo passo da eseguire per ogni procedura successiva invasiva delle vie biliari.
Controindicazioni sono:
• Diatesi emorragica
• Ipersensibilità a mezzo di contrasto
• Tumori maligni
• Malformazioni vascolari
• Ascite di entità rilevante
http://www.hackmed.org
[email protected] 18
Mencaroni Spartaco
Indicazioni sono:
• Palliazione di ostruzioni neoplastiche maligne
• Decompressione delle vie biliari e accesso per successive manovre invasive
• Decompressione preoperatoria delle vie biliari (di scarsa esecuzione)
• Decompressione profilattica dopo PCC o ERCP
Drenaggio biliare percutaneo (DBP)
Indicato nell’ittero ostruttivo, specie maligno, riduce l’entità dell’ittero e migliora le condizioni generali.
Costituisce la base delle altre tecniche.
Si possono fare drenaggi interni o esteri, oppure esterni e interni contemporaneamente. Oltre al drenaggio
chirurgico percutaneo è possibile tentare un drenaggio endoscopico, in genere provato prima.
→ Drenaggio biliare estero
E’ il metodo più semplice di decompressione biliare, per stenosi che non è possibile oltrepassare. Se la
stenosi può essere oltrepassata, si esegue invece un drenaggio interno-estero (vedi oltre)
1. Si cerca di oltrepassare la stenosi con guide angiografiche di varia natura. Se vi si riesce, si esegue
un drenaggio interno-esterno, altrimenti si prosegue con quello esterno.
2. Si inserisce fino a monte della stenosi una guida speciale sulla guida angiografica, detta anche guida
di Lunderquist, che è piuttosto rigida in tutto il percorso, tranne che nel tratto terminale (per evitare
traumi al dotto).
3. Su questa si inserisce il catetere a pig-tail, dotato di numerosi forellini nel tratto terminale arricciato.
4. Si sfila la guida e si effettuano lavaggi con soluzione fisiologica per rimuovere sangue o coaguli
presenti.
5. Si ancora il catetere. L’estremità a coda di porco è già abbastanza stabile, la parte esterna viene
fissata con punti di sutura cutanei o altri sistemi di ancoraggio. Al catetere viene collegata una sacca
di drenaggio
6. Si eseguiranno periodici lavaggi con soluzione fisiologica e antibiotica.
La scelta di questa tecnica si ha quando risulta inutile o impossibile superare l’ostacolo, oppure in presenza
di bile infetta, per evitare la contaminazione delle strutture a valle, oppure in emergenza.
In condizioni elettive, comunque, un drenaggio esterno può diventare esterno-interno facilmente.
Complicanze:
• Spostamenti → si tratta con sostituzione e riposizionamento
• Emobilia (rara) per contemporanea puntura della via biliare e della vena porta (di solito)
• Emorragia in caso di lesione arteriosa o di lesione venosa in corso di ipertensione portale. In questo caso
è necessario eseguire un tamponamento dell’arteria epatica1
• Infezioni batteriche dell’albero biliare
• Insufficiente flusso di bile attraverso il drenaggio
→ Drenaggio biliare interno esterno
Rappresenta una evoluzione della tecnica precedente, e si applica quando sia possibile e conveniente
oltrepassare la stenosi. La tecnica mista consente sia il ripristino della via biliare che la decompressione
esterna a monte della lesione.
1. Si esegue una PTC per documentare la stenosi e assicurarsi che non vi sia bile infetta. La cannula per
la PTC si ferma prima della stenosi
2. Si introduce nella cannula, e quindi oltre la stenosi una guida angiografica. La cannula dovrà essere
posta al centro della stenosi, dove è virtualmente più facile il passaggio della guida.
3. La cannula viene trascinata dalla guida oltre la stenosi
4. Si rimuove la guida e si inserisce nella cannula una guida di Lunderquist, con la quale si inserisce un
pig-tail come descritto prima. Si prende un catetere tipo pig-tail (coda di porco), con fori multipli,
1
Si esegue così: incannulazione dell’arteria mammaria inferiore al di sotto del diaframma, fino al tripode celiaco e da lì
verso l’arteria epatica. Si iniettano sostanze che polimerizzano a contatto con il plasma.
Mencaroni Spartaco
19
che viene posto a valle della stenosi con la punta e a monte della stenosi con la coda. In questo
modo, essendo il catetere forato in più punti, si ha un passaggio della bile attraverso la stenosi.
5. Per i primi giorni, al drenaggio interno attraverso la coda di porco viene accompagnato un drenaggio
esterno, in attesa che le condizioni reologiche della bile tornino normali e sia possibile un buon
flusso attraverso lo shunt
Complicanze:
• Spostamenti: relativamente frequenti
• Emobilie (rare)
• Colangiti
• Ostruzione del catetere
→ Endoprotesi biliare (drenaggio biliare interno)
Le endoprotesi, strumenti essenziali per l’esecuzione di questa tecnica, sono segmenti cilindrici da
posizionare a livello di stenosi giudicate inoperabili, di diversi materiali inerti (teflon, silicone, poliuretano)
di conformazione e lunghezza variabile. Queste sono tutte inserite all’interno del tubo biliare, e a differenza
delle altre due tecniche questo drenaggio non ha sbocchi all’esterno.
Il fattore limitante il flusso è il diametro dello stent, che dovrà essere il maggiore possibile che non incorre in
complicazioni di posizionamento e di invasività.
Siccome gli spostamenti sono le complicazioni maggiori, è importante che lo stent sia lungo abbastanza da
occupare tutta la via biliare e un tratto del lume del duodeno.
Sistemi con anelli circonferenziali diminuiscono le possibilità di spostamento, ma aumentano il trauma al
momento dell’impianto.
L’indicazione all’uso di stent è quasi del tutto a carico della patologia neoplastica maligna, in quanto
un paziente con lo stent è difficilmente operabile. L’utilizzo di stent ricoperti però sta allargando il
campo di applicazione anche alla patologia benigna.
Complicanze:
• Ostruzione: si esegue una sostituzione dello stent occluso, si deve anche posizionare un drenaggio
esterno che permetta di supplire alla funzione carente
• Migrazione (particolarmente frequente con stent)
• Emobilia franca, che si verifica se la via biliare è interessata da una lesione neoplastica che la rifornisce
di molto sangue
• Drenaggio insufficiente
• Ostruzioni tardive parziali o totali
• Colangiti (fino al 10% dei casi)
→ Confronto e indicazioni delle singole tecniche
• Il drenaggio biliare esterno ha essenzialmente o un significato palliativo su lesioni stenotiche non
superabili, o che non ha senso trattare, per migliorare la qualità di vita del paziente. Invece, utilizzato
come tecnica di decompressione preoperatoria, ha l’importante ruolo di trasformare un intervento di
emergenza in una situazione elettiva, nella quale è possibile agire con calma perché si scongiura il
pericolo di danni da ittero ostruttivo.
• Il drenaggio interno esterno e quello interno hanno il vantaggio di ripristinare il circolo entero epeatico
del materiale biliare e quindi devono essere utilizzate quando possibile. Però le lesioni multiple
impediscono il posizionamento di stents e quindi vengono trattate con drenaggio interno esterno.
• Il drenaggio interno elimina le complicazioni legate alla permanenza all’esterno del catetere, ma allo
stesso tempo rende molto difficile intervenire sul sistema se esso ha bisogno di manutenzione. Se è
possibile, però, è in genere considerata la tecnica migliore.
Bilioplastica
Metodica che si usa nelle stenosi benigne delle vie biliari. Si usa un catetere a palloncino per angioplastica
con la stessa tecnica per usata per la PTA.
http://www.hackmed.org
[email protected] 20
Mencaroni Spartaco
Calcoli intraepatici
Ci sono due tecniche per la rimozione dei calcoli in maniera esterna. La prima è con accesso percutaneo o
tipo a T: si inserisce un catetere a palloncino, con il quale si dilata la regione del calcolo. Poi si inserisce un
basket, con il quale si estrae il calcolo.
La seconda tecnica è la papillotomia endoscopica o la dilatazione endoscopica della papilla, e da qui, con
controllo ecografico, si preleva il calcolo trascinandolo nel duodeno.
La prima tecnica è preferibile se il calcolo è alto, la seconda se si trova vicino alla papilla. In certe occasioni
si può anche eseguire una tecnica mista.
Talvolta il catetere può subire un reflusso di bile, e allora si utilizzano cateteri con spirali apposite dette di
Gianturco, che diminuiscono il problema.
TIPS (transjugular intraepatic portosistemic shunt)
Questa procedura è una alternativa alla chirurgia in pazienti con sanguinamento frequente provocato da
ipertensione portale grave. La procedura mette in comunicazione una vena sovraepatica con la branca sinistra
della vena porta. Si introduce un catetere dalla giugulare destra e si raggiunge la cava e la vena sovraepatica
di destra. Con apposito ago, si punge il parenchima fino a trovare un ramo portale, che si incannula con una
guida fino alla porta. Infine, si posiziona in questa via uno stent permanente.
2.5 INTERVENTISTICA URINARIA
La nefrostomia percutanea è una alternativa alla procedura urologica per via ascendente, e trova
indicazione nel drenaggio della pelvi e dell’uretere in presenza di idronefrosi da ostruzione dell’uretere.
A partire da questo intervento si possono poi eseguire altre manovre, come la dilatazione di stenosi, il
posizionamento di cateteri che eseguono un drenaggio urinario interno o esterno, la rimozione di calcoli dalla
pelvi o dai calici.
2.6 INTERVENTISTICA DEL TUBO DIGERENTE
•
•
•
•
Dilatazione di stenosi esofagee: in alternativa all’endoscopia. Si fa una esofagoplastica transluminale
con catetere a palloncino inserendo una guida per via orale, che viene fatta passare fin oltre la stenosi, e
come nell’angioplastica, si fa passare il palloncino che si gonfia (non oltre 3-4 minuti per non produrre
ischemia da compressione).
Dilatazione di stenosi gastriche
Dilatazioni di stenosi nelle anastomosi gastro-coliche, colo-sigmoidee
Gastrostomia percutanea: trova indicazione quando non è possibile l’alimentazione orale per
ostruzione organica dell’esofago, o per cause neurologiche.
2.7 BIOPSIE
Le biopsie “a cielo coperto” possono essere estremamente importanti. Ci sono diversi tipi di biopsie, con
relative tecniche e strumentazioni.
• Citologia: ago aspirativo di diametro inferiore a 0,91 mm (oltre 20G) con punta a becco di flauto,
collegati a siringa che mantiene l’aspirazione forzata
• Istologia: ago tranciante che fornisce fruste di tessuto completo. Calibro in genere maggiore (16-18G)
• Biopsia superficiale: se la lesione è palpabile, non è indispensabile il controllo ecografico, che
comunque mantiene l’ago in posizione e assicura l’esecuzione della manovra corretta.
• Biopsia polmonare: ago sottile riduce il rischio di emorragie (20-22G), la guida TC consente di
raggiungere lesioni profonde e piccole (5 mm). Le lesioni subpleuriche possono essere seguite anche con
controllo ecografico soltanto.
• Biopsia mediastinica: controindicata nelle lesioni vascolare, importante per le masse di natura ignota.
La guida di solito è mediante TC.
• Biopsia sottodiaframmatica: diretta a rene, surrene, fegato, milza. Guida ecografica o TC, aghi diversi
a seconda della sede delle lesioni. Nelle biopsie epatiche è meglio lasciare fra cute e area da trattare uno
strato notevole di parenchima sano che permetta il tamponamento di eventuali sanguinamenti
• Biopsia ossea: principalmente usata per le neoplasie, è meglio della chirurgica per la minor invasività e
quindi minor possibilità di espandere e disseminare la lesione. Sono richiesti aghi speciali per
attraversare le porzioni calcificate dell’osso, o introduttori a vite. Basta la guida RX, ma a volte è
necessaria la TC (ossa piatte, midollo).
Mencaroni Spartaco
21
2.8 INTERVENTISTICA ONCOLOGICA
Chemioembolizzazione (TACE)
(Trans Arterial Chemio Embolization)
Terapia dell’epatocarcinoma e dei carcinoidi neuroendocrini. Iniezione di una sospensione di antiblastico in
mezzo oleoso che produce un embolo nel microcircolo del tumore, prolungando il tempo di contatto fra il
farmaco e il tumore, e togliendo flusso ematico alla neoplasia; questo viene fatto partendo dal presupposto
che i nodi di HCC sono spesso ipervascolarizzati e che la loro vascolarizzazione è per più dell'80% di origine
arteriosa, a differenza del restante parenchima epatico che riceve il sangue prevalentemente dal sistema
portale. La procedura infatti non provoca necrosi del tessuto circostante: perfino l’occlusione di un ramo
principale dell’arteria epatica è tollerata, visto che il fegato riceve il 75% del sangue dal flusso portale.
Al termine dell’infusione viene di solito iniettato un embolizzante riassorbibile (spugna o gelatina) che
prolunga l’effetto.
La procedura può essere fatta sulle vene epatiche (meno costosa e più facile, ma di minor efficacia) sul vaso
afferente al tumore. Nelle lesioni di piccole dimensioni da ottimi risultati (importante la valutazione TC a 15
giorni di distanza).
Questa procedura può essere applicata al polmone in caso di emottisi.
→ Protocollo operativo nel trattamento del carcinoma epatico con TACE.
• Studio angiografico completo del fegato (il circolo portale viene analizzato osservando la fase di ritorno
venoso del mezzo di contrasto iniettato nel tripode celiaco).
• Cateterismo superselettivo dell’arteria epatica di dx o sx, e poi dell’arteria segmentaria efferente al
tumore
• Iniezione di 50-70 mg di chemioterapico emulsionato con 10-15 ml di lipsodol (olio molto radiopaco,
che si fissa bene nelle lesioni ipervascolarizzate e aumenta la permeabilità delle cellule neoplastiche al
farmaco)
• Iniezione del materiale embolizzante
→ Il massimo risultato si ottiene con lesioni capsulate e se il cateterismo è superselettivo.
Indicazioni sono:
• HCC uninodulare maggiore di 3 cm, ipervascolarizzato. Se la lesione è minore di 8-9 cm si può anche
associare PEI
• HCC multinodulare che occupa meno del 40% del volume del fegato
Indicazioni all’associazione TACE + PEI sono:
• HCC uninodulare 3-9 cm
• Classe A o B di Child
• Assenza di trombosi portale
• Piastrinemia maggiore di 40000
L’applicazione contemporanea di TACE e PEI da grossi vantaggi perché l’effetto di una procedura si riflette
positivamente sull’altra:
EFFETTO DELLA TACE
MIGLIORAMENTO SULLA PEI
→
Diminuzione della consistenza parenchimale per → Migliore diffusione dell’alcool etilico
necrosi e distruzione dei setti
Reazione fibrosa successiva
→ Migliore ritenzione in loco dell’alcool
Embolizzazione
→ Ridotto wash out ematico dell’alcool
Controindicazioni:
• Child C
• Volume neoplastico maggiore del 40% del volume epatico
• Trombosi dei rami portali principali
• Shunt artero-portale
http://www.hackmed.org
[email protected] 22
Mencaroni Spartaco
→ Controllo dell’efficacia
Si fa un primo ciclo di terapia, poi la TC a 4 settimane di controllo. Segue un altro ciclo combinato con PEI e
infine un controllo con TC e aFP a 3 mesi.
L’utilizzo di lipsodol permette di osservare se il tumore è stato distrutto dalla terapia e in che misura. Al
controllo, il lipsodol molto opaco dovrebbe sostituire interamente la neoplasia. In base al pattern di
sostituzione si valuta la percentuale di necrosi:
• Denso e uniforme → 90-100%
• Con difetto singolo → 70-80%
• Sfumato - parziale → 50-70%
• A spot, assente → < 50%
→ Complicanze:
• Dolore
• Febbre intermittente
• Scompenso epatico
• Ulcera gastrica
Perfusione arteriosa
Posizionamento di cateteri permanenti di diametro tale da essere contenuti in una arteria afferente al tumore,
con serbatoio sottocutaneo contenente il farmaco, ad essi collegato. Le metastasi epatiche vengono spesso
trattate in questo modo.
Altri tipi di perfusione sono allo studio:
• Perfusione ipossica: occlusione arteriosa temporanea della zona neoplastica, successiva instillazione di
antiblastico
Alcolizzazione (PEI)
Inizialmente terapia di epatocarcinomi inferiori a 3 mm, estesa poi a lesioni secondarie o di maggior
diametro.
Consiste nell’instillazione in sede di alcool etilico al 99%, che provoca danno con duplice meccanismo,
diretto e conseguente alla trombosi dei piccoli vasi arteriosi interessati.
Per lesioni estese si possono utilizzare fino a 200 ml di alcool in anestesia generale (è dolorosa, soprattutto in
lesioni sottocapsulari).
Il trattamento di piccoli noduli non richiede ospedalizzazione e nemmeno anestesia. I risultati sono molto
buoni solo su lesioni molto piccole.
E’ un protocollo di minor efficacia rispetto alla chemioembolizzazione, e che ha il rischio di sgocciolamento
del liquido nel peritoneo, con peritonite chimica. Inoltre è scarsamente applicabile nei tumori provvisti di
capsula perché l’etanolo tende a diffondere eccessivamente dal sito di inoculo e a causare una perdita
eccessiva di parenchima epatico. In questi casi, se proprio non esistono altre opzioni è opportuno fare più
somministrazioni frazionate. Questa metodica ha il vantaggio di essere pratica, estremamente economica e
con scarse complicanze (peritonite chimica e ascessi infetti)
R.I.T.A.
Elettrocoagulazione a radio frequenze. Si introduce un ago elettrodo grande (15-18G), collegato ad un
generatore che produce attorno alla punta dell’ago, per effetto Joule, una dispersione termica in grado di
distruggere la neoplasia (la testina dello strumento sviluppa fino a 110°C) causando necrosi coagulativa
come l’etanolo ma in maniera più controllabile.
Non è dolorosa e non ha particolari controindicazioni, tranne che nel trattamento di lesioni vicino ai vasi o ai
dotti biliari, che possono essere danneggiate dal calore. Vantaggi rispetto all’alcolizzazione: meno
complicanze; svantaggi: metodica + complicata, necessita di anestesia locale o profonda se il tumore è
abbastanza vicino alla glissoniana.
Altre tecniche
• Fotocoagulazione laser: sotto guida ecografica con sonde a fibre ottiche collegate a un generatore laser,
inserite in ago da 19G inserito nella lesione.
• Ablazione con microonde: infissione diretta di apposito elettrodo che emette radiazione
elettromagnetica a 2450 MHz. Efficace su lesioni di diametro inferiore a 2 cm
Mencaroni Spartaco
•
•
Ablazione con ultrasuoni
Crioterapia (neoplasie prostatiche)
23
http://www.hackmed.org
CAP 3
RADIOLOGIA
[email protected] 24
Mencaroni Spartaco
DELLE STRUTTURE DEL COLLO
3.1 RINOFARINGE
Il rinofaringe, lo spazio aereo delimitato dal piano passante per il palato molle, le coane nasali e il pavimento
della fossa cranica anteriore, è ben visibile nell’RX diretta latero-laterale del cranio, con il paziente in
espirazione a naso e bocca chiusi.
Una analisi perfetta di questa struttura è però possibile soltanto con la TC, che è indispensabile per la
stadiazione delle neoplasie, patologia di più frequente interesse radiologico.
La cavità è radiotrasparente, e in proiezione LL assume un aspetto a clava, con la delimitazione posteriore
dei corpi vertebrali ben visibili.
Alcune condizioni in cui è importante lo studio radiologico:
• Ipertrofia adenoidea: tumefazione netta, peduncolata, parenchimatosa, che non modifica le strutture
ossee circostanti
• Cisti di Thornwaldt: cisti caratteristica che si sviluppa da residui della notocorda, ed ha un rapporto
caratteristico con il muscolo lungo del collo
• Neoplasie rinofaringee: importante la TC
I tumori maligni del rinofaringe possono essere infiltranti o peduncolati, in genere sono molto invasivi ed
hanno frequentemente un interessamento delle strutture ossee circostanti.
Lo studio RX diventa importante non soltanto per l’individuazione della lesione primitiva, ma soprattutto per
la stadiazione dell’invasione ossea e della loro estensione alla base del cranio.
La TC con scansione assiale è l’esame di elezione.
La RM invece assume una importanza ancora maggiore nell’osservazione dell’invasione dei piani muscolari
profondi e delle strutture nervose.
Sia la TC che la RM sono inoltre importanti per lo studio delle strutture attorno al faringe, che possono
essere spesso sede di fenomeni neoplastici.
3.2 LARINGE
L’esame diretto LL è il primo approccio al laringe: sebbene in questo modo le strutture dei due lati sono
sovrapposte, la proiezione AP non è fattibile in quanto il laringe è contenuto fra trachea e colonna vertebrale.
La TC, o alternativamente la RM, sono in grado di visualizzare invece tutte le strutture del laringe nel
dettaglio.
Le situazioni in cui si impone lo studio radiologico del laringe sono:
• Laringiti: soltanto in quelle situazioni in cui la laringoscopia è di difficile esecuzione, per edema o per
altre circostante, e in cui sia importante documentare l’interessamento di strutture adiacenti da parte di
processi infiammatori come ascessi.
• Papillomi: diagnosi differenziale fra ispessimenti di natura infiammatoria e quadri di TBC o di tumori
maligni.
• Carcinoma laringeo: la TC consente di identificare la lesione primitiva, e valutare la sua estensione alle
strutture circostanti, che in questo tumore è rapida e precoce. Inoltre è importante per la scelta del tipo di
intervento chirurgico e della metodica conservativa più adatta. Infine ha un ruolo importante nella ricerca
delle metastasi linfonodali.
• Paralisi laringee: in quelle monolaterali si mette in evidenza le asimmetrie fra le due corde vocali e si
può dare un giudizio clinico sulla lesione.
• Laringocele: facilmente diagnosticabili alla TC; spesso il laringocele è dovuto alla compressione da
parte di neoplasie, che con l’esame radiologico possono essere ricercate.
3.3 COLLO
Essendo una struttura composta essenzialmente di tessuti molli, questa risulta esplorabile principalmente
tramite ecografia, TC e soprattutto RM. Questa tecnica, in particolare, permette di eseguire seriazioni
decisamente sottili e ad alta risoluzione lungo tutte le direzioni dello spazio.
Le lesioni del collo vengono prima di tutto localizzate a seconda del loro rapporto con le fasce e le altre
strutture cervicali, e poi ne viene analizzata la consistenza e le altre caratteristiche.
In presenza di linfoadenopatie, che sono significativamente frequenti, la diagnosi si basa su reperti
morfologici e dimensionali, e quindi è molto meno efficace della biopsia.
Mencaroni Spartaco
25
Il ruolo principale delle tecniche di imaging è quindi quello di identificare e localizzare le lesioni, da
indagare successivamente con la biopsia.
3.4 TIROIDE
Si tratta di una struttura ben esplorabile anche alla semplice palpazione, e si possono valutare con relativa
certezza “a mano” tutte le lesioni e gli ispessimenti superiori ad 1 cm. Tuttavia spesso si palpano come
singoli noduli multipli, e sono male interpretabili le lesioni tiroidee.
E’ comunque importante, quindi, il ricorso a numerose tecniche di imaging, con vari obiettivi:
• Ricerca, definizione e caratterizzazione di lesioni nodulari
• Definizione dell’estensione di neoplasie
• Valutazione strutturale e funzionale della tiroide
• Definizione della presenza di tiroidi ectopiche o accessorie
• Controllo postoperatorio
• Controllo dell’estensione regionale e a distanza dei tumori maligni
METODI DI INDAGINE
RX diretta
Non è visibile per la sua scarsa opacità e per il contrasto basso con i tessuti circostanti. Ma se vi sono
ectopie, marcato ingrandimento o calcificazioni allora questi si rendono evidenti all’RX standard.
Ecografia
Esame elettivo per il primo approccio diagnostico alla patologia tiroidea, sia direttamente che come supporto
per l’esecuzione di biopsie.
Importante anche per la valutazione dei diametri, della struttura, per la caratterizzazione delle masse e dei
noduli, per il controllo postoperatorio.
Normalmente appare una struttura con due lobi lievemente asimmetrici, ecostruttura omogenea con echi fini
e regolari, iperecogena rispetto ai muscoli circostanti e alla trachea. I lobi sono limitati da una sottile capsula
iperecogena rispetto al parenchima, e possono esservi delle vene ipoecogene.
Aree ipoecogene fluide di non più di 2-3 mm sono normali accumuli di colloide.
Lo studio ecografico cerca:
• Dimensioni e morfologia della ghiandola
• Ricerca di noduli, di cui si osserva l’ecostruttura e la presenza di calcificazioni. All’eco si evidenziano
noduli cistici di circa 1mm e solidi di circa 3 mm
• Ricerca di adenopatie laterocervicali
• Valutazione della mobilità, capsula, presenza di infiltrazione dei tessuti attorno al collo.
• Vascolarizzazione dei noduli con il power e il color doppler.
Scintigrafia
Vedi parte di medicina nucleare
TC
Tecnica di seconda istanza per lo studio della tiroide. Non è in grado di distinguere direttamente fra lesioni
maligne o benigne, ma trova indicazione in:
• Stadiazione dei tumori maligni
• Stadiazione del linfoma tiroideo
• Ricerca di recidive postoperatorie
• Valutazioni di gozzi plongeant e dei loro rapporti con la trachea
• Valutazione del volume della tiroide nella programmazione della terapia con radioiodio.
• Valutazione dell’esoftalmo nel Basedow.
RM
Indicazioni simili a quella della TC, rispetto alla quale ha il vantaggio di poter disporre di più piani di
osservazione e di non necessitare del mezzo di contrasto iodato. A volte si riesce anche a distinguere fra
lesioni maligne e benigne, e spesso fra recidive e cicatrici nel postoperatorio.
http://www.hackmed.org
[email protected] 26
Mencaroni Spartaco
SEMEIOTICA RADIOLOGICA DELLA PATOLOGIA TIROIDEA
Malformazioni
• Aplasia e ipoplasia: all’eco il parenchima risulta assente o diminuito di volume; è importante la
scintigrafia per identificare aree di tiroide funzionante residue.
• Ectopia: si rivela con l’ecografia e soprattutto con la scintigrafia, risolutiva nell’evidenziare tessuto
tiroideo funzionante (con Tc o meglio ancora con iodio marcato).
• Cisti del dotto tireoglosso: formazione anecogena, variabilmente corpuscolata.
Alterazioni di funzione
• Ipertiroidismo di Basedow:
o Ecografia: dimostra ingrandimento diffuso e simmetrico della tiroide
o Scintigrafia Tc: aumento dell’attività fino a simulare la scintigrafia con I
o Color doppler: diffusa vascolarizzazione con velocità di flusso elevate per presenza di shunt
AV
o RM: aumento diffuso del segnale
• Ipertiroidismo da gozzo multinodulare tossico:
o Scintigrafia: aree ad aumentata e diminuita attività alternate
o Eco: ingrandimento per la presenza di noduli multipli iso o ipoecogeni.
• Ipertiroidismo da adenoma tossico di Plummer:
o Scintigrafia: regione ipercaptante, quasi sempre, in corrispondenza dell’adenoma
o Ecografia: nodulo di varia ecogenicità, con aspetti di ipervascolarizzazione, ed aree lacunari
all’interno
• Ipotiroidismo: sia primitivo che secondario, l’ecografia valuta il volume della tiroide, la scintigrafia il
residuo funzionale.
Gozzi
Il gozzo è l’aumento di volume della ghiandola. L’iperplasia tiroidea (o struma) è invece la presenza di aree
nodulari disseminate nel tessuto della tiroide.
L’iperplasia tiroidea diffusa non mostra caratteri particolari all’ecografia, in quando la trama tiroidea è di
solito normale. L’esame diretto AP dimostra nel gozzo cervicale una deviazione della trachea laterale, poiché
il gozzo è praticamente sempre asimmetrico.
In radioscopia si vede lo spostamento della massa tiroidea durante deglutizione o colpi di tosse.
Con l’ecografia si valuta efficacemente anche l’incremento volumetrico della ghiandola, che in età pediatrica
diffuso, non nodulare.
Nell’adulto prevalgono la nodularità e le degenerazioni colloido-cistiche.
La scintigrafia dimostra un tessuto funzionante con aree nodulari fredde.
TC e RM possono aiutare a comprendere la posizione del gozzo e i rapporti con le strutture adiacenti.
Tiroiditi
• Acute: ecografia rivela aumento di volume, con margini mal definiti e aree ipoecogene sfumate nel suo
contesto. L’aspetto al color doppler è ipovascolare per l’edema interstiziale.
• Tiroidite di Hashimoto: il volume aumenta inizialmente, poi diminuisce; l’ecostruttura è disomogenea
per la presenza di micronoduli, ipoecogeni, che sono molto indicativi. Il parenchima può apparire diviso
in lobi da setti fibrosi. Il flusso ematico aumenta.
• Tiroidite cronica fibrosa di Riedel: ecostruttura fortemente ipoecogena, e la scintigrafia mostra una
diminuzione della captazione su tutta la ghiandola.
Lesioni focali
Lo studio delle lesioni, di qualunque natura, si avvale fondamentalmente di ecografia, agoaspirato
ecoguidato, e talvolta della scintigrafia. Il problema diagnostico è in pratica la determinazione della natura
maligna o benigna delle lesioni.
Il valore predittivo della scintigrafia su questo non è eccellente: intanto la sua sensibilità è minore di quella
dell’ecografia, e poi se è vero che il 99% dei noduli caldi sono benigni, soltanto il 20-30% di quelli freddi
sono maligni.
Mencaroni Spartaco
27
Alcuni segni ecografici indicativi di benignità del nodulo sono:
• Iperecogenicità
• Presenza di componenti cistiche
• Presenza di livelli fluidi
• Alone perinodulare di spessore costante (capsula)
• Margini nett e definiti
• Calcificazioni periferiche a guscio d’uovo
• Più segni insieme aumentano la probabilità di nodulo benigno
Segni ecografici di malignità sono:
• Ipoecogenicità
• Alone ipoecogeno spesso e irregolare (infiltrazione)
• Calcificazioni sparse (corpi psammomatosi del carcinoma papillifero, o depositi di amiloide del
carcinoma midollare anaplastico)
• Invasione di strutture anatomiche adiacenti
Descrizione delle lesioni più frequenti
• Cisti: struttura per lo più anecogena con sepimentazioni, livelli fluidi, detriti
• Adenomi: solitari, spesso non funzionanti. Sono di ecostruttura variabile, con alone ipoecogeno spesso e
regolare. Possono diventare funzionanti, e allora sono caldi alla scintigrafia e intensamente vascolarizzati
al color doppler
• Tumori maligni.
o Carcinoma papillare: multifocale, precoce interessamento dei linfonodi locali. Di solito è un
nodulo ipoecogeno, a contorni mal definiti, spesso con corpi psammomatosi. Al color
doppler è ben vascolarizzato
o Carcinoma follicolare: invasività variabile e precoce. Insorge spesso su un precedente gozzo
multinodulare. Il solo esame citologico, e peggio ancora quello ecografico, non consentono
la diagnosi. Spesso all’ecografia la capsula risulta precocemente invasa (presenza di alone
ipoecogeno ampio e irregolare)
o Carcinoma midollare: spesso associato alla MEN, secerne calcitonina (molto indicativo), ed
è una lesione spesso unica, ipoecogena, intensamente vascolarizzato. Contiene calcificazioni
di amiloide, non capta iodio ma prende la meta-iodio-benzilguanidina.
o Carcinoma anaplastico: estremamente invasivo e a prognosi grave. Degenerazione delle altre
forme, appare come una massa infiltrante con grossolane aree di necrosi interne. RM e TC
sono indispensabili per la stadiazione
o Linfoma: 4% dei tumori tiroidei, si sviluppa su una tiroidite di Hashimoto, come una massa
ipoecogena di discrete dimensioni, con più lobi. L’accertamento istologico è indispensabile
per la diagnosi.
Spesso le neoplasie differenziate hanno una capacità residua di captare lo iodio, molto minore (2-3%) del
tessuto normale: quindi la scintigrafia può aiutare ad evidenziare queste neoplasie per mezzo del contrasto
che si crea fra il tessuto tumorale e quello normale.
http://www.hackmed.org
CAP 4 POLMONE
[email protected] 28
Mencaroni Spartaco
E
PLEURA
4.1 CENNI DI ANATOMIA
I due polmoni sono separati in lobi da scissure che si approfondano nel parenchima fino all’ilo, diverse fra
destra e sinistra.
A destra il polmone risulta diviso in tre lobi, superiore, medio e inferiore, da
due scissure:
•
•
Scissura obliqua (grande scissura) che separa il lobo superiore e medio da
quello inferiore. Inizia posteriormente all’altezza dell’ilo, sale seguendo la
superficie posteriore e portandosi lateralmente, fino ad incrociare il margine
laterale del polmone all’altezza del IV spazio intercostale, quindi scende
anteriormente e medialmente sulla faccia anteriore.
Scissura orizzontale (piccola scissura) che separa il lobo medio dal
superiore. Si origina anteriormente dalla grande scissura quando essa si
trova al livello del VI spazio intercostale, e prosegue orizzontalmente
circondando tutto il polmone
A sinistra invece il polmone ha soltanto la scissura obliqua, che separa il lobo superiore e la lingula
(l’equivalente del lobo medio di destra) da quello inferiore. La scissura è simmetrica a quella corrispondente
dell’altro polmone.
VIE AEREE
La trachea, organo pari e mediano (leggermente deviato a destra, con una impronta aortica a livello
dell’angolo della biforcazione) è il primo tratto delle vie aeree, di circa 18 mm di diametro,.
Si divide, a livello del suo incrocio con l’arco aortico e le arterie polmonari, in due bronchi principali, di
destra e di sinistra, con un angolo di circa 57°.
Il bronco di destra ha un diametro maggiore di quello di sinistra (12 mm e 10 mm), e si dirige all’ilo del
polmone corrispondente con un tragitto rettilineo e più breve di quello del bronco di sinistra. L’ilo di sinistra
è più alto di quello di destra.
Dopo i bronchi principali, si hanno una serie di ramificazioni all’interno del polmone, così schematizzabili.
NUMERO DI
DIRAMAZIONI
NOME
0
1
2
Trachea
Bronchi principali
Bronchi lobari
3
Bronchi segmentari
DIAMETRO
COMMENTI
(MM)
18
Una
12
Uno per polmone
7
3 a destra, 2 a sinistra (il
superiore fornisce un
ramo per la lingua)
5
10 a destra, sette a
sinistra
4
4–1
1 - 0,5
Scompare cartilagine e
tessuto elastico
4
5-10
11-13
Bronchi sub segmentari
Piccoli bronchi
Bronchioli
14-16
Bronchioli terminali
0,5
17-19
Bronchioli respiratori
0,5
20-22
Dotti alveolari
0,4
Scompaiono le cellule
secernenti
Epitelio cubico
STRUTTURE
Ognuno ad un lobo
Ognuno ad un
segmento
Gli ultimi vanno
ognuno ad un lobulo
secondario
Gli ultimi vanno
ognuno ad un acino
Gli ultimi vanno
ognuno ad un lobulo
primario
Mencaroni Spartaco
29
23
Sacchi alveolari
0,4
24
0,3
300 milioni X polmone
Alveoli
I dieci bronchi segmentari si distribuiscono ai dieci segmenti di destra, che sono:
• Apicale superiore
• Anteriore
• Posteriore
• Laterale
• Mediale
• Apicale inferiore
• Mediale basale
• Anteriore basale
Unità funzionale
I sette segmenti di sinistra sono:
• Segmentario apico-posteriore
• Segmentario anteriore
• Lingulare
• Apicale inferiore
• Medio-antero basale
• Laterale basale
• Posteriore basale
I segmenti sono importanti perché sono unità ventilatorie e circolatorie indipendenti.
I lobuli secondari sono la più piccola unità riconoscibile ad occhio nudo. Ognuno di loro ha la forma di una
piramide con l’apice verso l’ilo, da cui penetra il peduncolo bronchiolo arterioso, che successivamente si
ramifica seguendo le varie ramificazioni dei bronchioli terminali. Alla periferia del lobulo decorrono le vene
e i linfatici per questa struttura. Essa è la più piccola unità anatomica e funzionale identificabile nel
polmone.
L’acino invece è la struttura anatomica che fa
capo ad un bronchiolo terminale, (16°
diramazione).
Nell’acino sono organizzati gli alveoli, che
però si possono trovare anche nella parete dei
bronchioli respiratori di primo, secondo e
soprattutto terzo ordine. Gli acini sono
contenuti nei lobuli in numero di 3-5, e
hanno un diametro da 5 a 7 mm.
Dal punto di vista radiologico l’acino può
essere considerato come l’unità di base del
polmone.
Alla fine della terza diramazione dei
bronchioli polmonari la struttura dei
bronchioli non esiste più. Qui (19°
diramazione) inizia il lobulo, che sarà
composto soltanto da dotti alveolari e
alveoli. L’alveolo (24° diramazione) è la più
piccola unità anatomica del polmone.
All’interno di essi avvengono, tramite la loro
sottile parete, gli scambi alveolo-capillari.
http://www.hackmed.org
[email protected] 30
Mencaroni Spartaco
Gli alveoli, con la loro parete di forma a sfera incompleta (5/6), offrono una superficie complessiva di circa
40-90 m2 a seconda delle variazioni di età, sesso, costituzione, decubito.
All’interno sono rivestiti da un epitelio pavimentoso che poggia su una membrana basale. L’epitelio, fatto di
pneumociti di ordine I, è intervallato da pneumociti di ordine II che producono surfactant. Questo ha la
funzione di diminuire la tensione superficiale dell’interfacies aria sangue, e impedire il collasso dell’alveolo
secondo la legge di La Place.
I capillari esterni che li circondano hanno una parete abbastanza sottile da permettere la diffusione dei gas
respiratori durante il tempo di transito dei GR attorno agli alveoli.
A livello delle vie aeree più piccole (dotti alveolari) sono presenti delle comunicazioni dette pori di Kohn,
che sono le più numerose comunicazioni fra le vie aeree (ne esistono altre, come i canali di Lambert fra i
bronchioli terminali, ma sono meno importanti). Queste strutture garantiscono la distribuzione ventilatoria e
pressoria fra i comparti polmonari, e la loro disfunzione provoca o aggrava alcune patologie (enfisema,
pneumoconiosi).
VASCOLARIZZAZIONE
Il circolo polmonare ha bassa pressione ed elevato flusso; la bassa pressione è essenziale per evitare la
trasudazione del plasma negli alveoli o nell’interstizio. L’elevato flusso è indispensabile per motivi
emodinamici (flusso del cuore destro uguale a quello sinistro) e per garantire l’ossigenazione
dell’emoglobina.
L’arteria polmonare decorre nel mediastino dopo la sua origine dal ventricolo destro, (dove forma l’arco
sinistro medio del radiogramma mediastinico) e si divide in due rami all’altezza del suo incrocio con l’arco
aortico. La branca destra decorre orizzontalmente e si divide prima di arrivare all’ilo in due tronconi
(superiore e inferiore), la branca sinistra continua il decorso del tronco comune e si divide dentro l’ilo.
Entrambe le arterie si ramificano esattamente come i bronchi fino al terzo ordine, poi iniziano le arteriole
muscolari (fino ad 1 mm di diametro) e in seguito quelle elastiche (fino a 30 um).
Normalmente la vascolarizzazione alle basi è maggiore che agli apici.
Le vene polmonari nascono agli alveoli, con i capillari, le venule e le vene. Esse decorrono alla periferia
del lobulo, mentre invece le arterie sono centrali. Alla fine all’ilo confluiscono in due tronchi a destra e a
sinistra, che sboccano nell’atrio di sinistra.
Questo sistema arterioso serve soltanto agli scambi alveolari. La nutrizione del polmone è assicurata dalle
piccole arterie bronchiali, che originano a sinistra dall’aorta (2) e a destra (1) dalla prima delle arterie
intercostali. Queste si ramificano similmente alle arterie polmonari. Il loro ritorno venoso avviene per 2/3
nelle vene polmonari (senza influire sull’ossigenazione del sangue data lo loro modesta portata) e per 1/3 alla
vena azygos tramite anastomosi con le mediastiniche e le esofagee.
DRENAGGIO LINFATICO
I linfatici sono distinguibili in due gruppi principali:
• Intrapolmonari: accompagnano il peduncolo bronco-arterioso fino ai dotti alveolari
• Sottopleurici: formano un reticolo attorno ai lobuli secondari, seguendo le vene alla periferia del lobulo.
Tutte questi sistemi drenano ai linfonodi in intrapolmonari e mediastinici, secondo una suddivisione
territoriale che non ha niente a che vedere con la suddivisione lobare.
• Territorio superiore: corrisponde alla parte superiore e mediale del lobo superiore, e drena la linfa alla
catena laterotracheali omolaterali, e ai linfonodi mediastinici anteriori
• Territorio medio: corrisponde alla parte inferiore laterale del superiore, al medio e all’apice del lobo
inferiore a destra; alla lingula e all’apice del lobo inferiore a sinistra. Drena ai linfonodi laterotracheali
dello stesso lato e a quelli sottocarenali
• Territorio inferiore: corrisponde alla restante parte del lobo inferiore, e drena ai linfonodi sottocarenali
e a quelli laterotracheali dello stesso lato.
Punti di repere importanti sono:
Mencaroni Spartaco
•
•
31
Linfonodo Azygos: nell’angolo tracheobronchiale a destra
Linfonodo del dotto arterioso: nell’angolo trachobronchiali a sinistra, più laterale di quello di destra
4.2
ESAMI RADIOGRAFICI DEL POLMONE
RADIOGRAFIA
L’apparato respiratorio ha il vantaggio, essendo pieno d’aria, di possedere un contrasto naturale che permette
già all’esame diretto di evidenziare diverse caratteristiche della sua struttura.
Si effettua di solito in due posizioni:
• Sagittale PA: con il paziente in piedi, in proiezione postero anteriore (per evitare l’ingrandimento del
cuore che viene avvicinato alla sorgente di emissione), possibilmente in apnea per aumentare il contrasto
aereo. Si rendono così visibili:
o il disegno polmonare vascolare (la componente aerea non lo forma perché è
radiotrasparente). Il parenchima si vede solo in condizioni patologiche.
o la trachea: ipertrasparenza nastriforme, mediana, che si divide nei due bronchi principali,
anch’essi visibili
o il mediastino, come un’area di opacità centrale in cui sono apprezzabili caratteristiche linee,
come gli archi cardiaci, i ripiegamenti pleurici eccetera
o gli emidiaframmi (si chiamano così perché sono diversi da ciascun lato). Quello di destra si
continua con il cuore, ed è circa 1 cm più alto del sinistro per via del fegato. Al di sotto del
sinistro si può apprezzare la bolla gastrica.
o l’ilo polmonare (a metà fra clavicola e diaframma). L’ilo radiologico è costituito dai grossi
bronchi e dalle arterie polmonari che gli conferiscono un aspetto a virgola.
•
Laterale LS: la proiezione laterale standard è a sinistra, sempre per il motivo dell’ingrandimento del
cuore, ma si può fare anche a destra se vi sono reperti patologici da quella parte. Il paziente è in piedi con
gli arti superiori sollevati e paralleli. Si la riproduzione sovrapposta dei due polmoni e del mediastino, e
quindi non si fanno confronti fra le due parti. Si vedono però:
o Sterno anteriore e colonna posteriore: due aree di opacità fra le quali è visibile la trasparenza
del campo polmonare. Dello sterno è possibile apprezzare le varie componenti
o Trachea, sempre visibile come immagine nastriforme trasparente
o Bronchi principali: presi di taglio dal fascio di radiazione, appaiono come due ombre
trasparenti sull’asse della trachea, quello destro più in alto.
o Ombra cardiaca. Una opacità ovale che parte dal VI spazio intercostale,
o Ombra vascolare, dell’aorta (in corrispondenza dell’istmo dove sporge toccando il polmone
e creando un contrasto naturale) e della vena cava superiore (davanti e parallela alla trachea,
come una striscia opaca).
o Emidiaframmi: essendo sfalsati sono riconoscibili distintamente, quello destro è più in alto
o Le arcate costali sono ben distinguibili.
L’apice polmonare radiologico è la porzione di polmone al di sopra della linea orizzontale passante per
l’interno della clavicola.
Poiché è impossibile riconoscere radiologicamente le scissure polmonari, si distingue in radiologia un campo
polmonare superiore e uno inferiore. Il primo campo va dall’apice polmonare radiologico alla linea che
passa per l’estremo osseo anteriore della terza costa. Il resto (lobo medio/lingula e lobo inferiore) è detto
campo polmonare inferiore.
Il lobo superiore è in alto, il lobo medio in avanti, il lobo inferiore posteriore.
In radiologia può essere importante valutare la dinamica della respirazione polmonare, e si può fare o
attraverso la radioscopia dinamica, oppure osservando le variazioni fra una lastra in espirazione e una in
inspirazione.
Le regioni polmonari che subiscono un escursione maggiore in inspirazione sono le basi, che sono meglio
ventilati dell’apice. Nella fase espiratoria l’aria si riduce molto di più alle basi che all’apice, e questo, unito
alla maggior perfusione, provoca un maggior opacamento basale in ispirazione, specialmente a paziente
eretto (per l’aumento della P idrostatica alle basi). Questo è importante soprattutto per la possibilità di
interpretare questo opacamento come un reperto patologico.
http://www.hackmed.org
[email protected] 32
Mencaroni Spartaco
Interpretazione dei risultati: ombre non patologiche
Frequenti cause di ombre di dubbia interpretazione, ma non patologiche, sono:
• Mammelle femminili: vistosa differenza di trasparenza in caso di mastectomia unilaterale.
• Capezzoli (anche maschili)
• Calcificazioni esuberanti della prima costa (frequente)
• Ombre dei muscoli pettorali e dorsali in soggetti robusti
• Vestiti, ornamenti, medicazioni
• Scissure polmonari soprannumerarie (della azygos)
• Cuscinetto adiposo epipericardico particolarmente sviluppato
• Immagini della pleura
• Ombra della clavicola e dello sternocleidomastoideo
TC POLMONARE
E’ essenzialmente un completamento della radiologia, utile per la valutazione delle regioni ilari,
costodiaframmatiche, retrocardiache.
Sono utilizzate tecniche dirette e con l’aggiunta di mezzo di contrasto.
Esistono essenzialmente quattro tecniche di base:ù
• TC convenzionale: strati multipli di 5-10 mm, nella quale la risoluzione è sufficiente a permettere
l’osservazione anche dei bronchi piccoli
• TC ad alta risoluzione: strati di 1-2 mm di spessore, permette di identificare le strutture fini (scissure,
bronchioli, setti interlobulari) e le relative patologie
• TC spirale: in singola apnea si acquisisce tutto il volume toracico, con ricostruzione delle immagini a 5
mm o anche a 3 mm. Queste immagini, sottoposte a complesse ricostruzioni permettono la creazione di
immagini 3D molto dettagliate (broncoscopia virtuale, angiopneumografia).
• TC dinamica: indagine TC realizzata in modo da visualizzare le variazioni del parenchima polmonare in
momenti respiratori diversi (ad esempio in espirazione ed inspirazione). Può essere realizzata
semplicemente ripetendo la stessa scansione nella stessa zona in momenti diversi. E’ molto utile per
identificare fenomeni di intrappolamento aereo tipici delle bronchioliti.
E’ un esame importante sia per lo studio istologico fine delle lesioni, che per la localizzazione di esse in aree
mal raggiungibili con l’esame diretto. Inoltre è indispensabile per la stadiazione di lesioni infiltrative.
Il radiogramma è importante come esame di prima istanza, la TC come conferma e definizione.
SCINTIGRAFIA
Esistono due forme, quella ventilatoria e quella perfusionale. La prima ovviamente da informazioni sulla
ventilazione, la seconda sulla perfusione.
Ha un ruolo di prima istanza nello studio dell’embolia, dove il reperto di discrepanza fra ventilazione e
perfusione è patognomonico.
In condizione di alterata ventilazione o perfusione (o entrambe) si osservano:
• Lacune segmentali → tromboembolia, ostruzione bronchiale
• Lacune non segmentali → enfisema, ipertensione arteriosa
• Lacune eterogenee → bronchite cronica
ANGIOPNEUMOGRAFIA
Si realizza con puntura della femorale o una vena antecubitale del braccio, e cateterismo del tronco comune o
di un ramo (selettiva) o di una diramazione successiva (superselettiva).
Le indicazioni sono:
• Malformazioni arterovenose del polmone
• Tromboembolismo
• Malattie vascolari sistemiche con ripercussione sul polmone
Si può anche fare una arteriografia toracica con cateterismo retrogrado transfemorale, e da qui una
arteriografia bronchiale completa. E’ utilizzata di solito nei pazienti con emoftoe irrefrenabile di origine
neoplastica.
Mencaroni Spartaco
33
ECOGRAFIA
In genere nella patologia toracica si usa poco, perché lo scheletro e l’aria sono un ostacolo invalicabile agli
ultrasuoni. Sono però ugualmente importanti nell’esecuzione di manovre di radiologia interventistica
(toracentesi, drenaggio di versamenti saccati, biopsie superficiali).
RM
Il segnale emesso dal parenchima polmonare ha una intensità troppo bassa per permettere una risoluzione
anatomica delle strutture vascolari. Attualmente, perciò, si usa soltanto per valutare l’infiltrazione parietale
dei tumori apicali.
4.3
SEMEIOTICA RADIOLOGICA DELLE MALATTIE POLMONARI
Come criterio generale, in un radiogramma toracico assume significato patologico qualsiasi variazione
della densità in più o in meno rispetto al normale valore del parenchima polmonare.
Si parla quindi di:
• Opacità: in presenza di lesioni che addensano il parenchima riducendone o annullandone la normale
trasparenza (chiazze “bianche”). Qualsiasi processo che diminuisca il contenuto d’aria nei polmoni
ottiene questo risultato.
• Ipertrasparenza: presenza di lesioni a contenuto aereo (cisti, bollo di enfisema, cavità) che si lasciano
attraversare dai raggi X e sono quindi “più scure” del parenchima circostante.
Anche la distribuzione delle opacità o ipertrasparenze può essere importante (lobulare, segmentale, lobare) e
dare informazioni sul processo patologico in atto.
ATELETTASIA POLMONARE
L’atelettasia è la riduzione di volume di una parte di polmone in conseguenza alla diminuzione del contenuto
aereo di bronchi e alveoli. Il meccanismo può essere vario (da occlusione e riassorbimento, da compressione,
da infarto, da versamento), ma in genere ci si riferisce all’atelettasia che si crea per ostruzione e
riassorbimento.
In relazione alla sede dell’ostruzione delle vie aeree, l’atelettasia sarà segmentaria, lobare o polmonare (più
piccole sono difficilmente rilevabili). L’ostruzione spesso è di natura neoplastica, ma anche da compressione
esterna al polmone, cicatrici retraenti, processi infiammatori, corpi estranei (specie nella prima infanzia).
L’ostruzione determina atelettasia da riassorbimento, ma non sempre: infatti si può avere una ostruzione
incompleta che permette il rifornimento di aria con meccanismo a valvola, oppure si può avere una
comunicazione fra le vie aeree a valle dell’ostruzione stessa.
L’opacità si realizza pian piano, mentre l’aria viene riassorbita, e non è il primo segno di una atelettasia.
Segni di atelettasia lobare
• Dislocazione delle scissure, proporzionale alla variazione di volume dello spazio atelettasico. Vi sono
alterazioni delle scissure (come la concavità inferiore della grande scissura di destra) indicative di
atelettasia di un particolare lobo.
• Risalita dell’emidiaframma interessato (specie nel lobo inferiore)
• Spostamento del mediastino verso l’area atelettasica; la parte superiore del mediastino si sposta nelle
atelettasie superiori, viceversa quella inferiore.
• Iperinflazione del polmone residuo dello stesso lato o del polmone controlaterale. Il parenchima
iperdisteso si presenta trasparente con attenuazione (per distanziamento) della trama vascolare.
• Dislocazione dell’ilo verso l’aria atelettasica
• Riduzione dell’ampiezza degli spazi intercostali per “restringimento” del parenchima atelettasico.
Bisogna assicurarsi che non dipendano dalla scoliosi del paziente
• Assenza del broncogramma aereo: nel contesto degli altri addensamenti, infatti, si osservano sempre, per
contrasto, uno o più bronchi che proiettano sopra la loro immagine, normalmente invisibili.
Nell’atelettasia questo non succede. Questo segno è importante nella diagnosi differenziale con le altre
opacità.
Nell’atelettasia polmonare totale, invece, il mediastino è così tirato dal lato interessato che il polmone sano
può oltrepassare la linea di mezzo. Nella regione anteriore superiore (spazio di Nitsch), nella regione
http://www.hackmed.org
[email protected] 34
Mencaroni Spartaco
posteriore inferiore (spazio retrocardiaco) questo movimento è più evidente. In proiezione anteriore il
polmone “erniato” appare delimitato da quello atelettasico da una linea curva.
Alcune volte l’atelettasia dipende dalla riduzione del volume polmonare secondaria a compressione
estrinseca (quindi non ad ostruzione bronchiale). Queste atelettasie vengono chiamate anche collasso
polmonare o atelettasie compressive.
L’esempio più frequente è lo pneumotorace, ma anche il versamento pleurico e altre condizioni ne sono
responsabili.
A differenza del precedente, il meccanismo di riduzione del volume è la riduzione delle forze elastiche del
polmone, o della trazione pleurica, o l’aumento delle forze che lo comprimono. La pervietà bronchiale però
rimane, e quindi in queste forme è frequentemente visibile il broncogramma aereo.
Una forma particolare è quella da collasso per difetto di surfactante, che si chiama anche atelettasia adesiva:
il broncogramma aereo è spesso presente nelle prime fasi della malattia, che consegue ad alterazioni dello
sviluppo polmonare neonatale (malattia a membrane ialine).
Sono forme di collasso anche le atelettasie lamellari, spesso chiamate anche linee di Fleischener che
conseguono alla scarsità di espansione delle basi polmonari e spesso sono quindi appannaggio di soggetti
obesi o operati al torace ed addome, traumatizzati.
Queste “distelettasie”, uniche o multiple, sono opacità lineari di 2-3 mm di spessore, orizzontali sopra il
diaframma, che si risolvono però spontaneamente.
OPACITÀ ALVEOLARI
Si formano quando l’aria negli spazi aerei è sostituita, per un qualsiasi motivo, da liquido: il processo in
genere si estende rapidamente a causa della presenza delle suddette comunicazioni fra le vie aeree.
Le più piccole riconoscibili sono quelle dell’acino (6-8 mm), poi quelle del lobulo (10-25 mm) che possono
confluire in forme lobari.
Sono in genere delle aree cotonose, con margini cioè molto sfumati, con evidente e ben riconoscibile
broncogramma aereo (frequente se le alterazioni sono alveolari, come la polmonite, meno se il processo
interessa anche o soprattutto i bronchi, come nella bronchite).
Le cause di opacità possono essere distinte in acute e croniche:
•
Acute:
•
o
o
o
o
o
Croniche:
o
o
o
o
o
Edema polmonare
Malattia a membrane ialine
Polmoniti
Broncopolmoniti
Emorragie e inalazioni di liquidi e gas tossici (rare)
TBC
Sarcoidosi
Micosi
Linfomi e Carcinoma bronchiolo-alveolare.
Pneumopatia post irradiazione
In genere le opacità hanno caratteristiche, a seconda del processo che le provoca, abbastanza peculiari.
• Polmonite: tendono a raggiungere dimensioni segmentarie o lobari, diventando omogenee (opacità
diffuse). Frequente broncogramma aereo
• Broncopolmonite: disomogenee, broncogramma aereo spesso assente
• Edema cardiaco: addensamenti basali (gravitazionali) bilaterali, rapidamente confluenti (il trasudato,
meno viscoso, si muove con rapidità negli spazi polmonari)
• Edema vasogenico o infiammatorio: addensamenti a chiazze, omogeneamente distribuiti dall’apice alla
base, con minor tendenza alla confluenza (perché proteinacei e viscosi)
• Alveoliti: il riempimento è parziale, non si manifestano vere e proprie opacità, ma una “velatura” della
trasparenza diffusa, che da al quadro il nome di aspetto a vetro smerigliato.
Mencaroni Spartaco
35
OPACITÀ INTERSTIZIALI
Si tratta di ispessimenti che riguardano l’interstizio peribronchiale o attorno ai vasi (grosso interstizio)
oppure quello intralveolare (piccolo interstizio).
Sebbene siano molti i meccanismi alla base di questo ispessimento (trasudazione, essudazione, ingorgo
linfatico, proliferazione del connettivo…) il risultato è abbastanza omogeneo, anche se è possibile, con segni
particolari individuare spesso il processo specifico alla base.
Tutte queste opacità sono comunque:
• Piccole (< 1cm)
• Limitate all’interstizio
• Molteplici
• A margini netti
• Non confluenti
• Disposte su un fondo trasparente normale (se non sono troppe)
Si distinguono quattro tipi principali di opacità interstiziali:
→ Interstiziopatie reticolari
malattie diffuse dell’interstizio grosso, spesso associate al coinvolgimento delle strutture linfatiche. Si
ispessiscono le pareti dei grossi bronchi, che danno un aspetto reticolato, a binario. Sarcoidosi,
collagenopatie, edema interstiziale, asbestosi, fibrosi idiopatica.
→ Linee di Kerley
sono linee di opacità orizzontali, caratteristiche dell’interessamento dell’interstizio attorno ai lobuli, o di
quello subpleurico. Sono di due tipi:
• Tipo A: centrali e intraparenchimali, di 1 mm di spessore e 3-4 cm di lunghezza. Corrispondono ad aree
di tessuto connettivo nei quali corrono linfatici o vene, ispessite per via dell’edema, o della proliferazione
fibrosa.
• Tipo B: periferiche e basali, disposte perpendicolarmente alla superficie pleurica, sono dovuti
all’ispessimento, per gli stessi motivi, dei setti interlobulari, che sono periferici.
• Tipo C: è in realtà un artefatto di proiezione delle linee B
→ Interstiziopatie nodulari
malattie dell’interstizio peribronchiale, o che giungono tramite la distribuzione arteriosa, o linfatica, o per via
inalatoria; tutte assumono aspetto nodulare, con dimensioni variabili a seconda della malattia. Le malattie
che prediligono la via arteriosa (TBC miliare) si localizzano in posizione centrolobulare, quelle che
prediligono la via linfatica (Sarcoidosi) in posizione periferica. Sarcoidosi, TBC, linfomi, metastasi
→ Interstiziopatie cistiche
malattie fibrosanti come la fibrosi idiopatica, asbestosi eccetera sono caratterizzate da una sostituzione
dell’architettura polmonare, e nel rimaneggiamento rimangono piccoli spazi cistici. Questi si vedono meglio
con la TC ad alta risoluzione, e sono caratteristiche areole rotondeggianti ipertrasparenti, di pochi mm.
ALTERAZIONI DEL CIRCOLO POLMONARE
Pressioni polmonari normali
→ Arteriosa: 15-30 mmHg
Ipertensione lieve: 30-40
Ipertensione moderata: 40-70
Ipertensione grave: > 70
→ Venosa: 12 mmHg
Ipertensione lieve: 12-18
Ipertensione moderata: 18-25
Ipertensione grave: > 25
Iperafflusso
http://www.hackmed.org
[email protected] 36
Mencaroni Spartaco
Conseguenza di shunt cardiaco fra S e D, sforzi, gravidanza, febbre, tireotossicosi. Perché sia visibile è
necessario un incremento di almeno il 50-70% dei valori basali. Si rileva un incremento del disegno
vascolare del polmone, che tuttavia mantiene normali caratteristiche dei distribuzione e morfologia.
In queste condizioni non si verifica ipertensione, almeno fin quando il polmone riesce a mantenere il
compenso aumentando il calibro delle arteriole e diminuendo le resistenze.
Ipoafflusso
Tetralogia di Fallot, stenosi polmonare, embolia, obliterazione e distruzione di vasi (vasculiti), vasculopatia
ipossica. In tutte queste circostanze c’è una diminuzione del flusso ematico al polmone, con relativa
diminuzione del disegno polmonare e della sua trasparenza.
Deviazione
Il dirottamento ematico consiste in una deviazione compensatoria del flusso da territori danneggiati verso
altri integri, e si esprime con un aumento distrettuale del disegno, accompagnato ad una diminuzione, sempre
distrettuale, del disegno in altre zone.
Ipertensione venosa polmonare da insufficienza mitralica → dirottamento verso gli apici perché l’aumento
della pressione venosa è soprattutto basale. In questo caso si vedrà che il disegno dei campi superiori
eguaglia quello dei campi inferiori.
Ipertensione arteriosa
La pressione aumenta quando i meccanismi di riserva (territori poco irrorati, vasodilatazione arteriosa) sono
già stati sfruttati. Alcuni segni altamente indicativi sono:
• Dilatazione del tronco della polmonare (secondo arco di SX) e dei rami principali
• Dilatazione dei rami arteriosi all’ilo, che provoca un aspetto dell’arteria “ad albero potato”. La distanza
interpeduncolare (cioè fra il punto di massima concavità del profilo esterno degli ili) aumenta oltre 10 cm
nel maschio, 9,5 nella femmina.
• Restringimento successivo dei rami arteriosi dell’ilo: l’arteria assume allora un aspetto “a racchetta da
tennis” con il manico all’ilo
Ipertensione venosa
Attraversa caratteristicamente delle fasi precise:
• Dirottamento
o Aumento disegno dei lobi superiori
• Edema interstiziale:
• Edema alveolare
• Trasudazione pleurica
E’ importante il suo riconoscimento precoce. Si manifesta in genere per condizioni di scompenso
ventricolare sinistro.
L’ipertensione arteriosa e venosa insieme (pre e post capillare) si verificano nella condizione di scompenso
cardiaco acuto associato ad embolia, frequente nei politraumatizzati e nei reparti intensivi. Il quadro è la
somma degli altri due.
OPACITÀ SINGOLE ROTONDEGGIANTI PERIFERICHE
Il problema con queste è capire se si tratta di forme neoplastiche o malformative, e nel primo caso se sono
maligne e benigne. Causa le molteplici difficoltà diagnostiche, si considerano masse maligne fino a prova
contraria.
Si valutano:
• Accrescimento nel tempo: con più RX successivi. Qualsiasi dimostrazione di accrescimento di un
nodulo polmonare è motivo sufficiente per la sua asportazione. Quando nel radiogramma aumenta di
1,25 volte il diametro, il nodulo ha raddoppiato il volume. Il carcinoma broncogeno ha un tempo di
raddoppio di 2-18 mesi, i granulomi attivi di qualche settimana, le lesioni benigne di anni.
• Forma: scarsa utilità
• Diametro: se superiore a 4 cm a rischio
• Margini: i tumori benigni hanno margini ben definiti, i carcinoma nell’85% hanno margini sfumati
• Lobature: l’80% dei carcinomi hanno mammellonature periferiche che gli danno un aspetto lobato.
Mencaroni Spartaco
•
•
•
•
•
•
•
37
Espansioni a spina: sono espressione di tessuto connettivo che si irradia dai margini di un tumore e che
segue all’esterno. Possono essere presenti nei granulomi, ma di soliti sono fenomeni reattivi del
connettivo sano alla presenza di una neoplasia
Corona radiata: alone trasparente che circonda la lesione, formato da tessuto enfisematoso. E’
considerato fortemente indicativo della malignità della lesione.
Immagine lineare periferica: opacità lineare unica (a coda di topo) o duplice (a orecchie di coniglio),
che si estende dal margine laterale delle lesioni periferiche verso la pleura. Sembra legata all’invasione
delle cellule neoplastiche maligne nei confronti dei linfatici subpleurici.
Escavazione: maggiore è l’opacità, tanto più frequente è l’escavazione, dovuta alla presenza di aria che
entra attraverso le connessioni bronchiali all’interno della lesione.
Calcificazione: in genere segno di un processo benigno. Anche un tumore maligno può calcificare, o
possono farlo le aree di necrosi e di emorragia al suo interno; in genere le calcificazioni nelle lesioni
maligne sono distribuite alla periferia.
Rapporti con le scissure: le lesioni benigne tendono ad arrestarsi in corrispondenza di una scissura,
quelle maligne no.
Condizioni del paziente: fattori di rischio (fumo), età, sesso.
CALCIFICAZIONI
Avviene solitamente nel contesto di tessuti degenerati o necrotici, quindi esprime processi patologici già
esauriti. Ma può anche essere espressione di una patologia attiva.
• Parenchimali isolate: esito di un processo granulomatoso, in genere TBC (per esempio focolaio di
Ghon)
• Parenchimali diffuse: originano da diversi processi di natura trasudatizia, da pneumoconiosi, infezioni,
polmoniti, ipercalcemia, mieloma.
• Linfonodali: in genere accidentali nella TBC; caratteristiche quelle a “guscio d’uovo” della silicosi
• Pleuriche: vistose, a volte formano la così detta pleurite calcifica, un segno di pregresso emotorace,
piotorace, o versamento da asbesto.
• Tracheali: specie in età senile, quando è un fenomeno fisiologico. Le calcificazioni tracheali giovanili
possono essere indici di ipercalcemia o iperfosfatemia. Esiste anche una malattia con calcificazioni
tracheali ad origine sconosciuta.
• Arterie polmonari: nell’ipertensione precapillare, aneurismi della polmonare (raro), trombi
4.4
PROCESSI INFETTEVI DEL POLMONE
Si tratta in questo capitolo essenzialmente della tubercolosi e della polmonite, con qualche cenno ad alcune
comuni manifestazioni dell’AIDS, che sono piuttosto frequenti e in cui l’importanza della radiologia
diagnostica è elevata.
POLMONITI
Ci limitiamo a riportare i quadri radiologici diagnostici delle varie forme.
• Lobare tipica: da pneumococco, il batterio si moltiplica a livello alveolare dando luogo ad una
essudazione con scarsa componente cellulare. Il risultato è una opacità omogenea ad estensione lobare,
nel contesto della quale si apprezza sempre il broncogramma aereo. Si differenzia dall’atelettasia per
questo e per il volume normale, e da un esteso processo di TBC per l’assenza di lesioni cavitarie.
• Da Klebsiella: anche questo batterio colonizza l’alveolo, ma l’essudazione è molto abbondante e si può
avere un aumento di volume del lobo; si possono anche formare ascessi e fenomeni distruttivi a carico
del parenchima (fistole)
• Broncopolmonite: iniziano a livello bronchiale, e decorrono interessando gli alveoli in maniera
asincrona. Si osservano quindi opacità alveolari multiple, chiazzate, con interessamento anche
dell’interstizio attorno ai bronchi. Il processo è in genere limitato ad un segmento. Se il batterio
interessato è lo stafilococco, si possono avere focolai multipli che evolvono in ascessi. L’aspetto è
“nuvoloso”, ma a differenza della polmonite interstiziale, tende alla confluenza e si addensa.
• Interstiziale: tipica da virus e micoplasmi. L’edema e l’infiltrato interessano l’interstizio più che gli
alveoli, e quindi abbiamo una serie di opacità reticolari, e opacamenti alveolari a vetro smerigliato, che si
manifesta in pratica con un opacamento diffuso, come un velo di fumo sovrapposto al campo polmonare
interessato.
http://www.hackmed.org
[email protected] 38
Mencaroni Spartaco
FORME POLMONARI DA IMMUNODEFICIENZA
Riguardano in particolare i malati di AIDS, i soggetti in terapia immunosoppressiva, i malnutriti, i pazienti in
età avanzate, coloro costretti a terapie antibiotiche prolungate.
Aspergillosi invasiva
Grave forma da immunocompromesso, che coinvolge cuori, fegato, rene, cervello. A livello polmonare si
hanno diverse manifestazioni, la più comune delle quali è una broncopolmonite con addensamenti a
chiazze, che possono formare ascessi.
L’infarto emorragico con opacità rotondeggianti singole o multiple è anche abbastanza frequente.
Candidiosi polmonare
Addensamenti parenchimali a chiazze, con tendenza a confluire
Pneumocistosi
Si osserva in oltre la metà dei pazienti AIDS. Il quadro del radiogramma toracico è piuttosto caratteristico, ed
evolve in stadi successivi:
• Opacità reticolari o nodulari attorno all’ilo e alle basi
• Addensamenti a chiazze
• Edema alveolare intenso
Nelle fasi precoci l’RX è negativa, allora si può ricorrere alla TC ad alta risoluzione, o alla scintigrafia con
Ga-citrato che è estremamente specifica. Talvolta per la diagnosi di certezza può essere importante la
biopsia.
TUBERCOLOSI
La sintomatologia clinica che induce un sospetto di TBC (in soggetto a rischio o con contatti a rischio) è:
• Tosse persistente per almeno 3 settimane
• Febbricola persistente
• Sudore notturno
• Astenia, inappetenza, calo ponderale
• Emoftoe, dolore toracico, dispnea, alterazioni funzionali (forme avanzate). Oggi le emoftoe sono rare,
tempo fa erano frequentemente il sintomo di esordio.
Iter diagnostico
→ Al primo sospetto clinico è importante eseguire:
• RX torace standard
• Test Mantoux: lettura dopo 72h. Positivo alone di 5 mm in soggetti esposti professionalmente, malati
HIV, tossicodipendenti. Per gli altri, positivo alone di 10 mm.
• Esame diretto e colturale dell’espettorato: 3 campioni in 3 giorni distinti.
Con terapia steriodea o antiblastica la reazione di Mantoux può essere negativa. Nell’anziano è meglio
ripetere la tubercolina dopo 15 giorni, per effetto Booster.
Se il paziente non espettora, si può ricorrere ad aerosol con soluzione ipertonica e avvertire il laboratorio
della procedura. In alternativa si fa la broncoscopia con aspirazione diretta del materiale.
→ In presenza di una tubercolina positiva ed espettorato negativo, con quadro RX incerto, si procede così:ù
• Materiale in coltura su terreno particolare (metodo BACTEC) → risposta in 15 giorni
• TC
• Broncoscopia o ricerca PCR in caso di urgenza
• Terapia nell’attesa con antibatterici non attivi su micobatterici (betalattamici), poi ripetere esami
colturali.
→ In presenza di sospetto clinico di TBC extrapolmonare:
• TBC linfoghiandolare: esame istologico e citologico dopo biopsia del linfonodo
Mencaroni Spartaco
•
•
•
39
TBC genito-urinaria: esame batteriologico delle urine raccolte in tre giorni diversi. I campioni possono
essere conservati fino a 24h a +4° C.
Versamento pleurico: dosaggio ADA
TBC ossea e intestinale: diagnosi radiologica e biopsia
Il radiogramma del torace è un importante mezzo di screening, e spesso riesce a dirimere il quadro clinico.
Alla TC si ricorre quando:
• Sospetto di localizzazioni extrapolmonari
• RX – con clinica sospetta
• RX - ma con lesioni sospette
La TC può essere diretta o con mezzo di contrasto, ed ha il vantaggio di individuare le lesioni miliariche,
precisare numerose caratteristiche dei noduli polmonari, analizzare le zone di consolidazione, la
disseminazione bronchiale, le adenomegalie ilo-mediastiniche, e ovviamente tutte le lesioni extratoraciche.
Semeiotica radiologica della TBC
TBC primaria
Il picco di incidenza della TBC primaria è attorno ai 30 anni, ed è importante la diagnosi differenziale con la
sarcoidosi e il linfoma di Hodgkin.
Il così detto complesso primario (lesione polmonare + focolaio linfonodale) lascia tre reperti caratteristici
ben identificabili all’esame RX standard:
• Focolaio parenchimale: alveolite focale periferica non specifica che evolve in focolaio infiammatorio
dopo una decina di giorni. Si manifesta come una opacità singola, a limiti abbastanza netti, di tipo
alveolare.
• Opacità ilare: adenopatia ilare consensuale che si manifesta con un ingrandimento e opacamento
dell’ilo omolaterale, con diverse opacità omogenee, massive, a contorni netti.
• Strie linfatiche e adenopatiche: espressione della linfangite, si tratta di strie che collegano il focolaio
parenchimale a quello ilare, non sempre presenti.
Il 95% dei processi tubercolari tendono alla guarigione spontanea, e in questi casi possono eventualmente
recidivare delle lesioni calcificate a livello ilare legate alla calcificazione dei linfonodi, e meno comunemente
lesioni analoghe nel parenchima.
Nonostante questo, però, sono molte le possibili evoluzioni sfavorevoli e le complicazioni:
• Cavitazione del focolaio primario: formazione di una immagine trasparente, rotondeggiante, isolata. Da
qui può diffondere nei bronchi materiale bacillifero con formazione di ulteriori lesioni.
• Fistolizzazione dell’adenite: nelle pareti di un bronco provoca disseminazione dei bacilli
• Stenosi bronchiale : in genere il bronco lobare medio o quello lingulare. Si forma una polmonite cronica
• Disseminazione ematogena precoce
TBC post primaria
Si manifestano diverse lesioni a seconda della predominanza degli aspetti essudativi o di quelli produttivi.
• Infiltrato precoce di Assmann-Redeker: si tratta della forma essudativa più frequente, consistente in
una alveolite essudativa specifica circoscritta, che evolve verso la caseosi e l’ulcerazione, con
formazione di una caverna. Si localizza praticamente sempre al segmento posteriore del lobo superiore, e
quindi è al disotto della clavicola. Radiologicamente è una opacità tenue, rotondeggiante, di qualche
centimetro di diametro, a contorni sfumati. A differenza del complesso primario, non ha adenopatia ilare
attorno a sé. Guarisce se trattato.
• Lobite tubercolare: si ha una caseosi diffusa a tutto il lobo, con la formazione di ulcere e di escavazioni
che danno al tessuto un aspetto “a formaggio svizzero”.
• Broncopolmonite a localizzazioni multiple: opacità prevalentemente alveolari, disseminate a tutti i
campi dei due polmoni, che evolvono rapidamente verso le caverne
•
Forme miliari: sono forme produttive, originate di solito da una disseminazione ematogena o linfatica;
si formano un gran numero di granulomi tubercolari sparsi in tutti gli organi che sono spesso invisibili
http://www.hackmed.org
•
•
[email protected] 40
Mencaroni Spartaco
alla RX (ma non sfuggono alla TC, che è l’esame di elezione per questa forma). Le forme diffuse
tendono alla confluenza dei granulomi che appaiono come opacità nodulari ben definite.
Infiltrato fibro-nodulare all’apice: forma favorevole, produttiva e circoscritta, di TBC produttiva. La
TC permette di identificare le alveoliti, invisibili all’RX.
Adenite: processo di ripresa locale (ilare) degli esiti del complesso primario, con il quale è difficile la
diagnosi differenziale.
Le forme essudative e produttive spesso coesistono, rendendo più complessi i quadri radiologici. In genere
però le forme generali sono sempre riconoscibili.
Le caverne, aspetto evolutivo tipico e importante della malattia, sono visibili come una ipertrasparenza
delimitata, con differenze morfologiche nella parete a seconda del meccanismo per cui si originano.
Forme croniche
• Lobite cronica
• TBC cronica
• Tubercoloma: opacità rotondeggiante di oltre 1 cm di diametro, con calcificazione a volte presente. La
sua densità è maggiore di quella delle altre lesioni tubercolari.
Tubercolosi guarita e sindrome post tubercolare
I reperti più frequenti di una TBC guarita (esiti) sono:
• Fibrosi interstiziale
• Cicatrici
• Calcificazioni
• Bronchiettasie
Diagnosi differenziale
• Carcinoma: non ci sono calcificazioni, no enfisema centrolobulare, no caverne
• Sarcoidosi: adenopatia ilare bilaterale
• Linfomi
• Micobatteriosi atipiche
Trattamento
I bacilli migliorano le loro capacità moltiplicative con l’apporto di O2 dall’esterno, quindi nelle caverne si
hanno lesioni molto infette.
La resistenza spontanea ai farmaci è:
• Isoniazide: 1/106
• Streptomicina: 1/105
• Rifampicina: 1/105
• Pirazinamide: 1/103
In una lesione cavitaria ci sono circa 108 bacilli, e bisogna contare la capacità ulteriore di acquisire
resistenza. Da qui la necessità di agire con un trattamento a 3 o 4 farmaci.
Il medico decide di trattare il paziente per TBC quando in genere ottiene un escreato, la radiologia e la
coltura positive.
In base al tipo di paziente, vi sono diverse classi di rischio e di trattamento relativo
TIPO DI PAZIENTE
PRIORITÀ
TRATTAMENTO
Nuovo caso
Alta
2 mesi: isoniazide, rifampicina, pirazinamide e
etanbutolo2
4 mesi: isoniazide + rifampicina
Recidive
Bassa
2 mesi: isoniazide, rifampicina, pirazinamide,
etanbutolo, streptomicina
1 mese: sospensione streptomicina
4 mesi: di nuovo con i 5 farmaci iniziali
Fallimento
Alta
2
Isoniazide ed etanbutolo sono attivi contro i bacilli extracellulari, gli altri contro gli intracellulari
Mencaroni Spartaco
Mantoux positiva dopo 5 mesi di
terapia
Paziente cronico
41
Bassa
ALTRE MANIFESTAZIONI INFETTIVE COMUNI
Ascesso
Alcune forme infettive con tendenza fin dall’inizio ad una aggressiva attività cellulare necrotica evolvono
frequentemente con la formazione di ascessi.
Quando una opacità diventa un ascesso, il suo nucleo centrale si fa più denso e omogeneo; ma se l’ascesso si
svuota su un bronco o in un’altra cavità, allora compare una cavità trasparente molto spesso contenente un
livello liquido molto ben apprezzabile.
La parete interna può essere regolare o no a seconda della presenza o meno di residui infettivi. L’ascesso può
complicare una importante neoplasia periferica.
Micosi
• Istoplasma: nodulo ben definito, diametro inferiore a 3 cm, con calcificazione centrale caratteristica “a
bersaglio”.
• Actinomices: all’inizio è radiologicamente indistinguibile dalla polmonite lobare, ma poi cronicizza in
una forma granulomatosa con tendenza invasiva.
• Aspergillus: la forma saprofitica, non invasiva, caratterizzata da un accumulo di filamenti all’interno di
una cavità già esistente, ha un aspetto radiologico peculiare, con una formazione opaca rotondeggiante
omogenea all’interno di una cavità ovale, separata da una banda trasparente di vario spessore. La forma
invasiva è descritta nel paziente immunodepresso.
Echinococcosi
L’echinococcosi è una malattia diffusa soprattutto in Sardegna (allevamento delle pecore), in cui il parassita
provoca delle cisti polmonari.
Queste hanno un aspetto caratteristico, con opacità omogenea, a contorni molto netti (tracciati con il
compasso!), che ne permette la distinzione. Spesso può essere presente nella cisti una trasparenza falciforme,
dovuta alla penetrazione di aria.
4.5
NEOPLASIE POLMONARI
Il primo approccio diagnostico ad una neoplasia polmonare è in genere radiologico.
Il tumore al polmone è la prima causa di morte per neoplasia negli uomini, e la seconda nelle donne dopo il
cancro al seno, anche se l’incidenza nel sesso femminile sta aumentando di pari passo con il fumo. (in
California, per l’applicazione di rigide norme contro il fumo, si è avuto invece una riduzione di incidenza).
Epidemiologia
Morti per carcinoma polmonare (Italia): 30000/anno
Si tratta di un tipo di neoplasia in cui la chirurgia può poco, e il miglioramento delle tecniche non ha dato
grandi frutti (la sopravvivenza a 5 anni si è spostata dal 9 al 13% negli ultimi 20 anni). Importante quindi la
diagnosi precoce e la prevenzione.
Fattori di rischio:
• Fumo di tabacco
• Fumo passivo (stimato responsabile di 2000-5000 morti all’anno in Italia)
• Asbesto (associazione con il fumo: RR X 53)
• Radon
• Bisclorometilestere
• Idrocarburi aromatici policiclici
• Cromo, Nickel
• Arsenico
• Predisposizione genetica
http://www.hackmed.org
[email protected] 42
Mencaroni Spartaco
Rischi di esposizione
→ Fumo: M 22, F 12
→ Fumo passivo: 1 - 2,55
→ Asbesto:
non fumatore: 5
fumatore: 53 – 90
Diagnosi precoce del carcinoma
Sottoporre ad una diagnosi precoce alcune categorie di pazienti porta ad un anticipo diagnostico (È dello
staging), anche se la mortalità non risulta nel complesso significativamente diminuita.
I paziente da sottoporre a screening sono:
• Fumatori > 20 sigarette/die di età superiore a 45 anni
• Soggetti professionalmente esposti a fattori di rischio
• Precedenti familiari o personali di neoplasie polmonari
Le indagini di screening più adeguate sono l’RX torace e l’esame citologico dell’escreato.
Sensibilità:
• RX torace: 40-50%
• Esame cit: 25-30%
• Entrambi: 60-70%
•
•
•
•
•
Oltre a questo, i risultati ottenibili con la metodiche diagnostiche radiologiche sono parecchi.
Identificazione della lesione: RX standard per lesioni di dimensioni medio-grande, TC per lesioni
periferiche o piccole. Piccole lesioni bronchiali ad evoluzione endobronchiale sono visibili solo con la
broncoscopia.
Diagnosi di natura: RX e TC sulla base di reperti morfologici possono dare informazioni sulla natura
benigna e maligna di un nodulo. La TC può dare anche informazioni sulla via d’accesso per la biopsia,
mentre la PET è molto sensibile nell’indicare lesioni proliferative (altamente captanti).
Staging T: TC e RM
Staging N: TC e RM accuratezza 60%, PET oltre 90%. Importanti anche le tecniche di biopsia,
anch’esse ecoguidate.
Ricerca di metastasi: la PET ha la massima sensibilità ovunque ad eccezione dell’encefalo dove è
superiore la RM. Nei casi meno avanzati di neoplasia, quando è improbabile una diffusione metastatica,
viene eseguita di solito una TC toracica e surrenale.
Sintomatologia generale
I sintomi della neoplasia sono dovuti a:
• Crescita centrale o periferica del tumore
• Diffusione nel mediastino
• Diffusione sistemica
• Sindromi paraneoplastiche
CRESCITA CENTRALE
CRESCITA
PERIFERICA
DIFFUSIONE
MEDIASTINO
Tosse
Tosse (75%)
Tosse secca
Dolore localizzato
Dispnea (50-60%)
Emoftoe
Dolore toracico (45-49%)
Dispnea ostruttiva
Emoftoe (29-35%)
Stridore toracico
Febbre
Dolore toracico vago,
persistente, diffuso
Il dolore è legato sia all’interessamento della parete, che alla distruzione ossea,
molle, alla compromissione nervosa.
DIFFUSIONE SISTEMICA
Perdita di peso (68%)
Dolore osseo (25%)
Clubbing digitale (20%)
all’infiltrazione del tessuto
Criteri di malignità all’RX (diagnosi precoce)
Durante l’esame RX di un nodulo parenchimale, alcuni criteri morfologici assumono carattere prognostico.
Malignità
Benignità
Mencaroni Spartaco
43
• Dimensioni stazionarie da oltre 2 anni
• Presenza di calcificazioni
• Margini regolari
• Piccole dimensioni
• Lesioni satelliti
• Escavazione con parete sottile e livello idroaereo
Sono ovviamente reperti indicativi, ma poiché l’RX è il primo approccio diagnostico, è importante avere già
a questo livello una serie di parametri di riferimento per farsi un’idea diagnostica che possa influenzare l’iter
operativo.
•
•
•
•
Assenza di calcificazioni
Opacità > 3cm
Margini irregolari
Aumento dimensioni nel tempo
Iter diagnostico standard del carcinoma polmonare
1. Anamnesi (rischio professionale e voluttuario)
2. Esame obiettivo
3. RX torace
4. Esami ematobiochimici (raramente alterati)
5. Esame citologico dell’escreato
6. Fibrobroncoscopia
7. TC torace. Se lesione periferica si aggiunge anche biopsia transparietale o toracoscopia
8. Biopsia linfonodi prescalenici
9. Mediastinoscopia
10. Toracotomia
Dopo l’RC e la TC, il carcinoma centrale viene indagato con la broncoscopia e l’esame citologico, quello
periferico con la biopsia transparietale, la broncoscopia se possibile, la toracoscopia, la toracotomia.
Staging
L Indagini per la stadiazione
• TC torace e addome superiore con mezzo di contrasto
• Biopsia linfonodi mediastinici di diametro maggiore di 1 cm (nei casi operabili)
• Scintigrafia ossea e TC cerebrale solo in caso di sospetto clinico o se lo staging è N2
L La stadiazione del sistema TNM viene fatta per tutti i tipi di tumore polmonare e viene in genere
effettuata una distinzione in quattro stradi, che non si applica però al microcitoma: questi stadi permettono
poi di effettuare una diversificazione della terapia.
• Stadio 1a: T1; N0; M0
• Stadio 1b: T2: N0; M0
• Stadio 2a: T1; N1; M0
• Stadio 2b: T2; N1; M0 / T3; N0; M0
• Stadio 3a: T3; N0; M0 / T1-2 ; N2; M0
• Stadio 3b: T; N3; M0 / T4; N; M0
• Stadio 4: T; N; M1
Il limite di operabilità è fra lo stadio 3a e 3b
La stazione si applica anche in maniera più specifica alle diverse forme del tumore a seconda della loro
localizzazione: infatti soprattutto per quanto riguarda la T, è difficile definire con precisione un T1 da un T2
eccetera.
Staging T
Si distinguono quindi tre tipi di tumore, per ognuno dei quali ci sono dei criteri T specifici, per ogni stadio.
Essi sono i tumori ilari, i tumori intraperenchimale, e i tumori periferici.
Stadio
Is
1
Ilare
Intraparenchimale
Carcinoma in situ
Occupa un bronco segmentario o Minore di 3 cm
lobare, non invade i bronchi
Periferico
Lontana
dalla
pleura
viscerale, non invade la
pleura
http://www.hackmed.org
2
[email protected] 44
Mencaroni Spartaco
Bronco lobare o principale; il
limite del tumore non deve
essere all’interno di un bronco
più vicino di 2 cm dalla carena
dello sterno
Bronco principale a meno di 2
cm dalla carena dello sterno
di
cellule
Maggiore di 3 cm, o Infiltrazione
qualsiasi
diametro
che neoplastiche nella pleura
provoca atelettasia o infiltra viscerale, fattore negativo.
la pleura.
della
parete
Invasione
della
pleura Invasione
mediastinica
e
del toracica e del diaframma
pericardio, o alla parete
toracica o pericardio, ma
senza infiltrazione di cuore,
grossi vasi o esofago o
vertebre
4
Invasione strutture mediastiniche, vertebre, grossi vasi, carena
La succlavia, essendo in stretto rapporto con l’apice polmonare, subisce da esso una compressione notevole
quando vi sia una neoplasia del lobo superiore. La compressione sul plesso brachiale che ne deriva prende il
nome di sindrome di Sindrome di Ciuffini Pancoast.
3
Staging M (diffusione ai linfonodi, ML)
1. Micrometastasi: prognosi favorevole e linfonodi di volume normale
2. Metastasi massiva: nell’adenocarcinoma i linfonodi interessati sono di volume normale,
nell’anaplastico sono maggiori di 1,5 cm
3. Con diffusione extracapsulare
4. Skip metastasi: trasmissione nella catena linfonodale a salti da un linfonodo all’altro. Il concetto di
linfonodo sentinella, il primo che viene colonizzato di solito in un particolare tipo di neoplasia, è un
concetto teorico che si applica perché non ci sono altri mezzi più certi, ma in realtà la diffusione linfatica
è un concetto estremamente variabile che dipende da moltissimi fattori, fra cui la variazione anatomica e
l’eventuale calcificazione secondaria alla TBC.
Staging N
Mentre il T preoperatorio è abbastanza affidabile, l’N non lo è per niente, a causa della possibilità di avere
micrometastasi che sono difficilmente visibili.
• N0: assenza di metastasi
• N1: linfonodi delle regioni peribronchiali e ilari omolaterali
• N2: linfonodi mediastinici omolaterali e intertracheobronchiali
• N3: linfonodi mediastinici e ilari controlaterali
I tumori che si sviluppano a sinistra sono più a rischio, tendono a metastatizzare ai linfonodi controlaterali
con più facilità di quanto avvenga fra destra e sinistra.
Tecnica di indagine
Esame clinico
RX torace
TC
Ecografia
Mediastinoscopia
Toracoscopia
Biopsia prescalenica
Sensibilità
N3
(sovraclaveari)
N2
N2
N2
N2-N3
N2
N3
Clinica e peculiarità radiologiche dei diversi tipi di carcinoma polmonare
Carcinoma broncogeno
E’ il tumore polmonare per antonomasia, e origina dalle cellule della mucosa bronchiale. Si trova quindi
sempre in rapporto alle vie aeree, e si può distinguere in quattro categorie:
• Epidermoidale o a cellule squamose (origina dall’epitelio, in genere centrale)
Mencaroni Spartaco
•
•
•
45
Adenocarcinoma (cellule ghiandolari, in genere periferico)
o Bronchiolo-alveolare: sempre periferico
Microcitoma (tessuto neuroendocrino della parete bronchiale, infiltra precocemente la cava con sindrome
dello stretto toracico)
Anaplastico a grandi cellule
Queste quattro classi hanno diverso comportamento clinico e diversa associazione con sesso e fattori di
rischio. Dal punto di vista diagnostico radiologico, però, risulta avere una maggiore importanza la
distinzione sulla base della localizzazione della neoplasia.
→ Sviluppo centrale
Più frequentemente l’epidermoidale e il microcitoma, poiché originano da tessuto presente soprattutto a
livello delle grosse vie aeree. Si possono distinguere due categorie.
• Endobronchiale: sviluppo verso l’interno del bronco con formazione di masse polipoidi che finiscono
per ostruirlo. I fenomeni che si associano di conseguenza a questo tipo di tumore sono:
o Atelettasia: di facile riscontro diagnostico. Estese atelettasie sono il segno più frequente di
carcinoma polmonare a sviluppo ilare.
o Polmonite ostruttiva: complicazione frequente dell’atelettasia, in cui l’aria riassorbita viene
sostituita da secrezione e trasudato, con sovrainfezione batterica e quel che ne segue.
o Enfisema ostruttivo: complicazione che si forma con meccanismo a valvola quando
l’ostruzione è incompleta
• Transbronchiale: sviluppo attraverso la parete del bronco con infiltrazione progressiva delle strutture
peribronchiali dell’ilo, che subisce delle modificazioni visibili.
o Ingrandimento e deformazione dell’ilo: assume contorni ciclici, nel cui contesto sono
rilevabili tumefazioni linfonodali metastatiche.
o Strie ilari che si dipartono dalla massa centrale: dall’ilo si dipartono delle strie che sono
vasi linfatici interessati dal tumore
o Compromissione di nervi: nel caso di interessamento del frenico, si osserva un sollevamento
del diaframma corrispondente.
o Coinvolgimento dell’arteria polmonare
→ Sviluppo periferico
Soprattutto le forme di adenocarcinoma. Può presentarsi sotto tre aspetti morfologici principali.
• Forma nodulare periferica: opacità nodulare periferica, a contorni netti e lobati (attività proliferativa).
Dai margini si dipartono strie simili alle B di Kerley per l’invasione dei linfatici. Il nodulo è di solito
omogeneo, ma si possono trovare escavazioni ed aree di necrosi. La presenza di calcificazione nella
massa non esclude il tumore, che potrebbe aver inglobato una struttura calcificata nel suo sviluppo.
• Forma pseudopolmonitica: tipica del carcinoma bronchioloalveolare, questa modalità morfologica si
accresce riempiendo progressivamente tutti gli spazi alveolari, simulando un addensamento da
polmonite (da cui il nome). Inizialmente è visibile un nodulo singolo, poi si osserva un addensamento di
noduli con tendenza alla coalescenza e infine una massa lobare di aspetto simile alla polmonite, ma
differenziabile da essa osservando la periferia, dove è sempre visibile la natura nodulare del processo. E’
una presentazione rara (2%).
• Tumore di Pancoast: aspetto particolare che il tumore periferico assume quando si localizza a livello
dell’estremo prossimale di uno dei lobi superiori. Questo tumore invade precocemente il solco superiore
polmonare e si estende alle strutture osteo-nervose della regione della spalla. Questo da una sindrome
caratteristica detta appunto sindrome di Pancoast:
o dolore intollerabile localizzato alla spalla e irradiato al braccio
o atrofia dei muscoli della mano
o edema dell’arto superiore
o enoftalmo, miosi, ptosi palpebrale, anidrosi omolaterale (sindrome di Horner da
interessamento del SNA simpatico)
Dal punto di vista radiologico a questo tumore si associa:
o ispessimento della pleura apicale
http://www.hackmed.org
o
o
[email protected] 46
Mencaroni Spartaco
osteolisi dell’arco prossimale delle prime tre coste e dei corrispondenti peduncoli vertebrali
tumefazione ad estensione verso il collo in alto e in basso verso il corno ilare superiore
Adenoma bronchiale
Si tratta di tumori piuttosto maligni, che sono divisibili in tre entità principali.
• Carcinoide bronchiale: origina dalle cellule neuroendocrine delle ghiandole della mucosa bornchiale e
produce sostanze simili alla serotonina. Il carcinoide è molto vascolarizzato è da frequentemente
emottisi, e dal punto di vista radiologico assume tre diverse modalità di crescita.
o Centrale endobronchiale: frequente, spesso evidente alla TC come massa opaca nel
contesto della trasparenza di un bronco (pallina nel collo di bottiglia). TC spirale esame di
elezione
o Centrale esobronchiale: comportamento usuale dei tumori centrali
o Periferica: rarissima, nodulo o massa omogenea senza caratteristiche radiologiche che lo
differenziano dal carcinoma bronchiale periferico
Linfomi e leucemie del polmone
I linfomi interessano il polmone soprattutto come fenomeno secondario (nel 65% dei LH e nel 45 dei LnH).
Questo interessamento riguarda soprattutto l’ilo, dove sono localizzati la maggior parte dei linfonodi, e si
traduce in uno slargamento del mediastino che è il carattere fondamentale di queste neoplasie.
Lo studio delle stazioni linfonodali è possibile soprattutto con la TC, mentre il radiogramma standard è meno
indicativo.
Le localizzazioni parenchimali, infrequenti, assumo aspetto reticolare o di opacità alveolari a noduli multipli.
Le leucemia interesano invece di più il parenchima, con un interessamento parenchimale reticolare diffuso a
“linfangite carcinomatosa”. A volte però la linfangite è prodotta da infezioni, per via dello stato di
immunosoppressione che spesso si accompagna alle leucemie (per terapia e compromissione midollare).
Metastasi polmonari
Molti tumori possono raggiungere il polmone per via ematica, linfatica, o per contiguità. A seconda della
modalità di diffusione, le metastasi avranno caratteristiche differenti.
Le metastasi ematogene sono di solito opacità rotondeggianti o ovali, a margini netti, di densità notevole.
Sono localizzate ovunque nel polmone, con dimensioni variabili da pochi mm per le neoplasie molto
vascolarizzate, fino a 10 cm e più. A volte si diffondono in maniera impressionante (metastasi a tempesta di
neve).
Quelle per via linfatica invece assumono in genere un aspetto piuttosto reticolare a carattere interstiziale. In
genere il loro riconoscimento è difficile, e si basa sulla conoscenza di un tumore primitivo che
frequentemente metastatizza al polmone per via linfatica, come tumori di stomaco, mammella, pancreas.
L’aspetto di infiltrazione reticolare dei linfatici prende il nome di “linfangite carcinomatosa” e va sospettato
di fronte alla triade:
• Adenopatia ilare
• Opacità lineari che si dipartono da essa
• Strie B di Kerley
L’esame di elezione è la TC ad alta risoluzione
E’ possibile fare una associazione fra i vari tipi di tumore e il tipo di metastasi che danno.
TUMORE
CARATTERISTICHE DELLA METASTASI
Sarcomi
Metastasi giganti “a palla di cannone”
Capo, collo, genitali femminili, Metastasi con necrosi e cavitazione
adenocarcinomi del crasso
Osteosarcoma
Grosse metastasi parzialmente ossificate
Carcinomi tiroidei
Micrometastasi
Seminomi
Metastasi “a tempesta di neve”
Carcinomi mammari
Interessamento contemporaneo di polmone e pleura con versamento
pleurico
Mencaroni Spartaco
47
Stomaco, pancreas e mammella
Linfangite carcinomatosa
Interessamento
secondario Aspetto reticolare o miliariforme, con compromissione dell’interstizio.
polmonare di linfomi e leucemie
4.6 SINDROMI RESPIRATORIE OSTRUTTIVE
Descriviamo qui di seguito i reperti radiologici che possono aiutare nella diagnosi delle sindromi respiratorie
ostruttive.
Asma bronchiale
Lo studio radiologico è importante per identificare altre cause di broncospasmo o cause meccaniche che
possono aggravare lo stato asmatico (polipi, sinusite, reflusso gastroesofageo, ernia iatale).
Nell’attacco acuto si possono evidenziare i segni classici dell’iperinsufflazione polmonare:
• Abbassamento delle cupole diaframmatiche e mai a concavità superiore (enfisema)
• Ipoespansibilità delle basi polmonari
• Ampliamento dello spazio chiaro retrosternale
• Ili e disegno polmonare normale (diagnosi differenziale con enfisema)
Nell’intervallo fra l’attacco acuto e il successivo il quadro è normale, ma con il cronicizzarsi della patologia
asmatica possono comparire segni di ipertensione precapillare e cuore polmonare.
Bronchite cronica
La diagnosi si basa soltanto su criteri clinici, ma il sospetto può anche essere radiologico; inoltre si possono
escludere le bronchiettasie come causa di tosse produttiva.
• Disegno polmonare “sporco” con accentuazione della trama vasale, ma irregolare e sfumata
• Immagini a binario e opacità tubulari per ispessimento delle pareti bronchiali.
• Manicotti peribronchiali attorno alle immagini rotondeggianti trasparenti; si formano per l’ispessimento
della parete bronchiale; i bronchi presi in sezione appaiono circondati da questi ispessimenti.
• Iperinsufflazione di solito moderata
• In fasi avanzate segni di ipertensione polmonare e cuore polmonare cronico
Con la broncografia, esame più specifico, si può effettuare uno staging dell’interessamento bronchiale:
• Stadio 1: bronchi più sottili della norma per atteggiamento funzionale spastico
• Stadio 2: estroflessioni puntiformi lungo il decorso dei bronchi principali: si formano per la penetrazione
del mezzo di contrasto dentro al colletto delle ghiandole dilatate (segno di ipertrofia ghiandolare)
• Stadio 3: aspetto diffuso a corona di rosario della parete bronchiale, irregolarmente dilatata e ristretta. Si
hanno opacamenti “a zolle” per il mescolamento del mezzo di contrasto con i secreti presenti.
Enfisema
L’enfisema si può distinguere dal punto di vista clinica in una forma panlobulare, in cui l’interessamento
delle strutture elastiche e la loro distruzione interessa tutto l’acino e riduce quindi proporzionalmente la
componente ventilatoria e quella perfusionale, e una forma centrolobulare, in cui la distruzione è a carico
soltanto della componente dei bronchioli respiratori prossimali, quindi si crea un deficit della ventilazione
rispetto alla perfusione.
In base a questa distinzione, avremo due tipi di pazienti.
→ Tipo A con prevalente enfisema panacinoso
Prevalente sintomatologia dispnoica su quella ipersecretiva.
il paziente è in genere magro e longilineo e presenta caratteristicamente dispnea soprattutto da sforzo
mentre la tosse e l’ipersecrezione sono modeste.
La dispnea tipicamente espiratoria insorge progressivamente, inizialmente si manifesta dopo sforzo poi
diventa permanente e molto limitante nelle fasi avanzate.
L’espirazione è molto prolungata poichè dipende dal ritorno elastico che è ridotto.
http://www.hackmed.org
[email protected] 48
Mencaroni Spartaco
La caratteristica fondamentale è l’iperventilazione che permette al paziente di mantenere una adeguata
ossigenazione ma determina la dispnea.
Il tipo A viene infatti detto anche pink puffer = roseo soffiante.
Questi pazienti non vanno in contro alle crisi di insufficienza respiratoria da ipoventilazione in occasione
delle riacutizzazioni.
L’alterazione è fondamentalmente costituita dall’enfisema panacinoso che determina una distruzione dei
setti in corrispondenza delle parti periferiche dell’acino e anche i capillari che in essi decorrono.
Di conseguenza è mantenuto un normale rapporto V/Q anche se entrambi sono diminuiti e si ha una
normossia e assenza di cianosi a riposo.
Tuttavia l’estensione del letto capillare è comunque inferiore al normale e la durata dell’esposizione dei
globuli rossi agli scambi gassosi a livello dei capillari alveolari e ridotta.
Ciò non ha conseguenze a riposo perchè il tempo di transito dei globuli rossi è comunque sufficiente a
saturare l’emoglobina, in condizioni di attività invece il tempo di transito si riduce e determina un
insufficiente ossigenazione, condizione alla base dell’ipossiemia da sforzo.
La dispnea da sforzo dipende invece dal fatto che la riduzione del ritorno elastico del polmone determina il
collasso delle vie aeree soprattutto nella respirazione forzata in cui si ha una notevole negativizzazione delle
pressione intrapleurica.
Tipo B con prevalente bronchite cronica ed enfisema centrolobulare
prevalenza della sintomatologia ipersecretiva su quella dispnoica.
il paziente è generalmente brachitipo e in soprappeso e accanito fumatore che da molti anni presenta una
tosse produttiva.
L’insorgenza della tosse è di tipo subdolo e progressivo, inizialmente è presente al risveglio al mattino e
raramente supera i 60 ml/die.
L’espettorazione mattutina ha lo scopo di espellere le secrezioni che hanno ristagnato nelle ore notturne a
causa della riduzione della clereance mucociliare e della riduzione del tono ortosimpatico broncodilatatore.
All’inizio la tosse si manifesta solo nei periodi invernali e poi diventa persistente con periodi di
espettorazione mucopurulenta o talvolta emorragica che si fanno sempre più frequenti, gravi e di durata
maggiore.
È spesso presente cianosi anche nelle fasi di stato stabile e i pazienti vanno spesso in contro a episodi di
ipoventilazione con esacerbazione dell’ipossiemia e comparsa di ipercapnia in occasione delle
riacutizzazioni da infezioni.
Le alterazioni sono dovute alla bronchite cronica che si associa ad enfisema centroacinoso che interessa la
porzione centrale del lobulo e compromette di meno quella periferica, dove sono più rappresentate le
strutture vascolari.
Pertanto il danno maggiore si esercita nei confronti della componente ventilatoria il che determina una
riduzione del rapporto V/Q con effetto shunt che determina ipossiemia e cianosi con ipercapnia.
Alla cianosi oltre che la desaturazione dell’emoglobina contribuisce anche la poliglobulia secondaria a
ipossia renale con incremento di eritropoietina.
L’ipossiemia determina vasocostrizione ipossica delle arterie polmonari con conseguente incremento delle
resistenze e cuore polmonare cronico che può condurre allo scompenso ventricolare destro con edemi
declivi, epatosplenomegalia e ascite.
I pazienti di tipo B per questi motivi vengono anche detti blue and bloated = blu e gonfi.
Le indagini di riferimento sono il radiogramma toracico con componente dinamica dell’escursione
diaframmatica, e la TC ad alta risoluzione per la valutazione quantitativa della distruzione parenchimale. I
segni caratteristici dei due tipi di enfisema sono riportati in tabella.
ENFISEMA CENTROLOBULARE
ENFISEMA PANLOBULARE
(forma con aumento del disegno)
(forma con riduzione del disegno)
→ cupole diaframmatiche abbassate a concavità
→ interessa prevalentemente i campi superiori
verso l’alto (diagnosi differenziale con asma)
→ segni di iperinsufflazione di solito modesti
→ spazi intercostali distanziati e orizzontalizzati
→ formazione di bolle poco frequente
→ sterno incurvato anteriormente
→ disegno polmonare accentuato
→ vasi a contorno sfumato e irregolare, disegno cioè → ipertrasparenza dei campi polmonari con
sporco, come nella bronchite cronica
riduzione del disegno
Mencaroni Spartaco
49
→ bolle multiple a contenuto aereo, sottili, di
L’ipertensione precapillare e il cuore capillare sono dimensioni variabili ma sempre maggiori del cm
componenti d’obbligo
→ interessa prevalentemente i campi inferiori
Soltanto elle forme progredite c’è ipertensione
precapillare e cuore polmonare
Esami di complemento sono la scintigrafia ventilatoria, che da importanti informazioni sullo squilibrio fra
ventilazione e perfusione, l’angiopneumografia e la broncografia che mostrano reperti caratteristici ma
non intervengono di norma nella diagnosi.
L’indagine di complemento più importante è la TC ad alta risoluzione (HRTC) che:
• Identifica il substrato anatomico di una insufficienza respiratoria cronica
• Sorveglia l’andamento della patologia diagnosticata
• Accerta eventuali complicazioni neoplastiche o infettive
• Follow up del trattamento
Bronchiettasie
Sono dilatazioni delle componenti bronchiali di secondo, terzo e quarto ordine, che provocano l’accumulo di
secrezioni e le complicanze infettive delle aree interessate. In genere si tratta di condizioni acquisite che si
accompagnano a particolari malattie, come:
• Deficit di IgG
• Ipogammaglobulinemia primitiva
• Deficit di α1 antitripsina
• Fibrosi cistica
• Sindrome di Kartagener (situs visceurum inversus, sinusite, bronchiettasie)
Le forme acquisite sono legate alla partecipazione di meccanismi come la presenza di infezioni croniche
recidivanti dei bronchi e la presenza di masse ostruenti o corpi estranei.
La patogenesi di queste forme è essenzialmente legata ad alterazioni della mucosa, del tessuto muscolare
elastico e cartilagineo, con ritenzione delle secrezioni, dilatazione e riparazione con fibrosi. Questo porta alla
dilatazione abnorme del bronco perifericamente, tipicamente di III o IV ordine.
Morfologicamente queste forme si possono distinguere in forme:
• Cilindriche (post tubercolari)
• Sacculari (polmoniti ricorrenti atelettasiche)
• Ampollari
• Pseudobronchiettasie: episodi reversibili con terapia medica
La localizzazione varia a seconda delle forme:
→ Congenite:
- Bilaterali e plurisegmentarie dei lobi superiore e inferiore
→ Post tubercolari:
- Lobo superiore
- Segmenti apicali inferiori
→Postinfettive:
- Segmenti basali
- Lobo medio
- Lingula polmone sinistro
→Secondarie ad ostruzione da corpo estraneo
- Segmenti distali
http://www.hackmed.org
L’esame radiologico è effettuato con il radiogramma
fondamentali sono indicati in tabella.
Esame RX
• Disegno polmonare accentuato (ispessimento
della parete)
• Aree cistiche di 1-2 cm di diametro, con livelli
idroaerei (corrispondono ai bronchi dilatati)
• Presenza di celle a favo d’api (fibrosi associata)
• Iperinsufflazione compensatoria dei tratti non
interessati
[email protected] 50
Mencaroni Spartaco
toracico e con la TC ad alta risoluzione. Alcuni segni
TC ad alta risoluzione
• Dilatazione diffusa o focale del bronco
• Ispessimento della parete
• Presenza di secreto o tappi di muco
Si può anche effettuare una broncografia, dopo accurato drenaggio del secreto, che consente una definizione
morfologica precisa delle bronchiettasie e permette di osservare alcuni caratteri morfologici:
• Forme cilindriche: uniformemente dilatati, a delimitazione netta.
• Forme varicose: i bronchi assumono un aspetto a corona di rosario per il susseguirsi di dilatazioni e
restringimenti
• Forme sacciformi: i bronchi sono dilatati a palloncino, in maniera più marcata mentre si procede verso la
periferia
4.7 RADIOLOGIA DI ALTRE LESIONI POLMONARI
PATOLOGIE CISTICHE
Si distinguono:
• Cisti congenite: a parete continua, rivestita interamente di epitelio respiratorio. Immagini rotondeggianti
di ipertrasparenza vitrea, con limiti continui, sottili e completi.
• Cisti acquisite: si formano per riepitelizzazione di cavità ascessuali o tubercolari. Se questa è completa,
l’immagine non è distinguibile da quella delle cisti congenite.
• Bolle: si formano in seguito alla distruzione del parenchima. Sono aree rotondeggianti, trasparenti, a
sottile parete capillari.
• Vescicole (blebs): si formano nel contesto della pleura viscerale e sono causa frequente di pneumotorace
Esiste anche una patologia malformativa cistica, il polmone policistico, in cui la TC e l’RX standard hanno
un importante ruolo diagnostico.
PNEUMOCONIOSI
La radiologia è in grado di identificare i risultati ai quali porta la malattia, ossia la fibrosi polmonare,
l’enfisema ostruttivo, la fibrosi pleurica.
Essendo queste lesioni del tutto aspecifiche, in genere è necessaria una documentazione di esposizione
anamnestica per completare la diagnosi.
E’ tuttavia possibile una codificazione delle relazioni fra rilievi radiologici e alcune pneumoconiosi.
Silicosi
Dopo l’inalazione, le particelle penetrano e rimangono fino a livello alveolare. I macrofagi le fagocitano ma
rimangono uccisi dal loro potere citotossico, liberando le particelle che vengono ingerite da altri macrofagi in
un ciclo continuo che porta all’accumulo di macrofagi e liberazione di citochine.
Le citochine richiamano fibroblasti e plasmacellule, che iniziano, attivate dalle citochine, la produzione di
fibre collagene e quindi la ialinizzazione del parenchima.
Il meccanismo dell’uccisione di macrofagi riguarda il legame fra gruppi SiOH delle fibre di silice e gruppi
accettori di idrogeno nelle membrane lipidiche delle cellule, che si deformano e si rompono. La produzione
di collageno, responsabile della patologia respiratoria restrittiva, provoca invece l’imprigionamento della
silice e la cessazione dell’attività citotossica.
La tipica manifestazione iniziale è il nodulo silicotico, una lesione di 2-6 mm di colorito grigiastro, che
confluisce con altre identiche a formare masse di varie dimensioni (fino ad occupare anche un intero lobo). I
noduli, che si trovano nella metà superiore e posteriore dei polmoni, possono formarsi anche a livello dei
Mencaroni Spartaco
51
linfonodi ilari dove la silice viene drenata, dove assumono aspetti caratteristici di calcificazione, e assumono
la forma di un guscio d’uovo o di una conchiglia.
Istologicamente sono formati da fibre di collagene al centro, ad andamento concentrico, e in periferia fibre
reticolari, macrofagi e fibroblasti. Particelle di silice sparsa sono dimostrabili nei noduli.
Si localizzano attorno alle arteriole polmonari, nei tessuti dei setti alveolari e sotto la pleura, che appare
ispessita e aderente a quella parietale.
I bronchioli e le arterie coinvolti sono spesso distrutti, e nei noduli più grandi si formano a volte delle
caverne connesse con la TBC.
I rilievi radiologici sono possibili soltanto nella fase conclamata, dopo 10-20 anni dall’esposizione, e
mettono in evidenza opacità nodulari multiple, sparse in genere all’apice (meno alle basi).
Alle basi sono presenti aspetti enfisematosi.
All’ilo sono sempre presenti ingrandimenti dei linfonodi, nei quali spesso si trovano calcificazioni a guscio
d’uovo.
Le opacità tendono poi ad aumentare di dimensione e a conglomerarsi in masse grossolane: queste, con gli
anni, migrano allontanandosi dall’ilo e si lasciano dietro un parenchima enfisematoso.
Asbestosi
I meccanismi di danno di queste fibre sono:
• Alta capacità di penetrazione fino agli alveoli, dove si accumulano anche in grandi quantità. Questo fa si
che l’asbestosi sia una malattia in genere più diffusa della silicosi
• Capacità citolitica nei confronti dei macrofagi
• Capacità di attivare i macrofagi e produrre una reazione fibrosante
• Capacità di promotore nell’oncogenesi
• Capacità di adsorbimento di sostanze tossiche e cancerogene presenti nell’ambiente sulle fibre di
amianto (causa, questa, della sinergia fra fumo e amianto)
Inizialmente le fibre si localizzano alla biforcazione fra le piccole vie aeree, e qui si creano le prime lesioni.
Sia i macrofagi alveolari che quelli interstiziali iniziano a fagocitare le fibre, ne vengono distrutti e attivati, e
si crea una reazione fibrosante interstiziale diffusa a tutto il polmone.
I macrofagi attivati producono citochine che stimolano i neutrofili e i fibroblasti. In una fase precoce ci sono
infiltrati leucocitari della parete alveolare, presenza di macrofagi e deposizione di fibre collagene
nell’interstizio. Successivamente si ha un ispessimento diffuso e una fibrosi peribronchiale e perivascolare.
Nella fase iniziale è apprezzabile solo un aspetto a vetro smerigliato, nella fase conclamata invece la
reticolazione è più marcata, e tende ad occupare tutto l’ambito polmonare.
Si trovano anche frequentemente degli ispessimenti pleurici che vanno presto incontro a calcificazione.
Inoltre spesso si trovano delle opacità nodulari costituite da parenchima collassato in vicinanza di un
ispessimento pleurico (atelettasie rotonde).
ALVEOLITI ALLLERGICHE E POLMONITI CHIMICHE
Le alveoliti allergiche si manifestano con opacità multiple alveolari, a margini sfumati, prevalentemente a
livello basale. La tendenza alla confluenza è scarsa; questo quadro può regredire del tutto a sospensione
dell’esposizione, e ripresentarsi in seguito.
Nell’evoluzione della malattia si manifesta un quadro di reticolosi che permane anche dopo la fase acuta.
Le polmoniti da gas tossici (ARDS) si traducono radiologicamente in un quadro molto simile a quello
dell’edema polmonare (vedi oltre), ma che a differenza di questo interessa significativamente di più le parti
periferiche del polmone.
Questo quadro di solito è reversibile, ma si possono trovare poi dei segni di fibrosi e di enfisema
EMBOLIA, INFARTO ED EDEMA POLMONARE
Embolia
Embolia e infarto polmonare spesso sono associati; ma si consideri che non più del 10-15% delle embolie si
complicano con infarti, e che l’infarto è possibile anche per altre cause.
Incidenza:
http://www.hackmed.org
•
•
[email protected] 52
Mencaroni Spartaco
TVP (trombosi venosa profonda): 1/1000 anno
EP (embolia polmonare): 0,7-1/1000 anno
Età per lo più fra 60 e 62 anni.
I fattori di rischio sono molteplici, e vanno dalle procedure chirurgiche e mediche, ad alterazioni della
coagulazione acquisite o congenite, invalidità e protesi degli arti inferiori anestesia, immobilità e degenza,
condizioni di debilitazione di ogni tipo, malattie proliferative, neoplasie, età, obesità, e condizioni individuali
di predisposizione genetica.
A seconda della categoria di rischio del paziente si fa una profilassi specifica:
• Basso rischio: nessuna misura specifica
• Moderato: 5000 UI eparina /12 ore non frazionata; calze compressive o compressione intermittente
pneumatica
• Alto: 5000 UI eparina / 8 ore non frazionata, compressione intermittente pneumatica
• Altissimo: eparina ad alta dose, anticoagulanti orali
Si ha in genere embolia massiva per trombi di grande dimensioni e/o condizioni scadenti del circolo
generale. In questo caso il paziente subisce, dal punto di vista clinico, le conseguenze del cuore polmonare
acuto.
All’embolia massiva fa comunque seguito l’infarto polmonare con i suoi segni clinici e radiologici se il
paziente sopravvive,
L’infarto, invece, si manifesta frequentemente per quei trombi di dimensioni medie e piccole che
interessano pazienti con condizioni cardiocircolatorie buone, nei quali l’evento embolico non determina
morte e si può quindi manifestare l’infarto. Nell’anziano, se è presente una insufficienza di cuore sinistro,
all’embolia può non far seguito un infarcimento emorragico della zona compromessa per via di una
insufficiente pressione di perfusione.
Infine è possibile che la presenza di numerosi emboli di piccole dimensioni causi una sintomatologia clinica
senza evidenza di infarto, e alla riperfusione si creino fenomeni di emorragia.
ESAME
STRUMENTALE
RX standard
Nota: in realtà l’esame
radiografico
è
poco
significativo e spesso si
osserva una negatività. Si
usa quindi non tanto per la
ricerca di questi vecchi
segni descritti, ma per
escludere
broncopatie
croniche che possono
provocare
deficit
di
perfusione alla scintigrafia,
agevolare l’interpretazione
della
scintigrafia
in
presenza di cardiopatia,
evitare la pneumografia se
risulta positiva sia l’RX
che la scintigrafia
Scintigrafia
perfusionale
REPERTI DIAGNOSTICI E NOTE
•
•
•
•
•
•
•
Embolia
Marcata
riduzione
del
disegno
polmonare nel territorio interessato
Segno di Westernmark: ipertrasparenza
della zona interessata (per È della
perfusione) detto anche oligoemia; poco
frequente e difficile da rilevare
Dilatazione dell’arteria polmonare
all’ilo, e brusco restringimento a valle
(segno di Fleischner): questo segno può
essere
localizzato
in
prossimità
dell’embolo, o essere espressione
dell’ipertensione capillare.
Visibilità del broncogramma aereo
Tenue versamento pleurico reattivo
Prominenza dell’arco cardiaco medio di
sinistra (inizio del cuore polmonare)
Infarto
Area di tenue opacità alveolare, a contorni
sfumati, spesso in sede media o basale,
normalmente subpleurica. Detta anche
gobba di Hampton e si manifesta a
distanza dall’evento embolico.
• Raramente, e in genere in fase di
cicatrizzazione,
l’opacità
diventa
triangolare con apice verso l’ilo
• Dilatazione dell’arteria polmonare all’ilo
• Atelettasie lamellari basali
• Assenza del broncogramma aereo per
stravaso emorragico negli alveoli
• E’ possibile differenziare l’emorragia
dall’infarto soltanto con RX ripetute. La
prima compare entro 24 ore dall’embolia e
scompare senza traccia, il secondo
compare dopo qualche giorno e residua
una cicatrice
Mancata distribuzione del radiofarmaco in corrispondenza delle aree interessate. Questa
metodica è estremamente sensibile nell’identificare difetti di perfusione polmonare ma
bisogna evitare che vi siano già presenti alterazioni della perfusione come atelettasie o
bronchiettasie. Non è sufficiente da sola ma associata alla clinica fa diagnosi corretta nel
79% dei casi e in caso di normalità esclude la diagnosi di embolia polmonare
•
Mencaroni Spartaco
Scintigrafia
ventilatoria
TC spirale con
mezzo di contrasto
Angiopneumografia
RM
53
• Elementi non perfusi a valle dell’embolo con aree normalmente ventilate
• Embolia polmonare recente: segmenti non perfusi ma ancora normalmente ventilati
• Embolia polmonare subacuta: segmenti non perfusi e non ventilati
In una certa percentuale di casi accade che le aree non perfuse alla SP siano tali perché una
qualche patologia preesistente abbia limitato la ventilazione e si sia quindi verificata in quelle
aree una vasocostrizione riflessa. Allora si usa fare anche una scintigrafia ventilatoria associata
alla perfusionale allo scopo di identificare queste aree. Le aree di discordanza fra SP e SV
sono diagnostiche di embolia polmonare.
• Difetto di opacizzazione parziale o completo di un vaso arterioso polmonare (si
identificano fino ai vasi segmentari). L’impiego della TC è importante soprat
• tutto nelle situazioni di urgenza, quando è importane ottenere informazioni dettagliate sul
parenchima e sulla pleura.
• Una TC unica, estesa ad addome e arti, può identificare sorgenti emboliche
• Riesce a definire l’esatta sede di ostruzione vasale. Il difetto appare come una brusca
interruzione del riempimento con aspetto di “potatura vasale”.
• E’ spesso associata alla possibilità di intervenire direttamente sul trombo usando, tramite
lo stesso catetere, enzimi proteolitici o mezzi meccanici (trombolisi)
• Applicazione ancora sperimentale
Alcuni mezzi diagnostici possono essere importanti per la localizzazione di sorgenti degli emboli. Fra queste
tecniche ricordiamo:
• Eco-doppler
• Ecocardiografia transtoracica e transesofagea
• Flebografia degli arti inferiori e della cava inferiore
Inoltre nella diagnosi di embolia polmonare sono importanti una serie di esami di laboratorio:
• Enzimi sierici
• D dimero
• Prodotti di degradazione del fibrinogeno e della fibrina
Diagnosi alternative
• Alterazioni vascolari:
• Difetto di riempimento parziale: il vaso è ostruito al centro e soltanto alla periferia il mezzo
di contrasto riesce a passare. Si forma quindi il segno della “polo mint” se il vaso è preso in
sezione, del “binario” se è preso di profilo.
• Difetto di opacizzazione del lume per difetto di riempimento completo
• Oligoemia a valle dell’embolo
• Alterazioni parenchimali:
• Diminuzione della densità del parenchima (immagine nastriforme di 3mm perpendicolare
alla superficie pleurica)
• Emorragia a vetro smerigliato
• Versamento pleurico
• Sollevamento degli emidiaframmi
Ruolo della radiologia nella definizione dell’eziologia dell’embolia polmonare
Gli emboli del polmone possono essere di molti tipi:
• Trombotici
• Lipidici
• Gassosi
• Da liquido amniotico
• Settici
• Da corpi estranei
• Neoplastici
• Parassitari
http://www.hackmed.org
[email protected] 54
Mencaroni Spartaco
Sebbene la maggior parte corrisponda ad una TVP degli arti inferiori o delle vene pelviche, la diagnosi
differenziale può essere importantissima.
→ Le tecniche per svelare una TVP sono la flebografia radioisotopica, la captazione del fibrinogeno
marcato, la pletismografia ad impedenza, il color doppler, la flebografia diretta con mezzo di contrasto
iodato.
Soprattutto il color doppler, con la sua sensibilità del 99% e specificità 81%, riesce a eguagliare la
flebografia tradizionale, che però è ancora più accurata (deve essere immediatamente seguita da cavografia e
ileografia in tutti i soggetti sintomatici con TVP dimostrata agli arti inferiori).
→ L’embolia lipoidea si verifica in genere 1-3 giorni dopo un trauma osseo. All’RX si evidenziano
numerose opacità acinari disseminate con bordi sfumati
→ L’embolia settica segue in genere una endocardite batterica del cuore destro o per migrazione di trombi
infetti dalle vene periferiche (tossicodipendenti, cateterizzati, portatori di shunt congeniti, emodialisi).
Reperto caratteristico di nodularità multiple, rotondeggianti od ovalari, spesso escavate; queste contengono
spesso un livello idroaereo, espressione dell’erosione delle pareti bronchiali.
→ Le forme più caratteristiche da corpo estraneo si chiamano talcosi, e sono osservate in soggetti tossici che
si iniettano polveri di talco EV. Inizialmente si osservano noduli piccoli, quindi fibrosi interstiziale con
prevalente localizzazione ai campi medi e superiori, fino alla fibrosi diffusa irreversibile.
→ Embolie da migrazione endovascolare di parassiti (in genere schistosoma) sono rare, così come quelle da
migrazione di cellule tumorali. L’RX toracico è spesso poco significativa e si ricorre in genere, su sospetto
clinico, all’analisi con scintigrafia.
Edema
L’edema polmonare può essere considerato, dal punto di vista clinico, un aumento del contenuto acquoso
del parenchima e dell’interstizio polmonare, dovuto a tre tipi fondamentali di cause
• Aumento della pressione capillare (edema trasudativo)
• Aumento della permeabilità capillare (edema essudativo)
• Da diminuzione della pressione colloido-osmotica del plasma (da IRC)
Sono ovviamente possibili forme miste.
Diagnosi radiologica
L’esame RX standard del torace assume una importanza notevole:
• Permette la valutazione dell’EPA (edema polmonare acuto) da cardiopatia
• Valutazione della cardiopatia di base
• Valutazione prognostica dello stato dello spazio aereo non interessato dall’edema
• Monitoraggio dell’efficacia della terapia
Alcuni segni radiologici specifici che si modificano nell’EPA sono:
• Aumento della larghezza del peduncolo vascolare: è quella distanza che va dall’incrocio del ventricolo
di sinistra con il bronco principale destro fino alla verticale tangente al profilo esterno dell’origine della
succlavia di sinistra. In un soggetto normotipo in stazione eretta e inspirazione profonda, con distanza fra
tubo emittente e pellicola di 180 cm, questa distanza è di 48 ± 5 mm. E’ in stretta relazione con il volume
di sangue circolante.
• Segni di edema interstiziale:
o Ridotta trasparenza polmonare
o Sfumatura dei profili vasali
o Line settali A e B di Kerley
o Opacità da edema subpleurico
o Versamenti circoscritti o liberi nella cavità toracica
Mencaroni Spartaco
•
•
•
•
•
55
Opacità parenchimali: hanno variabile distribuzione spaziale (centrale, periferica, declive) e possiedono
inoltre caratteristiche in relazione alla causa di edema (presenza di broncogramma aereo in EPA
essudativo, assenza in EPA trasudativo).
Redistribuzione del flusso agli apici
Localizzazione centrale e periferica di liquidi extravascolare specie nelle zone declivi
Aumento del V polmonare
Ingrandimento del margine cardiaco
Diagnosi di tipologia
In una seconda fase si valuta la possibilità di ottenere una diagnosi tipologica sulle cause dell’edama.
→ In presenza di criteri orientativi verso una patologia cardiaca:
• Volume cardiaco normale o poco aumentato:
o Infarto del miocardio
o Miocardite acuta
o Cardiomiopatia in scompenso
o Cardiomiopatia con interessamento isolato del ventricolo SX
• Ingrandimento del ventricolo SX associato ad allargamento aortico:
o Insufficienza valvolare aortica acuta
o Se si associa anche ingrandimento atriale sinistro e impegno della cavità di destra, alora è
provabile un EPA che complica il decorso di una malattia mitralica.
In corso di evento cardiovascolare maggiore la presenza di EPA peggiora la prognosi in maniera
proporzionale alla sua gravità.
→ L’edema trasudativo evolve caratteristicamente attraverso varie fasi.
• Prima fase. Il liquido si raccoglie solo nell’interstizio, e quindi si osservano:
o Sfumatura del disegno vasale, specie all’ilo
o Manicotti peribronchiali
o Linee B di Kerley
o Ispessimento delle scissure interlobari per la diffusione di acqua dall’interstizio alla pleura
viscerale
• Seconda fase: il liquido si raccoglie anche negli spazi alveolari, e quindi si osserva una progressiva
diffusione di una grande opacità, cotonosa, che parte dalle basi e sale verso gli apici, nel contesto della
quale non è visibile il broncogramma aereo (i bronchi sono piedi di liquido). In alcuni casi il liquido si
distribuisce risparmiando in una certa misura le parti periferiche dei polmoni (a farfalla), e questo
dipende dalla maggior efficienza dei linfatici nelle parti periferiche del polmone.
→ L’edema essudativo fin dall’inizio ha il quadro del riempimento alveolare, mancano i segni di
ipertensione capillare, il cuore è normale. Caratteristica è la distribuzione a chiazze multiple, e il fatto che
nell’opacità spesso è riconoscibile il broncogramma aereo.
SARCOIDOSI
Raramente si ha un esordio acuto in cui nel radiogramma si osservano adenopatie ilari e mediastiniche
bilaterali, meglio visibili alla TC.
Nel quadro ad esordio insidioso, più frequente, si osservano opacità interstiziali reticolo-nodulari diffuse,
con netta prevalenza nelle parti periferiche dei campi superiori.
Nel giro di qualche anno si sviluppa un quadro di fibrosi a favo d’api, con bolle di enfisema paracicatriziale.
Spesso è presente il cuore polmonare cronico.
Con la scintigrafia a volte è possibile valutare la componente di attività e di estensione della malattia.
MALATTIA A MEMBRANE IALINE
Nelle prime ore di vita il quadro può essere negativo, ma entro 12 ore si in instaura un aspetto finemente
granulare, prevalentemente basale, in cui si ha la sovrapposizione di aree collassate nelle quali spicca il
broncogramma aereo.
http://www.hackmed.org
[email protected] 56
Mencaroni Spartaco
L’aspetto può progredire fino alla totale atelettasia polmonare.
4.8 PATOLOGIA DELLA PLEURA
Lo spazio fra la pleura viscerale e quella parietale è di circa 7 um, e contiene normalmente piccole quantità
di liquido (10-15 ml) prodotto dai foglietti stessi in base al gradiente pressorio fra essi (la pleura parietale ha
un microcircolo sistemico, a pressione più alta di quello viscerale che è di origine polmonare). Tutto
l’apparato delle pleure, con il connettivo associato ad entrambe, non supera gli 0,7 mm.
Con l’RX, la pleura è visibile come spazio limitante fra la trasparenza polmonare e l’opacità delle strutture
circostanti. Assume l’aspetto di una vera e propria linea soltanto a livello delle scissure.
Con l’ecografia, invece, la pleura è visibile come una linea iperecogena situata internamente alle coste e
interrotta dalla loro ombra acustica.
Con la TC, specie ad alta risoluzione, si può vedere distintamente la pleura insieme alle strutture che più le
stanno vicine (pleura + fasce + muscolatura associata) a livello degli spazi intercostali e delle scissure.
VERSAMENTO PLEURICO
Costituisce la risposta generica della pleura a molteplici eventi patogeni, ed è l’alterazione patologica di
rilievo più frequente. Può essere di tre tipi:
• Essudativo: aumento della permeabilità capillare.
o Infezioni
o Tumori primitivi e secondari
o Malattie del collagene e immunitarie
o Affezioni addominali
• Trasudativo:
o aumento della pressione idrostatica:
scompenso cardiaco
ostruzione della cava superiore
pericardite costrittiva
o diminuzione della pressione colloido osmotica
IRC
cirrosi ascitogena
ipoalbuminemia
dialisi peritoneale
• Da altre cause:
o Infarto polmonare
o Trauma
o Iatrogeno
o Asbestosi
o Interventi chirurgici e terapia radiante
→ All’RX torace standard si identificano versamenti anche modesti (250 ml o anche meno con
accorgimenti particolari come il decubito del paziente dal lato del versamento).
Tipicamente, in posizione frontale, il liquido si ritrova inizialmente alle basi, per poi risalire circondando il
polmone come una mantellina.
L’opacità indotta dal versamento è delimitata superiormente da una linea curva disposta obliquamente
dall’alto in basso e dall’esterno verso l’interno. In proiezione laterale appare una curva a concavità verso
l’alto.
Un versamento massivo si accompagna a spostamento del diaframma verso il basso e del mediastino
controlateralmente: se questo non avviene si deve sempre sospettare una componente patologica del polmone
o della pleura stesso che impedisce la dislocazione (atelettasia polmonare, mesotelioma pleurico).
Qualora entri aria nel torace durante un versamento, si ha un livello idroaereo.
Se c’è una modificazione dell’elasticità del polmone, si possono riscontrare disposizioni atipiche del
versamento, ad esempio invece di risalire il versamento si accumula continuamente sotto al polmone,
provocando una risalita dal parenchima che simula un innalzamento del diaframma.
Mencaroni Spartaco
57
Si formano frequentemente, se il versamento non si risolve rapidamente, dei tralci di fibrina che risultano
bloccare il liquido fra di loro. Nel radiogramma avremo quindi una opacità a banda, non più a menisco. Se il
versamento di fibrina è particolarmente intenso, avremo una vera e propria saccatura del versamento, che
risulta come una opacità ovalare.
Il versamento intrascissurale, invece, segue spesso ad episodi di scompenso cardiaco, dopo il quale scompare
rapidamente. Si vede come una opacità biconvessa.
→ All’ecografia risulta invece anecogeno, e quindi è possibile studiare le strutture che vi sono al di sotto,
fornendo guida molto utile per il drenaggio pleurico.
→ Alla TC si dispone con una configurazione tipica. E’ possibile ricavare utili informazioni sulla natura del
versamento, differenziando le forme ematiche da quelle sierose.
La TC e l’eco hanno l’importanza di valutare lo stato dei foglietti pleurici sotto al versamento, nonostante la
presenza di liquido, e quindi permettono la valutazione delle lesioni pleuriche che vi possono essere al di
sotto.
PNEUMOTORACE
Lo pneumotorace riconosce diverse cause:
• Spontaneo: ossia non si ritrova la causa
• Traumatico: di solito emopneumotorace, accompagnato o meno da fratture spontanee
• Patologico: apertura nella cavità di bolle di enfisema, cisti, blebs
• Iatrogeno: frequente durante la cateterizzazione della succlavia
→ Collasso polmonare
Se l’aria penetrata è molta, lo PNX è vistoso e si osserva un netto contrasto fra la trasparenza della cavità
toracica (senza alcun disegno polmonare) e il polmone collassato, che appare come una masserella di tessuto
a trasparenza ridotta, in genere nelle vicinanze dell’ilo. Il limite fra le due aree è dato dalla linea pleurica; è
importante riconoscerla quando il collasso polmonare è assai scarso, perché il tessuto polmonare appare in
questo caso poco opaco.
→ Pneumotorace chiuso
In espirazione, il polmone si riduce marcatamente di volume perché non è più trattenuto dalla pressione
pleurica negativa
→ Pneumotorace aperto
In espirazione, il polmone e lo pneumotorace in espirazione si riducono entrambi contemporaneamente. La
linea pleurica resta immobile.
→ Pneumotorace iperteso
Dopo alcuni cicli respiratori, il polmone interessato è completamente collassato all’ilo, ridotto alle
dimensioni di un pungo e addossato al mediastino. In assenza di aderenze, cuore e mediastino sono dislocati
dal lato sano per via della pressione elevata che si ha nel cavo pleurico iperteso, con compromissione
ulteriore della funzione respiratoria.
ISPESSIMENTI NON NEOPLASTICI
•
•
•
Esiti di pleuriti in fibrosi: sono frequenti in sede basale a livello dell’angolo costofrenico esterno, dove si
raccoglie il versamento. La TC ad alta risoluzione riesce a distinguere le diverse componenti
dell’ispessimento, ossia il tessuto adiposo, la pleura ispessita, e il parenchima polmonare sottostante.
Esito di pleuriti sierofibrinose in palle di fibrina, che regrediscono spontaneamente ma dopo alcuni anni
Ispessimento da asbestosi: opacità a banda marginocostale sottile, regolare, senza calcificazioni, che
oblitera il seno costofrenico.
NEOPLASIE DELLA PLEURA
http://www.hackmed.org
[email protected] 58
Mencaroni Spartaco
Mesotelioma
Può presentarsi in forma circoscritta o molto diffusa, fino ad avvolgere tutta la pleura come una cotenna ed
estendersi anche a quella controlaterale.
Si rileva un profilo pleurico irregolare che ispessisce il margine costale.
Alla TC spesso si rivelano degli aspetti di malignità:
• Estensione per tutta la circonferenza della pleura
• Spessore maggiore di 1 cm
• Noduli
Le calcificazioni nel contesto dell’ispessimento sono rare ma possibili, ed è anche possibile la presenza di
osteolisi costali.
Fibromi
Rari, di norma della pleura viscerale. Sono in genere opacità omogenee, e aggettano verso il polmone, dove
provocano atelettasia da compressione ma non invasione
Sarcomi
Masse circoscritte, rotondeggiante, a margini netti e irregolari. Si sviluppano verso la parete toracica dove
provocano vistose erosioni costali.
4.8 INDAGINI RADIOLOGICO CLINICHE DELLE CONDIZIONI POLMONARI FREQUENTI
DISPNEA
Sensazione di respiro insufficiente, che appare correlato a:
• Intensità dello stimolo emesso dai centri respiratori
• Attività dei muscoli respiratori
• Entità dell’ipossia e dell’ipercapnia
• Modulazione da parte dei meccanismi neurogeni centrali
Essenzialmente le malattie che provocano dispnea agiscono diminuendo la capacità di risposta del sistema
respiratorio e del suo controllo nervoso, oppure aumentano la necessità di ossigeno dall’esterno (o fanno
entrambe le cose). La dispnea può essere fisiologica quando ad esempio le richieste superano le normali
capacità respiratorie (sforzo fisico intenso). E’ patologica quando si manifesta per attività fisica inferiore
a quella normalmente tollerata
Insorge quando gli stimoli respiratori sono inadeguati alla necessità, quando lo sforzo è inappropriato alla
respirazione richiesta, quando gli impulsi nervosi per i muscoli respiratori sono inadeguati. Ha dunque un
gran numero di cause:
• Respiratorie:
o Ostruzione delle vie aeree (spasmo, edemi, corpi estranei)
o Broncopatie ostruttive
o Riduzione della compliance toracica
Pneumopatie restrittive
Restrizioni ossee della gabbia toracica
Versamenti pleurici
• Cardiovascolari
o Diminuzione della gittata cardiaca
Insufficienza di pompa
Vizi valvolari
o Ipossiemia arteriosa
o Diminuzione della massa eritrocitaria e del volume ematico
• Nervose:
o Lesioni anatomiche
Infettive
Emorragiche
Neoplastiche
Degenerative
o Alterazioni funzionali
Mencaroni Spartaco
•
59
o Alterazioni metaboliche
o Intossicazioni
Cause extrapolmonari ed extracardiache:
o Altitudine
o Febbre, ansia, psicosi
o Anemia
o Acidosi metabolica
o Ipertiroidismo od altre patologie ad “alta gittata”
o Deformità scheletriche
o Malattie degenerative neuromuscolari
Le forme cliniche della dispnea sono:
• Inspiratoria: ostacolo alla inspirazione (spasmi, corpi estranei…)
• Espiratoria: restringimento spastico o infiammatorio dei bronchi
• Da sforzo: improvvisa o graduale, da deficit di funzione respiratoria (enfisema, bronchite…)
• Di posizione: alterazione della funzione ventricolare SX → ortopnea
• Parossistica notturna: in genere cardiaca
Diagnosi
L’anamnesi identifica il tipo di dispnea e la presenza di patologie causa di dispnea, correlando le varie
patologie con l’andamento clinico (acute, subacute, croniche)
Radiologicamente si procede con l’RX torace, che dimostra:
• Patologie broncostruttive
• Malattie restrittive polmonari
• Evidenti cause cardiache come edema polmonare acuto associato a dilatazione del ventricolo SX
•
•
•
Forme acute:
o Ostruzioni aeree superiori
o Asma: il radiogramma toracico esclude la presenza di altre patologie e di complicazioni della
patologia asmatica, permette la diagnosi differenziale con embolia polmonare, edema e
ostruzione delle vie aeree
o Polmoniti
o Pneumotorace: diagnosi radiologica agevole dello PNX iperteso.
Collasso totale del polmone
Appiattimento dell’emidiaframma
Spostamento controlaterale del mediastino
o Embolia polmonare: si associa a dispnea nell’80% dei casi
Forme subacute
o Neoplasie laringe e trachea
o Neoplasie polmonari: fenomeno in genere tardivo di intensità proporzionale al distretto
respiratorio escluso
o Mesotelioma pleurico: dispnea nel 60-80% dei casi, proporzionale all’entità del versamento
pleurico e all’espansione della malattia. Inizia sotto sforzo e finisce a riposo. Il sospetto di
mesotelioma pleurico è indicazione elettiva alla toracoscopia.
o Versamenti pleurici: dispnea frequente e grave, spesso è necessaria la toracocentesi
o TBC: non frequente, ma può essere rapidamente progressiva in alcune forme particolari di TBC,
come quella miliare o quella essudativa a focolai confluenti.
Forme croniche:
o Bronchite cronica ed enfisema: tipicamente prima da sforzo e poi a riposo
o Malattie interstiziali: diagnosi di certezza solo con la biopsia. Pochi e aspecifici i rilievi
radiologici, se non con la HRTC
OSTRUZIONE RESPIRATORIA
Riconosce molte cause:
o Congenite e malformative
http://www.hackmed.org
o
o
o
o
o
[email protected] 60
Mencaroni Spartaco
Infiammatorie
Traumatiche
Neoplastiche
Metaboliche (diabete, fibrosi cistica, mucopolisaccaridosi)
Idiopatiche
Che si possono applicare al naso, faringe, laringe, trachea.
Il primo approccio a questi problemi è in genere la visita clinica generale e una specialistica di pertinenza
otorinolaringoiatrica.
L’iter diagnostico radiologico è comunque molto importante.
Ostruzione del neonato
• Atresia coanale: evenienza frequente, si esegue RX per verificare la presenza dell’atresia, che alla TC è
possibile differenziare in ossea o membranosa
• Massa: alla TC si osserva se esiste una connessione endocranica (encefalocele) o endonasale (neoplasia
o cisti nasale)
• Corpo estraneo: RX dei seni paranasali. Se il corpo è radiotrasparente è necessaria la TC
Ostruzione cronica o recidivante
Sospetto di neoplasia si valuta con la TC, eventualmente associata a mezzo di contrasto endovena, a
scansioni assiali e coronali. Una lesione espansiva va indagata con la RM
Ostruzione delle vie aeree superiori
• Dispnea inspiratoria da corpo estraneo: RX torace che riconosce direttamente i corpi radiopachi o
comunque riesce ad osservare segni indiretti nel parenchima polmonare (atelettasie, enfisema a valvola).
• Dispnea inspiratoria da trauma del collo: la TC è essenziale per identificare fratture o traumi delle
cartilagine
• Ostruzione acuta: RX del collo in proiezione laterale, che fa la diagnosi differenziale con le
infiammazioni dell’epiglottide e del laringe. TC e RM possono identificare ascessi peritonsillari e
retrofaringei
• Ostruzione insidiosa infantile: RX torace alla ricerca di cause polmonare, e per la ricerca di fistole
tracheo-esofagee ad H, RM per identificare cause mediastiniche o tracheali, lesioni vascolari, processi
espansivi del mediastino.
• Dispnea adulta: anamnesi per procedure invasive nelle vie aeree, irradiazione o chemioterapia (stenosi,
paralisi delle corde vocali, recidive neoplastiche). Si possono evidenziare 4 quadri più frequenti:
o Paralisi in adduzione delle corde vocali → RX torace TC mediastino – nervi cranici
o Recidiva neoplastica mucosa→ TC e RM
o Tumefazione sottomucosa → TC, agobiopsia ecoguidata
o Stenosi cicatriziale → RX collo e mediastino, TC per la valutazione dello spessore della
cicatrice
EMOTTISI
Espettorazione di sangue con colpi di tosse, di provenienza dalle vie aeree al di sotto della glottide. E’
significativa sempre, massiva al di sopra di 20 ml/24h, critica al di sopra di 600 ml/16 ore.
Riconosce il solito diluvio di cause:
• Polmonari
o Bronchiti acute e croniche
o Polmoniti
o Bronchiettasie
o Ascessi
o TBC
o Micosi
• Neoplastiche: carcinoma, adenoma, metastasi
• Malattie CV:
o Aneurismi
o Stenosi mitralica (ipertensione polmonare grave)
Mencaroni Spartaco
o
o
61
Scompenso VSX
Infarto polmonare / emorragia
•
Varie:
•
o Emofilia e turbe coagulative
o Goodpasture
o Corpi estranei
o Sequestro polmonare
o Traumi
Indeterminati: 10-20% dei casi
Il tipo di materiale espettorato si può collegare a volte alla patologia:
Bronchite, TBC, carcinomi
Materiale mucoso striato di sangue
Infarto polmonare
Sputo ematico senza materiale mucoso o purulento
Ascesso e bronchiettasie
Materiale ematico misto a pus e detriti (vomica)
Edema polmonare
Sangue diluito di aspetto rosato e schiumoso
Diagnosi radiologica
• RX torace in 2 proiezioni: quattro evenienze
o Patologico definitivo
o Patologico con certezza di impossibilità di definire esattamente la lesione → TC
o Patologico con indicazione immediata alla TC, e in seguito ad approfondimento diagnostico
con broncoscopia o biopsia transbonchiale (patologia ilare) o transtoracica (patologia
subpleurica
o RX torace normale con varie possibilità (soprassedere, RX di controllo, TC o biopsia)
• Arteriografia bronchiale: se tutte le tecniche descritte sopra risultano negative o incerte. Si possono
identificare fistole AV sostenute da bronchiettasie, e allora l’esame si prosegue con l’embolizzazione del
tratto arterioso della fistola.
http://www.hackmed.org
CAP 5 PATOLOGIA
[email protected] 62
Mencaroni Spartaco
DEL MEDIASTINO
La scarsa accessibilità clinica del mediastino ne fa un organo esplorabile quasi soltanto con le metodiche
radiodiagnostiche. TC, RM e RX sono quelle standard (no ecografia, eccetto che nell’indagine delle strutture
paraesofagee per la stadiazione di tumori). La scintigrafia interviene nella diagnostica delle neoplasie e nel
loro follow up postoperatorio.
Il mediastino è classicamente diviso in 4 spazi:
• Superiore: al di sopra del piano passante fra l’angolo dello sterno e la IV vertebra.
• Anteriore: dietro ai foglietti pleurici che convergono anteriormente e davanti alla linea passante
anteriormente al pericardio, all’aorta ascendente e ai vasi dell’arco aortico. Contiene timo, linfonodi, vasi
mammari interni
• Medio: tutto quello che sta al di dietro della trachea e del pericardio anteriore, fino ai vasi polmonari.
Contiene cuore, aorta ascendente, arco aortico e suoi vasi, vasi polmonari, nervi frenici, vago e
ricorrente, trachea e bronchi principali
• Posteriore: al di dietro dei vasi polmonari. Aorta discendente, esofago, azygos, radici nervose e nervi
intercostali, linfonodi.
I linfonodi del mediastino sono distribuiti in gruppi:
1. Linfonodi mediastinici alti, fra la vena anonima di sinistra e la trachea
2. Paratracheali superiori: a destra e a sinistra, all’altezza del margine superiore dell’arco aortico, sulla
trachea.
3. Paratracheali inferiori: a destra e a sinistra, al di sotto del margine superiore dell’arco aortico, sulla trachea
4. Linfonodi aorto-polmonari: a sinistra dell’incrocio fra la polmonare e l’aorta.
5. Paraortici: al davanti dall’aorta ascendente
6. Sottocarenali: sotto la biforcazione tracheale
7. Paraesofagei: sotto i precedenti, medialmente sull’aorta discendente
8. Del legamento polmonare: nel legamento a destra e a sinistra
9. Tracheobronchiali: a destra e a sinistra, prima della ramificazione del bronco principale
10. Intrapolmonari: lateralmente alla stazione precedente. All’interno del polmone questi linfonodi fanno
capo a quelli interlobari, lobari, segmentari e subsegmentari, che formano il circuito di drenaggio della linfa
polmonare.
Linfonodi normali (cioè di diametro inferiore ad 1 cm) sono identificati dalla TC e RM nel 90% dei soggetti
adulti.
5.1 METODICHE D’INDAGINE
RX
Di solito l’RX torace standard i due proiezioni mette bene in evidenza il mediastino. Si può usare
contemporaneamente il pasto di bario o alcune proiezioni particolari.
La radioscopia può essere utile per identificare alcune massi pulsatili.
In genere la semeiotica dell’esame RX si basa soltanto sull’alterazione del profilo del mediastino modificato
da parte di masse, in quanto normalmente il contrasto fra le strutture mediastiniche non è visibile.
Perciò esistono delle linee che, se alterate, indicano uno spostamento del mediastino da imputarsi a qualche
massa esuberante.
Queste linee sono fatte dai margini pleurici, dove la presenza del tessuto polmonare areato crea un contrasto
di assorbimento che permette di valutare la posizione reciproca del mediastino e dei polmoni.
TC
Fondamentale. Permette la risoluzione di tutte le strutture contenute, compresi i linfonodi, e la dimostrazione
di molte lesioni patologiche non visibili all’RX.
Soprattutto, la TC da informazioni molto dettagliate sull’estensione dei processi patologici e sul loro
rapporto con le strutture sane vicine, molto importante nello staging neoplastico.
Mencaroni Spartaco
63
Non riesce a distinguere fra lesioni maligne e benigne se non sulla base di alcune caratteristiche
morfologiche (natura cistica della lesione, lipomi, aneurismi).
Può essere importante l’utilizzo di un mezzo di contrasto vascolare, per lo studio della vascolarizzazione di
masse sconosciute e per la differenziazione delle lesioni dalle strutture cardiache.
RM
E’ l’esame che offre il miglior contrasto fra le diverse strutture (con assorbimento radiologico simile, ma con
diverso indice di risonanza tissutale).
Il suo ruolo normalmente non è la definizione della natura delle lesioni (per le quali è molto meglio la
biopsia TC guidata), ma per una miglior definizione dell’estensione del processo.
ECOGRAFIA
Solo lesioni direttamente in rapporto con la parete toracica o con il cuore possono essere valutate tramite
l’ecografia transtoracica. Invece la via transesofagea offre risultati superiori alla TC per la visualizzazione
delle neoplasie esofagee e loro staging, e nella ricerca di linfadenopatie di piccole dimensioni.
ALTRE METODICHE
•
•
Flebografia del mediastino: utile per lo studio del circolo collaterale in caso di ostruzione della cava.
La cavografia superiore si esegue con l’iniezione contemporanea di mezzo di contrasto nella vena
cubitale dai due lati.
Flebografia selettiva del timo: studio della miastenia grave (indagine complementare), con iniezione di
mezzo di contrasto nell’arteria timica (accesso dalla vena cubitale).
5.2 MASSE MEDIASTINICHE
Molto frequenti, poiché i tessuti del mediastino sviluppano frequentemente una iperplasia o altri tipi di masse
in risposta a numerosi stimoli patogeni di varia natura (infiammazioni, cisti, tumori). Tutte queste patologie
inducono uno slargamento del mediastino, visibile al radiogramma toracico, che frequentemente è l’esame di
primo approccio alle patologie mediastiniche.
La sintomatologia generale è abbastanza estesa per l’effetto compressivo che queste strutture possono avere
nei confronti delle strutture del mediastino. Particolarmente frequente:
• Sindrome della vena cava superiore
• Disfagia da compressione esofagea
• Tirage o cornage tracheale
• Sindrome di Bernard Horner
L’esperienza clinica ha dimostrato che esiste una correlazione fra il compartimento mediastinico di comparsa
e la natura della massa, ma questa non è una regola assoluta, e la natura delle lesioni può essere determinata
con certezza soltanto con l’agobiopsia.
Lipomatosi
In obesi, pazienti Cushing e trattati con corticosteroidi non sono infrequenti accumuli focali di grasso
adiposo non capsulato nel mediastino.
Questa lesione benigna, riscontrata di frequente all’RX torace, viene ben differenziata sia dalla TC che dalla
RM, per i valori contrastografici del tessuto adiposo, diversi dai tessuti circostanti nell’uno e nell’altro
esame.
In regione dei forami diaframmatici (iati) accumuli di grasso possono essere invece delle ernie omentali di
difficile diagnosi differenziale.
Cisti mediastiniche
• Congenite: broncogene, pleuriche, pericardiche, del dotto toracico
• Acquisite: timiche, da echinococco, pseudocisti pancreatiche
• Neoplasie di natura cistica: meningocele, teratoma, linfangioma
All’RX appaiono come tenui opacità rotondeggianti o ovali, a margini regolari e netti; la natura cistica della
massa si dimostra con la TC che presenta un valore densitometrico di tipo acquoso, pareti sottili. All’RM si
ottiene una bassa intensità T1 pesata e una alta intensità T2, piuttosto caratteristico delle cisti.
Se però le cisti sono mucose ed emorragico, queste caratteristiche distintive sono molto meno marcate.
http://www.hackmed.org
[email protected] 64
Mencaroni Spartaco
La TC differenzia bene le cisti da echinococco che hanno delle tipiche calcificazioni parietali.
Tiroide aberrante
Al radiogramma appare una massa a margini netti e regolari che disloca la trachea e l’esofago, e deborda da
entrambi i lati dal profilo mediastinico, nella quale possono esserci calcificazioni.
Se si dimostra l’estensione verso il collo o la mobilità con la deglutizione, la diagnosi è agevole anche
all’RX. Altrimenti, la scintigrafia con captazione di radioiodio è diagnostica: il valore di attenuazione alla
TC è elevato (lo iodio presente capta molto i raggi X); l’indagine TC è in indispensabile per stabilire
l’estensione e i rapporti della tiroide con le strutture circostanti.
Timo
Varia in forma e dimensioni nell’età: nei bambini è quadrangolare, negli adulti triangolare e poi va incontro
ad involuzione quasi totale.
L’iperplasia del timo è in genere pediatrica, mentre nell’adulto si può riconoscere solo con la TC e la RM
per l’aumento in genere modesto e regolare.
Il timoma si associa spesso a miastenia ed è maligno nel 25% dei casi. In RX è per lo più mascherato dal
cuore e dai grossi vasi.
Di solito è una massa circoscritta e lobulata, e dove raggiunge la parete toracica è separata da essa da una
zona di ipertrasparenza aerea (segno del solco). Possono esserci calcificazioni.
Alla TC si possono evidenziare anche lesioni piccole, e la RM riesce a definire piuttosto bene i limiti di
invasività della massa.
La diagnosi differenziale fra timoma e timolipoma (lesione benigna ma di difficile distinzione dal tumore
maligno all’RX) viene fatta con la TC per il valore di attenuazione negativo del tessuto adiposo, o con la RM
(alto segnale T1).
Linfadenopatie
Le linfadenopatie si manifestano in corso di TBC, mononucleosi, febbre delle montagne rocciose, silicosi e
sarcoidosi. Però le linfadenopatie più frequenti non sono quelle infiammatorie, ma metastatiche.
I linfonodi di oltre 1 cm sono agevolmente individuati da TC e RM, ma non la loro architettura interna (se
non calcificazioni o aree necrotiche). Il criterio dimensionale di malignità è abbastanza poco affidabile
perché spesso linfonodi infiltrati rimangono a lungo tempo di piccole dimensioni, per cui sono possibili falsi
negativi con una certa frequenza.
Neoplasie del mediastino
• Teratoma cistico e cisti dermoide: forme estese, debordanti dal limite del mediastino, che contengono
calcificazioni, aree ossee alternate a zone di struttura adiposa e acquosa. Non sono differenziabili le
forme maligne da quelle benigne senza una biopsia.
• Tumori neurogeni: il neuroblastoma è frequente in età pediatrica, mentre sono più frequenti nell’adulto
neoplasie delle cellule di Schwann e dei gangli. Sono abbastanza definibili con TC e RM
→ Linfomi: in genere il LH è piuttosto frequente nel mediastino, specie nei linfonodi del comparto
superiore. L’ombra mediastinica all’RX appare slargata da una massa lobulata, per lo più bilaterale, a
margini irregolari e limiti netti. Spesso sono presenti strie di diffusione linfatica dall’ilo al parenchima
polmonare.
Alla TC sono masserelle rotondeggianti, di densità parenchimatosa, a volte disomogenee. La contemporanea
opacizzazione dell’aorta e della cava con mezzo di contrasto consente di differenziarle nettamente dalle
strutture vascolari in sezione.
Le informazioni della TC sono molto utili per la programmazione di interventi di biopsia, o anche di
radioterapia e relativo follow-up, ma non consentono la diagnosi di natura.
Alla RM si ottengono risultati analoghi: le tumefazioni linfonodali in T1 si differenziano molto dal tessuto
adiposo (segnale più basso), e in T2 danno intensità di risonanza anche elevate in relazione alle cellule che le
compongono e alla struttura. Importante della RM è la capacità di differenziare fra recidiva e fibrosi dopo la
Mencaroni Spartaco
65
radioterapia. La fibrosi è infatti ipointensa nelle sequenza T1 e T2, essendo povero d’acqua e scarsamente
vascolarizzata, al contrario della recidiva con segnale medio e spesso disomogeneo.
→ Spesso può essere importante distinguere una cisti o un tumore da un aneurisma dell’aorta o
dell’anonima, che all’RX non sempre è possibile. La TC e la RM sono risolutive in questo.
Infine, durante anemia gravi croniche (specie talassemia) si possono avere nel mediastino opacità
mediastiniche multiple, ben demarcate, che sono masse di tessuto emopoietico extramidollare.
5.3 ALTERAZIONI DIVERSE DALLA PRESENZA DI MASSE
Mediastiniti
Le forme acute sono conseguenti alla rottura dell’esofago quasi sempre, o alla propagazione di un flogosi
linfonodale o all’estensione di un processo flogistico del collo. Possono estendersi al polmone o ai foglietti
pleurici.
Il mediastino appare molto slargato, con margini caratteristicamente mal definiti da tutte e due le parti. Si
può dimostrare la presenza di aria se c’è rottura di esofago, trachea o di un bronco. La trachea può essere
dislocata.
Le mediastiniti croniche sono in genere dimostrabili per via della tendenza a finire in fibrosi; il quadro
radiologico si correla strettamente alla possibilità di ostruzione della vena cava superiore, che deforma e
slarga la morfologia del mediastino.
Enfisema
Segue la rottura dell’esofago, trachea o bronchi, ferite penetranti, rottura di blebs della pleura polmonare. Si
osserva una serie di linee radiotrasparenti che si prolungano nel collo e nella parete toracica laterale. La TC
è più sensibile nell’individuare raccolte gassose di piccole dimensioni.
Ernia polmonare
Evenienza che segue a volte l’atelettasia di un polmone (erniazione di quello sano per compensazione), o al
fibrotorace, versamento pleurico, pneumotorace. Avviene spesso nella porzione retrosternale dove c’è una
minore resistenza delle strutture che circondano il polmone.
http://www.hackmed.org
CAP 6 CUORE
[email protected] 66
Mencaroni Spartaco
E GROSSI VASI
6.1 ESAMI STRUMENTALI
Rx
Si fa con 4 proiezioni tutte assieme al pasto baritato. Sagittale PA, obliquo posteriore sinistro, obliquo
posteriore destro, laterale sinistro.
Il principale tracciato è quello PA, in cui il cuore appare come un’ombra grossolanamente ellittica che è
delimitata da una serie di archi (2 a destra, 3 a sinistra).
L’ombra cardiaca, importante punto di repere per il radiogramma toracico che permette anche di valutare
alcune alterazioni morfologiche degli atri e dei ventricoli.
Le componenti che formano i cinque archi sono:
• Destro superiore: vena cava superiore
• Destro inferiore: contorno esterno dell’atrio destro
• Sinistro superiore: arco aortico
• Sinistro medio: sopra dal tronco della polmonare, sotto dal cono di efflusso del ventricolo sinistro
• Sinistro inferiore: ventricolo sinistro (la punta del cuore è di solito mascherata dall’opacità del
diaframma)
In proiezione laterale si delinea un ombra con un margine anteriore formato dall’aorta ascendente, tronco
polmonare e faccia sternocostale del ventricolo destro, e un margine posteriore formato da atrio sinistro e
ventricolo sinistro. Per limitare il margine posteriore dell’immagine cardiaca si usa effettuare
contemporaneamente esofagramma con bario.
La morfologia del cuore è influenzata sia dell’età che dalla costituzione del paziente. Nel bambino e nel
soggetto brachitipo è orizzontalizzato nel diaframma, mentre nell’adulto e nel longilineo è verticalizzato.
Oggi giorno l’importanza dei diametri cardiaci risulta sempre minore, in quanto il rapporto fra il cuore e le
strutture circostanti sono indicative di patologie molto di più dei diametri.
Allo studio del cuore si accompagnano particolarmente lo studio dell’ilo e del parenchima polmonare, per la
frequente associazione delle patologie cardiache e polmonari (ipertensione polmonare e scompenso cronico,
embolia e cuore polmonare acuto, asma ed edema polmonare cardiaco e scompenso acuto).
Ecografia
L’eco viene applicata il cuore in maniera particolare, sottoforma di un esame detto ecocardiografia, in cui è
possibile ottenere informazione sulle camere cardiache e sui grossi vasi di natura statica e dinamica.
Oltre all’osservazione morfologica e funzionale delle camere cardiache, associando la tecnica doppler si
possono mettere in evidenza i flussi intracardiaci, transvalvolari e di efflusso ai grossi vasi.
Con il color doppler è possibile mettere in evidenza i flussi contemporanei in direzione opposta
(insufficienza valvolare e rigurgiti), elemento diagnostico di importanza notevole.
Il paziente è supino o in decubito laterale sinistro. Si identificano una serie di piani che permettono la visione
delle camere insieme o di ogni camera singolarmente, o in varie associazioni.
Le informazioni che possono essere ricavate sono:
• Statiche/morfologiche: dimensioni, spessore parietale, conformazione delle strutture valvolari
• Dinamiche: contrattilità, cinetica parietale, flussi valvolari e parietali
Queste tecniche sono importanti per lo studio di cardiomiopatie ipertrofiche e dilatative, e soprattutto per
tutte le patologie valvolari.
Ma l’uso dell’eco si estende anche alle strutture attorno al cuore con lo studio del versamento pericardico e
del tamponamento cardiaco.
Si può fare anche una ecocardiografia transesofagea, nella quale la vicinanza della sonda e la mancanza di
strutture che assorbono gli ultrasuoni permette una risoluzione di immagini molto accurata e quindi la
possibilità di studiare eventi molto specifici (dissecazione aortica, ascessi anulari, degenerazione
aterosclerotica, malformazioni).
Mencaroni Spartaco
67
L’uso contemporaneo di mezzo di contrasto (microbolle gassose) permette di migliorare la risoluzione e
valutare la perfusione miocardica (ha meno controindicazioni dell’angiografia).
RM
Indagine di completamento all’ecocardiografia; ha infatti il vantaggio di poter definire qualsiasi piano si
desideri per lo studio delle camere cardiache e la possibilità di valutare la dinamica del movimento cardiaco
attraverso la sincronizzazione dell’emissione degli impulsi con l’onda R del cuore, cosa che fra l’altro
impedisce la rappresentazione di artefatti dovuti al movimento del cuore.
La grande differenza di segnale in T1 fra miocardio, sangue e grasso, e la possibilità di rappresentare in T2 il
sangue bianco permettono una elevata risoluzione di immagine.
Con l’uso di appositi programmi è possibile ottenere ricostruzioni dinamiche del movimento cardiaco.
Applicazioni fondamentali della RM sono le cardiomiopatie, la misurazione dettagliata degli spessori e
diametri delle cavità cardiache, lo studio della dinamica dei flussi, la definizione di masse cardiache, lo
studio della perfusione.
TC
Non molto importante nella valutazione della struttura interna e dei flussi nelle cavità cardiache (la TC non
distingue, senza mezzo di contrasto, fra sangue e parete del miocardio). Utilizzata per la valutazione del
pericardio, lo studio delle masse cardiache e paracardiache, gli aneurismi, le complicanze post chirurgiche.
Procedure invasive contrastografiche
→ Angiografia
Si può fare sia partendo dalla vena cava superiore (cateterismo della femorale) o in maniera selettiva
iniettando il mezzo di contrasto nell’atrio destro direttamente. Il mezzo di contrasto si distribuisce in quattro
fasi permettendo di visualizzare successivamente l’atrio destro e ventricolo destro, il circolo polmonare,
l’atrio sinistro e il ventricolo sinistro, l’aorta. Si usa in genere per le cardiopatie congenite
→ Aortografia toracica sopravalvolare
Tramite cateterismo retrogrado dalla femorale, si studia tutta l’aorta toracica e i tronchi superiori iniettando il
mezzo di contrasto a qualche cm dalle valvole semilunari.
Si mettono in evidenza le alterazioni di:
• Valvole semilunari (reflusso, insufficienza)
• Condizioni di malformazioni congenite (atresia, dotto arterioso di Botallo)
• Alterazioni acquisite (aneurismi, dissezioni, aterosclerosi, calcificazioni)
• Affezioni dei rami dell’aorta
→ Ventricolografia sinistra
Come prima, ma il catetere viene spinto fin dentro al ventricolo attraverso le semilunari. Permette la
determinazione di pressioni ventricolari, volumi, frazione di eiezione, gittata, che consentono uno studio
dettagliato della cinetica cardiaca. Durante la coronarografia viene sempre eseguita (tanto siamo lì...)
→ Coronarografia selettiva
Forma selettiva di angiografia, viene inserito un catetere all’origine delle semilunari e si inietta per ogni
coronaria una quantità adeguata di mezzo di contrasto.
Viene usata di routine durante gli esami preoperatori per l’impianto di bypass, interventi sul cuore di altro
tipo. Non è priva di rischio (mortalità 1:1000)
6.2 ALTERAZIONI DI MORFOLOGIA
Ogni camera cardiaca e grosso vaso ha una sua morfologia caratteristica che permette di valutare in maniera
abbastanza agevole la presenza di modificazione di dimensione. Questo è importante perché sovraccarichi di
pressione e volume (che si creano per alterazione della funzione valvolare) provocano la deformazione delle
strutture a monte.
Questa deformazione è riconoscibile con l’esame RX e studiata approfonditamente con l’ecocardiografia.
•
Atrio sinistro:
o Aggiunta dell’orecchietta atriale nella parte inferiore dell’arco medio di sinistra
o Sollevamento del bronco di sinistra
http://www.hackmed.org
•
•
•
[email protected] 68
Mencaroni Spartaco
o Dislocazione dell’esofago
Ventricolo sinistro:
o Arco inferiore sinistro allungato
o In proiezione laterale, bordo cardiaco sporgente oltre l’ombra della cava inferiore
o Dislocazione dell’esofago
o Spazio chiaro retrosternale normale (diagnosi differenziale con ipertrofia ventricolo destro,
che è anteriore e a contatto con lo sterno).
Atrio destro
o Arco inferiore destro allungato e prominente
o Sporgenza posteriore dell’ombra cardiaca
Ventricolo destro
o Profilo cardiaco spianato
o Punta cardiaca arrotondata
o Allungamento del contorno inferiore del cuore
o Obliterazione della metà inferiore dello spazio retrosternale (molto caratteristica)
6.3 VALVULOPATIE
Stenosi mitralica
All’RX può risultare anche normale se la stenosi è lieve, altrimenti si evidenzia ovviamente un
ingrandimento dell’atrio sinistro. Alla stenosi serrata fa seguito, dopo la creazione di ipertensione
precapillare polmonare, l’ingrandimento dell’ilo, dell’arteria polmonare e del ventricolo – atrio di destra.
L’ipertensione polmonare è ugualmente apprezzabile a livello radiologico (vedi polmone).
All’ecocardigrafia è possibile definire la dilatazione dell’atrio sinistro, e soprattutto la visualizzazione
diretta dei flussi transvalvolari, ed è l’esame di elezione.
L’RM permette anch’essa l’acquisizione di dati cinetici e soprattutto la visione distinta di eventuali trombi
da stasi nell’atrio (evidenziabili però anche con l’eco).
Insufficienza mitralica
La cardiomegalia da sovraccarico, con ingrandimento dell’atrio e del ventricolo sinistro, è di comune
riscontro anche all’esame radiografico. Per via della dilatazione atriale che “assorbe” l’accumulo di sangue
rallentando l’instaurarsi dell’ipertensione, le modificazioni polmonari sono in genere molto meno frequenti
che nella stenosi mitralica.
Esame di elezione al solito è l’ecocardiografia, che permette anche di definire la causa dell’insufficienza
valvolare, nonché delle conseguenze emodinamiche sul ventricolo.
Stenosi aortica
Le calcificazioni valvolari sono ben visibili all’RX. La presenza di ipertrofia del ventricolo sinistro, reperto
principale, è anche ben visibile. Sempre all’RX si può osservare a volte una caratteristica dilatazione
dell’arteria dopo la stenosi.
L’ecografia permette, assieme alle tecniche doppler, una visione dettagliata della cinetica valvolare e
cardiaca, soprattutto se viene eseguita in modalità transesofagea.
In questa patologia inoltre è anche possibile ricorrere al cateterismo cardiaco per studiare la dinamica
valvolare, le pressioni e la superficie della valvola stessa.
Insufficienza aortica
I reperti all’RX (ingrandimento del ventricolo, dilatazione tratto prossimale dell’ascendente, calcificazioni
valvolari) sono poco differenziabili da quelli corrispondenti della stenosi.
All’eco anche si osserva una dilatazione del ventricolo sinistro poco diversa da quella della stenosi. Il
contributo diagnostico risolutivo è dato dal doppler op dalla cine RM.
Alterazioni tricuspidali
All’RX la stenosi e l’insufficienza sono indistinguibili, e si osserva in entrambe ingrandimento atrio destro,
dilatazione della cava, innalzamento del diaframma di destra per epatomegalia da stasi. Con il doppler si
identifica le caratteristiche del rigurgito e il tipo e la gravità del vizio valvolare.
Mencaroni Spartaco
69
6.4 CARDIOMIOPATIE
Dilatativa
La forma dilatativa è molto ben studiata dall’ecocardiografia, che mette in evidenza sia l’ingrandimento del
cuore che il deterioramento della funzione contrattile con associata insufficienza mitralica. Si può misurare la
massa del ventricolo e la frazione di eiezione.
La RM, che valuta ancora meglio i parametri emodinamici, permette anche di dimostrare una miocardite in
fase attiva responsabile del quadro clinico, e di monitorare l’efficacia di interventi infiammatori.
Se si sospetta una patogenesi da insufficienza coronarica può essere indicata la coronarografia.
Ipertrofica
All’eco si identificano facilmente le forme ostruttive, e si evidenzia bene il caratteristico movimento sistolico
del lembo mitralico anteriore. Il doppler, rilevando il gradiente pressorio ai lati della stenosi, permette di
valutarne la gravità.
La RM invece permette di valutare anche la presenza di contemporanea ipertrofia ventricolare, e una misura
della contrattilità regionale molto accurata.
Restrittiva
Ecocardiografia evidenzia restringimento delle camere e aumento di spessore delle pareti, con
contemporanea dilatazione atriale e insufficienza valvolare (conseguenza del restringimento ventricolare).
I fenomeni degenerativi (amiloidosi, sarcoidosi) che provocano la malattia possono spesso essere identificati
con la RM.
6.5 CARDIOPATIA ISCHEMICA
Lo studio per immagini è spesso utile e non solo complementare alla diagnostica della cardiopatia ischemica,
soprattutto per la possibilità offerta da alcune tecniche di mettere in evidenza il miocardio vitale e la
rivascolarizzazione.
Ischemia transitoria da sforzo (angina)
L’ecocardiografia può essere importante durante l’esecuzione di test dinamici da sforzo o a riposo,
permettendo ad esempio di osservare risposte allo sforzo fisico patologiche (come la turbolenza della
cinetica parietale sotto sforzo).
L’esame gold standard è la PET, ma la sua limitata diffusione rende importante la scintigrafia perfusionale
del miocardio (vedi medicina nucleare, cuore).
La RM è inoltre capace di evidenziare anomali contrattili e di perfusione dopo lo sforzo fisico.
La stenosi coronarica responsabile della scarsa perfusione può essere valutata molto efficacemente con la
coronarografia, importante anche nella scelta del trattamento da eseguire.
Infarto del miocardio
Unica tecnica abbastanza “portatile” da poter essere usata durante un attacco acuto è l’ecocardiografia, che
identifica alterazioni della cinetica e le monitorizza nel tempo. Importante anche per l’individuazione
precoce di complicanze come la rottura del setto o la formazione di aneurismi, l’insufficienza mitralica o
papillare, la formazione di trombi.
Nel paziente con infarto dubbio può essere effettuata invece la scintigrafia perfusionale che evidenzia
miocardio vitale, oppure la scintigrafia con indicatore selettivo di infarto (già dopo 1-2 ore dall’inizio del
dolore è positiva la scintigrafia con Tc-glucarato).
Identificazione di miocardio vitale
Tecniche come la PET e la scintigrafia sono importanti per la identificazione del miocardio vitale, in grado
di riprendere, dopo adeguata riperfusione, la funzione contrattile normale, influenzando le scelte terapeutiche
e la prognosi.
Anche l’ecocardiografia evidenzia il miocardio vitale come zone ipo/acinetiche dove però la contrattilità
migliora con l’infusione di dobutamina.
http://www.hackmed.org
[email protected] 70
Mencaroni Spartaco
Rivascolarizzazione
La coronarografia selettiva sebbene molto invasiva è importante per valutare la pervietà dei bypass e
l’efficacia dell’angioplastica. Può però essere usata anche la RM.
6.6 PERICARDITE
•
•
Acuta essudativa: l’ombra cardiaca si deforma “a fiasca” per la raccolta di liquido negli spazi inferiori
del pericardio; la deformazione si modifica con il decubito. Si ha anche che l’arco superiore di destra si
allarga per la dilatazione della vena cava superiore e l’angolo cardiofrenico diventa ottuso. Ecografia
evidenzia versamenti anche di piccole dimensioni, mentre la TC e la RM evidenziano bene gli
ispessimenti pericardici e quei versamenti che si raccolgono nella parte posteriore.
Cronica costrittiva: quadro della stasi del piccolo e grande circolo è ben evidenziabile con l’RX; la
morfologia del pericardio non si modifica con il decubito. Durante l’espirazione si verifica un
movimento del cuore verso l’alto e medialmente. La TC identifica il tessuto fibroso attorno al cuore ed
ha un ruolo diagnostico di primo piano, anche per la facilità con cui evidenzia le calcificazioni (per
questo la TC è meglio della RM in questo caso).
6.7 MALFORMAZIONI CARDIACHE
Sono molto diffuse.
L’RX ha un ruolo di approccio importante, ma non riesce mai a identificarle in maniera caratteristica.
L’eco invece ha elevata sensibilità, soprattutto in epoca neonatale dove è più facile (il cuore è più grosso in
proporzione all’adulto, specie rispetto ai polmoni in via di sviluppo, e ci sono molte finestre acustiche).
Invece nell’adulto l’esame non invasivo principale è la RM.
Spesso la diagnosi definitiva viene però dall’angiografia e dal cateterismo cardiaco, soprattutto in fase di
raccolta di dati, in vista dell’intervento chirurgico.
Descriviamo qui di seguito i reperti fondamentali delle principali malformazioni, eccetto che delle alterazioni
valvolari discusse a se.
Coartazione aortica
• Dilatazione dell’aorta ascendente (prominenza dell’arco superiore destro)
• Alterazione del profilo aortico subito sotto all’arco in corrispondenza della stenosi
• Dilatazione sub stenotica
L’aorta nel complesso assume una formazione a “3”.
Il circolo ipercinetico delle intercostali che supera la stenosi può provocare delle caratteristiche osteolisi
meccaniche sulle coste (lesioni a colpo d’unghia).
L’angiografia è comunque l’esame di elezione, quando risulta difficile per la stenosi serrata si ricorre
all’angio RM.
DIV
La dilatazione del ventricolo destro è ben dimostrabile all’RX, mentre la sede, la dimensione e il tipo di
difetto sono molto spesso rilevabili all’ecocardiografia, sicuramente con il color doppler.
La ventricolografia sinistra o l’angiocardiografia definiscono esattamente l’entità dello shunt.
DIA
La dilatazione dell’atrio destro senza interessamento delle cavità ventricolari si rileva all’RX. Ecocardio e
RM sono utili come nel DIV, e anche qui la diagnosi risolutiva si ottiene con l’angiografia.
Pervietà del dotto di Botallo
Sia l’arco superiore di sinistra che quello medio sono dilatati (il primo per l’ectasia dell’aorta a monte dello
shunt, il secondo per la dilatazione della polmonare sotto lo shunt perché riceve il flusso).
Se l’ecografia è importante in epoca neonatale, e la RM nell’adulto, la risoluzione diagnostica si ha con
l’angiografia e il cateterismo cardiaco che dimostrano la pervietà del dotto.
Tetralogia di Fallot
Nelle forme lievi la malattia è radiologicamente asintomatica. Man mano che la stenosi polmonare aumenta
di gravità, invece, si ha una modificazione caratteristica dell’ombra cardiaca:
• Arco medio di sinistra rientrante → ipoafflusso nella polmonare
• Punta cardiaca arrotondata e nettamente al di sopra del diaframma → dilatazione del ventricolo destro
• Diminuzione netta del disegno polmonare
Mencaroni Spartaco
71
Il cuore ha una forma caratteristica a “zoccolo olandese”.
Le malformazioni del cuore (discontinuità fra setto e radice aortica, atresia della polmonare) sono
evidenziabili dalla RM e ecocardiografia. L’angiocardiografia mette in evidenza la stenosi polmonare e il
DIV.
Sindrome di Eisenmenger
Per la presenza o l’insorgenza di una ipertensione polmonare in un cuore con DIV o DIA si osserva una
inversione destro-sinistra del flusso dello shunt (la cardiopatia diventa cianogena). In questa sindrome il
ricorso all’angiografia è molto pericolosa, e viene quindi evitata. La diagnosi differenziale importante con
l’ipertensione polmonare viene fatta dimostrando la comunicazione fra le cavità cardiache con
l’ecocardiografia.
TUMORI
I tumori del cuore sono molto rari e nel 75% dei casi sono benigni. La RX occasionalmente evidenzia
modificazioni dell’ombra cardiaca, o della vascolarizzazione polmonare, secondarie alla presenza delle
masse. Ecografia e soprattutto TC e RM sono gli esami elettivi.
6.8 IPERTENSIONE
•
•
•
SISTOLICA
DIASTOLICA
Lieve
Moderata
Severa
Lieve
Moderata
Severa
140-159
160-169
>170
90-104
105-114
>115
Ipertensione labile: occasionale riscontro di valori alterati
Ipertensione maligna: ipertensione grave accompagnata da edema papillare ed essudati/emorragie
retiniche
Ipertensione scellerata: aumento di valori di pressione recente con alterazioni del fundus oculare senza
edema papillare
Dal punto di vista eziologico si distinguono vari tipi di ipertensione:
• Essenziale o idopatica: 6% dei soggetti generale, circa il 92-94% degli ipertesi
• Secondaria
o Sistolica:
Aortosclerosi
Insufficienza valvolare aortica
Tireotossicosi
Pervietà del dotto arterioso
o Sisto-diastolica:
Renale
• Renovascolare
• Del parenchima
Da cause ormonali
• Contraccettivi
• Cortico-surrenale
• Feocromocitoma
• Acromegalia
Neurogena
Da altre cause
• Coartazione aortica
• Policitemia vera
• Policitemia nodosa
Ipertensione nefrovascolare
Dal punto di vista diagnostico questo tipo di ipertensioni si possono evidenziare bene con la diagnostica per
immagini. Sono circa l’1-4% di tutti gli ipertesi, e siccome è difficile evidenziare la stenosi renale, si
definiscono ipertesi nefrovascolari quei soggetti in cui l’ipertensione migliora dopo la rivascolarizzazione
renale.
http://www.hackmed.org
[email protected] 72
Mencaroni Spartaco
Clinicamente si ha ipertensione di recente insorgenza, con progressione accelerata o maligna, refrattaria alla
terapia medica; in genere in soggetto fra 30 e 50 anni. Può esserci rumore di soffio addominale e spesso c’è
retinopatia grave.
La stenosi arteriosa deriva da aterosclerosi o da displasia fibromuscolare.
Diagnosi preradiologica
Differenziare le forme essenziali da quelle secondarie.
Importante l’anamnesi che permette di valutare la familiarità spesso associata alle forme primitive. Quelle
secondarie insorgono in genere prima dei 35 o dopo i 55 anni; precedenti infezioni ricorrenti alle vie urinarie
e traumatismi lombari, nicturia o polidipsia sono suggestivi di ipertensione nefropatica. ATndenza
all’aumento o perdita di peso suggeriscono rispettivamente Cushing o feocromocitoma.
All’esame obiettivo si valuta l’accumulo di adipe del Cushing, rumori di soffio vascolare dorsale
(coartazione istimica dell’aorta), ombelicale o al fianco (arteria renale); valutazione dei polsi femorali
Gli esami di laboratorio sono:
• Urine completo
• Test sierologici di funzionalità renale
• Potassio → iperaldosteronismo
• Determinazione delle catecolamine urinarie (feo)
• Determinazione del cortisolo urinario (Cushing)
Diagnosi radiologica
• RX torace: evidenzia le ripercussioni cardiopolmonari presenti nell’ipertensione e in alcune cause
identifica la patogenesi (insufficienza aortica, coartazione..). L’Rx però ha delle precisazioni:
o il sovraccarico pressorio ventricolare SX non associato ad aumento di V non si diagnostica
radiograficamente
o aortosclerosi: allungamento dell’aorta all’RX
o insufficienza aortica: dilatazione dell’aorta all’RX
o coartazione dell’aorta: osservare la piccolezza del cappuccio aortico, la rientranza del profilo
esterno dell’aorta discendente, e non soltanto le lesioni a colpo d’unghia delle coste
o pervietà del dotto: segni polmonari di iperafflusso, vascolari di ectasia del ramo sinistro
della polmonare, cardiaci di dilatazione dell’atrio sinistro
Tutte le altre tecniche radiologiche servono a documentare la patologia organica responsabile
dell’ipertensione secondaria o a diagnosticare l’ipertensione nefrovascolare.
•
•
•
•
Renografia radioisotopica: per la diagnosi di ipertensione nefrovascolare si impiega il DTPA Tc-99m,
che fornisce dati precisi anche nei casi in cui la stenosi interessa un ramo piccolo dell’arteria renale. In
questo esame la somministrazione di ACE-inibitori (captopril) provoca una rapida diminuzione del
flusso renale (↓dell’uptake ed eliminazione del tracciante) indicando una componente di attivazione
reninica.
Angiografia digitale: consiste nell’aortografia e nell’arteriografia renale selettiva. In genere riesce
molto bene a visualizzare una eventuale stenosi renale
AngioRM: sensibilità del 100%, specificità 92% su stenosi significative (oltre 50% del diametro del
vaso). I limiti sono la difficoltà di visualizzazione delle stenosi distali, e la sovrastima possibile
dell’entità della stenosi
Doppler: causa l’interferenza di adipe o gas la arteria renale è identificata solo nel 58-65% dei casi, e
risulta più difficile identificare l’arteria se è presente una stenosi. Non si riconoscono mai arterie
soprannumerarie.
Trattamento ipertensione nefrovascolare
• PTA: l’angioplastica viene comunemente impiegata. I risultati si confrontano favorevolmente con quelli
di rivascolarizzazione chirurgica. Nelle lesioni dell’ostio della renale però la PTA non ha buoni risultati a
distanza per cui è meglio inserire uno stent.
Mencaroni Spartaco
73
6.9 DOLORE PRECORDIALE (DIAGNOSTICA DIFFERENZIALE RADIOLOGICA)
Dolore che interessa l’area di proiezione del cuore sulla parete anteriore ma che non è sempre di origine
cardiovascolare, mentre non sempre il dolore del cuore si proietta nel precordio.
Il dolore CV è determinato dal cuore, dal pericardio e dai grossi vasi, in diverse situazioni:
•
•
•
Ischemia
Pericardite acuta. Dolore influenzato dagli atti del respiro, dalla tosse, a volte dalla deglutizione (simile a
quello pleurico), continuo, oppressivo, anteriore (simile all’infarto), in regione paracardiaca e alla spalla
di SX.
o Malattia reumatica
40,6%
o Infezioni batteriche
19,8%
o TBC
7,3%
o Pericarditi virali
10,4%
o Pericarditi uremiche
11,5%
o Pericarditi neoplastiche
3,1%
o Collagenopatie
2,1%
Dolore aortico
o Dissecazione: estremamente violento, localizzato alla zona della dissecazione ma migrante
in rapporto al tipo di dissecazione:
Tipo A: interessa aorta ascendente indipendentemente dalla sede di ingresso e di
estensione
Tipo B: non interessa l’aorta ascendente
Diagnostica radiologica
Ischemia e infarto
RX
• Segni di ipertensione venosa polmonare
• Calcificazioni coronariche in paziente con coronaropatia
• Calcificazioni miocardiche in paziente con infarto pregresso (raro)
• Questi reperti da soli, anche in presenza di dolore, non sono sufficienti per la diagnosi di ischemia in
atto
Ecografia
La dimostrazione di asinergia o assenza del normale movimento parietale sistolico, specie se segmentaria, è
un segno indiretto di ischemia che, associato alla dimostrazione di normalità del pericardio e dell’aorta, è
abbastanza specifico.
Pericardite
• RX: quasi sempre normale
• Eco: decisivo per la diagnosi di versamento anche piccolo, e diagnostica tutte le pericarditi
infiammatorie. Per le forme epistenocardiche e neoplastiche si associa anche la TC o la RM
• Ecocardiografia: si usa come esame successivo per dirimere dubbi
• TC e RM: sono perfettamente in grado di identificare una patologia pericardica in caso di dubbi ulteriori
Dissecazione aortica e fissurazione di aneurismi
• RX: Fornisce una serie di elementi si sospetto:
• Deformabilità del cappuccio aortico
• Alterazioni delle limitanti mediastiniche
• Aumento del diametro del mediastino
• Segni di ispessimento della parete aortica (valutazione possibile solo se sono presenti calcificazioni
dell’intima)
http://www.hackmed.org
•
•
•
•
[email protected] 74
Mencaroni Spartaco
Ecografia standard: la forma transtoracica è l’indagine di primo approccio al sospetto di dissezione
aortica nel torace. Criterio di diagnosi positiva è la dimostrazione di un lembo fluttuante nel lume aortico,
con evidenza di doppio lume vasale
Ecografia transesofagea: recente, netta diminuzione dei FP e FN rispetto alla eco standard. Sensibilità
98%, specificità 88%.
TC: indispensabile se agli altri esami si è evidenziato un aneurisma per escludere la possibilità di una
fissurazione
Angiografia: sempre meno utilizzata per la sua invasività, riservata a casi del tutto particolari
Esami di complemento nella valutazione del dolore precordiale
• ECG: in presenza di dolore persistente escluse le cause aortiche e pericardiche si esegue ECG anche in
assenza di sospetto clinico di infarto. In assenza di alterazioni ECG si deve prendere in considerazione la
possibilità di una dissezione aortica senza lembo flottante nel lume, che deve essere valutata alla TC (con
e senza mezzo di contrasto) e alla RM. TC e RM sono diagnostiche per la dissezione anche quando non è
possibile praticare l’ecografia transtoracica
• Aortografia toracica: eseguita a volte in paziente con dissezione accertata per chiarire il campo
operatorio.
• Coronarografia: valutazione funzionale e studio dell’anatomia coronarica. Le indicazioni a questo
delicato esame sono:
o Ischemia accertata ed elevata probabilità di malattia coronarica
o Angina instabile o stabile, refrattaria alla terapia medica
o Pregresso infarto miocardico e presenza di angina
o Aneurisma post-infarto del ventricolo sinistro
o Diagnosi equivoca di cardiopatia ischemica
o Paziente candidati a correzione chirurgica di vizi valvolari specie se anziani o
coronaropatici
La definizione di patologia coronarica richiede la definizione di almeno tre parametri angiografici, ossia
la riduzione del diametro, la lunghezza della stenosi e la morfologia della lesione. Il primo parametro
determina la riserva coronarica, ossia il rapporto numerico fra il flusso massimo misurato durante
iperemia indotta e il flusso basale. Fino al 50% di stenosi è ridotta solo la riserva coronarica, mentre
attorno al 75% di stenosi anche il flusso basale è ridotto significativamente.
La morfologia delle lesioni recentemente è stata correlata con il quadro clinico, e si distinguono
attualmente:
• Stenosi semplici: concentriche e a margini lisci e regolari → angina stabile
• Stenosi complicate: margini irregolarmente frastagliati, ulcerazioni e aspetti di
dissezione → angina instabile e infarto
• Lesioni complicate da trombi endoluminali
•
Cineventricolografia: fornisce informazioni su:
o Alterazioni del movimento parietale o asinergie regionali: si correlano male con il danno
strutturale del miocardio e non possono essere considerate espressione di necrosi o di danno
di vasi coronarici
o Alterazioni strutturali (aneurismi post infarto)
o Alterazioni dimensionali
Mencaroni Spartaco
CAP 7 PATOLOGIA
75
VASCOLARE
Si tratta in questo capitolo la patologia vascolare non occlusiva, per la quale si rimanda alla radiologia
interventistica (radiologia, capitolo 2).
7.1 DIAGNOSTICA STRUMENTALE DELLE ARTERIE
Ecografia
Nella pratica possono essere utilizzate tutte le tecniche, ma soprattutto è importante il doppler e tutte le sue
applicazioni. Anche la normale ecografia consente di acquisire elementi di informazione sulla patologia della
parete del vaso e sulla sua struttura.
Il vaso normale presenta lume anecogeno, delimitato da echi regolari e continui corrispondenti alla parete;
nelle arterie è possibile vedere una linea iperecogena sottile e continua che corrisponde alla parte fibrosa e
muscolare della parete.
Dinamicamente le arterie si distinguono perché sono pulsatili, le vene sono invece caratterizzate da una
deformabilità associata a movimenti muscolari o respiratori.
Arteriografia
Come ricordato sono le tecniche di indagine fondamentale. Oltre all’angiografia convenzionale, di cui
abbiamo già parlato, ne esistono fondamentalmente altre due, entrambe realizzate con tecnica simile alla
convenzionale, ma utilizzando tecniche di imaging di radioscopia digitale a sottrazione di immagine
consentono una selettività maggiore e un minor uso di mezzo di contrasto.
Angiografia digitale arteriosa (ADA)
Tecnica di elezione che rispetto all’angiografia convenzionale permette di studiare praticamente ogni
distretto (aghi di 4-5F) e usare meno mezzo di contrasto. I cateterismi selettivi e superselettivi delle
biforcazioni aortiche sono moltissimi (i più usati a livello coronarico, cerebrale, tripode celiaco e mesenterica
superiore).
Si accede dalla femorale e si prosegue con il catetere a ritroso fino alla biforcazione interessata nella quale si
inietta il mezzo di contrasto.
Angiografia digitale venosa (ADV)
Studio della patologia dei grossi vasi in assenza di polsi periferici. Si punge una vena del braccio dove si
inietta mezzo di contrasto che si diffonde sistemicamente. Non ha rischi di danno ai vasi legati al
cateterismo, ma non è per niente selettiva. La qualità dell’immagine non è eccellente e il mezzo di contrasto
è parecchio.
Si usa quando è impossibile raggiungere con il catetere il distretto interessato.
TC
Da sola riconosce solo i vasi di calibro maggiore, invece è importante con mezzo di contrasto nello studio
degli aneurismi, nelle complicazioni post operatorie, emorragie, fistole. La tecnica spirale, con successiva
ricostruzione di immagine in 3D, permette di visualizzare i vasi con risoluzione paragonabile all’angiografia.
RM
Il sangue in movimento non da segnale nelle sequenze classiche. Fra lume e parete vi è quindi un buon
contrasto e si possono vedere anche le alterazioni piuttosto fini. Si usa in genere a livello toracico dove la
ecografia non è praticabile.
7.2 PATOLOGIA ARTERIOSA
Forme congenite
Le malformazioni di decorso e origine in genere sono asintomatiche e il loro rilievo è occasionale. Fa
eccezione l’origine della succlavia di destra dall’arco aortico che può dare disfagia lusoria.
Aneurismi e fistole AV possono essere indagati rispettivamente con RM ed ecodoppler.
Le displasia arteriose sono invece spesso causa di ipertensione giovanile se colpiscono le renali, e possono
essere studiate agevolmente con ecografia e RM.
Arteropatie funzionali
Fenomeno di Raynaud: arteriografia mostra vasospasmo riducibile con vasodilatatori
http://www.hackmed.org
[email protected] 76
Mencaroni Spartaco
Acrocianosi: arteriografia simile al Rayunaud, con sovrapposta componente di stasi venulare
Forme infiammatorie
Le forme batteriche acute sono una controindicazione per il rischio di disseminazione all’arteriografia. Le
forme croniche sono per lo più TBC o luetiche. In genere con l’angiografia si riesce a valutare lo stato della
parete sia nelle forme infettive che in quelle reumatiche
Forme degenerative
Aterosclerosi
Spesso riguarda l’aorta toracica e addominale. Fin dall’RX del torace è possibile identificare una serie di
alterazioni precoci:
• Prominenza dell’aorta ascendente
• Innalzamento e sporgenza dell’arco aortico
• Calcificazioni parietali, spesso presenti a livello addominale.
Tutti questi reperti sono meglio caratterizzati però dalla TC e ancora meglio dall’ecografia, tecnica di
elezione non invasiva per lo studio delle alterazioni parietali. Con la sola ecografia è già possibile valutare:
• Percentuale di stenosi arteriosa
• Ispessimenti parietali
• Placche ateromasiche
• Trombi (non quelli recenti che sono anecogeni)
Associando all’ecografia la tecnica doppler diventa possibile anche studiare le stenosi dal punto di vista
emodinamico e monitorarle nel tempo.
Infine l’aortografia, che di per sé non è necessaria, può mostrare diverse alterazioni della parete e tutte le
alterazioni dell’aterosclerosi.
Furto della succlavia
Le tecniche doppler hanno oggigiorno soppiantato la diagnosi arteriografica, permettendo di identificare
bene la deviazione di flusso dal circolo basilare durante l’uso del braccio.
Aneurismi
Occasionalmente la diagnosi è possibile anche con il solo radiogramma del torace, specialmente quando la
massa aneurismatica ha un orletto calcifico ben risultante alla RX. Gli aneurismi toracici possono essere
inoltre visualizzati per lo spostamento degli organi del mediastino o per l’erosione dello sterno.
L’RX addominale riconosce soltanto grossi aneurismi calcificati.
Grossi aneurismi comunicanti con il lume principale dell’arteria sono ben visibili all’arteriografia e
all’ecografia; l’eco addominale è molto sensibile per gli aneurismi dell’aorta, rispetto ai quali ha la stessa
capacità risolutiva della TC, ma riesce meno bene a dimostrarne i rapporti con le strutture circostanti e i
limiti
La metodica più sensibile per il loro studio è però la TC, magari con mezzo di contrasto, che mette in
evidenza anche i piccoli aneurismi delle arteria intraparenchimali (aneurismi miliarici), e soprattutto riesce a
dare una definizione spaziale eccellente dei limiti e dei rapporti con le strutture vicine.
La RM è ancora migliore come definizione ed ha la possibilità di vedere trombi anche recenti nella parete,
ma rispetto alla TC è più lenta e laboriosa e non viene usata per la diagnosi di aneurismi in rottura.
Dissezioni aortiche
RX inefficace.
La TC riesce a dimostrare il lume vero e quello falso separati dall’intima, e consentire un orientamento
topografico indispensabile dal punto di vista chirurgico per preparare l’intervento. Idem la RM.
L’angiografia riesce a dimostrare i due lumi ma con minor precisione.
L’ecografia transesofagea è piuttosto sensibile, ma a livello addominale questa tecnica è poco efficace.
7.3 DIAGNOSTICA STRUMENTALE DELLE VENE
A livello venoso sono possibili due tecniche peculiari, la flebografia e la ecografia.
Mencaroni Spartaco
77
Flebografia
Consente uno studio anatomico e dettagliato di molti distretti venosi e della loro patologia. Si possono
distinguere varie metodiche.
Nel flebogramma normale le vene dotate di valvole sono attraversati da rigonfiamenti disposti lungo il
decorso quando i seni valvolari sono riempiti, mentre le vene prive di valvole hanno contorni lisci.
Per puntura diretta
• Arto inferiore: puntura di una vena del piede e infusione di mezzo di contrasto. Applicando un laccio
all’altezza del malleolo si blocca il circolo superficiale e si induce la diffusione del mezzo di contrasto in
quello profondo (se i rami comunicanti sono pervi). Si usa per lo studio di varici, tromboflebiti, sindromi
postflebitiche, ricerca di sorgenti emboligene.
• Flebografia ascendente: con paziente supino, si incannula una vena del dorso del piede, e si inietta
mezzo di contrasto legando all’altezza del malleolo. Dopo aver preso le radiografie del circolo profondo,
si toglie il laccio e si fa un’altra infusione, che stavolta interesserà il circolo superificiale
• Flebografia discendente: si incannula a livello ileo-femorale e si esegue una radiografia prima con
paziente supino, poi in piedi, per valutare la capacità di contenimento delle valvole del circolo profondo.
• Flebografia dell’arto superiore: puntura della vena del dorso della mano o della basilica (non cefalica)
al gomito. Indicazione nel sospetto di tromboflebite o infiltrazione / compressione delle vene ascellari
• Cavografia superiore: puntura laterale della basilica e iniezione bilaterale simultanea di mezzo di
contrasto. La metodica mette in luce soprattutto arti superiori e mediastino, con il sistema delle azygos, e
permette di visualizzare eventuali circoli collaterali di compenso.
• Cavografia inferiore: mediante puntura bilaterale della vena femorale all’inguine, o con cateterismo
femorale della cava all’origine. In genere nello studio di malformazione della cava.
La flebografia della cava è eseguita soltanto in casi dubbi o molto complessi, dato che di solito è sufficiente
la TC o l’ecografia.
Selettive
Si usa la stessa tecnica dei cateterismi arteriosi, raggiungendo di solito per via transfemorale le vene renali,
surrenali, iliache, tiroidee, azygos. L’iniezione del mezzo di contrasto è effettuata controcorrente. Queste
tecniche permettono anche il prelievo mirato di sangue venoso.
Di ritorno postarteriografico
In alcune condizioni è possibile osservare la vena dopo aver fatto una arteriografia, sfruttando il filtraggio del
mezzo di contrasto attraverso il circolo capillare. Questo è molto efficace ad esempio nella valutazione del
circolo spleno-mesenterico-portale dopo l’arteriografia del tripode celiaco.
Ossee
L’elevata capacità di drenaggio dell’osso rende possibile effettuare delle flebografie dell’osso semplicemente
inserendo mezzo di contrasto nella spongiosa. Sono metodiche meno utilizzate oggi che in passato.
7.4 PATOLOGIA VENOSA
SINDROME DELLA VENA CAVA INFERIORE
Si ha per ostacolo al deflusso che può avvenire in diversi punti del suo decorso:
• Prossimale: sindrome di Budd-Chiari, ostruzione al livello delle sovraepatiche
• Intermedia: a livello della confluenza fra una o entrambe le vene renali e la cava
• Distale: sotto la confluenza delle due vene renali (edemi dei genitali) o al livello delle vene iliache o
femorali (edema di un arto con vene collaterali superficiali sotto l’ostruzione)
L’ostruzione completa non è accompagnata da sintomi evidenti se si verifica lentamente, mentre invece
stenosi anche incomplete possono essere acutamente sintomatiche se si sovrappongono ad esse dei trombi.
Le patologie alla base dell’ostruzione possono essere diverse, maligne o benigne.
MALIGNE
BENIGNE
• Neoplasie primitive o secondarie del fegato, • Fibrosi retroperitoneale (indicazione allo stent)
surreni, ovaio, utero, pancreas, reni.
• Trapianto del fegato
• Sarcomi retroperitoneali
• Cirrosi e cisti epatiche
http://www.hackmed.org
•
•
[email protected] 78
Mencaroni Spartaco
•
Linfadenopatie pelviche o retroperitoneali
Leiomiosarcomi tipici della vena cava, visibili
alla TC come ispessimento parietale
•
•
Aneurismi infiammatori che danno aderenze (si
originano per infiammazione, complicanze di
bypass aortico o da complicanza chirurgica post
nefrectomia)
Patologie congenite (rare)
Atresia della cava inferiore
Causa più frequente trombosi, originata dal distretto femoro-popliteo.
Rischio di embolia polmonare¸ che è pericolosa sia se massiva che no (anche quella subsegmentale può
dare alla lunga cuore polmonare cronico).
Indagine di elezione scintigrafia perfusionale o se non disponibile TC meglio spirale.
La chirurgia non è utile a meno che si tratti di una trombosi massiva.
PATOLOGIA DELLA VENA PORTA
Si tratta di ipertensione portale per ostacolo al deflusso con ascite, splenomegalia, anomalie digestive, varici,
emorroidi, stasi venosa, presenza di circoli collaterali.
Esiste una classificazione emodinamica funzionale dell’ostruzione della porta:
• Presinusale
• Sinusale
• Post sinusale
Che sul piano clinico si traduce in prepeatica, epatica o postepatica.
Misure diagnostiche generali dell’ipertensione portale
Per misurare la pressione si usa un catetere nella vena sopraepatica: la P epatica libera così ottenuta è di 1-5
mm Hg. Si incunea successivamente il catetere fino ad incontrare una resistenza, e quella è la P epatica
bloccata (6-9 mmHg).
La differenza fra le due pressioni da un gradiente che permette di stabilire la gravità dell’ipertensione
portale:
• 7-15 mmHg → ipertensione lieve
• 15-30 mmHg → ipertensione moderata
• > 30 mmHg → ipertensione grave
Normalmente il circolo epatico ha tre vie.
• Afflusso arterioso (25%)
• Afflusso portale epatopato (75%)
• Efflusso sovraepatico
Quando, per qualsiasi motivo, il deflusso sovraepatico è impossibile, si attiva una seconda via di deflusso,
patologica, che è il circolo portale epatofugo. In questo si attivano dei circoli collaterali porta cava che
normalmente sono chiusi o a basso flusso, ma che in quelle condizioni diventano patologicamente attivi.
Questi sono:
• Il sistema del retius, una anastomosi fra le vene iliache e la cava tramite rami retroperitoneali
• L’anastomosi fra la mesenterica superiore e inferiore che attraversa il plesso emorroidario (responsabile
delle emorroidi)
• Il circolo superficiale perietale e periombelicale che collega le vene iliache con le epigastriche
(responsabile del caput medusae)
• Il circolo coronaro-stomacico che collega la mesenterica superiore con le vene esofagee (responsabile
delle temibili varici).
L’ipertensione che si crea nel circolo venoso portale (mesenterica superiore e iliaca) provoca l’ascite e la
splenomegalia, che si considera tale quando il diametro maggiore della milza è di oltre 14 cm.
Mencaroni Spartaco
79
Tecniche diagnostiche per immagini
• Ecografia: analisi strutturale di fegato e milza, ricerca di ostruzioni, dimostrazioni di ascite, analisi del
flusso portale, dimostrazione di ascite anche di minima entità
• TC: gli stessi rilievi in forma panoramica (migliore), ma non l’analisi del flusso
• RM: come la TC ma con la possibilità di informazioni sul flusso
• Angiografia: utilizzando l’arteriografia del tripode celiaco e analizzando il ritorno venoso si ottiene una
mappa dettagliata del circolo portale con individuazione degli ostacoli. Non sono possibili analisi
flussimetriche.
• Esofagogramma baritato: mette in evidenza le varici ma è molto meglio l’endoscopia, che permette
anche il trattamento.
Ipertensione presinusoidale
Ostacolo del sistema portale intraepatico (raro) o preepatico.
Le ostruzioni prepatiche sono causate da:
• Forme infettive
o Schistosomiasi
o Malaria
• Forme congenite
o Fibrosi
• Forme infiltrative
Le più comuni interruzioni preepatiche sono invece provocate da:
• Ostruzioni di:
o Vena splenica
Omentale
Gastriche brevi
Gastroepiploica
In genere sono implicate cause trombotiche, neoplastiche (pancreas), discrasie ematiche (policitemia),
infiammatorie (pancreatite, sepsi addominale, flebite)
Spesso si verifica il fenomeno della arteriolizzazione dei capillari epatici, per via del grande afflusso di
sangue in più dalla via arteriosa, che compensa la carenza di sangue dalla porta.
Ipertensione postsinusoidale
→ Frequentemente legata alla sindrome di Budd Chiari, la quale si forma in genere per la trombosi delle
vene sovraepatiche (70%) ma può anche essere congenita per presenza di una ostruzione membranosa
incompleta che diminuisce il deflusso venoso sovraepatico.
Le condizioni predisponenti alla trombosi delle sovraepatiche:
• Ipercoagulabilità
• Gravidanza
• Traumi
• Patologie mieloproliferative
• Cirrosi epatica avanzata
• Neoplasie
I circoli collaterali che si mettono in atto sono praticamente sempre quelli epatogiugulari; la SBC può però
dare un reflusso anche nelle retroperitoneali, in cui non si evidenziano circoli collaterali ma sono presenti
vortici.
La vena porta, pervia, presenta una inversione del circolo.
Altri sintomi sono:
• Epatomegalia per lo più del lobo caudato e superiore
• Splenomegalia
• Trombosi portale associata nel 20% dei casi
• Ascite
• Interruzione del flusso portale epatopato non compensato da arteriolizzazione ( a differenza che nella
ipertensione persinusoidale)
http://www.hackmed.org
•
•
[email protected] 80
Mencaroni Spartaco
Alla TC: aree di ipoperfusione associate a mancata opacizzazione delle vene sovraepatiche e della cava
inferiore (a differenza che nella presinusoidale in cui sono sempre visibili, poiché il sangue e il mezzo di
contrasto ci arrivano dalla via arteriosa)
Alla TC: impregnazione parenchimale disomogenea
Altre condizioni di ipertensione postsinusoidale sono:
• Trombosi della vena mesenterica: ha elevata mortalità e si tratta solo con la trombolisi; può essere data
da diverse circostanze:
o contraccettivi orali
o sepsi
o pancreatite
o policitemia
o deficit di antitrombina III
o chirurgia addominale
• Ostruzione della confluenza spleno-mesenterico-portale: in genere da pancreatite con emorragie o da una
stenosi serrata della porta che si complica con trombo
• Fistola artero-portale: sempre causa di ipertensione portale presinusale extraepatica, può provocare
arteriolizzazione capillare e quindi trasformarsi in ipertensione postsinusale.
In questi pazienti è importante valutare la presenza di shunt spontanei che possono essere predittivi di
particolari complicazioni:
TIPO DI SHUNT
COMPLICAZIONE
Splenorenale
SI
Emorragia digestiva
NO
Emorragia digestiva
Splenosurrenalici
SI
Emorragia digestiva
Splenosurrenalici
NO
Emorragia digestiva
• Cause cardiache:
o Scompenso congestizio
o Pericardite costrittiva
o Insufficienza tricuspidale
%
45%
60%
60%
94%
Ipertensione portale sinusoidale
Legata a patologie epatiche.
• Colangiosclerosi
• Cirrosi: specialmente alcolica, ma anche da qualsiasi causa. Nel fegato cirrotico ci sono anche ostacoli
postsinusoidali. Si riscontra anche e sempre ascite, splenomegalia e attivazione di tutti i circoli
collaterali, oltre i segni clinici di insufficienza epatica.
Alla TC le varici sono visibili come puntini neri sull’esofago bianco. In corso di cirrosi alla TC si vedono
anche:
• Ascite
• Splenomegalia
• Varici gastriche
• Dilatazione della vena porta
• Riabilitazione della vena ombelicale
INDICAZIONI ALLA TIPS
•
•
INDICAZIONI MAGGIORI
Sanguinamento acuto di varici non controllabile •
con terapia medica o scleroterapia
•
Sanguinamento ricorrente di varici nonostante •
terapia corretta
•
INDICAZIONI NON SEMPRE VALIDE
Asciti refrattarie
S. di Budd-Chiari
Controllo di sanguinamento in paziente in attesa
di trapianto
Sindrome epatorenale
Mencaroni Spartaco
81
CAP 8 RADIOLOGIA ADDOMINALE
In genere la patologia delle due sierose addominali è costituita da versamenti di natura varia, ascessi e
tumori. Tutte queste patologie possono essere indagate tramite RX (sommariamente), ecografia (in maniera
completa) e TC (in maniera dettagliata).
8.1 PERITONEO E MESENTERE
PERITONEO
Il peritoneo può essere funzionalmente distinto in tre sezioni comunicanti:
• Scavo pelvico: in comunicazione estesa con la cavità addominale tramite le docce perietocoliche, è la
parte più declive del peritoneo e spesso qui si raccolgono fluidi e secrezioni
• Addome: parte principale, diviso idealmente in due dal mesocolon, contiene numerosi recessi e ospita
anteriormente l’attacco del mesentere
• Retrocavità degli epiploon: spazio virtuale fra lo stomaco e il peritoneo parietale, comunica
abbondantemente con la cavità peritoneale tramite l’anello di Winslow: si trova anteriormente al
pancreas e in stretto rapporto con stomaco e milza.
Ascite
L’ascite dà sintomatologia quando viene a superare gli 800 ml circa: ma il più piccolo volume individuabile
è di 100 ml con l’ecografia, l’esame più sensibile.
L’intera cavità peritoneale risulta occupata da liquido per volume superiore a 1000 ml.
A differenza che nella patologia retroperitoneale, nell’ascite si riesce a vedere la limitazione netta dei
muscoli psoas da parte del tessuto adiposo.
L’ecografia è importante anche per la rimozione del liquido (paracentesi evacuativa).
Emorragia
Dopo traumi chiusi addominali, in genere rottura della milza o del fegato, ma anche in diatesi emorragiche o
per la rottura di tumori.
La dimostrazione della rottura viscerale e della raccolta liquida viene fatta tramite ecografia e TC; la
diagnosi differenziale fra le varie cause deve essere fatta con l’agobiopsia.
Ascesso
In genere eventi postoperatori: se non trattati hanno una mortalità del 30%, ed è importante una diagnosi
precoce.
L’esame RX diretto mostra la presenza di gas e liquido in sede atipica, con possibilità di individuare i
caratteristici livelli idroaerei.
L’ecografia consente spesso la dimostrazione diretta dell’ascesso, e alla TC si osservanp anche le
caratteristiche della parete.
Un particolare tipo di ascesso è quello sottodiaframmatico, che può essere sospettato anche da un RX
standard del torace quando si identificano:
• Livelli idroaerei sottodiaframmatici
• Elevazione dell’emidiaframma
• Versamento pleurico
• Strie atelettasiche basali da compressione
• Aumento della distanza fra il diaframma e la bolla gastrica (a sinistra)
Peritonite acuta
Quadro radiologico di ileo paralitico, con falde gassose sottodiaframmatiche se c’è anche perforazione
intestinale; in ogni caso è caratteristica la obliterazione della linea adiposa properitoneale (qualsiasi cosa sia).
Questo quadro è comunque diagnosticato principalmente in maniera clinica, e anche la peritonite tubercolare
o neoplastica non è affatto differenziabile da quella normale.
Neoplasie
Per lo più visibili all’ecografia in forma di noduli o placche di difficile individuazione con l’ecografia; alla
TC presentano densità simile a quella dei tessuti molli e sono spesso circondati da ascite: la loro
individuazione è agevolata dall’introduzione di mezzo di contrasto radiopaco in cavità peritoneale. Ecografia
http://www.hackmed.org
[email protected] 82
Mencaroni Spartaco
e TC hanno nel complesso una sensibilità molto minore a quella della laparoscopia che visualizza
direttamente la cavità peritoneale nel suo complesso.
MESENTERE
Linfoadenopatie
Non sono dimostrabili con la linfografia, ma tramite ecografia e TC
Neoplasie
Sono importanti clinicamente i carcinoidi e le metastasi, soprattutto quelle da tumori pancreatici. Possono
indurre intense reazioni desmoplastiche e frequente è l’infiltrazione neoplastica del grande omento.
Le cisti mesenteriche si sviluppano fra le pagine mesenteriche sottoforma di reazioni rotondeggianti, a
margini netti e regolari.
L’ecografia mostra il contenuto liquido della lesione, la TC ne definisce dimensioni e disposizione.
Ascessi e raccolte flemmonose
Compaiono in corso di pancreatite, malattie di Crohn, traumi penetranti e interventi operatori; si presentano
sottoforma di raccolte capsulate con o senza gas nel loro contesto.
Le pancreatiti necrotizzanti possono diffondere lungo il mesocolon inducendo perforazioni del colon e
peritonite. La malattia di Crohn coinvolge, nelle fasi avanzate, il mesentere.
Infine ispessimenti del mesentere si possono avere anche dopo traumi addominali anche di poco conto.
8.2 ESOFAGO
ESAMI STRUMENTALI DELL’ESOFAGO
L’esofago può essere effettuato sia in modalità morfologica che in modalità funzionale, con diversi esami
che comportano comunque l’opacizzazione del lume.
Esami morfologici
• Esofagografia a DC: il paziente viene invitato ad ingerire un quantitativo d’aria (con polveri
effervescenti o deglutizione a narici chiuse) che distende il lume dell’esofago. In seguito viene ingerito
50-100 ml di soluzione baritata che induce un verniciamento sottile e uniforme del lume. L’esame RX
viene fatto in posizione prona, che mette in evidenza particolarmente bene le ernie iatali
• Esofagografia opaca: metodica che mira a riempire completamente il lume, in modo che tutto quello
che vi aggetta appaia come un difetto di riempimento, quello che sporge come un eccesso; era diffusa in
passato prima di quella a DC. Si fa semplicemente ingerire una soluzione di bario ad alta viscosità e
media concentrazione, che riempie perfettamente tutto il lume.ù
• TC: riconosce molto bene il lume dell’esofagfo, ed è ideale per osservare la presenza di neoplasie e la
loro estensione ai tessuti paraesofagei
• Ecografia: viene fatta durante l’endoscopia, ed offre una buona visione della struttura della parete
consentendo anche di osservare le tre tonache
L’esofago è costituito da una serie di strutture funzionali; un primo segmento tubulare che costituisce tutta
la lunghezza dell’organo fino a poco sopra il diaframma, è dotato soltanto di attività peristaltica. Questo si
continua con il segmento vestibolare, che ha una funzione di sfintere ed è a riposo in contrazione tonica.
Il segmento vestibolare è formato da tre porzioni:
• Anello A: pozione sopradiaframmatica che con un anello muscolare forma il passaggio fra segmento
tubulare e vestibolare
• Porzione intraiatale, ancorata allo iato diaframmatico dalla membrana fibroelastica di Laimer.
• Porzione sottodiaframmatica, di circa 3 cm, che entra nello stomaco e contiene l’anello B; questo è una
escrescenza anulare della sola mucosa, rivestita prossimalmente da epitelio squamoso e distalmente da
quello colonnare3. Quando questo anello si restringe eccessivamente (al di sotto dei 13 mm) e provoca
disfagia si chiama anello di Schatzki.
In questa regione sottodiaframmatica è contenuto lo sfintere esofageo inferiore, una zona di alta pressione di
circa 3 cm. Esso è formato da diverse strutture:
3
Questa formazione corrisponde endoscopicamente alla “zig-zag line”.
Mencaroni Spartaco
83
A livello della giunzione esiste un ispessimento della muscolatura esofagea presente circa 1 cm al di sopra
dell’angolo di HIS: questa zona coincide sempre con la zig-zag line. L’esofago ha tre tonache muscolari:
circolare interna, semicicircolare intermedia e longitudinale esterna. A livello di quest’area esiste un
ispessimento della tonaca intermedia che si ancorano con le fibre dello stesso tipo nella giunzione (fibre a
cravatta svizzera) e del fondo gastrico (fibre di Willis). Il ruolo di queste fibre è quello del mantenimento
dell’angolo di HIS.
Il pilastro diaframmatico destro forma una pinza attorno alla porzione addominale dell’esofago, ed è detto
laccio di Allison.
L’angolo acuto di HIS e la bolla gastrica formano una strozzatura e una compressione dal fondo verso il
cardias che mantiene chiusa a valvola di Von Gubaroff, formata dalla protuberanza della mucosa
esofagea,detta “rosette”.
La membrana freno-esofagea che nella sua porzione inferiore forma un fascio che stringe il LES, e che
agisce da sfintere.
La pressione positiva addominale che agisce sul tratto addominale dell’esofago
Esami funzionali
• Pasto baritato: il paziente ingerisce una sola dose di bario in bolo, il cui transito viene seguito con
tecniche di radioscopia digitale e videoregistrato. Questo esame permette una analisi molto dettagliata del
transito esofageo e di eventuali disfunzioni cinetiche.
• Scintigrafia: permette di valutare con notevole precisione il transito del bolo attraverso l’esofago, di
solito fatta con Tc solfuro colloidale. A seconda dei casi l’acquisizione delle immagini richiede da 2-3
minuti a 30-40. Premette anche di valutare l’efficacia della terapia ed è l’esame di elezione per il reflusso
gastroesofageo, specie in età pediatrica. Inoltre, ripetuta l’acquisizione a 2-4 ore nel campo polmonare,
può valutare la presenza di polmonite ab ingestis.
PATOLOGIA DELL’ESOFAGO
Discinesie
Discinesie ipertoniche segmentarie
Prendono anche il nome di peristalsi terziaria, condizione patologica che porta alla contrazione scoordinata
di segmenti esofagei. Si tratta in genere di un epifenomeno di altre patologie esofagee; si diagnosticano con
gli esami funzionali nei quali appare, dopo il passaggio del bario, una serie di incisure marginali frastagliate
nel terzo medio dell’esofago
Spasmo esofageo diffuso
L’onda si arresta nel tratto prossimale dell’esofago, lo sfintere inferiore è normale. Le alterazioni
caratteristiche sono:
• Comparsa di contrazioni simultanee, ripetitive in risposta alla deglutizione, non peristaltiche
• Comparsa di contrazioni spontanee in assenza di deglutizione
• Intervalli di normale peristalsi
• LES normale
Si evidenziano spasmi anulari fra i quali si interpongono dilatazioni; sono disposte simmetricamente e in
genere in perpendicolare rispetto all’asse maggiore dell’esofago.
All’esofagogramma si evidenzia anche un aumento di spessore della parete (aumento della banda di densità
fra il bario e le strutture mediastiniche circostanti).
Acalasia
• Mancato rilasciamento del LES durante la deglutizione
• Assenza di attività peristaltica nel terzo inferiore del corpo esofageo (o peristalsi scoordinata)
• Dilatazione esofagea.
Di solito la pressione a riposo nel LES risulta aumentata.
Dal momento che la parte superiore dell’esofago risulta conservare la sua funzionalità, il bolo viene
inghiottito normalmente, ma rimane incastrato a monte della giunzione esofago-gastrica perché il LES non si
http://www.hackmed.org
[email protected] 84
Mencaroni Spartaco
apre e la muscolatura esofagea inferiore non è in grado di spingerlo contro la sua resistenza. L’ingresso del
cibo nello stomaco avviene solo quando la colonna di cibo vince con il suo peso la resistenza del LES.
La malattia attraversa tre fasi; una prima fase di compenso, in cui si ha soltanto restringimento del tratto
terminale dell’esofago, è difficilmente valutabile all’RX. Una seconda fase, in cui la peristalsi può essere
anche moderatamente aumentata e si ha una dilatazione modesta del corpo esofageo (fino a 6 cm), si osserva
abbastanza bene all’RX.
Infine in una terza fase si ha lo scompenso, in cui la parete esofagea non riesce a contenere l’accumulo di
cibo: in questa fase l’esame con bario riesce a dimostrare tutti i segni della patologia:
• Dilatazione abnorme dell’esofago, oltre 6 cm, con aspetto sigmoideo (dolicomegaesofago)
• Discesa del cibo per gravità, assenza completa di peristalsi
• A causa del passaggio selettivo di materiale liquido nel LES dalla parte inferiore dell’esofago e del
ristagno di aria nella parte alta, si ha il caratteristico segno della mancanza della bolla gastrica
• Aspetto a coda di topo della giunzione gastroesofagea per il difficoltoso passaggio del bario nello
stomaco.
• Segno del livello costante: si può vedere che il LES si apre a scatto quando la colonna di bario
nell’esofago raggiunge un certo livello, sempre costante, che evidentemente corrisponde ad un peso
sufficiente a vincere la resistenza muscolare.
L’acalasia si complica frequentemente con esofagite da stasi, alla quale segue con una frequenza maggiore
della media il carcinoma gastrico.
Discinesia ipotonica diffusa
Detta anche sclerodermia esofagea, condizione in cui, a seguito di malattie degenerative nervose o patologie
del collageno, l’esofago è atonico, slargato e peristalticamente silente.
In genere lo svuotamento dell’esofago è normale con il paziente in piedi (per gravità), ma in decubito questa
è completamente assente: sono presenti bolle d’aria a lungo immobili nel lume esofageo.
Acalasia vigorosa
Presenta le caratteristiche manometriche dell’acalasia classica e dello spasmo diffuso, ma è una malattia a se.
Presenta comunque:
• Contrazioni ripetitive, non propulsive, di grande ampiezza
• Mancato rilasciamento del LES
Dolore toracico, disfagia e rigurgito sono i sintomi essenziali. Non c’è dilatazione esofagea e alla
manometria tutti i segmenti sono interessati da spasmi, ed è la mancata dilatazione del LES che lo
differenzia dallo spasmo esofageo diffuso.
Alterazioni di struttura
Sono 3 malformazioni legate ad errori di separazione fra esofago e trachea
Atresia esofagea
Interruzione completa della canalizzazione dell’esofago, che termina a fondo cieco. Il neonato lamenta
episodi di soffocamento e rigurgiti durante l’alimentazione e marcata perdita di peso. Allo studio radiologico
si mette in evidenza:
• Decorso esofageo a fondo cieco, con tasca prossimale piena d’aria
• Totale assenza di gas intestinali all’RX addome
• Opacità polmonari alveolari irregolari per polmonite ab ingestis.
L’esame baritato non è necessario.
Atresia con fistola tracheo-esofagea
Oltre all’atresia esiste una fistola che è però posta distalmente all’interruzione del lume esofageo. La
sintomatologia e il quadro radiologico è lo stesso, ma si evidenzia una grande quantità di aria nell’intestino;
può essere difficile identificare la fistola.
Fistola isolata
In genere molto grave, la sintomatologia è data da episodi di soffocamento e tosse durante i pasti, ripetute
polmoniti refrattarie al trattamento, disfagia.
Mencaroni Spartaco
85
All’esame radiologico si osserva difficilmente la fistola, se non usando accorgimenti paricolari.
Diverticoli
Estroflessioni acquisite o congenite della parete esofagea intera (veri) o della sola sottomucosa (falsi). Sono
molto rare le forme acquisite, soprattutto sono forme di esofago doppio. Quelli acquisiti sono diverticoli da
trazione e da pulsione, i primi secondari ad un processo cicatriziale con retrazione fibrosa e i secondi ad un
indebolimento della parete con spinta eccessiva dall’interno.
Si dividono in faringei, medio-toracici ed epifrenici.
Diverticoli faringei (diverticolo di Zenker)
Diverticolo da pulsione secondario alla incoordinazione faringo-esofagea, o più raramente ad un disordine di
motilità dell’esofago.
Si ha che quando c’è una non coordinazione fra la contrazione faringea e il UES (ritardo di apertura di questo
o contrazione del cricofaringeo) nella parete posteriore dell’esofago, fra le fibre del muscolo costrittore
inferiore del faringe e il cricofaringeo, nell’area detta triangolo di Killian, dove sono assenti le fibre
longitudinali dell’esofago, si forma una estroflessione della sottomucosa che è limitata dalla colonna.
Crescendo, infatti, essa si sposta di lato, generalmente a sinistra, e lì si reperta.
Dopo somministrazione di pasto con bario si osserva una sacca mediana nella parte superiore del mediastino,
riempita parzialmente di bario, a convessità inferiore: spesso c’è in essa un livello orizzontale costituito da
aria e sostanze ingerite. Durante la deglutizione si sposta verso l’alto svuotandosi bruscamente del suo
contenuto.
Diverticoli toracici
15% di tutti i diverticoli dell’esofago, spesso asintomatici. La maggior parte di essi riconosce come eziologia
la trazione da parte di un linfonodo divenuto fibrotico a seguito di un processo tubercolare. Essendo dotati di
parete muscolare, e non tendendo all’aumento di volume, sono in genere asintomatici, anche perché sono
stirati verso l’alto o lateralmente, e quindi il cibo non tende all’ingresso dentro di essi.
Invece i diverticoli da pulsione, sebbene rari sono pericolosi perché secondari ad una pressione interna da
discinesia che provoca estroflessione della sottomucosa e mucosa attraverso una debolezza della parete
muscolare.
Radiologicamente sono una piccola tasca rotondeggiante riempita di bario collegata all’esofago da un
colletto ampio e corto.
Diverticoli epifrenici
Sono localizzati negli ultimi 10 cm dell’esofago, costituiti da mucosa e sottomucosa e considerati fra quelli
da pulsione. Sono legati a patologie con spasmo esofageo o all’ernia iatale con reflusso.
I sintomi iniziali sono digestione difficile, singhiozzo e pirosi, ma poi si ha anche rigurgito, dolore toracico e
disfagia. Spesso interviene una ulcerazione della mucosa con sanguinamento cronico.
Hanno aspetto radiologico simile a quello dell’ernia iatale, dalla quale si differenziano essenzialmente per i
contorni irregolari e l’assenza di rilievo mucoso, ma soprattutto per la normale posizione dell’esofago
terminale e dello stomaco.
Ernia iatale
Oggi si tende a distinguere fra ernie da scivolamento, ernie paraesofagee ed ernie da esofago corto. Accanto
a queste forme pure sono presenti spesso delle forme miste.
Ernia da scivolamento (tipo 1 di Akerlund)
A seguito dell’allargamento dello iato, una parte della porzione cardiale e del fondo gastrico scivolano nel
torace, per via della pressione addominale che è maggiore di quella toracica. Questo meccanismo è alla base
del 90-95 % delle ernie iatali.
Si tratta in genere di una situazione intermittente, l’ernia è in parte o del tutto riducibile con manovre
adeguate e viene evocata da manovre compressive dell’addome o dalla variazione di decubito. In genere è
una affezione asintomatica dell’età medio-alta, e in alcuni casi raggiunge una notevole dimensione.
http://www.hackmed.org
[email protected] 86
Mencaroni Spartaco
Lo studio radiologico viene effettuato di solito con il paziente in decubito prono, con l’addome compresso da
un cuscino, in inspirazione profonda. Il pasto baritato, una volta raggiunto lo stomaco, potrà evidenziare una
serie di segni caratteristici:
• Slargamento dello iato esofageo del diaframma
• Presenza della tasca erniaria (differenziabile dalla bolla gastrica per la presenza di pliche)
• Giunzione gastroesofagea al di sopra del diaframma
• Esofago terminale flessuoso
• Anello B in sede sopradiaframmatica (segno non sempre presente, ma patognomonico)
• Riducibilità (non costante) dell’ernia in stazione eretta
Ernia paraesofagea (tipo 2 di Akerlund)
Difetto di una parte della membrana freno-esofagea, provoca il mantenimento in posizione del cardias, ma
l’inserimento parallelo ad esso di una parte di stomaco nel torace, di solito il fondo. Questa condizione può
portare alla formazione di una sacca erniaria grande, dove si impegnano colon, milza o le anse intestinali,
con gravi conseguenze.
Si differenziano, con la stessa tecnica, dalle precedenti per:
• Conservazione dell’angolo di His (assenza di reflusso)
• Tasca erniaria a lato dell’esofago (la tasca contiene sia il fondo gastrico che l’esofago
sottodiaframmatoco)
• Assenza della bolla gastrica in sede normale
• Presenza di opacità a volte livellata in sede retrocardiaca
Ernia da esofago corto
Condizione in cui l’esofago nel suo complesso è accorciato, ristretto nel punto distale; sono in genere forme
acquisite, nelle quali è sempre presente il reflusso e l’esofagite, dalla quale spesso derivano.
La tasca erniaria è ben conservata e visibile, e l’ernia non è riducibile (diagnosi differenziale con ernia da
scivolamento).
Malattia da reflusso gastroesofageo
Diagnosi del reflusso
Il singolo episodio di reflusso si ottiene con la alterazione dei meccanismi antirefluesso dell’esofago e con la
presenza di condizioni gastriche che lo facilitano.
Esistono i seguenti meccanismi antireflusso:
• Sfintere crurale, del diaframma, attorno allo iato esofageo
• Angolo di Heis, fra fondo gastrico e cardias
• LES
La barriera anti – reflusso così costituita sopporta pressioni di 20 – 30 mm Hg; la pressione gastrica è
normalmente superiore a quella esofagea e il reflusso si crea quando il LES ha un tono basale inferiore a 6-8
mm Hg. Le cause della malattia possono essere dipendenti quindi dalla inadeguata chiusura della barriera o
dall’aumento della pressione gastrica. Le fibre del LES non sono né adrenergiche né colinergiche, ma
rispondono al VIP e al NO
Cause esofagee:
• Ipotonia del LES (sclerodermia, fumo di sigaretta, beta adrenergici, esofagite, farmaci calcioagonisti
e colinergici.
• Inappropriato rilascio del LES (aumento del numero e della durata dei rilasciamenti)
• Manovre chirurgiche ed endoscopiche
• Diminuzione della clearence esofagea
• Esofagite e diminuzione della resistenza della mucosa
Cause gastriche:
• Ritardo dello svuotamento
• Reflusso duodeno – gastrico, da asincronismo della peristalsi dei due organi
• Aumento del volume gastrico (pasti abbondanti)
• Vicinanza del contenuto gastrico con la giunzione esofagea (clinostatismo)
Mencaroni Spartaco
•
•
87
Aumento della pressione gastrica (obesità, gravidanza, ascite, abiti stretti)
Ernia iatale da scivolamento (perdita della componente crurale della barriera)
Il 10% delle situazioni riconosce un carattere idiopatico.
Il singolo episodio di reflusso non è patologico; lo diventa quando è cospicuo e frequente, tale da causare un
danno alla mucosa esofagea.
La diagnosi strumentale si impone quando la diagnosi clinica è dubbia e il trattamento medico non da
risultati favorevoli. Sebbene la metodica diagnostica di elezione sia l’accoppiata pH-metria ed endoscopia, la
diagnostica per immagini ha importanti applicazioni:
• Ricerca di cause: ernia iatale, alterazioni della motilità vengono indagati con pasto baritato
• Sostituzione della pH-metria con la scintigrafia nel bambino.
• Definizione della esofagite da reflusso, del Barret e della eventuale polmonite ab ingestis (fra le
complicazioni, vedi dopo).
• Informazioni morfologiche importanti nel preoperatorio.
Per il reflusso il pasto baritato è poco sensibile e specifico. Si ricorre ad altre tecniche, in genere non
radiologiche: come sottolineato prima, volte basta l’anamnesi per fare una diagnosi clinica, ma se non c’è
regressione dopo un ciclo di terapia o se i sintomi sono gravi, è necessario ricorrere alla diagnostica
strumentale.
• Anamnesi con fattori di rischio e indicazione dei sintomi tipici
• Evidenza di reflusso alla radiografia. Si ha solo nelle forme molto avanzate, ma diviene importate
ricorrere all’RX quando ci sia una stenosi peptica o si valuta la possibilità di un’ernia iatale.
• Registrazione del pH intramurale esofageo, con un elettrodo ingerito dal paziente, e pH-metria
dinamica nelle 24 ore. L’elettrodo viene fissato 5cm al di sopra del LES, e il test è positivo quando il pH
non cambia fra questo livello e lo stomaco, e diminuisce in seguito a manovre di compressione gastrica. I
fenomeni di reflusso sono ortostatici nel 10-33%, clinostatici 25-46%, biposizionali nel 65-75% dei casi.
Cut-off fissato a pH 4. Fornisce informazioni sulla durata degli episodi, sul tempo di esposizione dello
stomaco al pH acido, e sulle relazioni fra posizione e rflusso.
• Esofagogramma con pasto baritato. Utile per identificare le erosioni e le stenosi peptiche, nonché
l’evidenza di un adenocarcinoma.
• EGDS con prelievi bioptici multipli: diagnosi del Barrett in assenza di alterazioni radiografiche.
Evidenzia anche esofagite erosiva e stenosi peptica distale e permette la valutazione dell’esofagite.
Inoltre è utile anche per differenziare l’origine peptica o neoplastica di lesioni ulcerative o delle stenosi
• Manometria completa: fornisce informazioni sull’attività del LES e sulla funzione motoria dell’esofago.
• Test di Bernstein: infusione nell’esofago di HCL 0,1 N. Questo crea pirosi retrosternale solo nei pazienti
con esofagite. Il test è controprovato dalla ingestione di soluzione fisiologica, che non provoca bruciore
nei soggetti normali.
• Test di clearance acida dell’esofago: valutazione pH-metrica del numero di deglutizioni necessarie
perché l’esofago si liberi di 10ml di soluzione di HCL 0,1 N.
• Studi radioisotopici: ingestione di un isotopo non assorbibile, in genere Tc99, e valutazione della sua
transizione a livello esofageo. E’ una metodica assolutamente non invasiva che può essere usata nel
bambino.
Diagnosi delle complicazioni
Le complicazioni della malattia da reflusso sono:
Esofagite erosiva: lesioni evidenti all’endoscopia, con iperemia molto evidente, friabilità e ulcerazioni
che provocano sanguinamento ed emorragia digestiva
L’endoscopia è l’esame elettivo per la diagnosi dell’esofagite lieve, mentre le forme medie e severe possono
essere agevolmente diagnosticate anche all’RX.
Gli aspetti endoscopici permettono una classificazione di gravità dell’esofagite stessa, ma non sono così
efficienti nella valutazione delle stenosi; l’importanza di una possibilità di diagnosi radiologica sta nel poter
avere, in una sola seduta, un quadro diagnostico completo (individuazione di una causa eziologica
contemporaneamente alla valutazione di gravità dell’esofagite). Inoltre le metodiche di radiologia costano
meno ed hanno meno rischi.
http://www.hackmed.org
Aspetti endoscopici
Classificazione endoscopica di Savary Miller
dell’esofagite
• Grado I: edema con erosioni non confluenti
• Grado II: erosioni confluenti ma non di tutta la
circonferenza esofagea
• Grado III: erosioni confluenti estese a tutta la
circonferenza, emorragia
• Grado IV: ulcerazioni e/o stenosi peptica o altre
complicanze
[email protected] 88
Mencaroni Spartaco
Aspetti radiologici
• Ridotta distensibilità dell’esofago
• Ispessimento delle pliche longitudinali. Talvolta
è limitato ad una sola plica, che appare con una
protuberanza polipoide
• Scomparsa dell’aspetto liscio della superficie
mucosa (iperemia)
• Presenza di essudato infiammatorio in
pseudomembrane
• Erosioni e ulcere multiple, a chiazze o a strie,
con alone edematoso e pliche di fibrosi radiate
(aspetto a ruota di carro)
• Ulcere profonde: il processo si estende in
maniera continua, come nella colite ulcerosa
• Pseudodiverticoli
intramurali;
formazioni
provocate dalla dilatazione dei dotti ghiandolari
Stenosi peptica: danno della mucosa secondario alla fibrosi infiammatoria, produce disfagia ed è presente
nel 10% dei soggetti con un reflusso. Le stenosi del reflusso sono lunghe pochi cm e distali (giunzione fra
epitelio cilindrico cardiale e pavimentoso esofageo). La progressione è lenta e produce disfagia prima per i
solidi e poi per i liquidi.
Appaiono al pasto baritato come difetti di riempimento simmetrici, a contorni lisci, in genere vicini al giunto
gastroesofageo.
Esofago di Barrett: progressiva sostituzione dell’epitelio pavimentoso pluristratificato dell’esofago con
epitelio metaplastico, di tipo gastrico o intestinale, comunque colonnare. Il Barrett è da considerarsi a tutti gli
effetti una lesioni displastica precancerosa, che aumenta il rischio di insorgenza di un adenocarcinoma
esofageo.
La diagnosi di Barrett era un tempo distinta in due sottogruppi (short e long Barrett) a seconda della
lunghezza della lesione (maggiore o minore di 3 cm).
I criteri oggi necessari alla diagnosi si basano invece sulla vicinanza del reperto dalla ZZL e sul tipo di
metaplasia: in anatomia patologica, una metaplasia di tipo fondo gastrico non è da considerarsi un Barrett.
La metaplasia intestinale di Barrett è di tre tipi:
• tipo gastrico
• tipo cardiale
• tipo intestinale: questa forma può evolvere in adenocarcinoma della giunzione esofago-gastrica, che si
manifesta con calo ponderale e disfagia rapidamente progressiva.
L’esofago di Barrett si associa spesso alla stenosi peptica e quindi la disfagia in un paziente con reflusso
deve essere osservata con molta attenzione.
La diagnosi del Barrett è solo endoscopica: radiologicamente può essere sospettato quando si osserva un
aspetto reticolare, simile al rilievo gastrico.
Ulcera di Barrett: lesione ulcerativa nel contesto della metaplasia, che si può complicare con emorragia,
perforazione o stenosi.
Problemi respiratori: per aspirazione del materiale refluito e per broncospasmo provocato per via
indiretta dall’irritazione della mucosa esofagea.
Esofagiti infettive
Le esofagiti sono forme in genere abbastanza rare, appannaggio per lo più di categorie a rischio
immunologico (AIDS, trapiantati, chemioterapia).
Candida
Raramente si osserva anche come complicazione di acalasia o esofagiti chimiche.
Mencaroni Spartaco
89
Diagnosi essenzialmente endoscopica: alla RX si può osservare la presenza, nelle forme lievi, di aree di
mucosa indenne alternate ad aree con aspetto pseudomembranoso (aspetto ad acciottolato). Nelle forme
erosive, invece, si osserva una contemporanea presenza di erosioni (espansioni del riempimento) e di rilievi
anulari pseudopolipoidi (difetti di riempimento), per cui nel complesso tutta la mucosa appare irregolare.
Nelle forme erosive si possono avere anche deficit della motilità e temibili complicazioni come la
perforazione e la stenosi cicatriziale.
Herpes
Ulcere discrete superficiali nel tratto medio dell’esofago; difficile
differenziarla dall’esofagite erosiva da candida.
Citomegalovirus
Ulcere giganti, piatte, circondate da un alone edematoso. Sospetto
soltanto nei gravi immunocompromessi
Alcool
Fumo
Esofago di Barrett
Acalasia (ristagno di cibo)
Diverticolo
Ingestione di caustici
Radiazioni
S. di Plummer Wilson
Aflatossina fungina
Reflusso gastrico persistente
Condizioni socioeconomiche
scadenti
Varici
L’endoscopia permette una adeguata diagnosi e contemporaneo
trattamento efficace, ed è la metodica di elezione per questa
patologia.
Anche all’RX però queste radici sono di facile individuazione, anche
se
il loro aspetto può essere influenzato dallo stato di distensione e di
attività cinetica dell’organo. L’indagine deve essere eseguita in stazione eretta e poi integrata da
radiogrammi assunti in decubito prono.
Nella fase iniziale sono piccoli cordoni serpiginosi, mentre nella forma conclamata sono difetti di
riempimento nodulari.
Possono essere viste anche con l’ecografia intraesofagea (eventualmente associata a doppler) e con la TC.
Masse esofagee
Corpi estranei
Se radiotrasparenti, si evidenziano con pasto baritato. Se radiopachi, è sufficiente l’RX diretta del torace. In
genere si arrestano al restringimento aortico o nella parte terminale dell’esofago.
Dovendo poi toglierli con l’endoscopia, la diagnosi endoscopica è del tutto sufficiente, anche se può essere
pericoloso l’introduzione dell’endoscopio qualora vi siano corpi estranei taglienti.
Tumori benigni
Usualmente hanno un aspetto di deficit di riempimento centrale o eccentrico, a margini netti e regolari, senza
alterazione della motilità parietale. Il tratto a monte può essere dilatato. Possono essere polipi peduncolati
simili agli pseudopolipi dell’esofagite da reflusso
Tumori maligni
I fattori eziologicamente correlati sono molti e di varia natura. Tutte queste cause finiscono, in vario modo,
per provocare un danno infiammatorio della mucosa, che si evolve in una rigenerazione continua. In seguito
si ha displasia, metaplasia e cancro.
Classificazione
Ci sono diversi aspetti eziologici di carcinoma:
• Carcinoma in situ: considerato una entità istologica differente dal carcinoma spinocellulare,
caratterizzato da polimorfismo e disordine cellulare in ogni strato dell’epitelio
• Carcinoma squamoso: 95%, origina dalle cellule dell’epitelio pavimentoso non cheratinizzato che
hanno giunzioni fra una cellula e l’altra che assomigliano a spine, da cui il nome. Meno frequente nel
tratto superiore, si estende longitudinalmente, e invade rapidamente la muscolare, i linfonodi e le altre
strutture mediastiniche per contiguità. Diffonde a pleura, nervi frenici e ricorrenti, pericardio e aorta, e
dalla porzione inferiore diffonde a linfonodi sottodiaframmatici. Per via ematogena si dissemina al
fegato e alle ossa. E’ sensibile al trattamento radioterapico.
• Adenocarcinoma: origina in genere dall’epitelio di Barrett, meno frequentemente da un focolaio
ectopico di mucosa gastrica o dalle ghiandole sottomucose. Trattato successivamente in un paragrafo a
se.
http://www.hackmed.org
•
•
[email protected] 90
Mencaroni Spartaco
Sarcomi: Rari, più comune è il leiomiosarcoma. Rari i linfomi primitivi, per lo più NH. Il linfoma H
invece può avere un interessamento secondario abbastanza frequente.
Carcinoidi: rari ma ben documentati, secernono ACTH, calcitonina, paratormone e VIP.
Epidemiologia
Predispongono al carcinoma tutti i fattori di rischio che comportano
irritazione cronica della mucosa e ostacolo al transito del cibo.
Aree ad alta incidenza: Fascia asiatica del carcinoma esofageo, Finlandia,
Irlanda, Africa sudorientale, Iran (dove le donne superano gli uomini),
Normandia. Queste anomalie della distribuzione si spiegano male e ci sono
teorie per i vari posti.
Normandia: bevande ricavate artigianalmente dalla mele, fermentando
producono nitrosamine cancerogene
Iran: cibi speziati e bevande bollenti.
In Italia la situazione è la seguente: incidenza 6/105 maschi, 1,5 femmine
(più frequente al nord, 10-12 casi)
Età media di insorgenza verso la 5°-6° decade.
Alcool
Fumo
Esofago di Barrett
Acalasia (ristagno di cibo)
Diverticoli
Ingestione di caustici
Radiazioni
S. di Plummer Wilson
Aflatossina fungina
Reflusso gastrico persistente
Condizioni socioeconomiche
scadenti
→ Clinica
• Esordio: bruciore urente, disfagia progressiva inizialmente per i solidi e quindi per i liquidi, e rapido
calo ponderale. Molto spesso al momento della diagnosi la malattia si presenta in uno stadio già
inguaribile, poiché si avverte disfagia quando la stenosi supera il 60% del lume.
• Odinofagia, sensazione di corpo estraneo
• Rigurgito
• Calo ponderale
• Polmonite “ab ingestis”
In presenza di una disfagia insorta di recente, ipotizzare sempre la neoplasia, anche se spesso la causa è
benigna.
La disfagia tende ad aggravarsi rapidamente, si associa a sialorrea e a rigurgito, e assieme all’attività del
tumore induce pian piano una cachessia.
Dolore, singhiozzo e raucedine indicano l’infiltrazione alle strutture adiacenti del mediastino.
→ Diagnosi
L’esame di elezione è l’EGDS con biopsie multiple, che permette di evidenziare le lesioni della mucosa non
ancora sintomatiche, che sono erosioni associate ad una profonda infiltrazione simili all’acalasia.
Particolarmente importante è l’eco-EGDS, cioè l’associazione dell’endoscopio con un ecografo in posizione
laterale: lo strumento indaga le erosioni della mucosa, e permette l’estemporanea analisi della sottomucosa e
dei tessuti sottostanti alla lesione, per evidenziare la massa della lesione, la sua infiltrazione nell’esofago e la
diffusione alle strutture circostanti. Anche perché in 1/3 dei casi le biopsie risultano negative. E’ necessaria
l’osservazione del fondo gastrico tramite retrovisione con la torsione dell’endoscopio.
Il carcinoma dell’esofago può essere presente in tre forme morfologiche che ne condizionano il quadro
radiologico. E’ inoltre presente una forma precoce (early gastric cancer) che descriviamo a sé.
• Forme infiltranti: l’interessamento circonferenziale dell’organo è completo, e ne risulta un
restringimento concentrico, rigido e irregolare. Il tratto a monte è marcatamente dilatato, e fra la parte
indenne e il tumore si apprezza un consistente “scalino”.
• Forme polipoidi: formazioni aggettanti irregolarmente estese. La parete da cui originano è rigida e
spesso retratta verso l’interno; in genere non interessano tutta la parete e quindi si ha un restringimento
eccentrico del lume accompagnato da un difetto di riempimento corrispondente al polipo. La dilatazione
a monte è meno intensa che nella forma infiltrante.
• Forme variciformi: si diffonde nella sottomucosa, con estesi e tortuosi difetti di riempimento associati a
stenosi modesta del lume, non facilmente differenziabili con la radiologia dalle varici esofagee.
Mencaroni Spartaco
91
L’early esofageus cancer è una forma a sé stante di tumore (una variante del carcinoma squamoso) limitato
alla mucosa e alla sottomucosa senza metastasi linfonodali (da non confondere con il carcinoma gastrico
superficiale, ossia la forma classica che ha un contemporaneo interessamento linfonodale).
Questo tipo di tumore ha tre forme (aggettante, superficiale, depressa), e una prognosi meno drammatica.
Le forme superficiali sono molto difficilmente osservabili all’RX, le altre due un po’ meglio.
→ Stadiazione
Esame di elezione per stadiazione è la TC, che permette di differenziare la lesione sottoforma di
ispessimento focale o circonferenziale della parete a patto che superi i 5 mm. La TC non permette di
valutare l’infiltrazione dei singoli strati della parete, (per cui è necessaria la biopsia), ma può
efficacemente dimostrare l’estensione del tumore alle strutture circostanti (tessuto adiposo attorno
all’esofago, trachea e bronchi, tiroide, pericardio).
Sebbene con limiti legati al criterio dimensionale, la TC può evidenziare l’interessamento linfonodale,
frequente nel tumore dell’esofago.
Sistema TNM standard
Tx: tumore non valutabile
T0: assenza
T1s: carcinoma intraepiteliale in situ
T1: invasione sottomucosa
T2: invasione muscolare
T3: invasione avventizia
T4: metastasi di organi prossimali
M0: no metastasi
M1: metastasi presenti
Ml: metastasi linfonodali a
distanza
Nx: linfonodi non valutabili
N0: no linfonodi interessati
N1: estensione ai linfonodi
regionali
→ Grading e diffusione
In genere il grado è bene o abbastanza differenziato, ma ciò non impedisce al carcinoma di essere comunque
spesso diagnosticato ad uno stato avanzato.
L’estesa rete linfatica favorisce la diffusione della malattia neoplastica a distanza e lungo la sottomucosa.
Nidi di cellule neoplastiche si trovano regolarmente anche a diversi centimetri di distanza dalla neoplasia
originaria.
Le possibilità di diffusione del tumore sono:
• Longitudinale, lungo la mucosa esofagea
• Per contiguità interessamento dell’albero bronchiale e aorta, pericardio e a. polmonare
• Diffusione linfatica: mediastinici posteriori , addome superiore e collo.
• Diffusione ematica: polmoni e fegato. Queste metastasi non hanno in genere nessuna possibilità di
terapia risolutiva, nemmeno chirurgica.
La diffusione ai linfonodi è:
• Terzo superiore → linfonodi cervicali
• Terzo medio → linfonodi mediastinici e tracheali
• Terzo inferiore → linfonodi gastrici e celiaci
La prognosi è così sfavorevole soprattutto perché non avendo l’esofago una sierosa, la diffusione è
immediata.
8.3 STOMACO
STUDIO STRUMENTALE
RX
Si utilizzano sospensioni di bario che verniciano a parete sottile la mucosa gastrica dopo preliminare
distensione del lume con aria.
Il paziente viene tenuto a digiuno dalla sera precedente, e poi viene somministrato glucagone per indurre
ipotonia gastrica; viene quindi somministrata polvere effervescente e quindi 100 ml in sospensione di solfato
di bario.
http://www.hackmed.org
[email protected] 92
Mencaroni Spartaco
Si procede poi all’acquisizione di immagini in proiezioni standard e in stazione eretta dello stomaco e del
duodeno.
Alternativa alla radiologia di superficie è l’esame con pasto baritato che esattamente come il corrispondente
esame esofageo riproduce il lume dell’organo a stampo.
L’uso del solfato di bario può essere sostituito, se rischioso (sospetta occlusione o perforazione) con mezzo
di contrasto iodato solubile, che se si spande in cavità peritoneale non è dannoso.
Lo studio funzionale dello stomaco si esegue con l’aggiunta ad un pasto solido o liquido (in genere un toast
con uovo sodo in cui, prima della cottura, viene introdotto un quantitativo di Tc solfuro colloidale) e poi
utilizzando tecniche scintigrafiche per l’acquisizione delle immagini ogni 5’ o con la tecnica della
scintigrafia sequenziale.
L’immagine scintigrafica visualizza il processo di rimescolamento (i boli radioattivi ingeriti vengono fusi in
un unico bolo), lo svuotamento (progressiva diminuzione della conta radioattiva) e la triturazione del cibo
(frammentazione dei singoli boli ingeriti).
Anche l’ecografia può essere adoperata per studiare il funzionamento gastrico senza rischi biologici, ma in
maniera molto meno dettagliata della scintigrafia.
Morfologia radiologica dello stomaco
Lo stomaco del normotipo in stazione eretta ha una forma ad uncino, nel quale si riconoscono:
• La piccola curvatura, corrispondente alla parte interna dell’uncino
• La grande curvatura, corrispondente alla parte esterna
• L’angolus, cioè la zona dove la piccola curvatura fa la piega di raccordo fra corpo e antro
• Corpo (parte iniziale)
• Fondo (antro)
• Canale pilorico, visibile come una strozzatura che separa lo stomaco dall’intestino.
Sulla superficie sono visibili anche all’RX le pliche e le areole. Le prime sono aree di rilievo provocate dalla
contrazione della muscolaris mucosae, quindi cambiano nel tempo. Sono grossolane (8-9 in tutto lo stomaco,
di circa 2-10 mm di larghezza), e sono radiotrasparenti perché il bario si infila nei solchi fra le pliche;
mentre le areole non sono sempre riscontrabili (50-70%) e si trovano soprattutto nella metà distale di corpo e
antro Sono maglie radiopache di pochi mm di spessore, diffuse come un reticolo.
Dopo un tot di tempo l’effetto di paralisi farmacologica cessa, ed è possibile osservare l’onda peristaltica che
partendo la corpo raggiunge l’antro. A seconda di come lo stomaco si presenta mentre è attraversato da
quest’onda, si possono identificare diverse anomalie particolari (vedi semeiotica radiologica).
Quando la peristalsi è normale, l’onda peristaltica attraversa di seguito corpo, antro e piloro in cicli di circa
20 secondi.
Anche il tono basale dello stomaco a digiuno può essere importante: questo si osserva empiricamente
facendo ingerire il bario senza aver ipotonizzato lo stomaco. La resistenza delle pareti alla distensione
provoca una iniziale difficoltà alla penetrazione del bario, e le immagini radiologiche sono “triangolari” con
vertice verso il basso. Successivamente la resistenza della parete è vinta e si arriva alla classica immagine ad
uncino. Nello stomaco ipotonico invece si ha subito la presenza di bario nella parte bassa, dove cade per
gravità.
TC
Viene condotta dopo ipotonizzazione e somministrazione di mezzo di contrasto iodato. Rende possibile
l’identificazione di addensamenti parietali flogistici e neoplastici anche piccoli (5 mm), perforazioni e a
volte varici.
Ecografia
Evidenzia le singole porzioni gastriche in base alla sede e ai rapporti con gli organi continui. La bolla
gastrica può dare artefatti, ha una sensibilità comunque nel complesso minore della TC.
Viene usata in età infantile per la diagnosi di ipertrofia del piloro, e in associazione all’endoscopia per la
valutazione della parete gastrica, e permette la visione diretta del pancreas (è una delle metodiche più
sensibili per la rilevazione di piccoli tumori neuroendocrini).
Mencaroni Spartaco
93
PATOLOGIA GASTRICA
Semeiotica radiologica
Biloculazioni
In presenza di diversi processi patologici, esiste un rilievo semeiologico particolare del pasto baritato, ossia
la visione dello stomaco distinto in due porzioni, separate da una strettoia.
Esistono diverse condizioni che danno origine alla biloculazione:
• Ipotonia: il mezzo di contrasto si dispone nella parte declive, sfiancandola, e per contrasto la parte
superiore si allunga e si contrae al centro, dove appare una sorta di stenosi (stomaco a clessidra)
• Spina irritativa gastrica: la presenza di una ulcera, o anche una spina irritativa extragastrica possono
provocare un anello di contrazione della muscolatura che provoca la divisione dello stomaco in due lobi.
• Carcinomi infiltranti con reazione desmoplastica → stomaco a borsa di cuoio (estesa stenosi rigida che
modifica tutto il profilo dell’organo)
• Retrazione del piccolo epiploon (ulcera penetrante) → stomaco a borsa di tabacco con dilatazione della
regione antrale.
Alterazione di posizione
Sono in genere acquisite (ernia, ptosi), ad eccezione del situs viscerum inversus. In genere la alterazione più
comune è la ptosi del piloro e spostamenti transitori che lo stomaco subisce quando il colon è dilatato.
Alterazioni della superficie
Possono riguardare le pliche e le areole; alterazioni delle pliche si riscontrano in tutte le patologie dello
stomaco, mentre le areole sembrano modificarsi in alcune gastriti.
Varici gastriche
In genere seguono le varici esofagee dell’ipertensione portale. Si localizzano elettivamente nel fondo. Il
rilievo plicale del fondo assume allora un aspetto serpiginoso e ingrandito. Sono frequentemente causa di
sanguinamento massivo.
Diverticoli
Sono rari sia quelli congeniti che quelli acquisiti, veri o falsi, per la notevole resistenza della parete gastrica.
All’RX diretto sono spesso visibili come una bolla gassosa con all’interno un piccolo livello.
Si vedono benissimo all’esame con bario, e si localizzano nel 90% dei casi alla regione iuxtacardiale.
Nell’antro sono molto rari ma possono simulare una ulcera gastrica.
Ipertrofia del piloro
Le forme congenite o acquisite hanno una morfologia identica. Il canale risulta allungato, sottile, spesso
attraversato da una plica longitudinale con aspetto “a binario” caratteristico.
Il mezzo di contrasto, penetrando con difficoltà nel canale ipertofico, forma un calco “ad ombrello” molto
caratteristico: il manico è formato dal sottile lume pilorico, il cappello dal lume enterico normale.
Lo stomaco è dilatato e ipercinetico, ma ha ovviamente uno svuotamento ritardato e contiene residui di cibo
a digiuno.
In età pediatrica l’ipertrofia del piloro si può studiare meglio per via ecografica.
Occlusioni gastriche
• Invaginazione gastro-gastrica: rara, produce stenosi serrata con dilatazione del tratto a monte; si vede
bene con il mezzo di contrasto iodato
• Invaginazione gastro-duodenale: più frequente; si osserva un difetto di riempimento del bulbo
duodenale, centrale, circondato da anelli radiopachi, che sono i punti in cui il mezzo di contrasto entra fra
la tasca invaginata e la parete duodenale.
• Volvolo: rotazione dello stomaco attorno al suo asse longitudinale o mediale. Nel primo caso si sposta
lateralmente la grande curvatura, nel secondo la regione antrale si ribalta in alto. L’introduzione di
mezzo di contrasto con sondino permette di evidenziare il fulcro e il tipo di rotazione.
Le occlusioni vanno differenziate dalla dilatazione gastrica acuta, evento non raro di natura non ostruttiva,
che si riconosce già all’esame RX perché lo stomaco, benchè dilatato, è perfettamente normale in
http://www.hackmed.org
[email protected] 94
Mencaroni Spartaco
morfologia. La somministrazione di mezzo di contrasto permette di differenziare bene l’ostruzione dalla
dilatazione da altra causa.
Gastriti
Si diagnosticano piuttosto male con la radiologia, che riesce per lo più a riconoscere atteggiamenti funzionali
transitori suggestivi di gastrite, ma che non si correlano con i reperti anatomopatologici che sono necessari
per la diagnosi corretta.
In genere il tipo di studio che si fa è sulle alterazioni delle pliche.
Gastriti erosive
Si tratta delle gastriti in cui il processo non si estende al di sotto della muscolaris mucosae, e sono
diagnosticate meglio delle altre. All’esame baritato si osserva costantemente la presenza di lacune del velo di
bario sulla parete, piccole, che corrispondono ad aree di ipertrofia della mucosa: al centro di queste aree si
osservano raccolte puntiformi di bario che sono le erosioni.
Può essere difficile la diagnosi differenziale con il Crohn gastrico.
Gastrite antrale
L’ispessimento delle pliche, lo spasmo e la ridotta distensibilità e le ipertrofie lacunari della mucosa sono
limitati all’antro. Nelle forme erosive severe è difficile la diagnosi differenziale con il carcinoma gastrico.
Gastrite ipertofica
Si ha un ispessimento delle pliche soprattutto in regione del fondo e del corpo, dovuto all’iperplasia
ghiandolare. Spesso coesiste un’ulcera duodenale. Agevole ma importante la diagnosi differenziale con la
sindrome di Ménétrier.
Malattia di Ménétrier
Iperplasia della mucosa gastrica, di tipo foveale, limitata alle cellule superficiali e mucose, con la distruzione
delle cellule parietali e principali. Il colletto delle ghiandole si allunga e diviene molto tortuoso, e le stesse
pliche gastriche diventano più spesse e tortuose. Può esserci una infiltrazione linfocitaria e può esserci
metaplasia intestinale. Le pliche assumono all’RX un caratteristico aspetto “cerebroide”, ben visibile nel
fondo e nel corpo lungo la curvatura. La malattia provoca una enorme secrezione mucosa, che è responsabile
addirittura di ipoproteinemia; tutto questo secreto è visibile come difetto di riempimento diffuso della parete
perché il bario è ostacolato nella verniciatura dalla presenza di quelle secrezioni.
Gastrite cronica atrofica
La forma cronica della gastrite inizia come una evoluzione della gastrite superficiale: in essa le lesioni
infiammatorie sono limitate alla lamina propria della mucosa, e le ghiandole epiteliali sono separate da
infiltrato cellulare ed edema. In questo stadio le ghiandole sono intatte e conservate, anche se si può avere
una diminuzione del numero delle cellule mucipare e della loro attività.
Successivamente, si ha una gastrite atrofica, che inizia con l’estensione in profondità dell’infiltrato, che
finisce per distruggere e separare le ghiandole fra di loro. Questo processo inizia in genere dall’antro e si
estende in senso prossimale fino a interessare fondo e corpo gastrico.
Il quadro completo è quello dell’atrofia gastrica¸con una diminuzione della mucosa, dell’infiltrato a spese
del connettivo. La parete nel complesso risulta assottigliata, e all’esame endoscopico è possibile vedere la
rete vasale sottostante.
La gastrite atrofica è quindi di un aspetto evolutivo della gastrite cronica, che viene a ad essere riconoscibile
per la scomparsa delle pliche e delle areole dal fondo e dal corpo (aspetto “calvo” dello stomaco). Dove però
le areole sono focalmente ingrandite può esserci una metaplasia intestinale, che è l’ulteriore evoluzione di
questa malattia.
Queste forme croniche si distinguono in tipo A (autoimmune), B (da elycobacter) e C (da una serie di fattori
casuali per lo più di natura farmacologica). Oltre alla diversa localizzazione (B tipicamente antrale, A estesa
a tutto l’organo), sono possibili alcuni aspetti aspecifici della gastrite cronica di tipo B:
• Slargamento del piloro
• Ispessimento focale dell’antro (visibile alla TC, simula il carcinoma)
Mencaroni Spartaco
95
Ulcera
Clinica comparativa fra ulcera gastrica e duodenale
Lesione profonda, penetrante anche negli strati al di sotto della muscolaris mucosae (a differenza delle
lussazioni), con contorni netti e ben definiti, un alone infiammatorio molto più esteso che nell’ulcera
duodenale. Di solito nel fondo è presente una zona di necrosi eosinofila, con epitelio non integro, su una
matrice di tessuto di granulazione circondata da quantità variabili di tessuto fibrotico. Il fondo dell’ulcera
può essere pulito o contenere una grande quantità di sangue o essudati proteici.
La maggior parte delle ulcere gastriche è localizzata nell’antro, immediatamente distale alla fine della
mucosa acido secernente del corpo stomacico (cioè in media a 2/3 della piccola curvatura). Le ulcere che si
sviluppano nel fondo gastrico sono spesso associate ad HP (avviene nel 70% dei casi).
C’è una correlazione importante fra ulcera gastrica e duodenale e H. Pylori. Si pensa che chi contrae una
infezione precocemente, con sviluppo di una gastrite atrofica e acloridria, abbia più possibilità di sviluppare
una gastrica.
Altre cause importanti sono i FANS, responsabili del 15-20% delle ulcere, il reflusso duodeno gastrico, che
produce ristagno di cibo e retrodiffusione degli idrogenioni, e tutte le cause di gastrite che, mantenendosi nel
tempo, possono portare all’ulcera. In genere i livelli secretori sono normali, a differenza che nell’ulcera
duodenale dove sono alti.
L’ulcera duodenale, invece, è in genere provocata da uno squilibrio fra fattori protettivi (muco e
bicarbonato, PG, flusso sanguigno intramucoso, velocità di turnover cellulare di 24-36h), e fattori
aggressivi (pepsina, acido).
Fattori ambientali come H. Pylori e il fumo. Il batterio produce ammoniaca che alcalinizza il pH attorno alla
colonia, ma produce a distanza idrogenioni dannosi, produce fattori chemiotattici proinfiammatori e
attivatori delle piastrine, produce proteasi e fosfolipasi che degradano il muco. Il fattore più importante
sembra però la citotossina vacuolizzante del gene Cag-A ta, e i ceppi che ne sono portatori sono quelli
implicati nella patogenesi dell’ulcera duodenale.
Sembrano importanti anche fattori genetici (figlio di malato: richio 3x per l’ulcera duodenale, non gastrica).
Mentre il 95% dei soggetti con ulcera gastrica è HP+, solo l’80% di questi paziente risulta positivo per il
batterio. Se si eradica l’infezione, la possibilità di avere recidive diminuisce fortemente.
Ulcera gastrica e duodenale sono differenti anche nelle complicazioni:
ULCERA DUODENALE
ULCERA GASTRICA
Sanguinamento → 25%
Sanguinamento → 30%
Perforazione → 30%
Perforazione → 10%
Stenosi cicatriziale → 10%
Stenosi pilorica cicatriziale →10%
Cancro→ 5%
Cancro → < 1%
Estensione molto frequente ad altri organi
(pancreas 50%, coledoco e colecisti 20%).
Il 10% circa dei pazienti presenta le due ulcere insieme, e spesso in essi si trova una secrezione alta.
Diagnosi dell’ulcera gastrica
La metodica di elezione resta l’endoscopia, sia per l’ottima sensibilità che per la possibilità di trattamento
mirato e biopsia.
Il pasto baritato ha una sensibilità paragonabile (ulcere di 5 mm o più) e soprattutto permette l’osservazione
delle strutture vicine con la possibilità di una differenziazione fra ulcere benigne e maligne che si avvicina al
100%. Per questo motivo il controllo evolutivo delle lesioni note può essere fatto tranquillamente con la
radiologia.
E’ importante però eseguire correttamente l’esame, perché uno scarso verniciamento o una distensione
insufficiente possono nascondere lesioni piccole.
A seconda di come viene visualizzata, l’ulcera assume diversi aspetti:
Vista frontale
Vista laterale
• Raccolta radiopaca rotondeggiante od ovalare, • Immagine di eccesso di riempimento a cupola,
dove il bario entra efficacemente se l’ulcera si
che si verifica meno se il bario vi entra
trova in basso rispetto alla forza di gravità (il
parzialmente per la presenza di coaguli o detriti
bario vi penetra nel fondo)
nel fondo.
http://www.hackmed.org
•
•
[email protected] 96
Mencaroni Spartaco
Alone edematoso circostante
Aspetto a “cerchiello” se l’ulcera si trova in alto,
perché il bario entra solo nei margini
Alcuni rilievi sia nella zona dell’ulcera, sia localizzati sulla zona circostante, permettono di individuare
diversi stadi evolutivi dell’ulcera:
• Recente florida: margini netti a stampo, cratere occupato da residui di fibrina (difetto di riempimento)
• Acuta: simile alla precedente, ma margini sfumati per la presenza di edema circostante
• Callosa: di vecchia data, margini irregolari e sfrangiati, talora ispessiti per la fibrosi. Le aree di mucosa
circostanti possono essere modificate per la retrazione cicatriziale.
Oltre al segno diretto di dimostrazione di ulcera (la nicchia ulcerosa che si riempie con il mezzo di contrasto)
sono possibili diversi segni indiretti, spesso importanti per indicare dove l’ulcera può essere:
• Rientranza del profilo gastrico a monte e a valle della nicchia
• Edema periulceroso
• Convergenza delle pliche “a stella” verso l’ulcera
• Deformazione dello stomaco (a clessidra o a borsa di tabacco)
• Alterazioni della secrezione e della funzione gastrica.
Infine, importante, la presenza di segni distintivi fra ulcere benigne e maligne:
BENIGNE
MALIGNE
• Cratere ulceroso circondato da edema e pliche • Cratere irregolare
convergenti regolari
• Areole gastriche ingrandite, ma solo in sede • Areole in sede ulcerosa distorte o assenti
periulcerosa
• Pliche si interrompono bruscamente in presenza
del cratere
• Assenza di nodularità
• Le pliche assumono un aspetto nodulare
• La nicchia di profilo si proietta al di fuori del • La nicchia di profilo aggetta nel lume nel
lume gastrico
contesto di una massa parietale
Neoplasie benigne
Non sono frequenti. Ci sono polipi iperplastici e adenomatosi, che si evidenziano spesso come difetti di
riempimento aggettanti a margini regolari, cosa tipicamente benigna, di piccole dimensioni.
Sono ad angolo acuto con la mucosa se originano dalla superficie, ottuso se originano in profondità.
Possono però andare incontro a trasformazione.
I lipomi invece sollevano la mucosa in superfici curvilinee nette e regolari, cosa caratteristica di benignità.
ADENOCARCINOMA GASTRICO
Epidemiologia
Alta incidenza in Giappone, Cile e Finlandia. In tutto il mondo l’incidenza di questi tumori è in costante e
netta diminuzione, forse per la progressiva riduzione della contaminazione da HP. In effetti l’incidenza
sembra aumentare notevolmente nelle classi meno abbienti, e il fatto che i figli di emigranti acquistino il
rischio dell’area di arrivo sembra propendere per fattori ambientali che agiscono nell’infanzia.
Italia: 25 casi /105 abitanti
Età di insorgenza: 50-70 anni
M/F → 2:1
Sopravvivenza a 5 anni: <15%
Fattori di rischio confermati sono:
• Familiarità e ambientalità
• P53
• Basso livello sociale
• Dieta povera di frutta e verdura (antiossidanti)
Mencaroni Spartaco
•
•
•
97
Infezione da HP (oncogeno di prima categoria)
Dieta ricca di salati, conservanti, affumicati (Finlandia e Giappone)
Fumo di sigaretta
Patogenesi
Si ritiene che i primi agenti eziologici siano i nitriti prodotti dai batteri nitroriduttori. Gli alimenti avariati
contenenti batteri e l’HP incrementano la riduzione dei nitrati, i conservanti e il fumo di sigaretta
introducono nitrati dall’esterno. Un altro fattore che aumenta questa possibilità cancerogena è la presenza di
batteri
Altro filone eziologico è la presenza di lesioni ulcerative o erosive della mucosa, che possono portare
attraverso un processo infiammatorio a metaplasia intestinale. Come già detto (vedi), quella più pericolosa
è quella secernente solfomucine. La displasia che si ottiene può essere distinta in atipie di basso grado e di
alto grado. Quest’ultimo stadio viene considerato equivalente al carcinoma gastrico in situ.
Anatomia patologica
Endoscopicamente, le lesioni possono essere distinte in:
• Polipoidi
• A superficie ulcerata
• Infiltrative
La differenziazione cellulare appare ben differenziata, poco differenziata o con cellule a castone (tumore di
Kuchenberg).
Dal punto di vista anatomopatologico, si osservano invece queste due forme, con caratteristiche cliniche e
morfologiche diverse:
1. Adenocarcinoma gastrico di tipo diffuso: tipico dei soggetti giovani, ha una prognosi peggiore. Le
lesioni interessano tutto lo stomaco, compreso il cardias, e provocano una diminuzione della
distensibilità parietale, dando il tipico aspetto a borsa di cuoio.
2. Adenocarcinoma gastrico di tipo intestinale: soggetti anziani, aree ad alta incidenza. E’ il tipo di
carcinoma che origina dalla metaplasia intestinale secernente sialomucine. Si tratta di lesioni spesso
ulcerate, localizzate per lo più nell’antro e nel corpo, e precedute da stimoli infiammatori di lunga durata.
La prognosi è lievemente migliore.
Clinica
In genere i tumori asportabili sono asintomatici. Con il crescere della massa, inizia un senso di pienezza al
quadrante superiore dell’addome, fino ad un dolore marcato e persistente. Anoressia, sebbene molto
frequente, non è di solito un sintomo d’esordio.
A seconda della porzione interessata, l’esordio della malattia cambia:
• Fondo: interessamento del n. frenico → singhiozzo
• Cardias: disfagia
• Piloro: stenosi e vomito postprandiale
• Infiltrativo: compressione e diminuzione del volume gastrico → sazietà precoce, anoressia e calo
ponderale
• Ulcerativo: ematemesi ed anemia cronica
In caso di interessamento dei nervi addominali, le nevralgie specifiche sono molto dolorose. Nella metastasi
epatica, peraltro frequente, si hanno movimenti di ALP, AST, yGT.
La diffusione metastatica avviene frequentemente per continuità, al fegato, colon e pancreas. Il tumore di
Krukenberg metastatizza frequentemente all’ovaio per via transcelomatica. Può esserci metastasi ai linfonodi
addominali e sopraclaveari.
Diagnosi radiologica
Dipende ovviamente dal tipo morfologia che assume il tumore.
→ Forma vegetante:
caratteristiche irregolarità della superficie e dei margini, che permettono in linea di massima una agevole
diagnosi differenziale con le forme benigne. Le pliche si interrompono bruscamente in prossimità della
lesione e la peristalsi gastrica è bruscamente assente in corrispondenza della base di impianto.
http://www.hackmed.org
[email protected] 98
Mencaroni Spartaco
→ Forma infiltrante:
reazione desmoplastica con stenosi tubulare concentrica che riduce progressivamente il lume, evidente
soprattutto nella forma “scirrosa” .
→ Forma ulcerativa:
diagnosi più difficile, perché spesso il cratere ulcerato costituisce la quasi totalità della massa neoplastica, e
la componente aggettante è scarsa e per lo più “a semiluna” attorno al cratere stesso.
La lesione è impiantata su un tratto di parete rigido, non sporgente, e le pliche che convergono sono
amputate, a clava.
In genere sono importanti le alterazioni della cinesi gastrica relative alla presenza del tumore, specialmente
nelle forme che infiltrano le tonache muscolari.
Staging
Assume grande importanza la TC, in grado di distinguere fra T1-2 e T3-4, di valutare le linfoadenopatie, le
metastasi epatiche, peritoneali e ovariche (che vanno sempre ricercate, soprattutto in presenza di cellule con
castone del tumore di Krukenberg).
Può essere utile anche l’ecoendoscopia, per la distinzione fra T1 e T2.
E’ importante fare una stadiazione preoperatoria con il sistema TNM, al fine di migliorare le aspettative
dell’intervento.
Stadio
TNM
0
1A
TsN0M0
T1N0M0
1B
2
T2N0M0
T1N2M0
T2N1M0
T3N0M0
T2N2M0
T3N1/2M0
T4N1M0
T(1-4)N(0-2)M1
3A
3B
4
Caratteristiche
Sopravvivenza a
5 anni (%)
Negatività linfonodale; limitato alla mucosa
Linfonodi negativi, invasione della lamina propria o della
sottomucosa
Linfonodi negativi, invasione della tonaca muscolare
Linfonodi interessati; invasione della mucosa ma all’interno della
parete
Linfonodi negativi, estensione attraverso la parete
Linfonodi interessati, invasione della tonaca muscolare o estensione
attraverso la parete
Negatività linfonodale, aderenza al tessuto circostante
Metastasi a distanza
90
59
44
29
15
3
Carcinoma gastrico precoce
Si da questo nome alla neoplasia gastrica che non oltrepassa la sottomucosa. Esso ha un trattamento diverso
dalle forme più infiltrate di tumore, e una prognosi favorevole nel 90% dei casi. Si identificano tre aspetti
morfologici di questi tumori:
• Tipo I: protrudente
• Tipo II: superficiale
o 2a elevato
o 2b piatto
o 2c depresso
• Tipo III: escavato
Si diagnostica bene con l’esame baritato, soprattutto se accoppiato all’endoscopia. Le varianti morfologiche
hanno degli aspetti radiologici identici a quelli già descritti per il carcinoma esofageo precoce (vedi).
Sarcoma gastrico non linfatico
L’1-3% di tutti i tumori dello stomaco sono leiomiosarcomi. Interessano spesso le pareti anteriori e posteriori
del fondo gastrico, e sono caratterizzate da ulcere sanguinanti. In genere non metastatizzano per contiguità né
per via linfatica, ma giungono per via ematica al fegato e ai polmoni.
L’aspetto istologico può trarre in inganno, e anche lesioni benigne possono avere comportamento maligno.
Trattamento di scelta, terapia chirurgica. La chemio combinata è indicata nei pazienti con metastasi.
E’ raro, e si distingue dai grossi leiomi benigni solo quando si ulcera o va in necrosi vistosa. La TC e
l’ecografia possono essere importanti per valutare la componente, di solito abbondante, extragastrica.
Mencaroni Spartaco
99
Linfoma non hodgkin primitivo gastrico
E’ una delle malattie tumorali più rare, ma comunque rimane il più comune sito extralinfonodale per i
linfomi.
Il tipo di linfomi è generalmente NH a cellule B, spesso di tipo MALT, altre volte a grandi cellule. Più del
60% di questi LnH sono associati all’infezione da HP. L’eradicazione dell’infezione migliora notevolmente
la prognosi del linfoma.
Il linfoma gastrico risponde alla terapia molto meglio dell’adenocarcinoma, da qui la necessità di una
diagnosi differenziale in fase precoce.
Il 50% dei pazienti va incontro a remissione del linfoma dopo terapia antibiotica contro HP. Oggi la chemio
si configura come una alternativa valida alla terapia chirurgica.
Assomiglia molto all’adenocarcinoma, sia nella clinica, che nell’aspetto radiologico. Spesso le biopsie
rendono difficile identificarlo perché il tumore si localizza in profondità nella mucosa o nella sottomucosa.
Anche l’aspetto endoscopico è simile a quello dell’adenocarcinoma, sia nella forma vegetante ulcerativa che
in quella diffusa.
Radiologicamente la diagnosi differenziale fra carcinoma e linfoma è impossibile per le forme vegentanti e
ulcerative. Le forme infiltranti invece si differenziano con difficoltà dalla gastrite ipertrofica, nella quale
però, a differenza del linfoma, non compaiono ulcerazioni multiple.
8.4 DUODENO
MORFOLOGIA RADIOLOGICA
Lo studio del duodeno costituisce l’ultima fase dell’esame con pasto baritato, e di solito viene identificato
radiologicamente in due proiezioni oblique per differenziare la seconda porzione dalla terza.
• Bulbo: è un triangolo rivolto verso lo stomaco con la base e l’apice laterale e in alto. Ha pliche
longitudinali che a causa della distensione gassosa si appiattiscono e possono anche scomparire.
• Seconda porzione: decorre curvando di nuovo verso la linea mediana, con concavità verso lo stomaco.
Ha pliche trasverali caratteristiche di circa 2 mm di spessore, radiotrasparenti, dette “valvole conniventi”,
che sono delimitate da bande parallele, opache, su cui ristagna il bario. Internamente, a metà, è visibile
una formazione trasparente corrispondente alla papilla di Vater (coledoco e Wirsung) e una più piccola
detta papilla minor dove sbocca il dotto di Santorini. Se la papilla si riempie di mezzo di contrasto può
simulare un diverticolo.
• Terza porzione: va verso sinistra e verso l’alto, fino a piegare bruscamente verso il basso per
continuarsi, dopo l’angolo di Treitz, con il digiuno. Non si differenzia dalla precedente come struttura. Il
tratto di passaggio fra la seconda e terza porzione è abbrancato all’aorta addominale (dietro) e alla
mesenterica superiore che originando dall’aorta passa sopra al duodeno.
Oltre che radiologicamente tutte le porzioni duodenali possono essere evidenziate alla TC quando il lume
viene opacizzato con il bario o con mezzo di contrasto iodato per os. Viene meglio ancora se il paziente
assume polveri effervescenti (distensione con aria).
L’ecografia addominale evidenzia le tre porzioni ma difficilmente l’angolo di Treitz; è importante
l’ecoendoscopia per la valutazione della regione del coledoco e della testa del pancreas.
PATOLOGIA DEL DUODENO
Ostruzioni
• Atresia: presenza di un diaframma completo che ostruisce il lume del duodeno, facilmente evidenziabile
anche all’esame diretto addome per la cospicua dilatazione gassosa del duodeno e dello stomaco. Sul
radiogramma si forma quindi una “doppia bolla” con due livelli idroaerei, uno dello stomaco e uno del
duodeno. Nei settori a valle del digerente c’è nel neonato con atresia una completa assenza di gas.
• Stenosi: diagramma mucoso incompleto variabile, con sintomatologia simile a quella dell’atresia
condizionata dalla gravità della stenosi. Il quadro radiologico oscilla dalla normalità a quello
dell’occlusione, con distensione gastrica e duodenale. Si mette in evidenza con pasto baritato
• Ostruzione estrinseche: una briglia o un volvolo possono comprimere e ostruire completamente il
duodeno. Il quadro radiologico è quello di una ostruzione più o meno completa.
http://www.hackmed.org
•
[email protected] 100
Mencaroni Spartaco
Pancreas anulare: causa di ostruzione che si riesce ad osservare in genere soltanto con la TC.
Alterazioni della parete
Diverticoli
Di solito vicini alla papilla, sono speso congeniti e veri; l’estroflessione raggiunge anche notevoli
dimensioni, e il colletto è bene apprezzabile. Alcuni diverticoli costituiscono duplicazioni intestinali e sono
visibili anche come introflessioni.
Lesioni esuberanti
• Metaplasie gastriche: alterano il verniciamento della parete, e sono localizzate occasionalmente nel
duodeno (quasi sempre la loro presenza si ha nel contesto del diverticolo di Meckel nel tenue). Spesso
hanno origine da una metaplasia infiammatoria, e con la loro attività secretoria provocano dispepsia.
Assumono l’aspetto di piccole lesioni polipoidi o a placca, spesso nella base del bulbo.
• Iperplasia dei follicoli linfatici: allergie alimentari, malassorbimento, flogosi, anche neoplasie
intestinali o alterazioni immunologiche. Conferiscono alla superficie mucosa un aspetto cribroso.
Ulcera duodenale
Per le caratteristiche cliniche e patogenetiche vedi l’ulcera gastrica.
Hanno sede praticamente sempre bulbare, spesso nel terzo prossimale e nella faccia anteriore. Nel 15% dei
casi sono multiple, e nell’85% dei casi associate ad HP.
La semeiotica radiologica dell’ulcera gastrica si applica esattamente a quella bulbare, in particolare è
particolarmente evidente la triade di Akerlund:
• Presenza della nicchia
• Retrazione della curvatura vicina
• Estroflessione per spasmo “a dito indicatore” della muscolatura nella parete opposta
Nelle ulcere della parete anteriore lo spasmo ha origine nella parete verso il fegato (grande curvatura), in
quelle dalla parete posteriore lo spasmo è dalla parte dello stomaco (piccola curvatura).
TC ed ecografia possono occasionalmente evidenziare ispessimenti della parete di natura infiammatoria che
possono essere indagati all’RX svelando la presenza dell’ulcera.
Un aspetto particolare ce lo possono avere le ulcere post bulbari: in queste è frequente osservare uno spasmo
intenso, a “manicotto” di un tratto di duodeno più o meno lungo, nel contesto del quale sporge l’ulcera.
Le complicazioni (vedi ulcera gastrica), soprattutto la penetrazione dell’ulcera in altri organi, obbligano
all’osservazione attenta con uso delle tecniche radiologiche più idonee (TC, angiografia, esame diretto in
laparoscopia).
Sindrome di Zollinger-Ellison
Ulcere nel tratto intestinale superiore, marcata ipersecrezione acida gastrica, secondarie alla presenza di un
tumore pancreatico non insulare gastrina secernente. I tumori, che sono spesso multipli e di dimensioni
variabili da 1mm a oltre 20cm, si localizzano con uguale facilità nella testa del pancreas e nel duodeno. Il
90% di queste neoplasie si trovano nel triangolo dei gastrinomi, che è delimitato dalla giunzione coledoco
cistica, dalla giunzione fra terzo medio e inferiore del duodeno, e dal punto fra collo e testa del pancreas.
Circa 2/3 dei gastrinomi sono maligni, e un paziente su tre sviluppa metastasi, per lo più nei linfonodi
regionali e nel fegato.
Una buona metà dei casi di gastrinoma insorge nel contesto delle forme di neoplasie endocrine multiple, una
serie di malattie neoplastiche secernenti su base genetica. In effetti i pazienti con questa neoplasia hanno nel
contesto del tumore parecchi ormoni tutti però inattivi.
Gli effetti della gastrina nella parete gastrica sono un incremento ipertrofico di circa 3-6 volte la norma, e la
presenza di tumori carcinoidi provenienti probabilmente dalle cellule ECL che vengono iperstimolate.
In effetti tali valori sono stati trovati anche nei pazienti con anemia perniciosa e atrofia gastrica, che hanno
paragonabili valori di gastrina.
Mencaroni Spartaco
101
Clinica
Nelle fasi iniziali della malattia viene riscontrata una aumentata secrezione acida, con sintomi tipici
dell’ulcera peptica, ma di entità maggiore, di più lunga durata, e di difficile risoluzione con la terapia
farmacologica.
Il 75% delle ulcere hanno la tipica localizzazione antrale, ma si trovano anche nel duodeno e nel digiuno.
Meno frequentemente esistono anche steatorrea (inattivazione acida della lipasi pancreatica) e diarrea (da
irritazione del tenue). La steatorrea può anche dipendere dalla incapacità delle micelle di aggregarsi a pH
acido.
→ Diagnosi
All’esame baritato si evidenzia:
• Abbondante secrezione gastrica che diluisce la sospensione ed altera parecchio il verniciamento
• Ispessimento delle pliche gastriche, duodenali e digiunali per edema e flogosi delle cellule parietali
• Ulcere multiple localizzati nel bulbo (75%) ma anche nelle altre porzioni duodenali e nel digiuno
(patognomoniche)
Il gastrinoma può essere evidenziato con la scintigrafia con analogo marcato della somatostatina, utile anche
come esame valutativo dell’efficacia della terapia.
Ecografia, TC e RM possono aiutare nell’identificazione e delimitazione del tumore.
Importante anche l’arteriografia e i prelievi mirati nel sistema portale.
Neoplasie
Benigne
Per lo più formazioni aggettanti di piccole dimensioni a margini regolari (fibromi, adenomi, lipomi,
emangiomi), o neuroendocrini. Interessante l’adenoma per le sue potenzialità di degenerazione maligna.
Maligne
Gli adenocarcinomi possono essere infiltranti o stenosanti, oppure, più spesso, assumono la tipiche
caratteristiche della formazione neoplastica maligna:
• Formazione aggettante a argini irregolari
• Superficie mammellonata
• Base di impianto retratta
• Grosse dimensioni
Invece i linfomi si localizzano spesso nella seconda e terza porzione, in forma infiltrante a pieno spessore
della parete, con tendenza ad interessare tratti più o meno estesi del duodeno che assume un aspetto rigido,
tubulare, visibile sia alla TC che all’ecografia.
I linfomi provocano spesso il sollevamento della mucosa.
8.5 INTESTINO CRASSO
DIAGNOSTICA STRUMENTALE
Per il colon esistono numerosi esami, vuoi per la frequenza della patologia neoplastica, ma anche irritativa e
funzionale, vuoi per la sua accessibilità che lo rende ben studiabile.
Esame diretto
Eseguito di norma in ortostasi AP con cassetta radiografica di grande formato. Non viene effettuata nessuna
preparazione e si osserva quindi la distribuzione spontanea di gas e feci. Questo esame di per sé permette:
• Individuazione di stati di occlusione e subocclusione
• Osservazione di alcune fasi evolutive delle IBD e della colite idiopatica
• Conferma di diagnosi per megacolon tossico
Clisma a doppio contrasto
Il clisma è l’opacizzazione del colon con un sottile strato di mezzo di contrasto opaco (il solito solfato di
bario) reso capace di aderire solo alle pareti. Il lume viene “cancellato” distendendolo con aria. Consente
l’analisi della sola mucosa e di tutte le patologie che la riguardano.
http://www.hackmed.org
[email protected] 102
Mencaroni Spartaco
Il termine “doppio contrasto” (che si applica anche al clisma esofageo, gastrico e del duodeno) si riferisce al
contrasto fra aria e bario e fra bario e parete.
Per effettuare il clisma è necessaria l’eliminazione radicale del contenuto fecale (purganti) e poi preparare il
colon con antispastici e ipotonizzanti (Buscopan), quindi insufflazione dell’aria con semplice palla di gomma
collegata ad una sonda rettale (nei pazienti sensibili alla dilatazione colica si può usare anche CO2).
Consente una dimostrazione diretta delle pliche e delle austra, che appaiono come linee trasparenti
circondante dal bario che vi si deposita attorno.
Nel retto è possibile la dimostrazione di tutta una serie di pliche particolari che possono essere importanti
punti di repere.
La mucosa del colon è fondamentalmente liscia, e quindi è possibile identificare facilmente estroflessioni e
processi patologici anche molto piccoli (ordine di mm).
Clisma opaco
Realizza un calco del lume riempiendolo di sospensione baritata al 15-20% p/v. Anche qui è importante la
liberazione del colon dalle feci che vi ristagnano. La soluzione viene fatta scendere fino a riempimento
completo del colon (1,5-2 litri) e mentre questo avviene si fanno radiogrammi mirati (osservazione
radioscopica è fondamentale) del retto, del colon, delle flessure, del sigma, cercando di dissociare da ogni
tratto la sovrapposizione di altre immagini.
Qui le immagini dei processi patologici sono legate ai difetti o ai surplus di riempimento; a differenza del
clisma a doppio contrasto (DC) si possono evidenziare soltanto fenomeni patologici dell’ordine di cm. Si usa
quindi per:
• Età pediatrica
• Presunta scarsa collaborazione del paziente
• Controllo di situazioni patologiche già note
• Ricerca di diverticoli, anomalie di sede, decorso, forma
Clisma istantaneo
Clisma opaco effettuato senza preparazione, per studio rapido delle coliti in fase attiva. Infatti le aree
infiammate del colon sono di per sé prive di contenuto fecale e quindi la presenza di questo è indice di
mucosa normale.
Metodiche di studio della parete
Ecografia, RM e TC. Tutte queste permettono la visualizzazione diretta della parete del colon e del retto, con
differenti caratteristiche fra i diversi tipi di esame. Assumono importanza quando si deve valutare
l’estensione dei processi infiammatori o di altro tipo attraverso la parete.
•
•
•
Ecografia: permette già da sola di identificare i processi patologici di tipo neoplastico e linfomatosi; la
massa parietale è iperecogeno, il lume ipoecogeno per la presenza di gas. Una massa che deborda dalla
parete genera un aspetto lobato molto caratteristico. L’ecografia transluminale del retto è molto utile per
la valutazione dell’estensione parietale dei tumori.
TC: importante per il controllo dell’evoluzione parietale della diverticolite, del Crohn, nella stadiazione
delle neoplasie, ricerca di recidive e metastasi. Con l’insufflazione di aria e la contrastazione delle arterie
coliche per endovena si ottengono risultati molto buoni di “colonscopia virtuale”.
RM: pochi risultati nello studio del colon. Invece è molto valida nello studio della parete rettale con
bobine intracavitarie: il problema della differenziazione fra fibrosi e recidive di tumori del retto può
essere indagato anche con questa metodica (di solito si fa con la PET).
Angiografia
Limitato ruolo (è complessa, lunga e indaginosa, richiedendo il cateterismo selettivo delle arterie
mesenteriche). E’ usata per:
• Ricerca di lesioni angiodisplastiche causa di sanguinamento
• Studio dell’ischemia acuta occlusiva del colon
• Precisazione della mappa vascolare preoperatoria
Studio del transito
Importante per lo studio di alcune patologie funzionali è la valutazione del transito attraverso l’ingestione e il
monitoraggio di indicatori radiopachi (in genere dischetti di polietilene di 2X7 mm). Si somministrano la
Mencaroni Spartaco
103
sera prima con il pasto (circa 30) e si osservano il mattino successivo e poi dopo 6 ore, dopo altre 12 ore, e in
seguito ogni 12-24 ore fino all’espulsione completa.
PATOLOGIA DEL CRASSO
Ostruzioni congenite
Sono condizioni molto rare e di relativa importanza; si diagnosticano agevolmente con il clisma opaco; le
duplicazioni del colon sono importanti da individuare per le frequenza con cui quelle di destra si complicano
con invaginazione.
L’ano imperforato, causa comune di ostruzione colica in età neonatale, si osserva bene con l’esame RX
diretto con paziente a testa in giù (l’ostruzione è al punto di arresto della risalita di gas colico).
Importante le ricerca di fistole retto-vaginali e retto-vescicali.
Malattia di Hirschprung
Assenza congenita di cellule gangliari del plesso mioenterico con assenza di peristalsi in un segmento più o
meno esteso, e si può avere una serie di gravi complicazioni (ileo, ischemia, perforazione).
La sintomatologia evolve dalla semplice costipazione fino alla morte per inanizione o infezione.
L’esame diretto mostra le anse dilatate con aria e feci poco formate a monte dell’ostruzione: il retto è sempre
vuoto.
Il clisma opaco istantaneo dimostra la zona di transizione fra il segmento aperistaltico, non dilatato, e quello
normale, dilatato e iperperistaltico. I radiogrammi di controllo a 24 e 48 ore dimostrano la progressione
pressoché nulla del mezzo di contrasto.
Ostruzioni acquisite
In genere legate ad una stenosi tumorale o infiammatoria, o da un volvolo. Ma anche ernie incarcerate,
fecalomi, compressioni da masse estrinseche possono ostruire il transito.
Il colon a monte è dilatato e presenta numerosi livelli idroaerei; se la valvola è incontinente si distende
anche il tenue. Il clisma opaco dimostra l’ostruzione e la sua localizzazione, ma può essere pericoloso
eseguirlo per via della possibilità, non infrequente, di rottura del colon ciecale (dove il diametro è maggiore
e quindi, per la legge di La Place, la tensione parietale può aumentare notevolmente: il limite di rottura è
attorno ai 12 cm di diametro).
Un altro evento frequente è il megacolon tossico, una alterazione legata a complicanze della RCU nella
quale si ha la distruzione delle cellule gangliari e quindi la paralisi del colon-retto, con dilatazione a monte.
Colon catartico
Situazione di stipsi ostinata e peristalsi cronicamente ipovalida che consegue ad un utilizzo indiscriminato ed
eccessivo dei lassativi.
Con il clisma a DC si possono evidenziare una riduzione numerica delle austra e delle pliche semicircolari,
più precoce e intensa nella metà destra del colon.
Patologia infiammatoria del colon
Sindrome del colon irritabile
Detta anche sindrome dell’intestino irritabile, è una delle patologie dell’alvo più frequente. La malattia pur
avendo del tutto benigna, può essere estremamente fastidiosa per il paziente. Non riconosce in genere una
causa organica, biochimica od infettiva, ma è praticamente una alterazione funzionale.
Principalmente, si osservano disturbi alternati dell’alvo, diarrea e stipsi, e una bassa soglia di stimolazione
intestinale. Tipicamente, in questi soggetti, basta un catetere da 50cc con aria insufflata nell’intestino, mentre
normalmente ce ne vogliono 200-250.
Si pensa che la noxa patogena sia una alterazione della sensibilità intestinale e del resto dell’apparato
gastroenterico; sebbene lo stress in molti individui possa determinare una riacutizzazione della malattia, non
c’è alcuna prova che sia la causa di essa. Esiste poi, in altri gruppi di pazienti, l’evidenza di disturbi della
motilità del colon
La diagnosi della malattia è prevalentemente clinica ma, in quelle circostanze (non rare) in cui è necessario
fare diagnosi di esclusione, diventa importante la valutazione strumentale per escludere altre cause di
patologia.
Alcuni rilievi radiologici inoltre sono indicativi di colon irritabile:
http://www.hackmed.org
•
•
•
[email protected] 104
Mencaroni Spartaco
Iperaustratura e ipersegmentazione del colon (variante stipsi dolorosa)
Scomparsa totale delle segmentazioni coliche e delle pliche (variante diarrea dolorosa)
Comparsa di pliche spirali sulla superficie (variante stipsi e diarrea alternate)
Malattia diverticolare
Un diverticolo è una protrusione della parete intestinale che forma una canale a fondo cieco, lungo da pochi
mm a diversi cm, il diverticolo appunto. Si distinguono due forme di diverticoli, quelli veri, in cui la
protrusione è di tutta la parete, e quelli falsi, in cui la protrusione è della sola mucosa che crea un canale a
fondo cieco nello spessore della parete intestinale.
La diverticolosi è un processo di senescenza, legato alla debolezza progressiva della parete intestinale, ma
può anche essere congenita, ad esempio per la pervietà del dotto vitellino, oppure essere legato all’aumento
cronico della pressione endoluminale, ad esempio a monte di una stenosi.
I diverticoli del colon sono in genere erniazioni della parete nei punti in cui essa è attraversata da un vaso,
che interrompe la continuità della parete muscolare. La loro incidenza aumenta dopo i 50 anni, raggiungendo
il 20-30% della popolazione.
La patogenesi è legata a questo meccanismo: la muscolatura australe con il tempo e nei soggetti predisposti
si ispessisce, provocando delle stenosi segmentali che aumentano la pressione a monte. Nei soggetti anziani,
questo si assomma alla debolezza della parete.
La genesi del diverticolo è legata a fattori come:
• Età
• Predisposizione individuale
• Dieta povera di fibre e scorie
• Sedentarietà
La malattia diverticolare in genere si complica con la diverticolite, ossia l’infiammazione del diverticolo. In
ognuna delle fasi del processo patologico si hanno reperti radiologici diversi, in quanto lo studio di questa
malattia nel suo divenire si fa elettivamente con il clisma opaco a doppio contrasto.
Prediverticolosi
Ipertrofia muscolare della parete (da “iperlavoro”) che è visibile come un aspetto frastagliato (a dente di
sega) del margine del colon. Nel lume possono essere evidenti delle formazioni simili a pliche, provocate
dalla muscolatura ipertrofica
→ Diverticolosi
Le formazioni diverticolari sporgono caratteristicamente oltre i margini del colon se viste di profilo. Di
faccia hanno l’aspetto di anelli a margini netti all’interno, sfumati all’esterno.
Di solito il colletto è ortogonale all’asse colico, ma il sacco si piega e diventa ad esso parallelo; hanno spesso
dimensioni inferiori al cm, anche se nel sigma se ne possono trovare di giganti fino a 25 cm di lunghezza, e
sono ben differenziati dai polipi. Nel loro contesto possono esserci difetti di riempimento dovute a residui
fecali.
→ Prediverticolite e diverticolite
La sacca diverticolare è fragile, e si possono formare microperforazioni che inducono infiammazione e
flogosi localizzata attorno al diverticolo. Nei casi evolutivi la reazioni infiammatoria può essere diffusa, con
formazione di edema e infine di ascessi pericolici, che possono evolvere in fistole (vaginali, vescicali e
coliche).
Queste alterazioni infiammatorie possono interessare la parete così tanto da rendere ragione di problemi di
diagnosi differenziale con le IBD e con il carcinoma.
Rettocolite ulcerosa
È una malattia infiammatoria cronica che colpisce la mucosa del colon.
L’incidenza è di 35-100 su 100000 ed è ultimamente in aumento.
Sono colpite prevalentemente donne.
La prevalenza è maggiore nei non fumatori al contrario del morbo di Crohn.
I tassi maggiori di incidenza si osservano tra i 30 ed i 60 anni.
Mencaroni Spartaco
105
Nella colite ulcerosa c’è una infiammazione della sola mucosa del colon, che si presenta iperemica,
sanguinante e cosparsa di ulcere. Questo interessamento della mucosa è caratteristico perché è uniforme e
continuo, cioè non ci sono aree di mucosa sana intervallate ad aree malate, e nel 95% dei casi
l’interessamento è del colon-retto, in ogni caso mai esteso al resto dell’apparato digerente come invece capita
nel Crohn.
Un altro aspetto caratteristico è la formazione di infiltrati di neutrofili nelle ghiandole criptiche dell’intestino,
che può portare alla formazione di ascessi in loco (ascessi criptici) e alla distruzione della ghiandole stesse.
A differenza del Crohn, gli strati più profondi della parete del colon non sono di solito interessati, e questo
rende ragione del diverso rischio fra le due malattie di perforazione intestinale.
Si ha la presenza di ulcerazioni multiple della mucosa, più spesso superficiali, a volte confluenti.
La mucosa coinvolta si presenta intensamente iperemica e facilmente sanguinante.
Le zone di mucosa non erosa o in rigenerazione tendono a sostituire la mucosa erosa creando i cosiddetti
pseudopolipi di natura infiammatoria che non sono di per sé a rischio di trasformazione maligna, ma
possono rappresentare una lesione precancerogena, potendo insorgere un cancro nella regione circostante.
In effetti quando la malattia dura da molto tempo non è infrequente l’individuazione di una displasia.
L’enteroclisma a DC è il mezzo diagnostico di elezione; esso permette di individuare la colite, localizzare la
regione di avanzamento, lo stadio evolutivo, differenziare la colite ulcerosa dal Crohn quando non è possibile
farlo su base endoscopica.
L’aspetto radiologico distingue la malattia in diversi stadi:
• Stadio pre-erosivo: aspetto finemente granulare “a vetro smerigliato” dell’ampolla rettale e del sigma;
questa diminuzione della trasparenza diffusa è meno intensa di quella provocata da una infiammazione.
• Stadio erosivo: compaiono punteggiature baritate multiple, e superficiali
• Stadio ulcerativo: l’ulcera è una chiazza baritata rotondeggiante in fronte, un surplus di riempimento se
vista di profilo. Nella sottomucosa la lesione si espande con facilità e assume l’aspetto di un bottone di
camicia.
• Stadio di riparazione: possono essere visti gli pseudopolipi, di aspetto in genere rotondeggiante ma
anche multipli e bizzarri.
• Stadio di cronicizzazione: la mucosa assume aspetto trofico, con intestino crasso diffusamente ridotto di
calibro ma in particolare al retto-sigma, privo delle pliche semicircolari e delle austra; possono anche
ridursi o scomparire i flessi colici normali.
Anche l’esame diretto addome può, nella fase acuta già nota, identificare il fronte di avanzamento della
malattia sulla base del fatto che dove c’è colite non ci sono feci; inoltre il crasso infiammato contiene più aria
del normale, (quantitativo che aumenta bruscamente con il passaggio al megacolon tossico, diagnosi di
certezza quando il colon trasverso aumenta il diametro fino a 7 cm).
L’RX diretto può essere ripetuto anche ogni 12 ore per monitorare la progressione a colon tossico, a
differenza del clisma.
TC, RM ed ecografia possono essere utili a diagnosi avvenuta per la ricerca di carcinomi che nella rettocolite
ulcerosa hanno una incidenza di sei volte quella della popolazione generale.
Morbo di Crohn
La malattia di Crohn, a differenza della colite ulcerosa, è caratterizzata dalla presenza di una infiammazione
a tutto spessore con interessamento del mesentere e dei linfonodi locoregionali.
Può colpire sia il colon che l’ultimo segmento dell’ileo, con quadri molto variegati, anche perché pur
essendo solitamente una malattia monofocale, questa non è la regola. Spesso le lesioni si possono infatti
presentare al di fuori del colon stesso, e la malattia può colpire dalla bocca all’ano.
Con il progredire della malattia, la parte colpita (più spesso i vari tratti colpiti) presentano un ispessimento e
una fibrosi che può interessare anche il mesentere, e si accompagna a vari gradi di ostruzione intestinale. Il
mesentere, ispessito ed edematoso, si estende fino alla sierosa con caratteristiche digitazioni.
In netto contrasto con la RCU, l’aspetto della mucosa può facilmente essere normale; quando ci sono
alterazioni, però, esse sono caratteristiche, e la mucosa assume l’aspetto così detto ad acciottolato, per via
dell’edema sottomucoso e la presenza di ulcere lineari, disposte lungo l’asse maggiore dell’intestino, e
confluenti, anche nella sottomucosa. Queste ulcere scavano una fitta rete di canali che provocano
http://www.hackmed.org
[email protected] 106
Mencaroni Spartaco
frequentemente delle fistole fra l’intestino e i visceri vicini (la perforazione, invece, a causa
dell’ispessimento mucoso, è una evenienza rara).
Nelle fasi iniziali compaiono piccoli granulomi simil sarcoidosici non caseificanti nelle sottomucosa e nella
lamina propria che sono presenti solo nel 40-50% dei casi ma specifici, è presente infiltrazione di monociti e
macrofagi a livello dei linfonodi regionali, nelle placche del Pejer, nella sierosa e nel mesentere adiacente.
Nelle fasi più avanzate di malattia gli infiltrati aumentano e compaiono ulcerazioni profonde e fibrosi.
Le ulcere sono aftoidi o stellate o longitudinali o a bottone di camicia.
Si ha presenza di pseudopolipi giganti che si differenziano da quelli della colite ulcerosa che sono più
localizzati e più vicini.
Spesso l’interessamento della mucosa avviene in modo discontinuo, a differenza della RCU; inoltre, il fatto
che il processo interessi la parete a tutto spessore provoca la presenza di noduli infiammatori che
coinvolgono anche la sierosa e il mesentere. Come conseguenza della infiammazione sierosa, le anse
intestinali tendono ad aderire fra loro, formando a volte una massa palpabile in fossa iliaca di destra.
Microscopicamente, il tipo di infiammazione è granulomatosa. Quando sono presenti, i granulomi sono un
elemento caratteristico del Crohn, utile nella diagnosi differenziale soprattutto della RCU. Nel 30% colpisce
la parte terminale dell’ileo, nel 30% il solo colon, nel 40% si ha una localizzazione ileocolica. In alcuni casi
molto meno frequenti, l’interessamento è soltanto del tenue, e altre volte non è possibile fare una diagnosi
differenziale con la RCU.
Anche qui il ruolo del clisma a DC è importante, e rende possibile una certa gradazione evolutiva delle
lesioni della malattia.
Nelle fasi iniziali si ha una ipertrofia dei follicoli linfatici interessati dall’infiammazione, che compaiono al
clisma come un difetto di riempimento nodulare della parete, a margini sfumati (edema).
Le ulcere aftoidi sono visibili come piccole chiazze di mezzo di contrasto circondate da un alone
radiotrasparente di edema.
Nelle fasi conclamate della malattia sono visibili ulcere profonde, continue, polimorfe, con aspetto
caratteristico lineare e serpiginoso, che duplica il contorno dell’ansa.
Queste ulcere si intersecano nella mucosa dando il caratteristico aspetto ad acciottolato; le aree di mucosa
normale, protrudendo fra le ulcere incavate, danno l’impressione di essere sollevate e formano quindi degli
pseudopolipi.
La parete intestinale si ispessisce notevolmente, e si ha l’aumento della distanza fra le anse colpite e quelle
sane; tratti colpiti e tratti sani si alternano nelle fasi avanzate della malattia con così dette lesioni a salto o
“skip lesions”.
L’insorgenza di carcinomi del crasso è circa 20 volte maggiore nella malattia di Crohn che nel resto della
popolazione, da cui il ruolo di TC e RM nello staging e nell’individuazione precoce.
Colite ulcerosa
Morbo di Crohn
0 (ulcere continue e
piccole)
+/a 360°
0
+
+/0
++ (ulcere a tratti non
continui, grandi e
scavate)
++
non completo
+/++
++
++
++
++
++
++
+
Aspetti anatomo-patologici
Interessamento segmentario
Interessamento transmurale
Interessamento della mucosa
Granulomi
Fibrosi
Fissurazioni e fistole
Interessamento del grasso mesenterico e dei linfonodi
manifestazioni cliniche
Diarrea
Proctorragia
Mencaroni Spartaco
107
Dolore addominale
Massa palpabile
Fistole
Granulomi
Stenosi
Interessamento del tenue
Interessamento rettale
Megacolon tossico
Recidiva dopo colectomia
Neoplasia nelle forme di lunga durata
Complicanze extracoliche
+
0
+/+
++
++
++
++
++
+/- (ileite da reflusso)
95%
+
+
+
++ (ileite terminale)
50%
+/+
+/+
Colite ischemica
Condizione di infiammazione ischemica del colon che però non dipende da una occlusione (si chiama in quel
caso ischemia occlusiva), o da altre alterazioni dei vasi. La sua eziologia è discussa, e si manifesta con vivo
dolore in fossa iliaca di sinistra, improvviso, diarrea ematica.
Esordio brusco ma di regola remissione spontanea e duratura dei sintomi.
Su base clinica o radiologica è molto difficile distinguerla dalla RCU o dal Crohn o dalla colite spastica.
All’esame diretto addome si presenta un aumento del contenuto gassoso dell’intestino, fino al megacolon
tossico nei casi gravi. Il clisma opaco o a DC (controindicato nei casi molto gravi) individua le conseguenze
dell’essudazione e del sanguinamento, con vistosi difetti di riempimento a “impronta di pollice” dovuti al
sollevamento della mucosa da parte di raccolte ematiche sottostanti.
Il lume del colon è diffusamente ristretto e irregolare (differenza con le stenosi neoplastiche).
L’ecografia mostra le raccolte ematiche sottoforma di ispessimenti parietali, esaminando il flusso dei grossi
vasi con il doppler. La TC dimostra l’ispessimento parietale, l’emorragia, la presenza di gas nella parete
colica.
MALATTIA POLIPOSICA DEL COLON
Polipi
Æ il polipo per definizione è una massa che protrude nel lume.
Può essere:
¾Peduncolato (asse fibrovascolare)
¾Sessile (larga base d’impianto)
Adenomi (90%)
veri
Polipi iperplastici
(10%)
Polipi
Amartomi
Falsi
(non neoplastici)
Polipi
infiammatori
I polipi iperplastici sono alterazioni benigne con scarsa o nulla tendenza alla trasformazione in cancro del
colon, al contrario dei polipi adenomatosi. La distribuzione dei polipi nell’intestino segue una probabilità che
è inversamente proporzionale alla distanza dall’ano. Comunque, non si deve mai escludere la possibilità di
avere un polipo nel cieco, e si deve sempre eseguire una colonscopia totale.
Circa il 30% della popolazione sviluppa una poliposi adenomatosa del colon, ma di questi solo 1 su 100 si
trasformano in carcinoma. Ciò nonostante, i polipi sono la causa più frequente di insorgenza di un carcinoma
del colon. La tendenza alla trasformazione maligna è collegata a:
• Diametro del polipo
• % di componente villosa (villoso > tubolare)
http://www.hackmed.org
•
[email protected] 108
Mencaroni Spartaco
Morfologia (sessile > peduncolato)
Il processo che conduce dalla poliposi del colon alla trasformazione a carcinoma è ben noto, ed è
schematizzabile nelle seguenti tappe:
• Mutazione puntiforme del protoncogene K-ras
• Ipometilazione del DNA, con attivazione genica anomala
• Perdita di DNA (perdita allelica di un oncosoppressore come APC, DCC, p-53)
• Iperplasia
• Displasia
• Polipi che contengono nello spessore cellule carcinomatose (carcinoma in situ)
Chi ha un polipo adenomatoso ha la possibilità del 30-50% di averne un altro, e deve essere accuratamente
sorvegliato. La colonscopia di sorveglianza non ha senso se ripetuta prima di 3 anni, a causa del lento ritmo
di crescita degli adenomi.
I polipi neoplastici si trovano nel 10-15% dei soggetti oltre i 40 anni, in ordine crescente di frequenza
partendo dal retto verso il cieco (il 70% circa sono nel colon sinistro); nel 25% dei casi sono multipli.
La diagnosi più sensibile per l’individuazione del polipo è la colonscopia, che ne permette la visualizzazione
del 97-98%.
Percentuali del 90-95% si raggiungono anche con il clisma a DC (quello opaco solo il 55%).
I polipi sessili appaiono come un anello con contorno opaco, sfumato sul versante esterno e netto su quello
interno (al contrario dei diverticoli) se presi di fronte. Il contorno è generato dal bario che per capillarità
entra fra la mucosa e la base del polipo.
Di “tre quarti” assume un aspetto a bombetta inglese, mentre di profilo è visibile come una masserella a
calotta sferica con la base perfettamente allineata alla parete colica (la retrazione della base è un segno di
malignità).
Il polipo peduncolato appare di fronte come un immagine a doppio cerchio (la testa e la base), di ¾ o di
profilo come un peduncolo in rapporto con una masserella a calotta (la testa).
Gli adenomi tubulari sono per lo più sessili, e si fermano in genere a questa fase di sviluppo. Quelli villosi
anche sono spesso sessili, ma di dimensioni maggiori, e con una componente aggettante “spugnosa” per la
penetrazione del bario fra le frondosità della superficie.
Gli adenomi tubulo-villosi sono invece simili ai tubulari, dai quali non sono differenziabili radiologicamente.
In ogni caso la diagnosi di malignità e benignità è sempre istologica, e i polipi vanno comunque asportati;
alcuni segni radiologici di degenerazione maligna, comunque, sono:
• Sviluppo in superficie e non in spessore (polipo piatto)
• Dimensioni cospicue (non maligno < 5mm, 35% di malignità sopra a 2 cm)
• Irregolarità della superficie
• Retrazione della base
• Peduncolo corto, tozzo e poco mobile.
Poliposi
Polipi giovanili. Malformazioni amartomatose focale della mucosa del retto principalmente. Spesso si
presentano nei bambini al di sotto dei 5 anni, quasi sempre come lesioni sporadiche, raramente nel contesto
di una rara sindrome familiare. Grandi, diametro 2-3 cm, con una superficie liscia, o lievemente lobulata, e
un peduncolo che può raggiungere i 2 cm.
Il tessuto appare composto da ghiandole meno bene organizzate di quelle dei polipi iperplastici, con spazi
cistici.
Nelle forme normali non hanno nessun potenziale maligno, mentre nelle forme rare associate alla malattia
familiare si può riscontrare una possibilità di progressione ad adenoma, e quindi adenocarcinoma
Polipi della sindrome di Peutz-Jeghers. Questa impronunciabile malattia si associa alla presenza di polipi
insorgenti in forma singola o multipla in tutto il gastroenterico, a iperpigmentazione cutanea e mucosa (viso,
palmo delle mani, labbra, genitali). Si trasmette in forma autosomica dominante.
Mencaroni Spartaco
109
I polipi sono grandi, peduncolati, a superficie lobulata.
Essi hanno un asse portante formato da connettivo e muscolo liscio, che circonda un notevole numero di
ghiandole rivestite da epitelio e cellule mucose.
Questi polipi non hanno potenzialità maligna, ma la sindrome è associata ad aumento del rischio di
cancro del pancreas, mammella, polmoni e ovaie.
Poliposi adenomatosa familiare (PAF): presenza di innumerevoli polipi adenomatosi, che nel complesso
danno un rischio di sviluppare il carcinoma quasi del 100%. La poliposi del colon è una condizione ereditaria
rara caratterizzata dall’insorgenza di migliaia di polipi in tutto l’intestino crasso. La mutazione si trasmette
come carattere autosomico dominante, ed è caratterizzata da una delezione del braccio lungo del cromosoma
5, con perdita degli oncosoppressori implicati nella trasformazione maligna dei polipi adenomatosi. I pazienti
affetti cominciano a sviluppare polipi entro il 25° anno di età, e se non trattati praticamente tutti hanno un
carcinoma del colon. Si devono sviluppare almeno 100 polipi perché si possa diagnosticare questa malattia.
Una volta identificati questi pazienti devono essere trattati con colectomia totale. I figli di soggetti malati
devono essere controllati fino al trentacinquesimo anno di vita, e per farlo basta la sigmoscopia in quanto i
polipi si distribuiscono uniformemente in tutto il crasso.
Sindrome di Gardner: variante autosomica della PAF con in più aumento dell’incidenza di osteomi
multipli, cisti epidermoidali e fibromatosi. Aumenta anche il rischio di K della tiroide e del duodeno.
Sindrome di Turcot: sindrome molto rara, variante della PAF, a cui aggiunge l’incidenza di tumori del
SNC, soprattutto gliomi.
CARCINOMA DEL COLON RETTO
Epidemiologia
Circa il 98% delle neoplasie dell’intestino crasso sono adenocarcinomi. Di questi, molti insorgono su un
precedente adenoma, come discuteremo ampiamente nell’eziologia.
Incidenza di 300-400 casi /105 . Tale valore cresce con l’avanzare dell’età, raggiungendo un picco di
incidenza attorno a 75-84 anni. I maschi, andando avanti con l’età, assumono un rischio moderatamente
maggiore. Circa il 15% dei casi di carcinoma del colon viene però diagnosticato in giovane età, e in questi
soggetti si ha spesso una colite ulcerosa o una sindrome poliposica ereditaria (vedi sopra).
Geograficamente l’incidenza è alta in USA e in Europa orientale, mentre è 10 volte più bassa in Messico,
Sud America e Africa (differenze di alimentazione).
In Italia vi sono circa 10.000 casi per anno.
Eziologia
Ci sono implicati diversi fattori. Infatti il K del colon-retto insorge o per motivi dietetici-ambientali, oppure
per ragioni legate alla presenza di alterazioni genetiche (come nella HNPCC o nelle poliposi ereditarie).
Vediamo uno per uno questi fattori:
Progressione adenoma-carcinoma
Lo sviluppo di un K da un adenoma, definito progressione A-K, è documentato da diverse osservazioni:
o Incidenza sovrapponibile fra A e K
o Distribuzione simile nell’intestino
o Picco di incidenza per età di A precede di alcuni anni quello di K
o Il K precoce spesso è circondato da tessuto adenomatoso
o Stretta correlazione fra aumento degli adenomi (sindromi poliposiche familari) e K
Questo meccanismo è responsabile di diversi carcinomi, ma non di tutti.
Alterazioni genetiche
Alterazioni genetiche specifiche implicate sia nella genesi delle sindromi poliposiche familiari che ne
processo che conduce dalla poliposi del colon alla trasformazione a carcinoma. Questo meccanismo è
ben noto, ed è schematizzabile nelle seguenti tappe:
• Perdita di geni implicati nella riparazione del DNA (APC, MSH2). Questa perdita è congenita nelle
sindromi familiari, ma può avvenire in maniera acquisita ed essere alla base della trasformazione di un
polipo non familiare in un carcinoma
http://www.hackmed.org
[email protected] 110
Mencaroni Spartaco
• Mutazione puntiforme del protoncogene K-ras (può avvenire o no, e se avviene aumenta la rapidità del
processo)
• Perdita di gruppi metili nel DNA, provocata dal deficit di meccanisimi riparatori (ipometilazione del
DNA), con attivazione genica anomala
• Perdita di DNA (perdita allelica di un oncosoppressore come APC, DCC, p-53)
• Iperplasia
• Displasia
• Polipi che contengono nello spessore cellule carcinomatose (carcinoma in situ)
Alterazioni specifiche della Sindrome di Gardner e della PAF: in entrambe le malattie c’è una mutazione
di un gene localizzato sul cromosoma 5q21. La proteina codificata è la APC, implicata nella migrazione
delle cellule e nell’adesione. Essa inoltre lega la β-caderina, una proteina con attività oncogenica (che attiva
molti fattori di crescita) e forma un complesso intracellulare inattivo con essa, destinato alla degradazione..
La mutazione del gene APC diminuisce questa attività e aumenta la trascrizione di fattori di crescita. Inoltre
l’APC, implicata anche nella adesione cellulare, non trattiene le cellule attaccate l’una all’altra e facilita la
diffusione metastatica.
Carcinoma non poliposico del colon (HNPCC)
Detta anche malattia di Lynch, è una condizione ereditaria autosomico-recessiva, caratterizzata da
un’aumentata incidenza all’interno del gruppo familiare del cancro del colon. A differenza della poliposi, la
frequenza di insorgenza del carcinoma è massima nella porzione prossimale del colon, e l’età di insorgenza è
più bassa che nella popolazione generale. Spesso i pazienti hanno in associazione altre condizioni di
neoplasie associate. Si associa alla mutazione, trasmessa ereditariamente, di uno dei quattro geni implicati
nella riparazione del DNA coinvolti nella malattia (MSH 1 e 2 e PMS 1 e 2).
Fattori ambientali
Malattia infiammatoria intestinale: come altrove messo in evidenza, esiste una stretta associazione, che si
rafforza con il tempo, fra la RCU e l’insorgenza di una neoplasia del colon-retto.
Dieta: Nella maggior parte dei casi è il fattore ambientale che aumenta il rischio di incidenza di questa
malattia, tanto che il max di incidenza si ha nei Paesi occidentali e nelle aree urbane. Così come accade per
le patologie cardiovascolari, esiste una relazione diretta fra il cancro del colon e numero di calorie, grassi
animali, proteine nella carne e oli. I fattori genetici non sono in questo caso influenti, dato che i gruppi
migranti acquistano il rischio delle popolazioni ospiti.
La dieta occidentale contiene più grassi animali, che probabilmente determinano un aumento della flora
batterica intestinale anaerobica, che converte i sali biliari in cancerogeni, e inoltre è povera di fibre, con
conseguente rallentamento del transito intestinale, ristagno di cibo e accumulo di cancerogeni nella mucosa.
Soprattutto l’elevata introduzione di grassi animali sembra il principale fattore non ereditario, associato alla
scarsa introduzione di vitamine antiossidanti come A,C,E
Altre condizioni ad alto rischio sono:
• Streptococcus Bovis, per ragioni non note, si associa ad un aumento dell’incidenza del tumore quando
sostiene una batteriemia o una sepsi intestinale
• Fumo di sigaretta
Anatomia patologica
38% localizzato nel cieco e nel colon ascendente, 8% nel colon discendente, 18% nel trasverso e 1% in sede
multipla.
99% singoli, quelli multipli spesso nelle sindromi familiari.
Benché tutti possano insorgere da masse polipoidi adenomatose, essi assumono due aspetti morfologici
diversi a seconda che siano presenti a destra o a sinistra (colon prossimale o distale):
•
•
A destra insorgono in modo polipoide, e si estendono lungo la parete per lungo. Rarissima l’ostruzione
(anche per la liquidità del materiale fecale), comune la torsione e il sanguinamento
A sinistra crescono in modo circolare, ad anello di tovagliolo, restringendo il lume e provocando stenosi
molto frequentemente.
Mencaroni Spartaco
111
Con il passare degli anni, però, queste 2 forme infiltrano in profondità la parete e si vedono dalla sierosa
come masse solide e bianche, che causano spesso corrugamento della superficie esterna.
A differenza degli aspetti macroscopici, le caratteristiche micro sono molto simili: variano da cellule
cilindriche alte (che differiscono da quelle degli adenomi perché invadono sottomucosa e muscolare) fino a
cellule indefferenziate, che formano masse francamente anaplastiche.
Producono spesso mucina, che viene secreta nel lume e favorisce la diffusione di cellule neoplastiche, e
provocano una reazione desmoplastica responsabile della loro tipica consistenza dura.
Alcuni aspetti particolari:
• Differenziazione neuroendocrina (10%) : producono un carcinoma indifferenziato a piccole cellule e
possono elaborare una varietà di prodotti biologicamente attivi.
• Differenziazione di alcuni focolai in senso squamoso → carcinoma adeno-squamoso, più comune
nell’intestino distale.
• Neoplasie a cellule con castone
• Neoplasie anorettali: sono praticamente una cosa a se, e sono quasi sempre K a cellule squamose.
Clinica
Colon SX
Colon DX
Sanguinamento
rosso vivo
assente (sangue occulto)
Variazioni dell’alvo
+++ (falsa diarrea o stipsi)
-----Ostruzione
+
+/Anemizzazione
+/++
Una variazione dell’alvo improvvisa in un paziente di mezza età deve indicare un allarme per un possibile
carcinoma. Le variazioni dell’alvo non si manifestano molto se il tumore è localizzato a destra, perché le feci
sono liquide quando arrivano dall’ileo, e quindi non vengono ostacolate dalla presenza del carcinoma. A
sinistra si osservano anche crampi addominali, occasionale ostruzione e persino perforazione. Invece a destra
c’è più spesso sanguinamento, che può essere anche così intenso da dare anemia acuta, tachicardia e
palpitazioni, perché le lesioni carcinomatose spesso si ulcerano.
I carcinomi del retto, che spesso si associano a ematochezia o proctorragia, danno regolarmente tenesmo, e
basta l’esplorazione rettale per differenziarle da un carcinoma del colon.
Staging
Nei pazienti con il cancro del colon la prognosi dipende dal grado di penetrazione della parete e
dall’interessamento linfonodale, e dalla presenza di metastasi a distanza. E’ stata quindi costituita la
stadiazione di DUKES, equiparata al TNM, come riportato di seguito.
Dukes4
A
B1
B2
C
D
TNM
Numerica
TisN0M0
T1N0M0
T2N0M0
T3N0M0
T4N0M0
TxN1-3M0
TxNxM1
0
1A
1B
2A
2B
3
4
Descrizione
Neoplasia in istu
Neoplasia limitata alla mucosa
Neoplasia estesa alla sottomucosa
Estesa attraverso la parete
Estesa alla sierosa
Interessamento dei linfonodi regionali
Metastasi a distanza
Sopravvivenza
a 5 anni
99%
>81-85
64-78
27-33
5-14
http://www.hackmed.org
[email protected] 112
Mencaroni Spartaco
La maggior parte delle recidive si hanno dopo 4 anni, e la sopravvivenza a 5 anni diventa un indicatore di
guarigione abbastanza attendibile.
N1: metastasi ad 1-3 linfonodi regionali
N2: metastasi a 4 o più linfonodi regionali
N3: metastasi diffuse lungo i vasi
I linfonodi interessati sono quelli attorno al retto, emorroidari e i linfonodi iliaci interni ed esterni.
Diffusione
• Estensione diretta (vescica, prostata, utero, ureteri)
• Linfatica
• Ematogena
• Transperitoneale
• Intraoperatoria
Sede di frequenti recidive sono le aree di tessuto fibroso e adiposo nella parte inferiore del retto, detto anche
“mesoretto”.
Diagnosi radiologica
E’ essenziale una diagnosi precoce, nel cui contesto sono fondamentali i programmi di screening di
popolazione. Per questo nei soggetti normali a partire da 50 anni, e nei soggetti con predisposizione familiare
a partire dai 40, si esegue:
• Esplorazione digitale rettale e ricerca del sangue occulto nelle feci (annuale)
• Clisma opaco a DC o pancolonscopia, alternativamente ogni 3 anni (soggetti predisposti) o ogni 5 anni
(soggetti non predisposti)
All’esame radiologico si possono evidenziare quattro tipi di tumori:
• Piatto: variante più aggressiva, che si vede male se non è preso di profilo dal fascio di radiazioni.
Progressivamente infiltra tutta la parete adagiandovisi con un aspetto caratteristico come una sella sul
dorso di un cavallo. Spesso coesiste ulcerazione, e tende a trasformarsi nella variante anulare
• Anulare: infiltra tutta la parete molto in fretta e tende a restringere il lume in maniera marcata; il
passaggio tra la zona sana e quella interessata forma un caratteristico scalino. Raramente si ulcera ed
evolve verso l’ostruzione; è tipico della metà sinistra del colon.
• Carcinoma polipoide: forma più benigna ma più rara. Ha l’aspetto sessile con superficie irregolare, ed è
localizzato soprattutto a destra, dove induce sanguinamento capriccioso.
• Forma scirrosa: simile alla linite plastica dello stomaco, dove induce estese stenosi di lunghi tratti del
colon, con virulenza elevata. Interessa soprattutto la sottomucosa, dove si forma la reazione
desmoplastica, e quindi il passaggio fra zona sana e zona interessata si coglie male.
Ruolo dell’imaging tomografico nel tumore primario e nelle recidive locali
Le tecniche a disposizione sono:
• TC
• RM
• Ecografia transrettale
• Tomografia ad emissione di positroni (PET)
• Fluorescenza con AB monoclonali
•
• Mancano gli studi per capire quali di queste sia migliore.
• I dati prognostici per la sopravvivenza a 5 anni si basano principalmente sulla presenza di interessamento
linfonodale e sulla fissazione maligna del tumore attraverso l’invasione della parete.
•
• → Tecniche di imaging e stadiazione preoperatoria
• TC: assieme all’ecografia transrettale ottiene una buona valutazione. Il suo limite però è la difficoltà di
individuare interessamenti linfonodali precocemente, e quindi la sua sensibilità complessiva oscilla dal
41 al 64%, con una specificità però elevata; l’accuratezza della TC è tuttavia aumentata di molto con
l’uso di tecniche partciolari, del contrasto con aria, della collocazione del paziente in posizione prona.
Mencaroni Spartaco
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
113
RM: attualmente sembra avere gli stessi limiti della TC, alla quale è paragonabile. Ottiene però risultati
speciali per quanto riguarda l’invasione diretta dei tessuti ossei e muscolari. L’estensione nella parete
intestinale e l’interessamento dei linfonodi sono però punti deboli.
Ecografia: la procedura transrettale ha il vantaggio di distinguere gli strati normali della parete
intestinale e visualizzare la distruzione di essi da parte del tumore. La sensibilità di questa tecnica nel
valutare l’infiltrazione è del 50-57% (contro il 25-30% della TC). Il suo limite è la grande dipendenza
dall’operatore, che può far oscillare di molto la sensibilità della metodica.
Conclusione: la TC non dovrebbe essere utilizzata per la valutazione dei tumori primari, ma soltanto in
quei casi di sospetto di neoplasia diffusa. Può invece essere usata per guidare un agoaspirato delle
localizzazioni sospette. L’ecografia è utile per identificare i linfonodi regionali, ma non può predirne
l’istologia, e quindi è comunque necessaria una biopsia.
→ Tecniche di imaging e recidive locali
Sia la TC che la RM sono ampiamente impiegate, in quanto entrambe sono in grado di rilevare recidive
nel momento in cui il CEA è ancora basso e la sintomatologia assente.
Pure, per il loro elevato costo, si cerca di trovare una metodica di screening (come la colonscopia) che
possa avere una sensibilità paragonabile tenendo conto del fatto che lo staging preoperatorio e il tipo di
intervento effettuato possono essere correlati con la probabilità di recidiva.
TC: sensibilità dal 69 all’88%; la maggior parte degli errori derivano dalla difficoltà di individuare
recidive nel grasso pericolico o perirettale e di valutare l’interessamento dei linfonodi. Falsi negativi
possono essere legati alla possibilità che nel postoperatorio si formi una massa di tessuto di granulazione
facilmente scambiato per una recidiva locale, che può essere normale fino a 24 mesi dopo l’intervento.
Di solito la massa viene identificata a 2-4 mesi dall’intervento: in assenza di elevazione del CEA e di
sintomi, si attende e si osserva una diminuzione successiva delle dimensioni della massa. Può essere
opportuna una biopsia.
RM: può distinguere la fibrosi (basso segnale T1 e 2) dalla recidiva (alto segnale in T2). Tuttavia questi
studi sono ancora incerti, soprattutto perché la presenza di liquidi nel tessuto di granulazione e la necrosi
prodotta dall’irradiazione possono rendere il tessuto fibroso molto simile alla recidiva. Inoltre sembra
che la sensibilità della RM in questa discriminazione sia influenzata dalla sede del tumore. Sebbene però
non sia efficace nel dimostrarne la natura, la RM riesce a descrivere efficacemente la localizzazione e i
limiti delle masse.
La recidiva locale è il tipo più comune di patologia che si verifica dopo l’intervento per tumore del retto
o del colon. Poiché la recidiva può essere efficacemente trattata se diagnosticata precocemente, è
importante continuare il controllo dopo la rimozione del tumore originario.
In questo l’utilità della semeiotica clinica e del dosaggio del CEA è scarsa. La TC è importante, anche se
la sua capacità di discriminare la fibrosi dalla recidiva è nulla, e deve essere affiancata dalla RM che è
migliore. Inoltre la RM è importante per differenziare altre masse pelviche o tumori di natura istologica
diversa dalle recidive di carcinoma rettale.
Studi recenti hanno comunque dimostrato la difficoltà di rapportare la differenza di intensità di segnale in
T2 nel predire la malignità o benignità della lesione: si può affermare con certezza che bassa intensità
indica una notevole componente fibrosa, alta intensità una ipercellularità (benigna o maligna) o
edema.
Inoltre la presenza di tessuto fibroso può essere una risposta dell’organismo all’intervento e al
trattamento così come una recidiva o addirittura un tumore di natura diversa, data l’elevata frequenza con
cui alla neoplasia fa seguito una reazione desmoplastica.
Si ribadisce quindi che le tecniche di imaging possono essere molto utili nel definire l’estensione della
massa e anche osservarne le modificazioni nel tempo, ma per la diagnosi definitiva di natura è
indispensabile la biopsia in laparoscopia.
Compiti secondari della diagnosi radiologica
Dopo l’identificazione del tumore, si deve:
• Escludere localizzazioni multiple o secondarie non visibili endoscopicamente
http://www.hackmed.org
•
•
•
[email protected] 114
Mencaroni Spartaco
Definire l’estensione in altezza e circonferenza del tumore.
Studiare la plasticità della zona di impianto, in relazione al gradi di penetrazione del tumore nella parete.
Stabilire l’estensione extraperitoneale del cancro.
Terapia chirurgica
Vi sono principalmente due tipi di intervento:
• RAP: resezione addomino-peritoneale
• RAR: resezione anteriore del retto
•
• La prima forma, demolitiva, consiste nell’asportazione di tutto il retto e formazione di una stomia
permanente, mentre la seconda permette la rianastomosi fra i due monconi di retto. E’ ovviamente
possibile eseguire il secondo tipo di intervento solo quando il tumore non è eccessivamente esteso, ma
anche quando:
• la neoplasia non si trova troppo vicino allo sfintere anale (limite 7-8 cm in quanto il margine di sezione
deve essere almeno 5 cm al di sotto del tumore);
• a questa distanza limite, il tumore non deve superare il 50% di estensione circonferenziale;
• il grado della neoplasia è basso
•
• Fra 7 e 12 cm dall’ano, il tumore può permettere la conservazione dello sfintere a seconda dei parametri
indicati. Al di sopra dei 12 cm, la conservazione dello sfintere è sempre possibile.
• In ogni caso va asportato anche il mesoretto perché costituisce un punto di deposito delle cellule tumorali
per via della sua ricchezza in linfatici. La sua asportazione completa diminuisce nettamente la frequenza
di recidive.
•
• Alcune tecniche chirurgiche che hanno migliorato molto la prognosi dell’intervento:
• uso di cucitrici meccaniche: nella RAR hanno permesso la conservazione dello sfintere nei tumori in sedi
sempre più basse
• Resezione del mesoretto
• Mobilizzazione dell’intestino tenue (con reticelle che lo tengono sollevato rispetto alla pelvi) per evitarne
l’irradiazione
• Anastomosi colon-anale.
•
• Dopo intervento chirurgico in elezione, le recidive allo stadio I sono minori del 5%, ma allo stadio II
salgono già a 30, per arrivare a 70 nel III.
• La ripresa della malattia dipende anche da:
• Stadio avanzato e metastasi linfonodali
• Grado di differenziazione
• Invasione di linfatici
• Margini di resezione longitudinale: si tratta della lunghezza di mucosa non visibilmente infiltrata da
tumore che si è resecato con l’intervento. Assume una particolare importanza il margine distale, che se è
maggiore di 3 cm corrisponde ad una probabilità di recidive del 12%, se è di 2 cm al 22%. Se il margine
distale è minore di 3 cm si fa la radioterapia
• Margine di resezione radiale: spessore della parete non interessato dal tumore. Di norma deve essere
almeno di 0,5-0,9 mm per indicare un ragionevole successo nell’intervento.
•
• Indicazioni alla radioterapia
• Movimento dei markers, caratteristiche genetiche delle cellule
• Resezione parziale del mesoretto
• Margine di resezione < 3cm
• Invasione dei linfatici
• Stadio II
• Adenocarcinomi poco differenziati
•
Mencaroni Spartaco
•
•
•
115
L’associazione della radio con la chemioterapia sistemica con 5-fluorouracile migliora la sopravvivenza
e diminuisce le recidive. Oggi si usa anche il TP11, il cisplatino e altri farmaci. Si chiamano adiuvanti i
farmaci usati nel postoperatorio, neoadiuvanti i farmaci usati nel preoperatorio; questi ultimi possono
avere un importante effetto nella riduzione della dimensione del tumore, che così può risultare operabile.
Una controindicazione alla radio postoperatoria è la rigidità del peritoneo conseguente all’intervento: se
questo blocca il tenue completamente nello scavo pelvico non si può eseguire il trattamento, se il blocco
è parziale sì. Nel preoperatorio questi esiti cicatriziali non sono presenti e l’intestino può essere tolto
dallo scavo pelvico senza problemi utilizzando apposite retine.
http://www.hackmed.org
CAP 9 ADDOME
[email protected] 116
Mencaroni Spartaco
ACUTO
9.1 DIAGNOSI RADIOLOGICA
Clinica e patogenesi
Si tratta di un quadro fra i più difficili da interpretare per la brevità dei tempi diagnostici a disposizione, e per
la grande sovrapposizione di sintomi e segni associati variamente al dolore addominale. E’ perciò importante
discriminare immediatamente quei segni che possono essere indicativi di un quadro chirurgico:
• Disturbi della peristalsi
• Rigidità della parete addominale
• Segni di shock
• Presenza di ematemesi e melena
• Disturbi urinari e digestivi
• Alterazioni dell’equilibrio acido base e idro-elettrolitico
• Le cause di addome acuto sono innumerevoli. L’inutilità di impararle a pappagallo è purtroppo un
concetto di recente acquisizione ancora poco accreditato, e quindi risulta indispensabile compilare (e
memorizzare!) la seguente lista della spesa.
•
• Infiammazione peritoneale
• Contaminazione batterica
• Forme primitive
• Forme secondarie
• Appendicite
• Colecistopatie
• Malattie infiammatorie della pelvi
• Perforazioni intestinali
• Irritazione chimica
• Ulcera peptica perforata
• Pancreatite
•
• Sindromi occlusive intestinali
• Meccaniche
• Dinamiche
•
• Sindromi vascolari
• Embolia o trombosi
• ischemia o infarto intestinale
• Rotture vascolari
• Occlusione da compressione o torsione
• Ematomi spontanei da diatesi emorragica
•
• sindromi di origine retroperitoneale
• Pancreatiti acute e croniche
• Ascessi retroperitoneali
• Fissurazioni o rotture di aneurismi aortici
• Patologia ginecologica
• Patologia urologica
•
• Altre condizioni chirurgiche
• Sindromi traumatiche
• Sindromi iatrogene postoperatorie
• Dolore irradiato da zone extra addominali
•
Mencaroni Spartaco
117
• Sindromi non chirurgiche (simulanti un addome acuto, diagnosi differenziale)
• Cause metaboliche esogene
• Colica saturnina
• Morso da “vedova nera”
• Cause metaboliche endogene
• Uremia
• Chetoacidosi diabetica
• Porfiria
• Fattori allergici
• Cause neurologiche funzionali
• Cause neurologiche organiche
• Tabe dorsale
• Herpes zoster
•
Il dolore addominale può essere distinto in rapporto alla sede di insorgenza, in:
• Viscerale: origina dai visceri, in seguito a distensione, stiramento, spasmo, infiammazione e ischemia: è
vago e mal definito, dal lato del viscere pari o nella linea mediana se dispari. Quello importante è
accompagnato da sintomi del SNA.
• Parietale: è derivato dal peritoneo o dalla sierosa epatica, ha localizzazione piuttosto precisa, carattere
acuto e puntorio, e spesso è accompagnato da rigidità della parete addominale interessata. Si accentua
con la tosse e i movimenti, è scatenato dalla palpazione e diminuisce con la contrazione muscolare.
• Superficiale: riferito alla parete addominale, stiramento o coinvolgimento diretto dei muscoli o
infiammazione della cute. Insorge improvvisamente, viene avvertito come poco profondo ed è continuo.
La contrazione muscolare lo esacerba
• Riferito: dovuto ad innervazione crociata di organi differenti, viene avvertito lontano dall’organo
interessato. Le aree di riferimento (di Head) dei singoli organi possono essere a volte indicative.
Diagnosi pre-radiologica
E’ importante perché permette di individuare fattori di urgenza che costringono ad escludere una accurata
indagine radiologica passando subito alla terapia.
Anamnesi
Con le sue classiche informazioni su abitudini, interventi chirurgici, patologie associate. Particolare rilievo
alle caratteristiche del dolore e ai sintomi associati. Come detto, la sede del dolore è importante:
• Addome superiore → stomaco, duodeno, pancreas, milza, fegato, vie biliari
• Addome inferiore → colon e genitali
• Regione periombelicale → intestino tenue
• Regione presacrale → retto
• Ipocondio DX → fegato o vie biliari
• Fossa iliaca DX → appendicite o Crohn, malattie ginecologiche
• Ipocondrio SX → stomaco, milza, distensione della flessura splenica del colon
• Fossa iliaca di SX → diverticolite o malattie ginecologiche
Alcune zone di Head caratteristiche sono la scapola DX nelle coliche biliari, il dorso nelle pancreatiti acute,
l’inguine nella colica ureterale, la spalla nell’irritazione diaframmatiche
L’esordio improvviso è in genere legato alla perforazione o rottura di un viscere o alla occlusione, mentre un
esordio graduale indica un progressiva distensione di un organo cavo o l’irritazione peritoneale.
La durata del dolore può dare anche delle informazioni: minuti o secondi sono spasmi di organi cavi, le
coliche si valutano in ore, la pancreatite dura alcuni giorni. L’assunzione di cibo migliora il dolore
dell’ulcera peptica.
Nella peritonite il tipo e la quantità di sostanza che provoca dolore ne condiziona l’intensità:
• Sostanza acida provoca in piccola quantità molto più dolore che un grande quantitativo di sostanza a pH
neutro
http://www.hackmed.org
•
•
[email protected] 118
Mencaroni Spartaco
Il succo pancreatico provoca dolore molto più vivo della bile
Sangue e urina provocano poca irritazione.
Esame obiettivo
Importante la palpazione. Dolore provocato, rigidità, presenza di tumefazione, rumori peristaltici assenti o
anomali, soffi vascolari possono essere molto indicativi sulla diagnosi.
L’esplorazione rettale o vaginale possono aiutare a evidenziare ascesi pelvici. Importante anche l’esame
obiettivo toracico per evidenziare alterazioni della pleura e del torace secondarie ad alterazioni addominali.
Paracentesi
Con questo lavaggio si può evidenziare in maniera molto rapida la diagnosi di natura dei versamenti
peritoneali. Deve essere usata soltanto quando le condizioni sono gravi.
Le patologie che in genere sono così urgenti da non consentire di effettuare una diagnosi radiologica prima
di intervenire sono l’emoperitoneo e la rottura di aneurisma aortico.
Diagnosi radiologica
Rx torace standard
Si esegue per abitudine assieme all’RX diretta addome allo scopo di evidenziare processi polmonari
conseguenti a patologie addominali e identificare cause pleuriche o pericardiche che possono essere
responsabili direttamente del dolore addominale.
In previsione dell’intervento chirurgico, inoltre, questo esame è sempre richiesto dall’anestesista.
RX diretta addome
In quasi tutte le situazioni è l’esame di primo livello, in ortostasi e decubito supino per poter visualizzare aria
libera sottodiaframmatica o nel peritoneo e livelli idroaerei. Se il paziente non riesce a stare in piedi si esegue
in decubito laterale sinistro.
Nel bambino si fanno a volte in ortostasi capovolta.
Se la situazione clinica non è urgente, si può ripetere nel tempo l’esame per monitorare ad esempio quadri di
distensione intestinale.
Alcune indicazioni dell’esame RX possono essere conclusive ai fini della diagnosi, come la presenza di aria
libera (perforazione), o i livelli idroaerei a “scala a pioli” (occlusione intestinale meccanica), o la distensione
intestinale diffusa senza livelli (occlusione intestinale paralitica).
Spesso l’esame RX può essere orientativo nei confronti della diagnosi, ma sono comunque necessarie
indagini di secondo livello; sono queste la maggior parte delle evenienze. Infine, anche se l’esame RX risulta
negativo, questo non permette di escludere alcune patologie anche gravi.
Radioscopia
Limitato uso nelle condizioni in cui sia necessario visualizzare la motilità degli emidiaframmi o la peristalsi
intestinale.
Ecografia
Tecnica rapida e non invasiva con buona sensibilità. I limiti sono la dipendenza dall’operatore e la presenza
di ostacoli tecnici che si verificano durante l’addome acuto (urgenza, meteorismo, scarsa collaborazione,
presenza di cicatrici chirurgiche o suture).
Nelle patologie epatiche e biliari è altamente affidabile, così come per la visualizzazione diretta di milza, reni,
vescica e genitali. Utile pure per la ricerca di ascessi e versamenti liberi del peritoneo.
Pancreas e aorta addominale (specie in pazienti obesi e in presenza di meteorismo) si vedono male.
Importante infine per l’esecuzione di manovre ecoguidate.
TC
Permette una analisi dettagliata degli organi e dei loro contorni, oltre che delle strutture vascolari; ottima
anche la valutazione delle anse intestinali dopo la somministrazione di mezzo di contrasto, quando possibile.
Ha una migliore accuratezza rispetto all’RX e all’ecografia nella patologia pancreatica, traumi addominali,
lesioni vascolari e flogistiche.
Mencaroni Spartaco
119
RX del tubo digerente
Clisma opaco, clisma a DC, esofagogramma.
Indicazioni allo studio dell’apparato digerente con queste metodiche sono:
• Sindromi occlusive con sospetta invaginazione o volvolo
• Occlusioni basse per identificare la sede della stenosi
• Traumi chiusi dell’addome se si sospetta una rottura nel retroperitoneo o con peritoneo tamponante
Generalmente l’esame con mezzo di contrasto si fa in elezione, all’esaurimento della fase acuta per accertare
le cause di episodi di occlusione, melena, sanguinamento alto eccetera. Il mezzo di contrasto è normalmente
baritato, ma in caso di sospetta perforazione o fistola si usa quello iodato solubile.
Nel colon si usa il clisma a DC, che è controindicato soltanto in caso di perforazione (in caso di fistola fra
colon e peritoneo si usa il mezzo di contrasto iodato). Nella ricerca gastrocolica il clisma DC è l’esame di
elezione.
Urografia
In caso di colica renale l’ecografia è l’esame di prima istanza, l’urografia si fa solo nella fase di remissione
clinica, con normalizzazione della funzionalità renale.
Nei traumi con sospetta lesione renale e vie urinarie è più indicata la TC
Angiografia
Insostituibile nelle lesioni vascolari (emorragie o ischemie intestinali) con ruolo sia diagnostico che
terapeutico per la possibilità di embolizzare le arterie in sede di emorragia.
Per aneurismi e dissezione aortica è meglio la TC
ERCP
La colangiopancreatografia retrograda endoscopica fornisce una accurata panoramica delle vie biliari
dimostrando chiaramente la sede di ostruzione e spesso identificandone la causa. Permette di eseguire una
sfinterotomia decompressiva, rimozione di calcoli e se necessario il posizionamento di stent e di sondini
nasobiliari per alleviare i sintomi.
Linfografia
Solo nel caso di sospetto chiloperitoneo.
9.2 L’ESAME RADIOLOGICO NELLE VARIE CAUSE DI ADDOME ACUTO
PERITONITE ACUTA
Si tratta in genere di forme secondarie a sindormi:
• Appendicolari
• Biliari
• Vascolari
• Ginecologiche
• Perforative
• Insorte come complicanza di interventi chirurgici addominali
Talvolta esordisce in forma circoscritta poi evolve in forma diffusa.
Peritonite acuta in generale
Dolore addominale diffuso, contrattura lignea della parete addominale, tachipnea superficiale, tachicardia,
segni di shock dominano il quadro clinico.
La sintomatologia clinica spesso è piuttosto specifica per una causa, e l’esame RX ha un ruolo di conferma.
Nei quadri conclamati all’RX addome compare un quadro di ileo paralitico:
• Anse distese
• Ispessimento della parete e delle valvole conniventi (edema)
• Distensione del colon
• Livelli idroaerei piccoli, rari e tardivi
http://www.hackmed.org
[email protected] 120
Mencaroni Spartaco
Segni di versamento peritoneale diffuso possono essere rivelati anche all’RX come una opacità diffusa, mal
definibile, con le anse intestinali raccolte al centro dell’addome e dissociate fra di loro dall’essudato che si
forma fra di loro (a differenza dell’emoperitoneo in cui il sangue circonda le anse ma non penetra fra di esse).
I margini dei muscoli parietali ai margini dell’addome sono scarsamente visibili in presenza di versamento
peritoneale.
Se la peritonite esordisce in forma localizzata (ascesso localizzato), si può evidenziare con l’esame diretto
addome:
• Opacità localizzata con dislocazione dei visceri vicini
• Raccolta gassosa extraintestinale
• Fissità al variare del decubito di organi normalmente mobili
• Scarsa delimitazione di organi ben definibili nei soggetti normali
• Ileo localizzato ad una ansa (ansa sentinella).
• Scarsa mobilità di un emidiaframma alla radioscopia
Ecografia e TC sono molto sensibili nel localizzare queste lesioni, che appaiono come aree disomogene di
densità liquida, con eventuale presenza di piccole raccolte gassose, e riescono ad evidenziarne esattamente i
margini e i rapporti con gli organi vicini.
Peritonite biliare
Spesso dovuta ad una patologia infiammatoria della colecisti (nel 90-95% dei casi da calcoli). All’esame
diretto si evidenzia una distensione meteorica soprattutto nel colon prossimale, del trasverso e delle anse del
tenue in vicinanza del coledoco, con abbondante essudato endoperitoneale e bile.
I segni di semeiotica radiologica che permettono la diagnosi sono:
• Presenza di calcoli radiopachi nel coledoco o nelle vie extraepatiche
• Colecisti aumentata di volume, più opaca del normale perché piena di bile e calcoli
• Dimostrazione di aerobilia (infrequente) per incontinenza della papilla o fistola
Le raccolte fluide si diffondono lungo la doccia parieto-colica di destra fino alla pelvi.
L’esame di elezione è l’ecografia, la TC solo nei casi dubbi. Nel caso di colica con ittero ostruttivo è
giustificata la ERCP, che ha valore sia diagnostico che terapeutico (sfinterotomia decompressiva, rimozione
di calcoli).
In elezione, prima dell’intervento chirurgico sulle vie biliari se ne può fare uno studio molto accurato con la
colangio RM, che esclude calcoli nella via biliare o stenosi.
Peritonite appendicolare
Nella terza decade di vita è la causa più frequente di addome acuto; l’esame RX serve ad identificare la causa
appendicolare di patologia, ed escludere eventuali complicazioni (ascesso, fistola, rottura)
All’RX standard con paziente in posizione eretta segni caratteristici sono:
• Distensione gassosa del cieco con possibile livello idroaereo e delle ultime anse dell’ileo (anse sentinella
per appendicite acuta)
• Rilievo di appendicite opacata, pluristratificata, localizzata in fossa iliaca di destra (appendicolite).
• Visualizzazione di gas nel lume appendicolare, con eventuale livello idroaereo.
Con le tecniche di ecografia ad alta frequenza l’appendicite risulta visibile solo se infiammata; in questa
situazione il suo lume non risulta più virtuale, la parete si ispessisce con aspetto “a bersaglio”, la peristalsi è
assente.
E’ frequente la dimostrazione di raccolte attorno all’appendicite, ipoecogene; in corso di un vero e proprio
ascesso periappendicolare l’esame diretto evidenzia una opacità con livello idroaereo in fossa iliaca di destra.
L’ascesso può essere intra od extraperitoneale in relazione alla sede dell’appendice, e in alcuni casi la
raccolta può scivolare lungo le docce parietocoliche fino in sede pelvica.
Tecniche di secondo livello come la TC possono essere impiegate nella definizione di ascessi e raccolte
circostanti.
Peritonite da perforazione intestinale
Mencaroni Spartaco
121
Complicanza di molte situazioni, dall’ulcera gastrica ai diverticoli, alle neoplasie, alle deiscenze di cicatrici,
ai traumi.
La perforazione determina pneumoperitoneo e successivamente un versamento libero nella cavità
addominale.
L’esame iniziale è l’RX standard addome in decubito laterale SX in ortostasi che mette in evidenza la “falce
diaframmatica” che si forma anche in presenza di piccole quantità di aria.
Un segno di aria libera è la visualizzazione della parete di anse intestinali; invece la presenza di aria nella
cavità epiploica è un segno di perforazione gastrica.
L’aria libera può non formarsi se la perforazione avviene in una zona coperta da aderenze peritoneali, e
allora si identificheranno immagini gassose in sede atipica, con comportamento anomalo al variare del
decubito.
Il clisma con piccola quantità di mezzo di contrasto iodato (non bario!) identificano la sede e la causa della
perforazione; la TC dimostra la presenza di raccolte gassose e liquide anche in caso di negatività all’esame
RX diretto. Nel sospetto di perforazione coperta la TC è importante.
Peritonite da torsione intestinale
Sono situazioni rare. Si tratta in genere della torsione della colecisti, del grande omento, della milza. In
queste evenienze l’esame dell’addome non fornisce elementi decisivi per la diagnosi, e si può identificare il
quadro soltanto con la laparotomia esplorativa.
OCCLUSIONE INTESTINALE
In caso di sospetto di ileo assume una grande importanza l’esame diretto dell’addome in ortostasi (se
possibile) ed eventualmente (a seconda della gravità del quadro clinico) con mezzo di contrasto.
Questo esame permette di riconoscere la natura dell’ileo, la localizzazione dell’eventuale ostruzione (ileo
meccanico) e di individuare le complicanze.
In casi fortunati la causa di ileo è possibile anche individuarla con il semplice esame radiologico.
Il ruolo dell’esame diagnostico radiologico è principalmente quello di distinguere le forme dinamiche (che
spesso non necessitano di intervento chirurgico), da quelle meccaniche.
Ileo meccanico
Può essere causato da ostacoli:
• Intraluminari
• Intramurali
• Extraluminari
C’è una lunga lista di cause possibili:
• Aderenze (congenite, post chirurgiche, postflogistiche)
• Incarceramento di un sacco erniario
• Volvolo
• Invaginazione
• Neoplasie stenosanti intestinali e non
• Stenosi da IBD e diverticolite
• Fecalomi
• Parassitosi intestinale
• Calcoli biliari di dimensioni grandi che transitano nel tenue tramite una fistola
Il quadro dipende dalla sede e dall’entità dell’occlusione: c’è esordio improvviso nelle occlusioni alte,
subdolo in quelle coliche.
Il dolore è crampiforme, con vomito (fecale o biliare a seconda della sede) precoce nelle forme alte, alvo
chiuso a feci e gas, disidratazione, turbe elettrolitiche e segni di shock.
L’esame RX diretto permette spesso di identificare il tipo di occlusione e a volte anche la sede.
Le anse a monte appaiono dilatate e in preda ad una forte peristalsi (in fase iniziale, poi l’ileo dinamico ha
una componente paralitica). Tendono ad incurvarsi ad U rovesciata (concavità verso il basso), e presentano
naturalmente vistosi livelli idroaerei che si dispongono come i pioli di una scala.
La linea di opacità attorno alla parete è ispessita, e così pure le anse possono apparire solcate da una serie di
strisce opache che rappresentano la parete ispessita.
http://www.hackmed.org
[email protected] 122
Mencaroni Spartaco
Le valvole conniventi sono ben rappresentate, spesso ispessite ed edematose.
Se l’occlusione non è molto recente e non si associa ileo paralitico da ischemia, il colon sarà del tutto privo
di aria e quindi si osserva la scomparsa della cornice colica.
Alcune forme di occlusione si associano ad una componente vascolare (volvolo, ernia incarcerata,
invaginazione o malrotazione). In queste forme è immediato l’instaurarsi di una sofferenza vascolare con i
seguenti segni:
• Scarsi livelli idroaerei (vomito precoce)
• Assenza di mobilità nei vari decubiti dell’ansa interessata
• Possibile identificazione di area opaca per ispessimento da stasi venosa della parete
• Valvole conniventi non ispessite o appiattite
Se si associa ischemia e gangrena, la parete appare intensamente dilatata e a margini sfumati: si può avere
anche una notevole quantità di essudato peritoneale fra le anse distese.
Dal punto di vista topografico, possono distinguersi occlusioni alte, medie e basse. A seconda della sede
dell’occlusione i tratti interessati sono diversi.
• Occlusione del piloro o duodeno: determina distensione gastrica con vomito precoce
• Ostruzione del piccolo intestino: dilatazione isolata del tenue con scarso contenuto meteorico
• Occlusione del grosso intestino: se la valvola è continente, si ha una distensione del solo colon, che può
avere livelli idroaerei. La dilatazione simultanea di tenue e colon si associa ad una incontinenza della
valvola.
L’esame RX con bario è controindicato nelle ostruzioni meccaniche, e semmai si somministra mezzo di
contrasto idrosolubile (ma solo se l’ostruzione è alta, altrimenti il mezzo di contrasto si diluisce troppo per
evidenziare l’ostruzione).
Viceversa, il clisma opaco si può usare nelle ostruzioni del colon, e in caso di volvolo o invaginazione, il
riempimento con sostanza opaca e densa può favorire il riposizionamento del colon; il clisma opaco è però
controindicato in caso di perforazione o fistola.
Ileo paralitico
Origina da una insufficienza della normale peristalsi, spesso causata da infiammazioni peritoneali e
retroperitoneali, con paresi neurogena riflessa. Deriva da:
• Ischemia intestinale
• Ematomi retroperitoneali
• Precedenti interventi chirurgici adominali
• Affezioni renali o disturbi metabolici
Clinicamente si ha una marcata distensione addominale e malessere generale.
All’RX in genere si differenzia male dall’ileo meccanico nelle fasi iniziali. Una caratteristica è che la
distensione interessa uniformemente il colon e il tenue, e non è mai vistosa.
I livelli idroaerei possono essere presenti, ma non si dispongono come una scala a pioli; sono scarsi e tardivi,
e soprattutto immobili.
La disposizione delle anse è disordinata (non a canne d’organo come nell’ileo meccanico) e le pareti sono
scarsamente ispessiti.
In caso di flogosi acuta di un organo peritoneale (colecisti e pancreas soprattutto) i sintomi e i segni
radiologici possono essere limitate ad una o più anse vicine (ansa sentinella).
Alla radioscopia la peristalsi risulta del tutto assente o molto ridotta.
A volte la TC può assumere rande importanza, soprattutto per quel che riguarda la dimostrazione della causa
meccanica di ostruzione; la dilatazione delle anse e le alterazioni della peristalsi possono essere ben
documentate anche all’ecografia.
MALATTIE VASCOLARI DELL’INTESTINO
Il dolore di tutte le forme è grave e diffuso, ad origine improvvisa (anche se un dolore addominale meno
intenso, al fianco o ai genitali, può essere un segno di rottura di aneurisma dell’aorta addominale).
Forme da embolia o trombosi
Mencaroni Spartaco
123
Assenza di segni di peritonite e presenza di dolore diffuso, da parecchie ore, a tutto l’addome: questo può
essere indicativo di una ischemia mesenterica non occlusiva, da molteplici cause:
• Vasocostrizione
• Ipovolemia
• Ridotta gittata cardiaca
• Ipotensione arteriosa
Oppure di una trombosi venosa. Frequenti sono il vomito, il reperto di massa addominale dolente (anse
ischemiche) e l’emissione di feci poltacee miste a sangue, seguita dalla chiusura dell’alvo (ileo paralitico
sopraggiunto).
Spesso l’episodio acuto è preceduto da claudicatio intermittensIschemia mesenterica
L’esame radiologico diretto dell’addome è l’indagine preliminare che può dimostrare un quadro di ileo
paralitico generalizzato (a volte esteso anche allo stomaco), con perfetta immobilità delle anse. Quelle
interessate dalla lesione possono anche presentare ispessimento della parete con riduzione del lume (che
contiene scarso gas e ha aspetto frastagliato).
Piccole raccolte aeree lineari, nello spessore della parete (fenomeni di necrosi) sono un segno abbastanza
indicativo ma raro.
Spesso è presente concomitante versamento pleurico alle basi.
L’esame risolutivo è l’arteriografia che dimostra direttamente la sede dell’ostruzione e le condizioni di tutti
il circolo mesenterico.
Emorragie acute intestinali
Possono essere causate da:
• Ulcera peptica
• Gastrite erosiva
• Varici
• Traumi
• Neoplasie
• Diverticoli
In RX addome non si vede niente. Le tecniche contrastografiche e l’endoscopia dimostrano spesso la sede e
la causa del sanguinamento.
Decisivo il ruolo dell’arteriografia, che ha anche la possibilità di effettuare direttamente l’embolizzazione
dei vasi interessati.
Lesioni acute dell’aorta addominale
Fissurazione o rottura di aneurismi, dissezioni aortiche. La TC fornisce le informazioni fondamentali: la
diagnosi radiologica ha lo scopo di identificare la natura dell’addome acuto, confermare l’eventuale necessità
di un intervento di urgenza, fornire limiti importanti per l’approccio chirurgico, come i limiti topografici,
l’entità del sanguinamento, le condizioni degli organi addominali.
Si può fare diagnosi con l’ecografia solo in alcuni casi: normalmente l’ecografia visualizza l’aorta, ma la
presenza di una lesione acuta provoca ileo paralitico e il meteorismo impedisce la visualizzazione del vaso.
L’esame diretto addome, spesso, viene fatto perché non sempre il quadro clinico è drammatico (ad esempio
in un aneurisma tamponato), ma fornisce solo dati indiretti.
Nel sospetto di dissezione aortica è molto indicata la RM, con l’aggiunta delle sequenze angiografiche
(angio-RM) che visualizzano efficacemente i vasi sanguigni. Il limite è il tempo lungo di esecuzione.
Ematoma retroperitoneale spontaneo
Frequente nei pazienti in terapia anticoagulante; in genere lo spandimento ematico avviene per rottura di
piccoli vasi in genere nel contesto di muscoli come lo psoas,e la diagnosi differenziale è ottenuta con la TC
che fornisce una definizione precisa della localizzazione e dell’entità dell’emorragia.
http://www.hackmed.org
[email protected] 124
Mencaroni Spartaco
PANCREATITI ACUTE O CRONICHE RIACUTIZZATE
Frequente l’addome acuto da infiammazione del pancreas, che nell’80% dei casi è scatenato da alcolismo o
da patologia delle vie biliari.
Il quadro clinico e la prognosi sono determinate dall’entità del danno.
Si tende comunque ad avere un interessamento dei tessuti attorno all’organo, soprattutto nelle forme
necrotiche emorragiche.
Si avranno spesso raccolte flogistiche ed ematiche nel retro peritoneo, nella cavità degli epiploon o nel
peritoneo stesso, trombosi vascolari e versamenti pleurici a distanza.
La diagnosi differenziale si impone con:
• Perforazione di ulcera peptica
• Infarto mesenterico
• Ostruzione intestinale con strozzamento
• Fissurazione di aneurisma dell’aorta addominale
La diagnostica per immagini serve a confermare la diagnosi, fornire elementi di diagnosi differenziale e
valutare l’entità del danno, oltre localizzare e definire raccolte flogistiche circostanti.
RX addome
Poco specifico, dimostra un ileo dinamico localizzato in sede superiore sinistra o al centro dell’addome. Il
duodeno, le prime anse del digiuno sono in genere le sentinelle. Caratteristica anche la brusca interruzione
della distensione del colon trasverso in regione paravetrebrale specie a sinistra.
In corrispondenza della loggia pancreatica ci può essere un relativo aumento dell’opacità e, in caso di forme
croniche, calcificazioni. Tipica anche la scomparsa e la scarsa definizione dei reni e dei muscoli psoas per
l’estensione del processo nei dintorni della ghiandola.
Le pancreatiti da calcolosi presentano i segni della calcolosi biliare.
RX torace
Evidenzia il versamento pleurico basale con addensamento parenchimale nei campi polmonari inferiori, più
frequente a sinistra.
RX addome con mezzo di contrasto solubile
In fase acuta può dimostrare:
• Distensione della C duodenale con pliche ispessite; il profilo mediale può essere improntato dalla testa
del pancreas ingrandita.
• Segno del 3 invertito per edema della papilla
• Ristagno del mezzo di contrasto in duodeno
• Impronta nella parete gastrica posteriore
Ecografia
Esame di seconda istanza. Ruolo limitato per difficile visualizzazione dell’organo. Non riesce a definire con
esattezza la diffusione della raccolta flogistica.
E’ invece accurata la valutazione di una eventuale calcolosi biliare e di versamenti intraperitoneali. Nel caso
in cui il pancreas sia esplorabile, l’ecografia può distinguere le forme edematose e necrotico-emorragiche.
Criteri distintivi ecografici fra pancreatite edematosa e necrotico emorragica
FORMA EDEMATOSA
FORMA NECROTICO EMORRAGICA
• Aumento volumetrico non uniforme
• Aumento volumetrico globale
• Ecostruttura disomogenea
• Aspetto ipoecogeno omogeneo
• Contorni irregolari
• Contorni netti
• Raccolte liquide peripancreatiche
TC
E’ l’esame di elezione nel sospetto di pancreatite acuta. I suoi pregi sono:
• Differenzia le forme edematose da quelle necrotizzanti sempre
• Valuta con precisione le aree di colliquazione
• Stima la porzione sana residua
Mencaroni Spartaco
•
•
125
Fornisce un bilancio spaziale completo delle raccolte di liquido retro o intraperitoneali
Identifica e descrive con precisione eventuali pseudocisti
INFEZIONI ACUTE EXTRAPERITONEALI
Possono provocare peritonite, e sono secondarie a patologie flogistiche, traumatiche o neoplastiche degli
organi retro o intraperitoneali.
L’iter diagnostico in questi casi è sempre lo stesso:
• Esame diretto addome
• Ecografia
• TC
Generalmente lo spazio pararenale è la regione più comunemente interessata da queste flogosi, in genere
secondarie al Crohn, alla diverticolite o all’appendicite retrocecale.
RX addome
Opacità disomogenea con piccole raccolte gassose, che cancella il profilo dell’angolo epatico a DX e della
milza a SX; dislocazione antero-laterale del colon ascendente o discendente.
Negli ascessi dello spazio pararenale anteriore (derivati da infezioni renali) si dimostra una opacità non
omogenea che cancella il profilo renale, mentre il rene è spesso innalzato e medializzato, poco mobile o
immobile del tutto. La cancellazione del tratto superiore del profilo dello psoas è caratteristica.
Le raccolte dello spazio posteriore invece sono più rare (focolai di osteomielite del rachide, perforazione
del retto o sigma) con segni radiologici significativi:
• Cancellazione della linea del fianco e del tratto inferiore dello psoas
• Spostamento laterale del polo renale inferiore
Ecografia
Buona accuratezza solo nella valutazione delle logge renali
TC
Più completa e precisa, individua con certezza la sede del processo infettivo e le eventuali complicanze.
SINDROMI OSTETRICO-GINECOLOGICHE
Flogosi, emorragie, perforazioni tubariche, torsioni dell’utero o degli annessi possono provocare addome
acuto.
In associazione con esami di laboratorio specifici l’imaning di laboratorio è fondamentale per la diagnosi.
Essenziale è l’ecografia pelvica che spesso inquadra perfettamente le patologie. La TC e la RM hanno un
ruolo di secondo livello (la seconda di più).
SINDROMI UROLOGICHE
La causa più comune di addome acuto è la colica da calcoli ureterali. L’urografia può essere eseguita solo
dopo raffreddamento del quadro clinico. In fase acuta si può effettuare:
• RX diretto addome: presenza e sede di calcoli radiopachi; dimostra anche l’aumento volumetrico di un
rene per idronefrosi
• Ecografia: consente una valutazione precisa del parenchima renale e delle vie escretrici, identifica
calcoli anche non visibili all’RX nei calici e nella pelvi, dimostra dilatazione dell’uretere, permette studio
accurato della vescica
Altra causa di addome acuto sono gli eventi infiammatori del rene (nefriti, ascessi, prionefrosi).
In questi casi la TC è l’esame migliore che permette la valutazione del rene e dei tessuti circostanti
eventualmente interessati dal processo. Deve essere impiegata nei casi in cui l’ecografia non è applicabile.
SINDROMI IATROGENE
Un quadro di dolore addominale con ileo paralitico e vomito è frequente dopo gli interventi chirurgici, e in
genere tende a risolversi da solo.
Temibili complicazioni però sono:
• Emoperitoneo
http://www.hackmed.org
•
•
•
•
[email protected] 126
Mencaroni Spartaco
Peritonite
Dilatazione gastrica acuta
Occlusione intestinale
Ischemia mesenterica
Complicazioni derivate dalla biopsia epatica o renale (in genere emorragie o ematomi) sono ben
identificabili alla TC, che è anche la tecnica di elezione per l’identificazione delle complicazioni infettive
che seguono gli interventi chirurgici.
Gli ematomi addominali dopo posizionamento di cateteri venosi possono essere identificati con l’ecografia, e
meglio ancora con la TC; ecodoppler e angioRM possono valutare il decorso dei vasi vicino alla lesione.
QUADRI NON ADDOMINALI CHE SIMULANO ADDOME ACUTO
Sono diverse patologie:
• Torace:
o Pleura
o Polmoni
o Cuore e grossi vasi
• Malattie del metabolismo:
o Iperlipemia
o Deficit di C1 esterasi
o Febbre mediterranea familiare
o Porfiria
o Colica saturnina
• Lesioni a carico dei nervi sensitivi
o Herpes zoster
o Artrosi che provoca compressione nervosa o radicolare
o Tumori o ernie del disco
o Diabete
o Sifilide
SINDROMI ADDOMINALI IN PEDIATRIA
•
•
•
•
•
•
•
Peritoniti
Peritonite meconiale (calcificazioni diffuse nell’addome)
Invaginazione intestinale (primi 2 anni di vita) con ileo misto; ruolo diagnostico e terapeutico del clisma
opaco
Volvolo del tenue
Ernie
Ileo da meconio (neonati affetti da mucoviscidosi)
Enterite necrotizzante: quadro caratteristico con sottili raccolte gassose nello spessore della parete, per
via della necrosi tissutale (pneumatosi), distensione e livelli idroaerei, aria libera in peritoneo, gas sulla
vena porta (segno sfavorevole)
TRAUMI ADDOMINALI
Il paziente deve essere sottoposto a TC o ad ecografia per escludere lesioni a visceri interni, o emoperitoneo.
L’intervento sarà poi in laparoscopia.
Mencaroni Spartaco
CAP 10 FEGATO, COLECISTI
127
E VIE BILIARI
10.1 ANATOMIA E TECNICHE DI INDAGINE
Dal punto di vista vascolare il fegato può essere diviso in 8 segmenti indipendenti, ognuno dei quali è
avvolto da un singolo peduncolo della glissoniana contenente:
• un ramo della vena porta
• un ramo dell’arteria epatica
• un ramo della via biliare del proprio lato.
Questo è importante dal punto di vista chirurgico per resezioni mirate, ed è importante localizzare ogni
processo focale epatico in uno di questi segmenti.
Essi sono:
• Lobo sinistro:
• Segmento II, laterale superiore (milza)
• Segmento III, laterale inferiore (flessura colica di sx)
• Parte mediana del fegato:
• Segmento I, lobo caudato: posteriormente lungo la linea mediana
• Segmento IV, lobo quadrato: anteriormente lungo la linea mediana
• Lobo destro:
• Segmento V, inferiore anteriore: subito a destra della linea mediana, in basso
• Segmento VI, inferiore posteriore: a destra del lobo V sempre in basso
• Segmento VII, superiore posteriore: a destra del lobo VIII, sopra al lobo VI, in alto
• Segmento VIII, superiore anteriore: subito a destra della linea mediana, in alto
•
RX diretta
E’ direttamente apprezzabile il fegato dato che la sua tenue opacità omogenea parenchimatosa è circondata in
alto dalla base polmonare, in basso dal meteorismo colico e dal rene destro. Con questo esame si osserva in
genere la presenza di calcificazioni o trasparenze patologiche, ma nessun altro elemento di patologia epatica.
Si può invece osservare una serie di reperti di epatomegalia:
• Innalzamento della cupola epatica (emidiaframma sinistro come confronto)
• Abbassamento della flessura colica destra
• Dislocazione della bolla gastrica
• Deformazione del contorno epatico
Alcuni calcificazioni epatiche importanti sono quelle litiasiche, da traumi o da ascessi, cisti da echinococco,
o anche tumorali o da TBC miliare.
Le trasparenze più facili da riscontrare all’RX sono gli ascessi epatici.
Ecografia
L’ecografia è un esame di accesso al fegato molto importante come prima istanza in molte patologie; è uno
dei pochi casi, forse l’unico, in cui la possibilità di analisi dell’ecografia è superiore a quella della TC e
della RM, alle quali si ricorre principalmente per avere informazioni di tre dimensioni per programmare
l’intervento chirurgico.
L’ascesso è sotto costale con paziente supino; ostacoli principali sono il meteorismo colico, l’obesità e la
steatosi marcata, che può rendere invisibile il lobo caudato.
L’ecostruttura del fegato è di piccoli echi parenchimali diffusi e omogeneamente distribuiti, senza
ispessimenti focali.
Le vene sovraepatiche e i vasi portali appaiono come strutture ecoprive che solcano il parenchima; i dotti
biliari e i rami dell’arteria epatica non sono apprezzabili normalmente a livello segmentario, mentre i vasi
portali sì e possono aiutare a distinguere i segmenti del fegato. Si riconoscono bene le formazioni
legamentose.
http://www.hackmed.org
[email protected] 128
Mencaroni Spartaco
La tecnica doppler è anche molto importante per via della ricca vascolarizzazione epatica. Essa permette di:
• Determinare la presenza di flusso nei vasi per la diagnosi di trombosi
• Caratterizzare il flusso e distinguere i vasi portali e dell’arteria epatica
• Effettuare misurazioni sui vasi
• Caratterizzare le lesioni focali (emangiomi, shunt, noduli tumorali vascolarizzati)
Infine l’ecografia costituisce un sistema di guida ottimale per la biopsia epatica.
TC
Di notevole importanza; si usa di solito mezzo di contrasto uroangiografico iniettato con pompa a 3-5 ml/s,
evidenziando una fase vascolare in cui il mezzo di contrasto si distribuisce all’aorta e all’arteria epatica, una
fase parenchimale e una di equilibrio in cui il mezzo di contrasto viene gradualmente eliminato.
A circa 4-6 ore si può avere una nuova distribuzione epatica per l’eliminazione del contrasto con la bile,
importante per lo studio dei colangiocarcinomi.
Le lesioni tumorali sono vascolarizzate principalmente dall’arteria epatica, e quindi hanno la massima
visibilità nella prima fase; le lesioni di sclerosi, con poca o punta vascolarizzazione, sono meglio visibili
nella fase parenchimatosa, dove rimangono meno dense del resto.
Il parenchima epatico è omogeneo, con valori di attenuazione attorno a 45-70 UH. I dotti biliari sono sempre
visibili se dilatati o se contengono aria, le vene e le arterie in genere sono scarsamente visibili senza mezzo
di contrasto.
La colecisti ha valore di attenuazione fra 0 e 40 a seconda della densità della bile.
RM
Utile per la caratterizzazione delle lesioni focali; in sequenze T1 pesate si ottiene una buona risoluzione
anatomica del fegato (forma, sede, rapporti delle lesioni focali), mentre nelle sequenze T2 si ottiene una
buona definizione della struttura delle lesioni focali e una migliore individuazione di esse, specie se associate
a mezzo di contrasto.
Il parenchima ha intensità media nelle sequenze T1 pesate, bassa in T2; la colecisti è sempre ben
apprezzabile con segnale di tipo liquido, che aumenta in T1 dopo il pasto per la concentrazione della bile.
Angiografia
Utilizzata di norma in seconda istanza, per definire la mappa vascolare dell’organo e definire la possibilità di
intervenire in una lesione focale; assume una certa importanza nello studio delle lesioni focali. Per via
angiografica sono possibili interventi altamente selettivi come la chemioembolizzazione, l’embolizzazione di
fistole, aneurismi, creazione di TIPS.
Il cateterismo selettivo è del tripode celiaco e della mesenterica superiore, superselettivo dell’arteria epatica.
E’ importante prima dell’intervento chirurgico perché le varianti anatomiche sono notevoli e frequenti.
10.1 PATOLOGIE FOCALI DEL FEGATO
Le lesioni epatiche possono essere distinte in focali e diffuse.
NEOPLASIE BENIGNE
Adenomi epatocellulari
Sono i tumori benigni di riscontro più frequente nella donna durante il 3° - 4° decennio di vita. Sono
associati probabilmente ad un elevato livello di estrogeni dovuto all’uso di contraccettivi orali. Gli adenomi
multipli, invece, sono associati con la glicogenosi di tipo I.
Morfologicamente sono formazioni voluminose, di 10 cm di diametro, contenenti epatociti normali o solo
lievemente atipici, con elevato contenuto di glicogeno e quindi più chiari.
In genere è presente dolore, epatomegalia dovuta ad una massa palpabile, ma può anche esservi una
emorragia importante intratumorale che provoca anche shock.
La diagnosi è essenzialmente basata sulla TC, sulla RM e arteriografia selettiva. Un metodo sofisticato per
dimostrare l’assenza delle cellule di Kupffer è la scintigrafia con Te99, che indica una ipocaptazione. In circa
il 10% dei casi possibile la trasformazione maligna, soprattutto negli adenomi grandi o multipli. Se è una
Mencaroni Spartaco
129
lesione grande, superficiale e resecabile, dovrebbe essere asportata, soprattutto se si pensa di iniziare una
gravidanza che mette la neoformazione a rischio di rottura.
Iperplasia nodulare focale
Neoplasia più frequente nel sesso femminile, non associata a contraccettivi orali, senza rischi elevati di
necrosi o emorragia. E’ un tumore solido con una parte centrale fibrosa, e proiezioni stellate che si estendono
intorno. Queste proiezioni contengono epatociti atipici, cellule epiteliali biliari, cellule di Kupffer e cellule
infiammatorie. La scintigrafia con tecnezio indica una captazione attiva, per la presenza di dette cellule.
Emangioma
Tumori benigni del fegato più comuni, sono caratteristici del sesso femminile. Sono lesioni asintomatiche, di
solito di modeste dimensioni, che non presentano rischio di emorragia e non si trasformano mai in una
lesione maligna. Di solito vengono diagnosticate con esami di routine o per altre condizioni. La TC spirale è
il mezzo migliore per differenziarle da altre lesioni maligne identificate ecograficamente.
EPATOCARCINOMA
I tumori maligni del fegato possono derivare da due tipi di cellule, le cellule di Kupffer e gli epatociti, e sono
gli epatocarcinomi, e le cellule dell’epitelio dei condotti biliari, allora si chiama colangiocarcinoma.
Il carcinoma epatocellulare primitivo è una delle neoplasie più comuni, di solito con eziologia legata alla
cirrosi, e incidenza elevata in Paesi come l’Asia e l’Africa, dove in alcune zone raggiunge i 500 casi per 100
mila abitanti.
In Europa è responsabile dell’1-2% delle neoplasie di riscontro autoptico; alle nostre latitudini il massimo
dell’incidenza si osserva fra i 40 e i 50 anni.
In Italia ci sono 200.000 cirrotici, e circa 14.000 casi di epatocarcinoma ogni anno, che fa un’incidenza di 610 per 105.
M>F (4/8:1)
Età 65-70 anni
Il 90% dei casi che insorgono è associato a cirrosi. In effetti, in ogni momento il 7% dei cirrotici presenta
epatocarcinoma (il 5% ogni anno). Questo è sufficiente a definire la cirrosi come una lesione preneoplastica, e a giustificare uno screening semestrale con ecografia e alfa feto – proteina (AFP).
Eziologia
Condizioni che provocano cirrosi: Qualsiasi condizione che provoca un danno epatocellulare cronico e
stimola la mitosi delle cellule epatiche aumenta il rischio di carcinoma. Fra queste sono importanti:
• Cirrosi alcolica
• Emocromatosi
• Deficit di a1AT
• Schistostomiasi
• Ipertirosinemia
Infezione associata da HBV e HCV: Il motivo dell’alta incidenza nelle aree di Africa e Asia è legato alla
prevalenza di questi virus, che in molti casi provocano cirrosi.
Il ruolo dell’HBV è stato ampiamente documentato come agente oncogeno puro, e si hanno prove di questo
attraverso il riscontro abituale della presenza di genoma virale nelle cellule tumorali, negli epatociti
circostanti non malati. Il virus oltre a questo induce l’espressione anomala di certi geni cellulari,
riarrangiamenti ed altre alterazioni geniche.
Sebbene siano numerose le correlazione fra HCV e carcinoma epatico, sfugge ancora il meccanismo
oncogeno di questo virus, che si pensa agisca essenzialmente attraverso la cirrosi e la relativa naturale
progressione di essa a tumore.
Una importante conseguenza di questo è che il paziente con infezione cronica da HBV è a rischio di
carcinoma anche se non ha la cirrosi.
Carcinogeni chimici e tossine:
http://www.hackmed.org
•
•
•
•
[email protected] 130
Mencaroni Spartaco
Aflatossina B: tossina di un fungo (Asperigillus Flavus) che infetta in genere le derrate alimentari
non correttamente conservate, tipico di alcune regioni dell’Africa dove queste vengono conservate
nelle buche scavate per terra. Questa tossina sembra capace di interferire con l’espressione della p53.
Vinilcloruro
Amianto
Anabolizzanti ed estrogeni
Aspetto morfologico
Nodulare: Aspetto più comune, singola lesione infiltrativa. 60 – 70 %
Multinodulare: 20 – 30%
Diffuso (spreeding) <1%; infiltrazione massiva e destruente
Una forma a piccoli noduli e ben differenziata ha la migliore prognosi, mentre quella diffusa poco
differenziata ha la prognosi peggiore e crescita più rapida.
Clinica
Dolore addominale
Calo ponderale 35%
Astenia 30%
Ittero e vomito 8%
Emoperitoneo 12%
Massa addominale
70-90%
43%
I sintomi peraltro abbondanti possono passare inosservati con una certa facilità perché spesso in questi
pazienti esiste un quadro sottostante di ascite, e quindi si interpreta la sintomatologia come un
peggioramento di essa.
I rilievi di laboratorio e il monitoraggio ecografico servono appunto ad evitare che si creino errori
interpretativi di questo genere. In genere frequenti sono gli aumenti della ALP e dell’aFP, e anche una forma
atipica della protrombina (des-gamma-carbossiprotrombina)
Le complicanze più temibili dell'epatocarcinoma sono l'ittero ostruttivo, l'enterorragia da rottura di varici
esofagee e l'emorragia intraperitoneale da rottura del tumore stesso
Una percentuale di pazienti può avere anche una sindrome paraneoplastica, per lo più associata alla
produzione da parte del tumore di:
Eritropoietina
Ipercalcemia
aFP, CEA, ALP, gGT
Ipoglicemia
Ipercolesterolemia
Porfiria cutanea tarda
Diagnosi
→ Ecografia: l’indagine di primo approccio per eccellenza, serve a monitorare la progressione della cirrosi e
l’eventuale comparsa di noduli primitivi in soggetti ad alto rischio, in etilisti cronici, in malati di epatite C.
Un HCC primitivo appare come un nodulo rotondeggiante solitamente anisoecogeno (si tenga presente che
non c’è sempre corrispondenza tra ecogenicità e densità rilevata con la TC). Ogni neoformazione epatica
riscontrata con questo metodo deve essere indagata con tecniche successive. La sensibilità di questo esame è
alta per i noduli di diametro maggiore ai 3 cm, ma comunque con i nuovi mezzi di contrasto selettivi per il
tessuto epatico è possibile discriminare lesioni > 1 cm, anche se isoecogene. Di solito infatti le forme piccole
sono ipoecogene, quelle grandi iso o iperecogene. La presenza di una struttura iperecogena periferica molto
sottile indica la presenza di una capsula limitante esterna. Se poi vi sono vasi sanguigni adesi alla capsula ciò
è molto utile per la diagnosi.
La rilevazione può essere ostacolata dai noduli della cirrosi.
→ Color doppler: sebbene poco utile per differenziare angiomi da epatocarcinomi (flusso troppo lento nei
primi) è importante per identificare il pattern di vascolarizzazione del tumore e scoprire eventuali lesioni
trombotiche nel parenchima.
Mencaroni Spartaco
131
→ TC spirale: permette la risoluzione della diagnosi differenziale fra epatocarcinoma e angioma epatico
sintomatico, dubbio che si pone in una minoranza di casi e che non può essere risolto dalla semplice
ecografia perché il flusso sanguigno all’interno dell’angioma è troppo lento per dare origine all’effetto
Doppler e così l’intera struttura sembra avascolare. Alla TC l’epatocarcinoma appare come una massa
primitiva, ipo o isodensa, con eventuali lesioni satelliti. Il mezzo di contrasto viene preso in maniera
disomogenea per via della presenza nel tumore di trombi e di shunt AV.
Ricordare che i tumori primitivi prendono il mezzo di contrasto molto meglio delle metastasi; questa
discrepanza è maggiore nella fase arteriosa dell’infusione di mezzo di contrasto.
Alcuni tumori possono assumere un aspetto infiltrativo, in genere gli epatocarcinomi e alcuni linfomi, e
quindi avere una difficoltà diagnostica per l’assenza di lesioni nodulari. Questi possono essere diagnosticati
con la TC che presenta una disomogenicità parenchimale diffusa con riduzione del coefficiente di
attenuazione.
→ Risonanza Magnetica Nucleare: Spesso è usata al posto dell’ecografia per la sua maggiore sensibilità,
ma ha un costo più elevato ed è più complessa da utilizzare. Segnale variabile in T1 rispetto al contenuto
fibroso e alla steatosi, iperdenso in T2. Definisce meglio della TC la capsula del tumore e la struttura interna
della lesione.
→ Arteriografia dell’arteria epatica: Anche questa viene usata per la diagnosi differenziale con gli
angiomi. Viene fatta una arteriografia su tripode celiaco e mesenterica superiore; 20-30 sec dopo l’infusione
il mezzo di contrasto si distribuisce al fegato. La visualizzazione del circolo delle sovraepatiche è possibile
tramite la cateterizzazione della cava e la sua occlusione con palloncino. L’iniezione successiva di mezzo di
contrasto che è costretto a ristagnare rende visibili le vene. Queste metodiche sono state quasi abbandonate
per via della possibilità di ottenere risultati migliori con l’ecografia.
→ Scintigrafia con tecnezio99: Permette l’individuazione delle cellule di Kupffer dentro la massa tumorale,
che hanno una attiva captazione del mezzo di contrasto. La neoplasia epatica si differenzia così in
epatocarcinoma e colangiocarcinoma, oltre che per altri segni di cui si dirà dopo.
Gli esami di laboratorio, ricordati nella clinica della malattia, sono importanti anche per la diagnosi oltre che
per il follow-up post-terapeutico. I livelli critici di aFP sono superiori a 500 ug/l, in quanto livelli inferiori si
hanno nelle neoplasie di altro genere che metastatizzano al fegato, nell’epatite virale, eccetera. La persistenza
di alti livelli, oltre a 1000, è indice abbastanza sicuro di neoplasia epatica in presenza di un quadro clinico
compatibile.
Risolutiva nei confronti di una lesione identificata mediante le tecniche di imaging è la biopsia epatica
percutanea, oppure in via laparoscopica.
La biopsia si esegue sotto guida ecografica, per via percutanea transpleurica con ago di Menghini modificato.
La procedura comporta una mortalità irrisoria (<0,1%) ma è da evitare in molti pazienti con cirrosi o
comunque insufficienza epatica a causa della piastrinopenia e della coagulopatia sottostante. Altra
complicazione può essere lo spreading, cioè la diffusione iatrogena delle cellule neoplastiche nel cavo
peritoneale e pleurico, che può pregiudicare la guarigione da malattia qualora venga eseguito un trapianto. La
sensibilità della biopsia è dell’86%, limitata soltanto dall’eventualità di mancare il nodulo con l’ago, mentre
la specificità è del 100% (nessun FP se il patologo è capace)
Terapia interventistica radiologica
(vedi radiologia interventistica, cap 2.8)
Valutazione prognostica
Si usa la classificazione di Child
Bilirubina
(mg/dl)
Score
Albumina
(gm/dl)
PT (Sec)
Encefalopatia
Ascite
1
<2
> 3.5
1-4
None
None
2
2-3
2.8 - 3.5
4-6
1-2
Mild
http://www.hackmed.org
3
>3
[email protected] 132
Mencaroni Spartaco
< 2.8
>6
3-4
Severe
Child class: A: 5 - 6, B: 7 - 9, C: > 9.
METASTASI
Sono lesioni focali di riscontro frequente.
Ecografia
Le lesioni assumono variabilissimi aspetti, a seconda del tumore di provenienza:
• Noduli solidi anecogeni → origine ovarica o mammaria
• Noduli solidi iperecogeni a bersaglio → origine colica o rettale
• Ecostruttura mista
Spesso coesistono forme di ecostruttura diversa; in genere nelle lesioni più grandi è frequente trovare aree
lacunari centrali corrispondenti a necrosi.
L’accuratezza dell’ecografia è buona (80%) ma scende se si osservano le lesioni nel fegato steatosicoTC
Nella maggior parte dei casi assumono l’aspetto di lesioni ipodense e disomogenee, che captano il mezzo di
contrasto in maniera meno evidente del parenchima (tale differenza è maggiore nella fase iniziale
dell’infusione). L’accuratezza è elevata (85-90%) e alcuni la considerano la metodica di prima istanza.
RM
Le metastasi sono ipodense rispetto al parenchima in T1 e iperdense in T2.
Non è possibile identificare esattamente la natura delle lesioni senza ricorrere alla biopsia epatica. Alcune
lesioni però sono identificabili all’ecografia e non hanno bisogno della biopsia ecoguidata:
• Iperplasia nodulare focale
• Angiomi
• Epatocarcinoma fibrolamellare (variante giovanile a prognosi migliore), in cui però va fatta biopsia per il
grading
• Lesioni cistiche
ANGIOMI
Gli angiomi assumono all’ecografia caratteristiche abbastanza peculiari di una lesioni a margini netti e
regolari con ecostruttura iperecogena regolare omogenea. Nel 95% dei casi l’ecografia è sufficiente a fare la
diagnosi anche se il doppler, causa la lentezza del flusso, non può esservi applicato in maniera risolutiva.
Alla TC con mezzo di contrasto assumono il colorante in maniera lenta, abbondante e progressiva; a volte le
lesioni più grandi sono fibrose al centro e questo può rallentare ulteriormente la captazione del colorante,
creando problemi di diagnosi differenziale con le metastasi che come detto sono meno captanti del
parenchima normale.
Alla RM sono caratteristici, con segnale ipodenso in T1 e molto iperdenso in T2, cosa che consente quasi
sempre la loro differenziazione dalle metastasi nei casi dubbi a TC ed ecografia; assume importanza anche la
scintigrafia con globuli rossi marcati con Tc99.
ADENOMI E IPERPLASIA NODULARE FOCALE
Sono entrambi lesioni rotondeggianti che all’ecografia hanno una struttura iso o ipoecogena, regolare. A
volte possono avere un’area iperecogena stellata al centro con tessuto fibroso.
Però con le tecniche doppler si possono mettere in evidenza dei segnali centrifughi di flusso arterioso alla
periferia. Se si hanno queste due caratteristiche la diagnosi è agevole.
TC e RM sono poco migliori, e si basano sempre sulla ricerca dell’area stellata che non è costantemente
presente. Possono però dare informazioni di diagnosi differenziale fra adenoma e iperplasia osservando la
presenza nel primo di aree di necrosi o emorragia.
Mencaroni Spartaco
133
Unica tecnica che permette la diagnosi differenziale è la scintigrafia con Tc99 che viene attivamente captato
dall’adenoma.
CISTI
Le cisti sono ecograficamente diagnosticabili come formazioni rotondeggianti con ecostruttura liquida pura,
a margini netti. Questo è sufficiente a differenziarle da ogni lesione focale di natura solida. Quelle da
echinococco possono però, dopo qualche tempo, sepimentarsi in numerose “cisti figlie” che contengono il
parassita attivo. La presenza di calcificazioni nella parete è un importante segno che indica la inattività della
cisti.
Il ricorso alla TC è indicato solo quando ci sono difficoltà per l’esecuzione dell’ecografia (grasso,
meteorismo).
ASCESSI
In genere di qualsiasi natura siano sono accompagnati da una chiara sintomatologia clinica (febbre remittente,
leucocitosi, perdita di peso, astenia, nausea e malessere). La TC è l’indagine di elezione per la loro
osservazione, dato che non sempre quelli piccoli sono visibili all’ecografia. Sono aree ipodense, di forma e
margini irregolari, con alone periferico ipodenso dopo il contrasto (capsula).
All’interno possono avere sepimentazioni, ma il tipico aspetto è quello d una lesioni “a bersaglio” con un
alone esterno costituito dalla capsula e uno interno dalla componente colliquata dell’ascesso.
Possono anche essere presenti livelli fluidi o idroaerei (la presenza di gas è un segno sfavorevole perché si
associa alla presenza di anaerobi).
10.2 PATOLOGIE DIFFUSE DEL FEGATO
EPATITI DIFFUSE
In genere la diagnosi di queste affezioni è puramente clinica. L’ecografia può dare informazioni di massima
osservando un fegato di dimensioni aumentate ma con ecostruttura normale.
Solo nel caso di necrosi acuta il parenchima ha ecostruttura ipoecogena disomogenea e dimensioni ridotte. o
TC e RM non hanno essenziali indicazioni diagnostiche
STEATOSI
La steatosi in genere si associa a numerose condizioni patologiche ed è quindi un segno molto aspecifico. Si
diagnostica facilmente all’ecografia con la presenza di echi di piccole dimensioni, diffusamente ispessiti,
che determinano una difficoltà alla penetrazione degli ultrasuoni (il grasso li ostacola) e rendono mal visibile
il lobo caudato e i segmenti profondi del lobo destro. Importante anche la drastica riduzione dell’ecogenicità
del rene destro rispetto al sinistro per via dell’aumento dell’attenuazione da parte del fegato.
Si accompagna ad aumento di volume epatico e può essere focale (a “zolle”) e per la sua attenuazione può
mascherare la presenza di lesioni focali .
CIRROSI
Si caratterizza sul piano istopatologico per la presenza di noduli di rigenerazione in associazione con aree di
fibrosi, e per la disorganizzazione della struttura del parenchima. Queste modificazioni si riflettono anche sul
piano radiologico.
Ecografia
E’ l’indagine di prima scelta e consente di rilevare tutti i segni di cirrosi
• Variazione di volume: aumenta nelle forme da alcool
• Variazioni di morfologia: diminuisce il volume del lobo destro mentre aumenta quello del lobo caudato
per ipertrofia compensotoria. Il rapporto fra il caudato e il destro diventa maggiore di 0,65.
• Segni diretti:
o Irregolarità dei margini
o Alterazione della tessitura
o Alterazioni vascolari: i vasi portali e le sovraepatiche spesso risultano dislocati e compressi,
a decorso tortuoso per la presenza dei noduli di rigenerazione.
• Ipertensione portale
o Circoli collaterali:
Vene coronaro-stomaciche con vene esofagee
Plesso emorroidario
Sistema del Retiuz
http://www.hackmed.org
[email protected] 134
Mencaroni Spartaco
Vene paraombelicali
Nodularità: forma macronodulare in genere da epatite, forma micronodulare (<1cm) in genere da alcool.
La nodularità non è un carattere distintivo assoluto e le lesioni nodulari devono essere sempre
considerate con sospetto per la possibilità di insorgenza di HCC molto spesso derivato direttamente da
cirrosi (specie se HCV relata).
Nelle forme micronodulari però l’ecografia può anche risultare completamente normale. Le tecniche
doppler possono dare informazioni molto importanti sullo studio dell’ipertensione portale.
•
Tecniche di seconda istanza
La presenza di noduli di rigenerazione che captano attivamente il ferro può essere agevolmente identificata
con la RM (il ferro è un super paramagnetico).
La TC è in grado di valutare efficacemente il volume epatico e i circoli collaterali dell’ipertensione portale.
Infine la scintigrafia con radio colloide, raramente usata, permette l’osservazione di una ridotta captazione
epatica che viene compensata da un aumento della captazione del tracciante da parte dei macrofagi splenici e
midollari (compensatoria).
10.3 INDAGINI DELLA COLECISTI
Ecografia
Studio quasi sempre di prima istanza, che diagnostica praticamente da sola la colelitiasi, le colecistiti e a
volte anche le neoplasie. Consente lo studio della cinetica della contrazione della colecisti.
Il paziente deve essere preparato con carbone vegetale per ridurre il meteorismo intestinale e a digiuno da
almeno 8 ore per garantire presenza di bile nell’albero biliare e nella colecisti, che distende anche il campo di
indagine.
L’accesso è sottocostale e in inspirazione profonda, tramite la finestra acustica epatica.
Le vie biliari intraepatiche più piccole visibili sono i dotti biliari segmentari, negli spazi portali, quando sia
presenta una ectasia anche lieve: si riconoscono perché duplicano l’immagine dei vasi portali (immagine a
doppia canna di fucile).
I dotti epatici destro e sinistro si vedono normalmente.
La colecisti è ovalare se presa trasversalmente, piriforme se presa longitudinalmente. E’ ridotta dopo pranzo,
con pareti contratte e ispessite.
La via biliare principale è sempre apprezzabile ad eccezione del tratto dietro a pancreas e duodeno per la
presenza di gas intestinali.
La bile ha ecostruttura liquida come il sangue, e a volte per differenziare le vie biliare ectasiche dai vasi è
necessario il color doppler.
RX diretta
Decubito prono, fianco destro sollevato. Da informazioni utili soltanto sui calcoli radiopachi.
Colecistografia orale
Studio di seconda istanza. Si somministra mezzo di contrasto per os 12-16 ore prima dell’esame:
frequentemente si ha una scarsa opacizzazione della colecisti, principale limite. Si usa in genere acido
iopanoico e acido icotamico. Il paziente rimane digiuno dalla somministrazione fino all’esame. La
colecistografia è possibile perché il mezzo di contrasto viene assorbito nell’intestino ed escreto dopo
coniugazione con la bile. Nella colecisti si ha concentrazione di 10 volte del mezzo di contrasto per il
riassorbimento idrico.
Alcune cause di mancata opacizzazione della colecisti sono:
• Ostruzione intestinale, esofagea, pilorica
• Ritardo di svuotamento gastrico
• Turbe intestinali come malassorbimento o diarrea
• Colecistite
• Calcoli incuneati nel cistico o nell’infundibulo
• Riassorbimento o mancata concentrazione del mezzo di contrasto nella colecisti
Normalmente si riesce ad evidenziare la sola colecisti (fondo, corpo, infundibulo); se viene provocata la
contrazione si riesce spesso a vedere il dotto cistico e solo occasionalmente il coledoco.
Indicazioni alla colecistografia orale sono:
Mencaroni Spartaco
•
•
•
•
135
Valutazioni di malformazioni colecistiche
Analisi della parete della colecisti
Valutazione della natura dei calcoli
Studio della contrazione della colecisti
TC
Come complemento all’ecografia nello studio degli itteri ostruttivi neoplastici per la migliore definizione
dell’estensione locale delle masse epatiche maligne.
Trova indicazione nella dimostrazione delle perforazioni e nella valutazione combinata delle patologie
pancreatiche che riconoscono una eziologia anche biliare.
Esiste una tipologia di mezzo di contrasto ad escrezione biliare molto sicura.
Si riesce in genere a visualizzare i dotti segmentari nel 40% dei casi, in fase di ridistribuzione epatica del
mezzo di contrasto. Tutte le strutture sottostanti sono visualizzate bene, ma la giunzione fra il dotto cistico e
la via biliare principale non è sempre ben visibile.
RM e Colangio-RM
Esiste il mezzo di contrasto paramagnetico per la colecisti, e lo studio con l’RM trova indicazione come
complemento all’ecografia nell’ittero ostruttivo e per la miglior definizione dell’area occupata da masse
epatiche.
Si dimostra costantemente e con certezza solo la via principale e la colecisti: in caso di dilatazione però tutto
l’albero biliare è ben evidenziato fino al livello dell’ostruzione. La bile è iperintensa in T2 con segnale di
tipo liquido; in T1 varia a seconda della concentrazione (diminuisce dopo pranzo quando l’acqua costituisce
il 95% della bile).
Scintigrafia
Derivati dell’acido imminodiacetico marcati con Tc99 per la documentazione di quasi tutte le alterazioni, in
quanto si riesce a visualizzare tutte le strutture della colecisti e a studiare efficacemente il transito del mezzo
di contrasto.
ERCP
“Colangio Pancreatografia Retrograda Endoscopica”
Accesso retrogrado all’albero biliare durante l’endoscopia; si introduce un endoscopio a visione laterale fino
alla papilla, e poi con apposita cannula si incannula la papilla stessa. In essa viene iniettato un mezzo di
contrasto uroangiografico diluito a bassa pressione prima nel dotto pancreatico e poi nel coledoco.
Le complicazioni sono basse e la metodica è molto buona.
Le controindicazioni sono la pancreatite acuta e le pseudocisti pancreatiche.
Unisce la possibilità di valutazione endoscopica diretta della papilla e dello sbocco dei dotti escretori alla
possibilità di evidenziare radiologicamente tutto l’albero biliare in maniera molto dettagliata, in quanto è
possibile anche prolungare l’iniezione di mezzo di contrasto onde visualizzare efficacemente anche i dotti
biliari intraepatici.
Evidenzia ogni difetto morfologico dei dotti biliari, calcoli, e sede di stenosi e occlusioni con accuratezza del
100%. La natura dell’ostruzione viene identificata nel 95% dei casi. Inoltre è possibile effettuare durante
l’esame biopsie, estrazione di calcoli con basket, papillotomie decompressive.
Radiologia interventistica
Vedi capitolo 2.4
10.4 PATOLOGIA DELLA COLECISTI
MALFORMAZIONI
Possono essere numerose a tutti i livelli:
• Colecisti (agenesia, duplicazione, malposizione, atresia, anomalie di forma, presenza di setti e stenosi)
• Dotto cistico (anomalie di sbocci, di lunghezza, decorso, dilatazione cistica congenita)
• Dotti biliari (agenesia, atresia, stenosi, presenza di dotti accessori, dilatazione segmentaria)
• Coledoco
• Papilla
http://www.hackmed.org
[email protected] 136
Mencaroni Spartaco
Tute queste alterazioni possono essere efficacemente indagate con la colecistografia orale e l’ecografia.
Indagini fini possono essere eseguite anche con la colangiografia RM
CALCOLOSI BILIARE
E’ la patologia più frequente a carico della colecisti. Lo studio per immagini serve a identificare i calcoli e
riconoscerne la natura, riconoscere le complicanze, programmare interventi risolutivi (con la identificazione
del tipo di calcolo) e infine identificare se possibile la patologia di base che ne favorisce la formazione.
Assume a questo proposito importanza la tipologia dei vari calcoli.
Ricordando che praticamente tutti i calcoli sono formati da diversi tipi di sostanze e che in ogni tipo è
presente calcio in componente variabile (che ne determina la radiopacità) si possono distinguere vari tipi di
calcoli.
TIPO
Colesterinici puri
COMPOSIZIONE
Colesterolo
< 4%
Puri di bilirubinato di
calcio
Misti Aschoff I
Bilirubinato
Elevata
Nucleo colesterinico
e
mantello
di
bilirubinato di calcio
Nucleo
misto,
mantello
di
bilirubinato
Media
Nucleo NO,
mantello SI
Elevata
nel
mantello
Nucleo
poco,
mantello SI
Misti Aschoff II
% CA
EZIOLOGIA
Diminuzione
delle
sostanze
che
solubilizzano il colesterolo o aumento della
sua concentrazione
Accumulo e precipitazione di bilirubina
indiretta, promossa da infezioni biliare
OPACITÀ
DIMENSIONI
NO
< 1cm
SI
Fattori predisponenti alla formazione di calcoli sono:
• Razza e luogo di residenza: Centro America, Messico, Cecoslovacchia e Svezia alta prevalenza, bassa
in Africa, Cina e India
• Età: in età adulta aumenta la produzione di colesterolo
• Sesso: più frequente nella donna
• Obesità e dieta
• Diabete e iperlipidemia
• Terapia con fibrati: induttori della lipoproteinlipasi, questi farmaci riducono il pool di colesterolo
circolante, ma causano un aumento della produzione epatica di colesterolo rendendo la bile più
litogenica.
• Cirrosi epatica: la prevalenza di colelitiasi nel cirrotico è maggiore di due-tre volte che nel soggetto
normale, a causa della cronica emolisi, e infatti si hanno calcoli di pigmento anziché di colesterolo
• Emolisi
• Malattie del tenue: riducono il riassorbimento dei sali biliari, rendendo la bile più satura in colesterolo.
Il rischio aumenta di quattro volte.
• Fibrosi cistica: la diminuzione del riassorbimento qui si somma anche all’aumento della viscosità delle
secrezioni che possono saturare la bile.
• Chirurgia gastrica: provoca la diminuzione della motilità della colecisti.
Ecografia
E’ l’esame di elezione per l’identificazione dei calcoli nella colecisti e nei dotti intraepatici con elevata
accuratezza (sensibilità 98%), meno per l’identificazione dei calcoli della via biliare principale.
→ I calcoli della colecisti sono formazioni endoluminali fortemente ecogene, che hanno un caratteristico e
importante cono d’ombra posteriore. Calcoli con poco calcio e recenti possono avere uno scarso cono
d’ombra. In genere in questi calcoli l’iperecogenicità è limitata al mantello, che è la zona che si calcifica per
prima.
Le misure minime osservabili in condizioni ottimali sono di circa 1 mm; in genere affondano nella bile e a
paziente supino si trovano nella parete posteriore della colecisti; quelli puri di colesterolo galleggiano.
Alcuni rilievi ecografici si associano spesso alla colelitiasi:
• Sospensione finemente particolata → bile densa
• Echi grossolani in sospensione → infiammazione e presenza di essudato corpuscolato
• Aumento di ecogenicità della bile che diventa simile al parenchima epatico → fango biliare
Mencaroni Spartaco
137
→ I calcoli dei dotti intraepatici sono strutturalmente identici ai precedenti, e spesso si dispongono in
maniera impilata nei dotti (il primo calcolo che provoca stenosi fa ristagnare la bile e facilita la formazione
di calcoli a monte).
→ I calcoli della via biliare principale sono a volte non apprezzabili per la presenza dell’intestino gassoso
davanti, e possono essere sospettati in presenza di una ectasia della via biliare.
Altre metodiche
Alla colangio RM si possono evidenziare tutti i calcoli indipendentemente dalla loro posizione come aree
rotonde e prive di segnale nel contesto della bile marcatamente intensa. Il limite di risoluzione si ferma e 3
mm.
L’esame diretto consente spesso di identificare la morfologia dei calcoli valutandone la trasparenza o la
l’opacità.
La TC consente di evidenziare la composizione strutturale del calcolo con misurazioni densitometriche che
permettono a volte di analizzarne la struttura, ma non è sempre efficace.
E’ migliore la colecistografia orale che permette di identificare i calcoli come masserelle endoluminali
lacunari, in cui il mezzo di contrasto non entra. In posizione eretta i calcoli si stratificano nella bile secondo
la loro densità (menisco di Akerlund).
PATOLOGIA INFIAMMATORIA DELLA COLECISTI E DEL COLEDOCO
L’ecografia e la colecistografia diagnosticano efficacemente sia le colicistiti litiasiche e non litiasiche (rare);
il loro ruolo è però principalmente quello di valutarne le complicanze e di fornire informazioni sulle possibili
cause del processo infiammatorio.
Colecistite acuta
L’ecografia dimostra:
• Aumento uniforme di spessore della parete, con diminuita ecogenicità per edema
• Presenza di calcoli
• Ispessimento del tessuto circostante alla colecisti per estensione della flogosi
• Eventuali raccolte fluide (perforazione)
La presenza di bile corpuscolata (da pus e fibrina) con aumento di volume sono un chiaro segno di
evoluzione verso l’empiema.
L’esame diretto addome dimostra ileo paralitico secondario con la possibile presenza di anse sentinella in
regione duodenale.
Colecistite cronica
L’ecografia dimostra:
• Riduzione di volume della colecisti fino all’atrofia conclamata
• Aumento di spessore ed ecogenicità della parete per sclerosi
• Alla scintigrafia il tempo di visualizzazione della colecisti è tardivo
L’esame diretto può indicare la presenza di calcificazioni (colecisti a porcellana) e di bile opaca.
Colangiti
Sono forme infiammatorie delle vie biliari in genere sostenute da processi infettivi. All’ecografia si
dimostra:
• Ispessimento della parete delle vie biliari
• Aerobilia
• Ectasia irregolari dei dotti biliari
• Diminuzione dell’ecogenicità del parenchima biliare adiacente, con possibile formazioni di ascessi e
calcoli.
In questi casi la colangiografia percutanea transepatica possono essere importanti per manovre
decompressive e per il prelievo di bile infetta.
http://www.hackmed.org
[email protected] 138
Mencaroni Spartaco
Colangite sclerosante
Forma degenerativa associata a RCU o primitiva, dà luogo a progressiva sclerosi e obliterazione delle vie
biliari con formazione di ectasie irregolari a corona di rosario, visibili alla TC e all’ecografia ma del tutto
aspecifiche. La diagnosi è posta quindi solitamente tramite biopsia durante una ERCP.
NEOPLASIE DELLA COLECISTI
I tumori benigni (adenoma e papilloma) si trovano di solito nel fondo in costante rapporto della parete e non
offrono particolari problemi di diagnosi differenziale.
I tumori maligni che interessano le vie biliari sono di tre tipi.
Colangiocarcinoma: La neoplasia delle cellule dell’epitelio biliare extraepatico colpisce al 60% gli uomini,
fra la 5° e la 7° decade; ha una eziologia associata a:
- infezioni parassitarie e virali a carattere cronico delle vie biliari
- anomali congenite con ectasia
- colangite sclerosante
- colite ulcerosa
- esposizione professionale a cancerogeni della lavorazione della gomma
La colelitiasi invece non è ancora stata accertata come agente eziologico,
Il colangiocarcinoma è di due tipi: diffuso e nodulare (tumore di Klatskin). Quest’ultimo è spesso
localizzato alla biforcazione del coledoco, dove si riuniscono i due dotti epatici. La colecisti in questo caso
spesso scende, e se ne permette la visualizzazione alla colangiografia. Questo aspetto è detto colecisti
collassata.
Il tumore di Klatskin si distingue in tre aspetti morfologici, associati a stadi progressivamente peggiori
- interessamento di un singolo dotto epatico
- interessamento di tutte e due i confluenti epatici
- diffusione multifocale nella zona della giunzione
L’intervento chirurgico è possibile solo nel caso del primo tumore.
La clinica delle neoplasie dell’epitelio extraepatico di solito è caratterizzata da:
• ostruzione biliare
• ittero non accompagnato da dolore
• prurito
• calo ponderale
• feci acoliche
• a volte dolore sordo vagamente localizzato nell’ipocondrio di destra
• a meno che la lesione interessi una regione alta del dotto, la colecisti è palpabile e distesa
In genere la colestasi si manifesta solo durante uno stadio avanzato di neoplasia. Questo provoca un ritardo
diagnostico a volte anche parecchio importante. La diagnosi viene solitamente posta dopo colangiografia per
un riscontro ecografico di dilatazione delle vie biliare intraepatiche; la massa viene comprovata all’ecografia
e successivamente studiata alla TC: la stadiazione richiede spesso la biopsia con ago tranciante.
Carcinoma della papilla di Vater; Può essere sede di metastasi dei tumori epatici, del pancreas e del
duodeno. Primitivamente ospita sarcomi, carcinomi o adenocarcinomi.
Gli adenoK vegetanti sono caratterizzati dalla crescita lenta, dalla prognosi clinica più favorevole, rispetto ai
tumori infiltrativi della papilla, che sono spesso diffusamente invasivi. In genere la sintomatologia è quella
dell’ittero ostruttivo, e la tecnica diagnostica è la colangiopacratografia retrograda endoscopica, che
permette la visione e la biopsia della papilla e la pancreatografia per escludere K della testa del pancreas.
La terapia è un’ampia escissione chirurgica, che purtroppo però spesso deve fare i conti con la possibilità di
trovare metastasi a distanza, e quindi una sopravvivenza limitata
Cancro della colecisti: La maggior parte dei tumori della colecisti si sviluppa in presenza di calcoli anziché
in associazione con i polipi, anche se comunque anche in questi pazienti il rischio rimane molto basso.
F>M 1:4, età media di insorgenza 70 anni. Incidenza 3 casi su 100000 abitanti anno negli Usa.
Mencaroni Spartaco
139
La forma più comune sono gli adenocarcinomi dell’epitelio secernente della colecisti. Clinicamente nella
maggior parte dei casi si tratta di episodi di dolore, calo ponderale, ittero e massa palpabile. In alcuni casi si
può sovrapporre una colangite.
Si distingue in una forma infiltrante scirrosa, in cui non è facile la diagnosi differenziale con le colecistiti
croniche, e una forma papillare vegetante di agevole diagnosi ecografica.
Si diagnostica con l’ecografia, la TC, e l’agobiopsia ecoguidata. La TC assume molta importanza soprattutto
nella valutazione dello sconfinamento epatico del tumore.
La prognosi di questo tipo di tumore è estremamente grave: in genere il 75% dei pazienti non sono
asportabili al momento dell’operazione, e di questi il 96% muoiono entro l’anno. Fanno eccezione quei casi
scoperti casualmente durante una laparoscopia esplorativa.
La radio e la chemioterapia non sono efficaci.
10.5 RUOLO DELLA DIAGNOSTICA RADIOLOGICA NELL’ITTERO
La radiologia diretta addominale ha un ruolo marginale.
Ecografia
La dilatazione delle vie biliari è estremamente facile da osservare con l’ecografia (accuratezza 92%), ed è un
reperto immediato di un ittero colestatico ostruttivo. Per cui in un paziente con ittero si chiarisce tramite
ecografia:
• se esiste dilatazione delle vie biliari
• a che livello è l’ostacolo
• eventuali processi provocanti l’ostruzione
La dilatazione del coledoco inizia già dopo 4 ore dalla comparsa dell’ostruzione acuta, mentre le vie biliari
intraepatiche si dilatano lentamente, in maniera “centrifuga” rispetto al dotto epatico comune, e spesso
asintomatica.
Invece nelle forme croniche, soprattutto neoplasie della testa del pancreas, questa dilatazione avviene
lentamente e riguarda soprattutto le vie biliari interapatiche (risulta quindi meno immediata da identificare).
In particolare la bilirubinemia rimane a lungo normale e non si hanno evidenze di ittero. Assume allora
importanza l’osservazione di marker come le gamma GT in caso di sospetto clinico, molto più precoci.
Nelle forme neoplastiche l’ecografia ha anche la possibilità di osservare le strutture vicine al pancreas e i
linfonodi per dare informazioni ulteriori sulla neoplasia.
Vi sono condizioni in cui nonostante l’ostruzione delle vie biliari queste non si dilatano, ad esempio nelle
forme molto recenti, o nella coledocolitiasi con ostruzione incompleta, oppure nelle forme di colangite
sclerosante.
L’ecografia riesce ad identificare agevolmente la sede dell’ostruzione eccetto che nel coledoco terminale,
coperto spesso dal meteorismo intestinale.
E’ molto meno accurata invece nel determinare di che natura sia l’ostacolo
Colangiografia endovenosa
Nei pazienti itterici con bilirubinemia superiore a 3 mg/dl non può essere effettuata.
Si usa quindi in pazienti con precise indicazioni:
• presenza di calcoli distali del coledoco (specie in pazienti colecistectomizzati)
• incremento di fosfatasi alcalina e gamma GT
• ecografia negativa
• sintomatologia di colica biliare
ERCP
Possibilità di visualizzare il coledoco distale, con visione diretta della papilla. Possibilità di effettuare biopsie
e pancreatografia durante l’esame. Le biopsie possono essere a raschiamento o per aspirazione, sulla papilla
o sulla bile stessa.
Consente la estrazione della maggior parte dei calcoli nella via principale.
Colangiografia percutanea
Metodica di intervento possibile in alternativa alla ERCP
http://www.hackmed.org
[email protected] 140
Mencaroni Spartaco
TC
Consente una analisi contemporanea del parenchima, della colecisti e delle vie biliari. Il limite principale è la
necessità di effettuare scansioni assiali del coledoco che riportano una serie di sezioni, mentre invece
nell’ecografia si può osservare tutto il decorso.
Essa però non ha le limitazioni dell’ecografia (aria, grasso, cicatrici) per lo studio del tratto terminale del
coledoco, che è quello più importante. Essa dunque rileva la sede dell’ostruzione soltanto nell’85% dei casi
(meno dell’ecografia), ma la natura è identificabile nel 75% dei casi (quasi mai con l’ecografia).
Inoltre consente un accurato panorama del campo di intervento in previsione dell’operazione chirurgica.
RM
Presenta una ottima panoramicità e una risoluzione di contrasto superiore alla TC, con la possibilità di
ottenere immagini multiplanari e non solo assiali.
Si possono usare delle particolari sequenze nelle scansioni coronali di colangio RM con mezzo di contrasto
paramagnetico che da risultati molto buoni. Il principale vantaggio è l’assenza di radiazioni ionizzanti e di
mezzi di contrasto iodati osmolari.
Biopsia con ago sottile
Importante perché tutte le tecniche di imaging sono morfologiche non istopatologiche e non possono dare
molte informazioni sulla natura dei processi ostruttivi.
Mencaroni Spartaco
141
CAP 11 PATOLOGIA DEL PANCREAS
11.1 ESAMI DISPONIBILI
METODICHE DIRETTE
RX addome
Non da informazioni dirette sul pancreas, ma soltanto analisi indirette come la distensione di anse intestinali
vicine. L’unico caso in cui può visualizzare direttamente delle alterazioni è nella presenza di calcificazioni
all’interno dei dotti o di aree di necrosi calcificate.
Ecografia
La tecnica di prima istanza è spesso l’ecografia, anche se è molto limitata nell’osservazione diretta della
ghiandola. Richiedendo una lunga preparazione intestinale con eliminazione dei gas e svuotamento del
trasverso, si preferisce spesso andare direttamente alla TC.
Il pancreas normale ha una ecostruttura solida omogenea, e spesso il Wirsung è dimostrabile come una
immagine iperecogena a binario.
I vasi pancreatici si visualizzano con il doppler. L’ecografia trova applicazione anche nell’esecuzione delle
biopsie pancreatiche.
TC
Esame fondamentale. Il mezzo di contrasto baritato diluito rende possibile l’individuazione delle anse
digiunali e dello stomaco, punti di repere importanti.
Può anche essere eseguita una scansione con mezzo di contrasto iodato endovena per lo studio dei tumori
pancreatici ipervascolarizzati.
Offre informazioni sulla morfologia, contorni, sui piani adiposi circostanti (importantissimo in corso di
pancreatite acuta per il frequente ed esteso interessamento). Il parenchima in condizioni normali è
densitometricamente omogeneo.
RM
Consente lo studio del parenchima con sequenze particolari messe a punto appositamente (pancreatico-RM)
e la visualizzazione del sistema duttale pancreatico.
Nelle sequenze T1 pesate il tessuto adiposo si differenzia molto bene dal parenchima, agevolmente
distinguibile anche dalle lesioni neoplastiche. In T2 il pancreas perde di contrasto, ma risultano molto ben
visibili il coledoco, il tratto intrapancreatico del Wirsung ed eventuali raccolte fluide attorno alla ghiandola.
La somministrazione di mezzo di contrasto paramagnetico negativo è anche molto importante per cancellare
il segnale delle anse intestinali che è fonte di disturbo.
ERCP
Trova indicazione nella diagnostica delle infiammazioni stenosanti della papilla e nei suoi tumori, ma
soprattutto nella valutazione iniziale delle pancreatiti e nell’individuazione di piccoli carcinomi non
risolvibili all’ecografia o alla TC.
Angiografia
Si ricorre ad essa in seconda istanza per lo studio di tumori secernenti del pancreas endocrino; questi possono
essere valutati sia con l’esame arterioso selettivo del tripode celiaco e della mesenterica superiore, sia con il
cateterismo della vena splenica (misurazione delle sostanze secrete dal tumore in condizioni basali e dopo lo
stimolo secretorio).
MODIFICAZIONI DELL’APPARATO DIGERENTE DURANTE LA PATOLOGIA PANCREATICA
Occasionalmente lo studio dello stomaco, del duodeno e del colon può mettere in evidenza delle situazioni
pancreatiche attraverso la dimostrazione di dislocazioni, compressioni, infiltrazioni. Questi segni indiretti,
che assumevano più che altro importanza in era preecografica, sono comunque importanti perché fonte di
rinvenimenti patologici occasionali.
Sono importanti:
• presenza di varici gastriche, del sollevamento dell’antro e del bulbo da compressione dello stomaco
• slargamento della C duodenale, passaggio rapido del mezzo di contrasto baritato dalla prima alla seconda
porzione del duodeno (a getto d’acqua) per la compressione del duodeno (segno di Pannhorst)
• segno del “3 rovesciato” di Frostberg per compressione della C duodenale
http://www.hackmed.org
•
[email protected] 142
Mencaroni Spartaco
Dislocazioni del colon trasverso o della flessura colica di sinistra per masse pancreatiche rispettivamente
del corpo e della coda.
11.3 PATOLOGIA DEL PANCREAS
ANOMALIE CONGENITE
Ce ne sono alcune di un certo rilievo.
• Pancreas diviso: secondo alcuni predispone alla pancreatite ricorrente: si tratta di una mancata fusione
dei due abbozzi pancreatici per cui il dotto di Wirsung drena la parte inferiore della testa e il processo
uncinato, il dotto di Santorini corpo e coda. La diagnosi si fa con la ERCP
• Pancreas anulare: per difetti di rotazione il pancreas si avvolge attorno al duodeno provocando vari
gradi di stenosi. La diagnosi viene sospettata all’RX addome per la presenza di due livelli aerei nel
duodeno e nello stomaco, alla TC e RM, e viene confermata tramite ERCP nell’85% dei casi per
dimostrazione del dotto anulare
• Fibrosi cistica: deficit genetico della secrezione acquosa e mucosa della ghiandola (e di tutti gli altri
organi del corpo) con ristagno e attivazione intraduttale degli enzimi litici. La progressiva fibrosi e
sostituzione adiposa, con formazione di cisti multiple, è la conseguenza della malattia. Il riconoscimento
dell’interessamento pancreatico è possibile con l’ecografia (aumento dell’ecogenicità da fibrosi) e con la
TC (calcificazione diffuse, diminuzione del valore di attenuazione per sostituzione adiposa)
• Cisti multiple: diagnosticabili all’ecografia.
PANCREATITE ACUTA
La diagnosi è fondamentalmente clinica (dolore, amilasi, criteri di Ramson, esami di laboratorio, segni di
shock), ma la diagnosi radiologica ha lo scopo di:
• Definire il tipo di pancreatite e la situazione anatomopatologica
• Definire l’interessamento extraghiandolare
• Identificare le complicanze
• Definizione della prognosi
Esame diretto addome
Evidenzia a volte dei segni indiretti importanti, come la distensione delle anse centrali del digiuno (anse
sentinella), o della C duodenale (più specifico), o del colon trasverso. Un opacamento dei quadranti
addominali superiori può indicare la presenza di un versamento diffuso attorno alla ghiandola. Importante
anche la possibilità di evidenziare un versamento pleurico, frequentemente accompagnato alla patologia
pancreatica.
Ecografia
Spesso ostacolata dalla distensione delle anse intestinali, non evidenzia alterazioni in oltre 1/3 dei casi. Nella
forma edematosa rileva aumento di volume e dilatazione del Wirsung, nella forma necrotico-emorragica
dopo le prime 24 ore si osserva l’area pancreatica ipoecogena con raccolte liquide corpuscolate nel contesto.
TC
Analogamente all’ecografia può non rilevare alterazioni in oltre 1/3 dei casi. Assume però un importante
valore prognostico la scansione con mezzo di contrasto.
Nelle forme edematose rileva un ingrandimento diffuso del pancreas con diminuzione della densità del
parenchima (edema), e scarsa definizione dei contorni. Queste forme sono del tutto benigne.
Nelle forme necrotiche, invece, si osserva una diminuita densità del parenchima nelle prime 24-48 ore,
mentre le aree emorragiche presentano elevata densità alla scansione diretta. Alla scansione con mezzo di
contrasto si osserva l’alternarsi di aree a perfusione normale (vitali) e aree a perfusione scarsa o nulla
(necrosi o edema).
Successivamente le aree necrotiche vanno incontro a massiva colliquazione.
Oltre a ciò la TC è utile per lo studio delle complicazioni.
Riesce a identificarle tutte, a partire dalle raccolte fluide: la pancreatite è “complicata” quando la raccolta
supera la barriera del peritoneo e coinvolge prima la retrocavità degli epiploon, e poi il peritoneo.
Altra complicazione identificabile alla TC è la pseudocisti, una lesione cavitata che comunica con i dotti e si
forma per l’azione litica degli enzimi. Si differenzia dalla cisti per l’assenza della parete e la presenza della
comunicazione.
Mencaroni Spartaco
143
Il flemmone pancreatico è la massa di tessuti adiacenti interessati dal processo di flogosi e necrosi: alla TC
assume un aspetto eterogeneo, con presenza di bolle aeree ed aree di necrosi nel contesto.
PANCREATITE CRONICA
Ci sono due tipi di lesione, la forma calcificata (in cui si ha come fattore provocante in genere l’abuso di
alcool) e la forma ostruttiva, provocata dalla presenza di lesioni che ostruiscono il dotto pancreatico.
L’esame diretto dell’addome identifica 1/3 delle calcificazioni.
L’ecografia invece dimostra la diminuzione di volume per atrofia parenchimale, e un aumento
dell’ecogenicità in relazione alla fibrosi della ghiandola.
La TC è un esame di conferma della dilatazione della ghiandola e dei dotti, della sua sostituzione
fibroadiposa, e dimostra calcificazioni o calcoli che ostruiscono il dotto in misura maggiore delle altre
metodiche.
Per l’individuazione delle forme iniziali di pancreatite cronica è del tutto fondamentale la ERCP; il dotto di
Wirsung può presentare solo piccole variazioni di calibro, ma i dotti secondari appaiono già dilatati e tortuosi,
spesso infiltrati.
Nelle forme conclamate le alterazioni sono più grossolane e sono facilmente diagnosticabili.
NEOPLASIE PANCREATICHE ESOCRINE
Sono adenocarcinomi che originano dall’epitelio dei dotti.
Il carcinoma del pancreas è rappresentato per il 90% da adenocarcinomi duttali (cellule del dotto di
Wirsung), mentre le forme a cellule insulari costituiscono il restante 5%. La testa del pancreas è
interessata in maniera doppia, circa il 50% dei casi, rispetto al corpo (30%) e alla coda (20%).
Si sviluppa attorno ai 50 anni, M = F, incidenza 10/105.
Eziologia
Fattori di rischio certi sono:
• Fumo di sigaretta
• Caffè
• Dieta iperlipidica
• Pancreatite cronica
• Contatto prolungato con i derivati del benzene
Non sono invece associati a fattori di rischio eventi come alcolismo, diabete, colecistotomia.
Clinica
Se si esclude l’ittero, i sintomi di esordio sono in genere abbastanza insidiosi. L’ittero invece ha comparsa
improvvisa, senza dolore iniziale, ed è provocato dall’ostruzione del coledoco. Infatti il tumore si accresce
nel lume e invade la parete, obliterando il dotto.
Una volta che questo evento ostruttivo si è verificato, si manifestano i segni della clinica, ma è comunque
ormai troppo tardi per intervenire: il 98% delle persone che sviluppano una neoplasia pancreatica muoiono
per le sue conseguenze.
• Dispepsia
• Perdita dell’appetito
• Astenia
• Calo ponderale (sempre presente, per malassorbimento e per anoressia)
• Dolore epigastrico a sbarra, spesso notturno, esacerbato dal cibo, di difficile controllo, che spesso
richiede oppiacei, quando soprattutto si verifica una infiltrazione dei nervi splacnici e del peritoneo. E’
più forte se associato a neoplasie del tronco e della coda, ed è caratteristicamente attenuato dalla
flessione delle gambe sul bacino.
• Urine ipercromiche
• Feci di aspetto chiaro
• Prurito
• Regola di Courvoisier: colecisti distesa e palpabile in assenza di colangite e senza colica biliare fa
ipotizzare una neoplasia del pancreas.
Più raramente, il tumore può comprimere le strutture vicine, dando ipertensione portale e splenomegalia.
http://www.hackmed.org
[email protected] 144
Mencaroni Spartaco
La malattia ha una diffusione locale molto rapida, perché il pancreas non ha la tonaca sierosa essendo un
organo retroperitoneale.
Per contiguità diffonde rapidamente a duodeno, stomaco, vasi retroperitoneali.
Diffonde anche rapidamente per via linfatica e per via celomatica.
Diagnosi
La diagnosi precoce di questo carcinoma è molto difficile: infatti i sintomi e la clinica danno una evidenza
minima soltanto quando la neoplasia si è già diffusa: questo accade per la rapidità di diffusione metastatica.
I marker che esistono sono due:
CEA: sensibile ma poco specifico
CA19.9: sensibilità 81%, specificità 90%; non è però precoce. Attualmente si cerca di usarlo come
programma di Screening.
• Ecografia: associata allo studio radiologico con mezzo di contrasto per escludere ulcera peptica ed ernia
iatale. Riesce a volte ad evidenziare, con scarsi risultati, la neoplasia come una lesione nodulare solida
iperecogena che si associa ad ectasia del Wirsung a monte. Nelle localizzazioni cefaliche è frequente
l’infiltrazione del coledoco. I vasi pancreatici infiltrati possono essere dimostrati al color doppler.
• TAC: eccellente capacità prognostica, nella stadiazione e nella valutazione dell’operabilità. Il tumore ha
un coefficiente di attenuazione molto simile a quello del parenchima, quindi nelle scansioni dirette è
dimostrabile soltanto se provoca compressione di qualcosa. Invece con mezzo di contrasto assume il
tracciante meno del parenchima normale.
• RM: elevata sensibilità nell’individuazione di piccole lesioni ipointense in T1 e iperintense in T2
• Retrograda: diagnostica le stenosi del Wirsung. Pochi falsi negativi, permette la diagnosi differenziale
fra la pancreatite cronica, le forme di papillite stenosanti e il carcinoma.
• Agobiopsia con guida ecografica: conferma del sospetto clinico, evita l’intervento chirurgico, ma è
associata a rischio di disseminazione (seeding).
• Angiografia: permette di valutare l’estensione della massa.
Può essere importante la diagnosi differenziale fra pancreatite cronica e neoplasia, che si può fare osservando
la presenza di stenosi del coledoco bruca, con profilo irregolare e distorsione marcata.
NEOPLASIE ENDOCRINE
Sono una notevole quantità di APUD-omi (insulinoma, gastrinoma, VIPoma, somatostatinoma,
glucagonoma). Sono rari (1/105), spesso funzionalmente attivi, di grading abbastanza basso ma con tendenza
alla metastatizzazione anche precoce, e spesso le metastasi sono più aggressive del tumore originale.
Vengono in genere sospettati per la loro attività funzionale, che è maggiore nelle metastasi che non risentono
dell’effetto filtro del circolo epatico.
Si ricorre allo studio radiografico per confermare la presenza del tumore, localizzarlo e programmare
interventi di resezione, valutare la diffusione e per il follow up.
All’ecografia si osserva il tumore casualmente; la sensibilità migliora con la metodica transgastrica o
transesofagea.
L’indagine elettiva di studio è la TRC, che dimostra bene i tumori attivi anche se piccoli, in quando sono
dotati di grande vascolarizzazione e prendono bene il mezzo di contrasto.
La RM può essere una buona alternativa.
La scintigrafia è importante con traccianti recettoriali specifici anche perché dimostra la presenza di recettori
per la somatostatina, offrendo la possibilità di instaurare una terapia medica.
L’angiografia è importante per la possibilità di effettuare un cateterismo venoso mirato dell’asse
splenoportale, con accuratezza anche del 100% nella diagnosi degli insulinomi, localizzandoli sulla base
della provenienza della secrezione ormonale.
Mencaroni Spartaco
CAP
12
PATOLOGIA
145
DELLA
MILZA,
DEI
SURRENI
E
DELLO
SPAZIO
RETROPERITONEALE
12.1 STUDIO PER IMMAGINI DELLA MILZA
RX diretto
Consente di vedere l’ingrandimento della milza o la presenza di eventuali calcificazioni, associabili a
numerosi processi (esiti di flebiti, cisti da echinococco, aneurismi calcificati dell’arteria splenica, ascessi
calcificati, TBC miliarica). Minima importanza nella rottura della milza.
Ecografia
Molto efficace. Si usa per misurare i volumi e i diametri, ricerca e caratterizzazione di lesioni focali, ricerca
di ematomi e rotture traumatiche.
La milza ha ecostruttura solida omogenea con echi simili a quelli epatici, i margini possono normalmente
presentare indentazioni e setti.
TC
Come l’ecografia, dimostra meglio dimensioni e rapporto con le strutture vicine ma è indispensabile la
somministrazione di mezzo di contrasto angiografico perché altrimenti non si vede il parenchima.
La densità è uguale o inferiore a quella del fegato.
RM
Vantaggio di dimostrazione migliore dei rapporti della milza, efficiente nella dimostrazione di ematomi e di
accumuli di ferro. Milza segnale basso in T1 e alto in T2 rispetto al fegato, per via dell’elevato contenuto di
acqua.
Angiografia
Selettiva tripode celiaco, superselettiva arteria splenica; si può studiare il decorso venoso e praticare
procedure interventistiche come l’embolizzazione della milza in corso di ipersplenismo.
12.2 PATOLOGIA DELLA MILZA
SPLENOMEGALIA
Fenomeno frequente quando la milza si ingrandisce, per i suoi rapporti molto stretti con gli altri organi, è la
loro dislocazione. La milza induce una impronta sul tratto medio della curvatura gastrica, poi ingrandendosi
sposta lo stomaco avanti e medialmente. L’ultima struttura che viene dislocato è l’angolo di Treitz.
La splenomegalia fa parte dell’ipersplenismo, una condizione di aumento di volume della milza, riduzione
della crasi ematica e iperplasia midollare da iperproduzione. Il quadro si risolve con la splenectomia.
Spesso la diagnostica per immagini riesce a identificare sia la splenomegalia che la causa di ipersplenismo.
Ecografia e TC sono gli esami per dimostrare la variazione di volume dell’organo, mentre la scintigrafia con
emazie marcate permette lo studio del sequestro splenico dei globuli rossi.
L’arteriografia viene usata come interventistica per l’embolizzazione.
Alcuni tipi di splenomegalia hanno aspetti peculiari:
• Forme infiltrative (linfomi, istiocitosi, mononucleosi): ecografia rivela una struttura omogenea con echi
focali. La componente focale si identifica alla TC e RM (sensibilità 90% anche per lesioni piccole)
• Forme infiammatorie: ecostruttura con echi grossolani e più intensi della norma; alterazioni dei valori
di attenuazione del parenchima alla TC
• Forme congestizie (da ipertensione portale o ICC): diagnosi angiografica. Nelle forme acute la milza è
ingrandita e l’arteria splenica ancora normale, nelle forme croniche sia l’organo che l’arteria sono
entrambi ingranditi. La tecnica doppler permette lo studio dell’ipertensione portale. La TC è utile per
rilevare aneurismi dell’arteria splenica, complicazione dell’ipertensione portale.
INFARTO SPLENICO
Può complicare una splenomegalia, diagnosi differenziale con infarto del rene sinistro.
http://www.hackmed.org
[email protected] 146
Mencaroni Spartaco
Ecografia con color doppler e TC danno dimostrazione diretta dell’area infartuata, che appare ipoecogena
all’ecografia, e con ridotta captazione del mezzo di contrasto alla TC. E’ un’area rotondeggiante o più
caratteristicamente triangolare con apice all’ilo e base superficiale.
Difficoltà quando la zona infartuata è andata incontro a colliquazione. Diagnosi di certezza angiografica con
dimostrazione della trombosi vasale responsabile dell’infarto. La scintigrafia splenica, oggi meno usata, è
positiva dopo 24 ore.
ASCESSO
Molto raro, ma ad alta mortalità (65%).
All’RX diretto si può dimostrare a volte il livello idroaereo dentro l’ascesso (paziente in stazione eretta).
L’ecografia indica una lesione focale parenchimale a ecostruttura mista cistica e solida, la TC il classico
aspetto a bersaglio con centro ipodenso. Se il soggetto è in piedi, la densità del contenuto dell’ascesso appare
stratificata.
Nelle forme fungine non è infrequente il riscontro di piccoli ascessi miliarici.
LESIONI FOCALI
•
•
•
•
•
Cisti: rare, sono identificate spesso alla ecografia, TC e RM. Più frequenti da echinococco, oppure
pseudocisti da infarti o ematomi. Si identificano a volte alla RX diretta per la presenza di calcificazioni.
Tumori benigni: molto rari, in genere emangiomi importanti per la facile e pericolosa rottura. Oppure
linfangiomi che sono cisti multiple a parete sottile, meno di frequente a forma capillare o cavernosa.
Tumori maligni: in genere sarcomi molto aggressivi, alla TC come aree ipodense disomogenee con aree
di necrosi colliquativa all’interno, all’ecografia come aree ipoecogene.
Linfomi: lesione maligna più comune nella milza, raramente primitivo. Si manifesta come un
ingrandimento diffuso omogeneo, non differenziabile da altre lesioni focali infiltrative. L’aspetto è
aspecifico: ipoecogeno all’ecografia, ipodenso alla TC. Si identifica meglio dopo mezzo di contrasto, e la
diagnosi è posta con la biopsia.
Metastasi: poco frequenti, ad eccezione del melanoma che spesso preferisce la milza. Anche queste sono
lesioni focali di difficile differenziazione
ROTTURA DI MILZA
Secondaria a traumi penetranti, iatrogena, da traumi interni (facile per via del meccanismo di trazione
compressione sui legamenti splenici), o spontanea da processi patologici.
Nella rottura completa massiva immediata è positivo l’RX diretto dell’addome (associato al radiogramma
toracico):
• Velatura diffusa dell’addome con livello liquido in stazione eretta
• Ombra splenica ingrandita e sfumata; compressione su stomaco, rene e colon
• Compressione ben visibile sulla grande curvatura gastrica per edema ed emorragia nel legamento gastroilienale.
• Distensione gassosa da ileo adinamico
• Risalita e paralisi dell’emidiaframma sinistro
• Fratture costali a sx (25%)
Nelle rotture meno drammatiche e più piccole è importante l’ecografia e la TC alla ricerca di liquidi
peritoneali liberi e di liquidi dentro la milza penetrati tramite una breccia della capsula. Se l’emorragia è
sottocapsulare la TC e l’ecografia l’identificano piuttosto bene, permettendo anche un follow up del processo
patologico che spesso è trattato in maniera conservativa.
Nei casi dubbi si ricorre all’arteriografia superselettiva.
12.3 INDAGINE STRUMENTALE DELLO SPAZIO RETROPERITONEALE
Difficile identificare i processi patologici. Prima della TC questi venivano osservati solo indirettamente per
l’effetto sugli altri organi e strutture.
→ L’esame standard è la TC, che permette un ottimo contrasto fra la matrice connettivale adiposa e il
parenchima degli organi intraperitoneali e retroperitoneali. Permette l’identificazione dei linfonodi e del loro
ingrandimento, l’analisi delle raccolte fluide, la valutazione delle emorragie.
Si acquisiscono piani trasversali e si somministra mezzo di contrasto per os per opacizzare l’intestino. Se si
vogliono identificare i grossi vasi è necessario mezzo di contrasto iodato.
Mencaroni Spartaco
147
→ RM applicata di recente è molto efficace per l’ottimo contrasto fra le strutture retroperitoneali e le
capacità di studio diretto multiplanare.
Ideale per la valutazione dell’estensione di tumori retroperitoneali, e per differenziare recidive da esiti fibrosi.
→ Ecografia è limitatissima per via del tessuto adiposo e del meteorismo intestinale. Si usa per lo più con
tecnica doppler nello studio dei vasi addominali.
→ RX diretta addome può dare informazioni sull’infiltrazione o compressione del rachide da parte di
processi retroperitoneali.
→ Esami di complemento sono l’urografia, esame per OS del digerente o clisma DC per lo studio di una
patologia retroperitoneale che si sospetti di origine urinaria o intestinale. Aortografia e cateterismi
superselettivi sono usati per le procedure interventistiche di embolizzazione. Per il coinvolgimento
neoplastico della cava e dei linfatici (magari non ingranditi e non dimostrabili con la TC) possono essere
importanti rispettivamente la cavografia e la linfografia.
12.4 PATOLOGIA DEL RETROPERITONEO
RACCOLTE FLUIDE
Possono essere:
• Urinose: rottura delle cavità pieliche
• Flogistiche: infiammazione degli organi addominali profondi e dei piani muscolari epispinali
• Emorragiche: traumi o rottura di aneurismi
• Linfatiche: rottura del dotto linfatico o ampie linfoadenectomie
C’è continuità fra gli spazi retroperitoneali, quindi una raccolte pararenale anteriore, posteriore o iliaca può
trovarsi in ognuno di essi. La TC identifica agevolmente la raccolta e ne valuta l’estensione: il valore di
attenuazione diminuisce fino a diventare liquido. Le raccolte di vecchia data possono provocare ispessimenti
del connettivo circostante ed è difficile la diagnosi differenziale con gli ascessi. Con l’ausilio dei parametri
clinici e di laboratorio si fa spesso diagnosi di natura della raccolta stessa (anche perché a seconda della
composizione i liquidi raccolti hanno valori diversi).
La RM è analoga alla TC ma definisce meglio gli ematomi per il tipico comportamento paramagnetico
dell’Hb.
Ecografia quasi inutile, riconosce solo raccolte grosse e non riesce a definirne bene i margini.
Esame diretto addome solo grosse raccolte che possono rendere sfumata o non apprezzabile l’ombra degli
psoas. Gli ascessi possono essere visti se contengono un livello o calcificazioni.
L’aortografia può dare dimostrazione diretta degli stravasi ematici.
FIBROSI RETROPERITONEALE
Processo patologico primitivo o secondario che tende ad avvolgere a manicotto le strutture anatomiche
presenti. La forma primitiva è sconosciuta, le altre si formano in reazione a farmaci, interventi chirurgici o
versamenti.
L’indagine di elezione è la TC che dimostra il manicotto fibroso attorno a vasi o organi che ha densità
parenchimatosa che ben risalta nel connettivo lasso addominale.
L’ecografia è utile per la dimostrazione della compressione vasale con le tecniche doppler, ed è importante
per dimostrare una idronefrosi da compressione dell’uretere e posizionare una stomia.
Anche l’urografia è importante per dimostrare l’interessamento degli ureteri.
RM importante per quei pazienti con IR nei quali l’urografia o TC con mezzo di contrasto iodato sono
controindicati. Il tessuto fibroso ha bassa intensità in T1e T2.
La diffusione del mezzo di contrasto nella fibrosi indica una fase attiva, la sua assenza una completa sclerosi
irreversibile.
LINFADENOPATIE
Si diagnosticano in genere con la linfoadenografia che è l’unico esame in grado di evidenziare linfonodi
anche piccoli (TC solo maggiore di 1cm) e di fornire informazioni sulla natura del processo adenopatico. La
http://www.hackmed.org
[email protected] 148
Mencaroni Spartaco
RM fornisce informazioni simili alla TC ma non ha le controindicazioni al mezzo di contrasto, mentre
l’ecografia può valutare alcuni linfonodi situati sotto particolari finestre acustiche, in genere linfonodi
superficiali.
Per la sua semplicità rispetto alla linfoadenografia la TC è l’esame di prima istanza, e in caso di dubbio si
ricorre alla biopsia prima ancora che alla linfoadenografia (che però viene usata per l’estensione della
malattia di Hodgkin alle catene lombo-sacrali.)
TUMORI
Sono lesioni rare e quasi sempre maligne del connettivo (non si considerano le diffusioni linfatiche di altri
processi neoplastici), ma anche dei nervi o dei vasi, o di residui embrionali. Nell’85% dei casi sono maligne.
L’indagine di prima istanza per masse palpabili è l’ecografia che presenti i soliti limiti e se identifica le
masse queste appaiono in genere ipoecogene.
La TC è quindi indispensabile e permette la valutazione dell’estensione e i rapporti della massa. Il ruolo della
RM ha risultati migliori per la multiplanarità e una migliore risoluzione di contrasto (come sempre nel
differenziare parenchimi da uno stroma connettivale).
Entrambe le tecniche hanno un limite ad 1cm; lesioni molto grandi possono essere difficili da valutare in
relazione alla loro origine primitiva. Alcuni caratteri morfologici possono orientare verso la diagnosi di
natura benigna o maligna:
CRITERI BENIGNI
CRITERI MALIGNI
• Lesioni polilobate
• Lesioni rotondeggianti
• Margini irregolari
• Margini regolari
• Struttura disomogenea con aree liquide e necrosi
• Struttura omogenea
• Infiltrazione
• Separazione dalle strutture circostanti
La tecnica migliore per valutare l’infiltrazione delle fasce e delle strutture circostanti è la RM
Alcuni esami complementari sono:
• RX addome: evidenziazione aspecifica e tardiva delle masse e soltanto per compressione e spostamento
di organi visibili
• Urografia: utile per valutare dislocazione del rene e dell’uretere
• Esame contrastografico tubo digerente: masse a partenza intestinali
• Arteriografia: studio della vascolarizzazione del tumore e chemioembolizzazione
• Linfografia: studio di cisti linfatiche e linfangiomi
12.4 SURRENE
La diagnostica per immagini si propone di identificare con esattezza la natura delle sindromi iperfunzionanti
del surrene (adenoma, iperplasia o carcinoma?). In questo è fondamentale lo studio con la TC, la RM e
soprattutto la scintigrafia, secondaria l’ecografia.
Inoltre altri obiettivi sono:
• Ricerca e indagine di metastasi surrenaliche
• Identificare e indagare masse surrenaliche
ESAMI STRUMENTALI
RX diretto
Interesse limitato alla ricerca di calcificazioni surrenali patologiche come in corso di Addison o TBC, o in
alcuni tumori o cisti.
TC
Indagine sempre di prima istanza nello studio del surrene, nel quale fornisce immagini molto espressive per
via del contrasto naturale indotto fra grasso retroperitoneale circostante e tessuto parenchimale. I surreni si
acquisiscono in una sola scansione spiroidea, dopo somministrazione di mezzo di contrasto iodato. Il mezzo
di contrasto orale baritato permette di differenziare le masse surrenaliche dalle anse intestinali.
Nell’analisi dei noduli surrenalici è importante l’analisi dei valori densitometrici, per i quali un valore
inferiore a a0 è indice di una massa benigna, superiore a 20 di una maligna (sospetti da indagare alla RM)
Mencaroni Spartaco
149
RM
In genere in seconda istanza per l’analisi differenziale delle masse e per la valutazione dei rapporti con gli
organi circostanti dei processi patologici del surrene (vantaggio della multiplanarietà).
Le tecniche di soppressione del grasso hanno un eccellente rilievo per l’identificazione della presenza di
tessuto adiposo patologico.
Ecografia
Difficile lo studio del surrene, specie a sinistra. Nel complesso fornisce risultati inferiori a TC e RM.
L’indagine identifica le lesioni benigne e maligne come masse ipoecogene e a struttura eterogenea.
Con le tecniche doppler identifica il coinvolgimento delle strutture vascolari di aorta e vena cava.
Angiografia
Metodiche arteriografiche e anche flebografia per prelievi selettive. Unica indicazione oggi rimasta è la
determinazione di origine di grosse masse pararenali dubbie.
Il cateterismo è inizialmente dell’aorta, e in seguito selettivo della diaframmatica media, della surrenalica e
della renale.
La flebografia è diretta alla vena surrenalica di ciascun lato, con iniezione lenta del mezzo di contrasto.
Importante anche per la diagnosi del feocromocitoma, nel quale l’assorbimento del mezzo di contrasto è
caratteristicamente intensa, disomogenea e spesso compare un orletto iperdenso espressivo della
ipervascolarizzazione periferica.
TUMORI BENIGNI
Adenoma
Responsabile del 20% dei Cushing. Alla TC appare come un nodulo in genere piccolo (3cm), rotondeggiante
e a margini indefiniti. Per l’elevato contenuto lipidico ha di solito valori bassi. Il surrene controlaterale può
apparire atrofico.
Alla RM il segnale può essere isointenso con il parenchima epatico in T1 e in T2.
Non sempre è facile la diagnosi differenziale con l’iperplasia surrenalica senza la biopsia.
Mielolipoma
Neoplasia benigna non funzionante e rara; ha significato clinico se aumenta di dimensioni e da luogo ad
emorragie.
All’ecografia è molto iperecogeno con aree ipoecogene all’interno: infatti è costituito da tessuto adiposo nel
quale sono annidate aree di tessuto ematopoietico.
La TC e la RM sono poco importanti per la scarsa rappresentazione del tessuto adiposo.
Cisti surrenaliche
Lesioni rare, in genere esiti di pregressa emorragia o parassitarie. Hanno diametri variabili, forma
rotondeggiante e margini definiti. Meno spesso presentano calcificazione a guscio d’uovo.
La presenza dell’emorragia induce valori elevati alla TC e all’RM in T1 (presenza di metaemoglobina).
EMORRAGIA SURRENALICA
Traumi da parto, ipossia e sepsi neonatale sono le cause più frequenti.
L’indagine di prima istanza è l’ecografia, ed evidenzia un area iperecogena disomogenea, che
progressivamente si riduce di dimensioni e diventa ipoecogena. La diagnosi differenziale viene fatta con il
color doppler per l’assenza di segnali di flusso.
La TC nell’adulto è l’esame principale ed evidenzia un’area iperintensa che tende a rapida scomparsa.
Alla RM l’aumento di segnale in T1 non si ha sempre: all’inizio l’emoglobina è ossigenata, e la
metaemoglobinemia, responsabile dell’aumento del segnale, si ha solo dopo qualche ora, e dura poco perché
poi si forma emosiderina.
NEOPLASIE MALIGNE
Feocromocitoma
Nel 10% dei casi è maligno e può recidivare e metastatizzare.
L’indagine di prima istanza è la TC, estesa a tutto l’addome, che evidenzia una massa di dimensioni variabili,
disomogenea per densità con lacune necrotiche, che va incontro a marcato assorbimento del mezzo di
contrasto per ipervascolarizzazione (soprattutto al bordo con formazione di un orletto opaco).
La RM è utile nella stadiazione in sede atipica, come fra la cava e l’aorta.
http://www.hackmed.org
[email protected] 150
Mencaroni Spartaco
Carcinoma primitivo
Rara, funzionante nel 50% dei casi, la lesioni si identifica alla TC come una massa di grandi dimensioni a
struttura disomogenea (calcificazioni, necrosi lacunari), spesso invasiva localmente, soprattutto infiltrante la
vena cava superiore e la vena surrenalica.
L’assenza di tessuto adiposo permette la diagnosi differenziale con adenomi di grosse dimensioni.
Alla RM si osserva, per la multiplanarità, una migliore definizione dei rapporti con il fegato e il pancreas.
Metastasi
Frequenti. Si originano spesso da:
• Mammella
• Polmone
• Tiroide
• Melanomi
•
• La differenziazione con adenomi poggia sull’elevato valore alla TC (maggiore di 20), e sulla
iperintensità in T2. Nella diagnosi differenziale andranno considerati anche il feocromocitoma e il
carcinoma primitivo surrenalico. La validità dell’approccio TC e RM limita la necessità di ricorso
all’agobiopsia.
•
Mencaroni Spartaco
CAP 13 APPARATO
151
URINARIO
13.1 ESAMI STRUMENTALI
RX diretto
Spesso è il primo approccio, previa pulizia intestinale. Radiogramma AP con raggio centrato sull’ombelico.
Si riesce a riconoscere:
• Ombre renali: meglio se il tessuto adiposo perirenale è molto rappresentato; il rene destro è di solito
lievemente inferiore di dimensione a quello sinistro e sta più in alto per la presenza del fegato. I contorni
sono netti e regolari.
• Decorso degli ureteri: presenza di calcificazioni e calcoli
• Regione vescicale: se distesa, la vescica è apprezzabile come tenue opacità che presenta nella donna
l’impronta dell’utero.
Si vedono poi le ossa e i margini del muscolo psoas.
Urografia
Studio morfologico delle vie urinarie e informazioni anche sul parenchima midollare e corticale; può dare
una certa stima anche della funzionalità renale residua osservando il parenchima che prende il mezzo di
contrasto.
Si inietta in bolo o per fleboclisi un mezzo di contrasto specifico “uroangiografico” che ha una buona
filtrazione renale e quindi opacizza l’urina.
Di solito si introducono per fleboclisi 100 ml di mezzo di contrasto a concentrazione di iodio di 300 mg/l in
7 minuti, o 250 ml a 150 mg/l in 12 minuti. Le vie urinarie vengono ben dimostrate anche senza nessuna
preparazione del paziente.
Dopo 2 ore il 65% del mezzo di contrasto è stato filtrato dal glomerulo, il 90% dopo 6 ore.
Esistono anche altre tecniche oggi meno usate.
Si distingue nel contesto dell’esame tre fasi, corrispondente al passaggio del mezzo di contrasto lungo i vari
distretti renali:
• Fase nefrografica: aumento poco rilevante dell’ombra del parenchima renale, per la diffusione del mezzo
di contrasto nel parenchima. Da 0 a 15 minuti dopo l’infusione; aree non funzionanti del rene (cisti,
tumori, caverne…) si evidenziano come lacune nel riempimento parenchimale.
• Fase calicopielografica: calici, ampolla e inizio degli ureteri sono visibili già 2-3 minuti dopo l’infusione
del mezzo di contrasto. I calici di 3 ordine (corrispondenti all’apice delle papille) sono visibili come una
coppa se presi di profilo, ad anello se presi davanti, e sono 8; quelli di secondo sono in genere 4, quelli di
primo sono due, e confluiscono nella pelvi renale. Nell’uretere sono presenti dei restringimenti fisiologici,
uno a livello della giunzione con la pelvi e l’altro all’incrocio con l’iliaca esterna. Altro restringimento è
a livello della porzione transmurale nella vescica.
• Fase cistografica: si inizia a opacizzare la vescica già dopo 30’ dall’iniezione del bolo. Si proietta davanti
al coccige e al sacro, e nella donna ha l’impronta dell’utero sovrastante. Invitando il paziente ad urinare
si può osservare il residuo minzionale.
Indicazioni elettive all’urografia sono:
• Cause di ematuria
• Calcoli renale o ureterale (calcoli trasparenti, studio della funzione renale)
• Lesioni del parenchima renale (TBC, necrosi papillare e midollare)
• Ricerca di anomalie congenite e acquisite, in fase preoperatoria
• Studio dei tumori delle vie urinarie
Pielografia
Introduzione diretta nelle vie urinarie di un mezzo di contrasto opaco o gassoso. Realizzata tramite tre
modalità.
http://www.hackmed.org
[email protected] 152
Mencaroni Spartaco
→ Pielografia retrograda
mezzo di contrasto uroangiografico iniettato a bassa pressione nelle vie urinarie dopo cateterizzazione di uno
o entrambi gli ureteri.
Trova indicazione per:
• Analisi delle vie escretrici in caso di rene non visibile all’urografia
• Dimostrazione di alcune malformazioni come l’uretere a fondo cieco
• Fase preliminare di procedure interventistiche sulle vie urinarie
•
• → Pielografia anterograda transcutanea
• Puntura all’altezza dell’apofisi della II vertebra lombare, penetrazione per 7-8 cm. Si controlla l’ingresso
dell’ago con aspirazione di urina, e poi si inietta sotto controllo radioscopico mezzo di contrasto iodato a
bassa pressione. Utile per valutare ostruzione ureterali alte in paziente con controindicazioni all’urografia.
•
• → Pielografia anterograda transnefrostomica
• viene praticata in genere quando esiste già una nefrostomia per motivi terapeutici, ed è una valida
alternativa alla forma transcutanea. Viene fatta in genere per controllare lo stato degli ureteri dopo
l’intervento
Cistografia
Studio della vescica tramite infusione di mezzo di contrasto diretta dopo evacuazione del contenuto urinario
di circa 250 ml di mezzo di contrasto diluito.
Si può anche aggiungere la documentazione della minzione (cistouretrografia minzionale) in maniera
dinamica.
E’ poco frequente anche perché la vescica si analizza molto bene con l’ecografia
Ecografia
Prima istanza in diverse condizioni di alterazione sia morfologica che funzionale nel rene. Negli ureteri è
meno efficace per via del decorso profondo senza finestre acustiche, mentre la vescica è anch’essa molto ben
esplorabile poiché a contatto con la parete addominale anteriore.
Il rene presenta un aspetto ovale, con una zona centrale molto ecogena che è la pelvi (le vie escretrici, se non
dilatate, non sono visibili). La zona circostante è ipoecogena, e in essa si evidenzia a volte il profilo delle
piramidi midollari.
Il flusso ematico renale è ben visibile al doppler, anche se nel rene sinistro l’arteria è mal visualizzabile per
la mancanza di una finestra acustica.
Displasie, idronefrosi e masse renali vengono indagate primariamente e direttamente all’ecografia.
Importante anche nello studio di IR, ipertensione nefrovascolare e nell’esecuzione ecoguidata di biopsie.
La vescica ha la parete iperecogena, continua e regolare; la vescica ben distesa ha il lume ampio, con
struttura ecogena liquida, che permette di valutare il residuo post-minzione. La parete e il meato ureterali
possono essere studiati finemente con ecografia per via cistoscopica (con questa metodica si individuano
tumori della parete di diametro fino a 2 mm).
La determinazione di calcoli è molto accurata nella pelvi e nella vescica, molto meno negli ureteri.
TC
Riesce a studiare molto bene sia i reni che gli ureteri e la vescica. La scansione renale diretta va bene per
l’analisi delle masse, mentre lo studio funzionale del parenchima e della vascolarizzazione è necessario il
mezzo di contrasto iodato.
La vescica prende il mezzo di contrasto subito nella parete (studio della vascolarizzazione di lesioni focali) e
dopo 10-15 minuti si opacizza l’urina (studio funzionale della vescica).
Il rene viene ben definito come struttura e rapporti, e il mezzo di contrasto permette anche di differenziare la
corticale dalla midollare. Sono sempre ben visibili i vasi e la fascia di Gerota (mentre la capsula renale no).
Gli ureteri si evidenziano molto bene soprattutto dopo la fase di filtrazione del mezzo di contrasto, e la
vescica è ben delimitata esteriormente dal tessuto adiposo pelvico, internamente dal lume a contenuto liquido.
Mencaroni Spartaco
153
Indicazioni alla TC:
• Traumi renali (indagine di prima istanza)
• Ostacolo al deflusso urinario
• Masse renali (tutte le caratteristiche morfologiche, follow up postoperatorio)
• Dislocazioni delle vie urinarie
• Infezioni renali
• Litiasi (se altre indagini non sono efficaci)
• Stadiazione del carcinoma vescicale
RM
Indagine alternativa alla TC, vantaggiosa in quanto dispone di mezzo di contrasto meno impegnativo per il
rene, multiplanarità e una migliore risoluzione di contrasto.
Esistono inoltre particolari sequenze studiate per identificare selettivamente i fluidi (uro-RM). Le vie urinarie
vengono distese con un mezzo paramagnetico speciale. Esiste anche la possibilità di utilizzare l’angio-RM
per lo studio dei vasi renali.
In T1 è ben riconoscibile tutto il parenchima renale, le cavità pieliche diventano iperintense in T2; la fascia
di Gerota in T1 si riconosce bene perché è una struttura fibrosa a bassa intensità in mezzo al tessuto adiposo
molto intenso.
Ureteri distesi da urina sono ben distinguibili (basso segnale in T1, alto in T2).
La vescica ha un lume che per contrasto urinario è come gli ureteri (alto in T2 basso in T1). La parete da
media intensità e si differenzia dal lume molto bene in T2, dal grasso perivescicale meglio in T1.
Indicazioni alla RM sono:
• Caratterizzazione di natura della masse renali (non comprese alla TC)
• Identificazione del contenuto emorragico di cisti
• Complicanze postoperatorie e rigetto acuto del trapianto
• Stadiazione del carcinoma renale in particolare estensione della trombosi venosa neoplastica
• Stadiazione del carcinoma vescicale
• Valutazione di stenosi e aneurismi dell’arteria renale.
Angiografia
Importante nell’ipertensione nefrovascolare dove assume ruolo terapeutico per il posizionamento di stent ed
esecuzione di PTA.
Inoltre è possibile l’identificazione di grosse lesioni neoplastiche vascolarizzate e il contemporaneo
trattamento embolizzante.
L’esame inizia dall’aortografia addominale con determinazione delle arterie renali, e il cateterismo selettivo
di una di esse. Si può fare la flebografia renale allo scopo di misurare la renina.
13.2 PATOLOGIA MALFORMATIVA DELL’APPARATO URINARIO
DISMORFIE
Alterazioni di numero e posizione
• Rene unico: rara, maggior frequenza nel maschio. Il rene unico ha una maggiore possibilità di essere
posto in sede ectopica, e viene di solito ad avere una cavità pielica più grande. E’ di dimensioni circa
doppie del normale.
• Rene soprannumerario: per essere tale deve essere fornito di vie escretrici e di vascolarizzazione
autonoma. Di solito più piccolo del normale, si situa al di sopra o al di sotto di quello normale dello
stesso lato, dal quale è separato o unito da un sottile istmo. L’uretere decorre fra quelli normali, oppure si
infila in uno di essi, o ancora può sboccare in vescica o anche fuori di essa.
• Fusione dei due reni: il rene migra dalla pelvi alla sede lombare ruotando contemporaneamente e nel
frattempo separandosi in due masse che diventeranno i reni definitivi. Il rene unico rimane in sede
pelvica come una massa unica, bilobata, dalla quale si dipartono le vie escretrici indipendenti.
• Ectopie semplici:
o Per difetto: un rene rimane in sede pelvica, l’altro è in posizione normale o manca. L’uretere
è molto corto e si associa a malrotazione
http://www.hackmed.org
•
[email protected] 154
Mencaroni Spartaco
o Per eccesso: un rene risale eccessivamente fino a collocarsi in una ernia diaframmatica
Ectopia crociata:
o Semplice: un rene si situa dal lato dell’altro. Il rene deviato si riconosce per l’anomalo
decorso dell’uretere, che attraversa la linea di mezzo e sbocca in vescica dal suo lato. Di
solito il rene ectopico si situa al di sotto di quello normale, talvolta fondendosi con esso.
o Bilaterale: i due reni sono entrambi deviati verso il lato opposto, con incrociamento degli
ureteri al di sopra della linea mediana
Queste malformazioni, che possono rimanere silenti per tuta la vita anche se aumentano il rischio di infezioni
e calcolosi, si diagnosticano anche a TC ed ecografia, ma l’esame di elezione per il loro studio è l’urografia.
Anomalie di forma e volume
Aplasia renale
Quella bilaterale è incompatibile con la vita. In quella monolaterale il rene normale è ipertrofico e spesso
ectopico, con alterazioni della via escretrice.
Si valuta con ecografia, urografia e nei casi dubbi alla TC.
Ipoplasia renale
Presenza di un rene di volume inferiore alla norma e insufficientemente sviluppato, con struttura abbozzata
(spesso un solo calice). Quella monolaterale solitamente è una condizione asintomatica, ma può anche dare
una persistente piuria dal lato interessato, e a volte ipertensione arteriosa.
Quella bilaterale si accompagna di regola a sintomi simili alla nefrite cronica con creatininemia e azotemia
elevate e sintomi di rachitismo.
Quando è presente ipertensione arteriosa risulta importante una diagnostica accurata del rene responsabile;
spesso l’ecografia è sufficiente e la diagnosi può avvenire anche per caso durante altri controlli. Anche
l’urografia (anterograda e retrograda) possono essere importanti per la diagnosi di contemporanee anomalie
delle vie escretrici.
La prognosi della forma unilaterale è del tutto benigna e l’ipertrofia compensatoria del rene sano permette
una vita del tutto normale, mentre la forma bilaterale è grave.
E’ detta armonica quando il rene e il suo sistema escretore sono piccoli ma normali, disarmonica se sono
presenti anche anomalie della via escretrice.
Iperplasia renale
Aumento numerico dei lobi, delle piramidi e delle papille, non legate ad una forma di ipertrofia
compensatoria. Non ha interesse clinico se non per la compressione che il rene può esercitare sugli organi
vicini.
Displasia
Alterazione della composizione del parenchima e della morfologia del rene. Spesso si associa alla presenza
di una duplicazione della via escretrice e la porzione displastica è quella che si associa alla via escretrice
soprannumeraria.
Anomalie di fusione: rene a ferro di cavallo
E’ una anomalia abbastanza frequente, circa 1:400 e colpisce spesso il sesso maschile (2:1). Si tratta della
fusione dei due reni (poli superiori o inferiori) davanti alla colonna vertebrale. L’istmo che unisce i due reni
è spesso fibroso e poco vascolarizzato. Se non c’è interessamento della via escretrice, l’anomalia è
compatibile con la vita.
Spesso la fusione rende impossibile la rotazione interna del rene e quindi i bacinetti e la pelvi sono orientati
verso l’avanti. In genere quindi gli ureteri passano al di sopra dell’istmo.
A volte anche l’istmo presenta un uretere. Le arterie sono in genere molteplici (da 1 a 10) rendono complesse
le manovre operatorie.
La fusione dei poli inferiori è molto più comune della fusione dei poli superiori.
Sintomatologicamente, il rene a ferro di cavallo può dare dolori soprattutto nella posizione eretta, spesso
vaghi e mal definiti, che spesso si accentuano nella iperestensione della colonna (segno di Rovsing).
L’ammalato quindi assume una postura lievemente flessa.
Mencaroni Spartaco
155
Si diagnostica con l’esame diretto addome, ma la diagnosi di conferma è urografica.
Displasia renale cistica
Esistono fondamentalmente tre tipi di displasia renale cistica. In entrambe il tessuto normale si accompagna
alla presenza di tessuto non renale e di cisti diffuse.
• Rene multicistico: forma estrema di displasia nella quale il parenchima renale è totalmente sostituito da
un ammasso di formazioni cistiche. L’uretere è costantemente atresico. E’ di solito unilaterale; il rene
malato all’RX appare come un’ombra opaca prima di calcificazioni, mentre l’eco rivela bene la natura
cistica del processo. Il bilancio funzionale è valutato alla scintigrafia, mentre l’urografia con mezzo di
contrasto da tutte le informazioni desiderate ma viene usata di rado per la grande quantità di mezzo di
contrasto necessario; infatti il rene cistico non è silente, ma fra le cisti ci sono residui di parenchima
funzionante, che prendono il mezzo di contrasto facendo apparire il resto come una serie di aree lacunari
• Rene policistico infantile: bilaterale e simmetrica, a prognosi sfavorevole, è tanto più grave quanto
precocemente insorge. Il quadro ecografico è sufficiente alla diagnosi, con aumento delle dimensioni
renali, incremento dell’ecogenicità e cisti multiple di diametro inferiore a 2 cm. L’urografia distribuisce
il mezzo di contrasto in maniera maculare all’interno del parenchima nelle cisti e la sua escrezione nelle
vie urinarie è molto tardiva (anche 24 ore).
• Rene policistico dell’adulto: forma meno grave, a insorgenza tardiva. Le cisti sono soprattutto corticali;
la malattia è di solito bilaterale con un lato più interessato. A differenza della forma infantile, le cisti
espandendosi perdono continuità con i tubuli, e non si ha la loro opacizzazione urografica. Ecografia e
TC sono gli esami di elezione; il parenchima residuo ha ecogenicità aumentata. All’urografia le cisti
appaiono come aree di lacuna del riempimento, caratteristica della forma adulta
11.3 CALCOLOSI URINARIA
Il calcolo è una concrezione formata da sostanze organiche o inorganiche che prendono origine talvolta nei
serbatoi o nei canali escretori dell’apparato urinario.
La calcolosi delle vie urinarie è un fenomeno abbastanza diffuso nella popolazione:
• 50 anni Æ 17/1000
• 60 anni Æ 46,5/1000
Alcuni fattori sembrano legati all’aumento della calcolosi:
• Razza (aumento in popolazione euroasiatica)
• Età (3°-5° decade)
• Sesso (M 3:1)
• Ereditarietà (per lo più nella calcolosi uratica, vedi)
• Geografia (USA, Europa, India)
• Clima (alte temperature, clima secco Æ disidratazione)
• Dieta (calcio, ossalati, dieta ipeproteica, scarso apporto idrico)
Ci sono 5 tipi di calcoli che hanno alla base della loro genesi molti meccanismi, in parecchi casi comuni:
1. Calcoli di calcio: ossalato di calcio, fosfato di calcio, carbonato di calcio, misti
65%
2. Calcoli di urea
23%
3. Calcoli fosfo-amino-magnesiaci: legati alle infezioni, in diminuzione
2,5%
4. Calcoli cistinici
0,5%
5. Calcoli misti: di solito infezione sopra un nucleo di calcio o urato
9%
Esistono due diversi modi di formare calcoli, e diversi fenomeni che sono implicati in misura varia nella
litogenesi. I modi sono la nucleazione eterogenea e omogenea.
• Soprasaturazione delle urine: secrezione nelle urine di materiali insolubili in quantità tale da superare
il prodotto di solubilità per quelle sostanze e provocarne quindi la precipitazione. Queste sostanze
precipitano su aggregati omogenei della stessa composizione (nucleazione omogenea)
• Produzione di una matrice proteica nell’urina: questa facilita la precipitazione delle sostanze
insolubili eventualmente presenti nelle urine, e si creano quindi dei precipitati composti da un nucleo
proteico sul quale si addensano materiali diversi (nucleazione eterogenea)
I fattori che possono favorire l’uno o l’altro modo di nucleazione sono:
http://www.hackmed.org
•
•
•
•
•
•
•
•
[email protected] 156
Mencaroni Spartaco
Aumento di secrezione di una sostanza insolubile: determina il tipo di calcolo che si crea. Come
meglio vedremo dopo, queste sostanze possono essere calcio, urati, ossalato, cistina, xantina, diossido di
silicio.
Deficit di fattori inibitori: nelle urine esistono molte sostanze che hanno lo scopo di impedire
l’avvenimento delle nucleazioni inibendo la formazione dei cristalli, come magnesio, pirofosfato,
nefrocalcina, rna, proteina di Tamm Horsfall non polimerizzata. Questi sono importanti perché nell’arco
delle giornate e dei mesi possono verificarsi variazioni importanti del volume urinario e queste sostanze
impediscono la precipitazione inopportuna di sostanze insolubili.
Variazioni delle urine: aumento del pH, diminuzione del volume.
Aumento dei fattori favorenti la formazione dei cristalli: urato sodico colloidale e proteina di Tamm
Horsfall polimerizzata.
Presenza di nuclei litogeni: corpi estranei, tessuto necrotico, matrice mucoproteica che a volte può
anche essere l’unica componente di certi calcoli
Anomalie strutturali come il rene a ferro di cavallo o le ectopie.
Stasi urinaria
Infezioni
Diagnostica radiologica
Il paziente con colica renale che giunge all’osservazione ha nel 95% dei casi un calcolo. Quindi lo studio
delle vie urinarie in questa situazione ha come scopo:
• L’identificazione dei calcoli
• Il loro studio morfologico e dimensionale
• La ripercussione del calcolo nelle vie escretrici (nefropatia ostruttiva)
Fino a 4 mm il calcolo migra spontaneamente e viene espulso. Sopra a 6 mm sono frequenti le complicanze.
Esame radiografico diretto
La radiografia diretta addome, in varie proiezioni per differenziare i calcoli renali da quelli biliari e dai
linfonodi, riesce ad identificare accuratamente tutti i calcoli radiopachi. L’opacità dei diversi tipi di calcoli è
variabile:
• Radio opachi: fosfato di calcio, ossalato di calcio, carbonato di calcio, calcoli misti (UTI)
• Debolmente opachi: fosfato di ammonio-magnesio (struvite), cisteina
• Trasparenti: urato, xantinici, ammonio
Circa il 95% dei calcoli comunque sono quelli radiopachi. Fattori limitanti sono la difficoltà di una
preparazione ben accurata dell’intestino che è responsabile di un notevole miglioramento diagnostico
(diminuzione FN), la dimensione del calcolo, le sovrapposizioni ossee.
FP sono prodotti da calcificazioni esterne alle vie urinarie che si proiettano su di esse. L’accuratezza è nel
complesso però elevata (90%). Alcuni tipi di calcoli hanno caratteristiche peculiari:
• della pelvi e del bacinetto → a stampo
• dell’uretere → piccoli e rotondeggianti od ovali
• della vescica → grandi, spesso giganti, a bersaglio. Possono essere situati su diverticoli
Ecografia
Dimostra calcoli radiopachi e trasparenti indifferentemente fino a 2 mm di diametro, in tutti i segmenti
urinari compresa l’uretra posteriore con sonde transrettali.
Tutti i calcoli appaiono come una formazione iperecogena con cono d’ombra sottostante (non sempre ben
visibile), e si accompagnano sempre a dilatazione della via escretrice.
L’eco mostra anche le alterazioni del parenchima renale e l’eventuale idronefrosi, mentre le complicazioni
infettive come ascessi o nefrite diffusa si dimostrano meglio alla TC.
Urografia
Trova indicazione nel dubbio di appartenenza di una immagine calcifica alle vie urinarie, e per l’analisi fine
dello stato delle vie urinarie (piccola idronefrosi, perforazione, compressioni o pinze da banderelle fibrose).
Mencaroni Spartaco
157
Non è controindicato fare l’urografia subito dopo la colica, anche se si vedrà peggio (stasi della peristalsi
ureterale da irritazione riflessa). Il ritardo di opacizzazione della via escretrice per questo motivo può essere
anche di 12-24 ore, durante le quali si vedrà solo il rene (questo non significa che vi sia una ostruzione
residua).
Pielografia
Indicata per studio di ostruzioni non chiarite all’RX o all’ecografia, con prudenza per le possibili
complicazioni infettive.
TC
Attualmente usata per identificare calcoli “difficili” e per valutare la presenza di complicazioni
infiammatorie o di altro tipo. Possibile uso come esame di prima istanza per la ricerca del calcolo data la sua
grande sensibilità.
Cenni di interventistica
• Tecniche percutanee: estrazione (litotomia) o distruzione (litotrissia) del calcolo dall’esterno,
realizzando preliminariamente un accesso nefrostomico sotto guida ecografica, da cui si fanno passare gli
strumenti. Complicanze 5-10%, ma costano poco e sono i facile esecuzione.
• Litotrissia extracorporea: bombardamento con generatori di vario tipo (elettrici, idraulici, magnetici) di
onde d’urto che frantumano il calcolo dall’esterno. Buona efficacia (85% dei calcoli) ma diversi limiti:
o Aritmie
o Obesità (le onde d’urto non raggiungono il calcolo)
o Anomalie della via escretrice che non consentono l’eliminazione dei frammenti
o Complicanze di ematomi renali
o Difficoltà di eliminazione dei frammenti
In queste procedure lo studio per immagini è importante per dare le informazioni che servono a programmare
l’intervento e per controllarne l’efficacia.
13.4 UROPATIA OSTRUTTIVA
L’uropatia ostruttiva è una condizione generale di ostacolo al deflusso dell’urina con dilatazione del tratto
escretore a monte e ripercussioni secondarie sul parenchima fino all’idronefrosi e alla distruzione del rene.
La sede dell’ostruzione condiziona l’interessamento bilaterale o unilaterale dei reni, e le cause possono
essere molteplici.
Ci sono due situazioni diverse che si possono creare:
• Ostruzione graduale con pressione che non supera il limite per la filtrazione glomerulare: la filtrazione
continua, il parenchima subisce meno danni e si ha dilatazione della pelvi e dei bacinetti. L’urina
prodotta viene in parte riassorbita dalle vene e dai linfatici della pelvi renale.
• Ostruzione acuta con pressione che supera quella di filtrazione glomerulare: arresto della filtrazione con
creazione di atrofia parenchimale da compressione e progressione all’IRC. La pelvi e i bacinetti non si
dilatano e si ha l’idronefrosi
La diagnostica per immagini cerca la causa di ostruzione ed effettua il monitoraggio sulle vie urinarie alla
ricerca delle complicazioni.
RX diretto
Individua i calcoli radiopachi ma nessuna complicazione renale
Ecografia
Dimostra i calcoli molto bene ma anche tutta una serie di segni diretti di uropatia ostruttiva. In ordine di
progressione del danno, questi sono:
• Dilatazione diretta della via escretrice a monte dell’ostruzione
• Progressiva distensione della pelvi renale, fino che appare come un’area ovalare ecopriva nel contesto
della massa del parenchima renale
• Distensione dei calici visibili come aree ecoprive di forma allungata all’interno del rene
• Se l’ostruzione prosegue, si formano aree ipoecogene nello spessore del parenchima e si osserva un
assottigliamento del parenchima
http://www.hackmed.org
[email protected] 158
Mencaroni Spartaco
Nell’ostruzione acuta, dove i segni di dilatazione sono meno specifici, si può osservare un aumento delle
resistenze vascolari renali al color doppler.
Urografia
Migliore dell’ecografia nel dimostrare la causa dell’ostruzione (specialmente se parenchimale) ma solo se la
funzionalità renale residua consente l’escrezione di una buona quantità di mezzo di contrasto. Anche la
dilatazione delle vie urinarie e della pelvi è dimostrata efficacemente.
Dimostra anche i reperti di ipertrofia prostatica (dilatazione delle vie urinarie simmetrica e bilaterale).
Pielografia
Sostituisce l’urografia in caso di rene non funzionante. Affiancata dall’uro-RM. E dalla TC, che dimostra
tutti i tipi di litiasi e i processi espansivi retroperitoneali causa di ostruzione.
13.5 GLOMERULONEFRITI E NEFROPATIE PARENCHIMALI
Le glomerulonefriti sono in genere moderatamente significative all’ecografia e all’urografia. L’esame di
elezione in questi casi è la immunofluorescenza e la biopsia renale, che permettono la diagnosi eziologica e
la stadiazione del processo di danno.
La diagnostica strumentale può però fornire alcuni tipi di informazione collaterale e osservare segni indiretti,
come:
• Il raggrinzimento renale e la riduzione di volume delle vie escretrici delle forme croniche
• Alterazioni del flusso in fase acuta e cronica rilevabili al doppler
• Emorragie alveolari e glomerulari della Goodpasture
Nelle nefropatie interstiziali acute può essere significativo il doppler che documenta una serie di
alterazioni di flusso legate all’edema interstiziale, e soprattutto la TC con la comparsa di aree ipodense a
margini sfumati.
Nelle nefropatie interstiziali croniche ci sono invece alterazioni più caratteristiche.
• Diminuzione di volume
• Incisione dei contorni renali di natura cicatriziale
• Spessore del parenchima diminuito specie nelle regioni polari
• Ecostruttura di densità aumentata
• Modificazioni morfologiche infiammatorie della papilla documentabili all’urografia
• Alterazioni scintigrafiche di fissazione del tracciante a livello corticale (alta sensibilità)
La necrosi della papilla di solito ischemica, si può associare alle pielonefriti o al diabete. Si identifica
piuttosto bene all’urografia come un processo progressivo di erosione a partenza dai calici di 3° ordine che si
estende verso la papilla “circondandola” e infine distruggendola.
Gli esiti finali, con una immagine cavitaria all’ilo, devono essere differenziati dalla cisti.
La nefrocalcinosi è una lesione caratterizzata dalla precipitazioni di sali di calcio nei tubuli e nell’interstizio,
legata a processi patologici renali o malattie sistemiche del metabolismo del calcio. Sono calcificazioni
puntiformi in genere midollari con risparmio della corticale, ben dimostrabile a RX diretta, ecografia e TC.
La TBC renale si forma generalmente per diffusione ematogena e interessa primariamente la corticale, dove
forma lesioni granulomatose nodulari isolate. Queste possono andare incontro ad una evoluzione detta
abortiva, con il confinamento del processo alla midollare entro una parete fibrosa, o ad una evoluzione
estensiva, con caseosi e diffusione delle lesioni a pelvi, ureteri e vescica.
Essenzialmente le alterazioni della via urinaria vengono estesamente e molto bene caratterizzate
dall’urografia, mentre le lesioni parenchimali a qualunque stadio sono ben dimostrate dalla TC. In presenza
di ostruzione di sospetta natura TBC che impedisce l’urografia si ricorre alla pielografia ascendente, mentre
in genere l’ecografia non consente rilievi specifici.
L’ascesso in genere deriva da una pielonefrite acuta, e si localizza sia all’interno del rene che nel
parenchima. All’ecografia assume l’aspetto di una massa a margini irregolari e contenuto liquido
corpuscolato.
Mencaroni Spartaco
159
La TC lo definisce meglio nei suoi rapporti. Spesso si trova gas all’interno della lesione e si fa subito
diagnosi di natura in maniera abbastanza agevole. Se l’ascesso si estende ai calici si ha la dimostrazione
all’urografia della penetrazione di urina al suo interno.
L’ascesso perirenale viene dimostrato sia per i segni di compressione e dislocazione del rene che per
l’osservazione diretta alla TC, che ne valuta la topografia, i rapporti con gli organi adiacenti e ne identifica
l’origine.
13.6 NEFROPATIE VASCOLARI
Infarto
Diagnosi agevole tramite scintigrafia renale con indicatori a fissazione corticale, e con l’ecodoppler che
dimostra l’assenza di flusso nella zona infartuata. Anche la TC con mezzo di contrasto dimostra l’assenza di
captazione. Arteriografia solo raramente necessaria.
Ipertensione nefrovascolare
Vedi capitolo sull’ipertensione
13.7 NEOPLASIE RENALI
Si possono classificare in:
1. tumori che colpiscono il parenchima renale
carcinoma a cellule renali
tumore di Wilms
2. tumori che colpiscono le vie urinarie
CARCINOMA A CELLULE RENALI (TUMORE DI GRAVITZ)
Rappresenta l’1-3% di tutti i tumori maligni viscerali e l’85-90% di tutti i tumori renali maligni.
Colpisce prevalentemente individui anziani (quinta-settima decade) con un rapporto M:F=2:1.
A causa del colore giallo e della somiglianza delle cellule renali con quelle della corteccia surrenale in
passato si riteneva che originasse da residui surrenali perciò veniva chiamato ipernefroma.
Oggi invece è stato dimostrato che origina dall’epitelio tubulare e che perciò si tratta di un
adenocarcinoma renale, il colore chiaro del citoplasma delle cellule neoplastiche deriva dall’estrazione dei
lipidi del citoplasma da parte dei fissativi nell’allestimento del preparato istologico.
Eziologia
Il tabacco è il maggior fattore di rischio appurato (r.r. : 2), poi sono emersi anche l’obesità, l’ipertensione, la
terapia estrogenica non bilanciata, l’esposizione all’asbesto e ai derivati del petrolio e ai metalli pesanti.
Condizioni frequentemente associate, ma non si sa se predisponesti sono l’IRC, la malattia cistica renale e la
sclerosi tuberosa (come l’angiomiolipoma).
Vi è una piccola quota (14%) di tumori renali familiari
Aspetto
Il carcinoma a cellule renali può originare da qualsiasi parte del rene ma più spesso si trova ai poli in
particolare quello superiore.
Al momento della diagnosi di solito la lesione è solitaria ed unilaterale e costituisce una massa sferica che va
dai 3 ai 15 cm, composta da tessuto grigio-giallastro brillante (giallo “zolfo”) che altera la configurazione del
rene.
Aumentando progressivamente di volume il tumore tende a diffondere verso i calici e la pelvi, cioè a livello
dell’ilo renale facendosi strada verso l’uretere.
Una caratteristica peculiare di questo tumore è la tendenza ad invadere la vena renale (avendo questa una
parete più sottile di quella dell’arteria) formando una colonna solida di cellule neoplastiche all’interno del
vaso. Ciò può determinare la formazione di un trombo neoplastico continuo nella vena cava inferiore. Se
questo processo avviene a SX si ha un varicocele cosiddetto “sintomatico” omolaterale
Raramente si ha l’invasione del grasso perirenale e del surrene.
Istologicamente il tumore può presentare vari aspetti architettonici:
1. papillare
2. solido
Spesso nei tumori si ha la commistione dei due aspetti.
http://www.hackmed.org
[email protected] 160
Mencaroni Spartaco
Clinica
I 3 sintomi classici sono rappresentati da:
1. Dolore costo-vertebrale
2. Massa palpabile
3. Ematuria di solito microscopica e capricciosa (intermittente con periodi di remissione piuttosto
lunghi) – è il sintomo più importante e frequente
Il tumore può rimanere silente finché non raggiunge grandi dimensioni, in quel momento può dare origine a
sintomi generalizzati quali febbre, malessere, astenia e perdita di peso. Le metastasi (ematogene) sono
precoci e frequenti e soprattutto non correlate alle dimensioni del tumore: le sedi principali di
metastatizzazione sono in ordine di frequenza:
9 polmone (50%)
9 ossa (33%) - metastasi prevalentemente osteolitiche al contrario del carcinoma prostatico
9 linfonodi regionali
9 fegato
9 surreni
9 encefalo
9 tiroide
nel 10-15% dei casi si possono anche avere metastasi nel rene controlaterale.
Le metastasi avvengono per via ematica attraverso la vena cava.
Una caratteristica tipica di questo tumore è quella di metastatizzare ampiamente prima di dare origine a
qualsiasi segno o sintomo locale: perciò può capitare ad esempio che un tumore in stadio avanzato si
manifesti con una frattura patologica causata da una metastasi a livello osseo.
Il quadro di crescita asintomatica può presentarsi in molti pazienti cosicché il tumore può aver raggiunto il
diametro di 10 cm al momento della diagnosi.
Talvolta invece può dare precocemente origine a numerose sindromi paraneoplastiche causate da una
disregolata produzione di ormoni tra cui:
9 Policitemia
9 Ipertensione
9 Ipercalcemia
9 Amiloidosi
9 Disfunzione epatica
9 Femminilizzazione o mascolinizzazione
9 Sindrome di Cushing ecc.
Altre volte capita invece che tumori di dimensioni notevoli non danno luogo a metastasi.
La sopravvivenza media del carcinoma renale è del 45% a 5 anni (70% in assenza di metastasi a distanza,
solo 15% in presenza di invasione del grasso perirenale).
Diagnosi
Grading
• G0: tumore senza anaplasia (adenoma)
• G1: ben differenziato
• G2: moderatamente differenziato
• G3: scarsamente differenziato
• G4: indifferenziato (nessuna somiglianza con le cellule dei tessuti di partenza)
Staging
Livello
to
Tx
T1
T2
T3
Descrizione
Tumore primitivo non evidenziabile
Tumore non valutabile, ma evidenza di tumore renale per una metastasi con cellule
renali
Tumore limitato al rene
Tumore limitato al rene
Tumore che invade le strutture renali ma non supera la fascia di Gerota
T3a
T3b
Ghiandola surrenale
Vena renale o vena cava inferiore (al di sotto del diaframma)
Dimensioni
?
Max 2,5 cm
> 2,5 cm
Mencaroni Spartaco
161
Vena cava al di sopra del diaframma
T3c
Tumore che invade oltre la fascia di Gerota e gli organi vicini
T4
La fascia di Gerota è un ispessimento fibroso che circonda il grasso perirenale. Anteriormente prende
rapporto con il peritoneo posteriore, e posteriormente con la fascia dei muscoli perivertebrali.
Livello
Descrizione
Linfonodi non valutabili (non è stato eseguito uno studio adeguato)
Nx
Linfonodi regionali liberi da metastasi
N0
Linfonodo regionale singolo interessato da metastasi non superiore a 2 cm
N1
Linfonodi regionali interessati da metastasi di diametro non superiore a 5 cm
N2
Linfonodi regionali interessati da metastasi di diametro superiore ai 5 cm
N3
La stadiazione clinica dei linfonodi è spesso soggetta ad errori, e anche quella chirurgica. Spesso i linfonodi
portati dal patologo risultano essere ingrossati per processi infiammatori e non per la reale presenza di
metastasi
Livello
Descrizione
Mx
Metastasi a distanza non accertate
M0
Assenza di metastasi a distanza
M1
Metastasi a distanza presenti (si considerano M anche metastasi a linfonodi extra regionali)
Il problema maggiore è la presenza di micrometastasi che si vedono anche dopo 8-10 anni dall’asportazione
del tumore primitivo.
Diagnostica strumentale
L’esame di elezione è la TC, massimamente sensibile per l’adenocarcinoma di Gravitz. Viene fatta con
scansioni assiali, in genere cranio caudali. La lesione assume un aspetto di un’area circoscritta a margini
sfumati, isodensa o ipodensa nelle scansioni dirette, che va incontro a precoce assorbimento del mezzo di
contrasto e irregolare rispetto al parenchima circostante.
Alla RM la lesione si presenta di segnale variabile, con intensità inferiore nella corticale in T1.
TC e RM possono evidenziare le alterazioni del rene e delle vie urinarie, l’infiltrazione delle fasce e la
stadiazione, la trombosi della vena cava, la presenza di linfonodi aumentati di volume nell’ilo e in sede
paracavale. Molto importante per osservare se il tumore è capsulato.
I rilevi ecografici sono occasionali, mentre assume importanza nei casi più semplici per la tipizzazione.
Inoltre viene usata per la esecuzione di biopsie e con il doppler può valutare l’interessamento dell’arteria
renale e della cava.
Urografia e angiografia possono avere importanza nella valutazione dell’interessamento vascolare e
nell’esecuzione di chemioembolizzazioni.
TUMORI UROTELIALI RENALI
Fino al 10% dei tumori renali prende origine dalla pelvi renale; essi comprendono un vario spettro di lesioni,
che vanno dal papilloma benigno fino al franco carcinoma papillifero. Come nel caso della vescica il
papilloma può essere difficilmente distinguibile da un carcinoma papillifero a basso grado.
Di solito tutti quanti si manifestano precocemente con ematuria macroscopica e colica renale, idronefrosi e
dolore sordo al fianco e quindi quasi mai possono raggiungere grandi dimensioni.
Spesso sono multipli e quasi sempre associati a un concomitante carcinoma vescicale. È dimostrata una
correlazione con la nefropatia da abuso di analgesici.
Nonostante le piccole dimensioni la prognosi non è buona: 50% a 5 anni, 10% se sono infiltranti.
La diagnosi viene fatta in genere con l’urografia e in seconda istanza con la pielografia retrograda. La
definizione dell’infiltrazione viene fatta con la TC che ne consente il rilievo diretto.
TUMORE DI WILMS
Rappresenta la neoplasia renale primitiva più comune nell’infanzia essendo generalmente diagnosticata entro
i 2-5 anni di età. È il terzo tumore nella fascia d’età prima dei 10 anni. È caratterizzato da una
predisposizione genetica che è confermata dal fatto che spesso si associa ad altre malformazioni congenite.
http://www.hackmed.org
[email protected] 162
Mencaroni Spartaco
Il tumore più essere congenito e dare parto distocico.
Le cellule tumorali sono quelle presenti nel corso della nefrogenesi ed il differenziamento si manifesta solo
sotto forma di glomeruli e tubuli a sviluppo incompleto. Lo stroma è di tipo fusocellulare indifferenziato.
Raramente possono essere presenti elementi differenziati quali tessuti eterologhi come epitelio squamoso o
mucinoso, muscolo liscio, tessuto adiposo, cartilagine e tessuto sia osteoide che nervoso.
Il tumore è piuttosto aggressivo in quanto tende a superare la capsula e a comprimere gli organi vicini (es. fa
risalire il diaframma determinando atelettasia polmonare).
SARCOMI
Rari. Alla TC e RM caratteristiche simili all’adenocarcinoma, ma con dimensioni maggiori. Il liposarcoma
ha tessuto adiposo ben visibile alla RM (non alla TC, che lo differenzia male), l’osteosarcoma calcificazioni
grossolane.
LINFOMI
Possono interessare i reni in fase avanzata. Si diagnosticano anche all’ecografia, come lesioni nodulari
ipoecogene omogenee, che possono indurre aumento progressivo del rene.
Alla TC il tessuto presenta valori di attenuazione uguali al parenchima, ma ha un assorbimento del mezzo di
contrasto molto minore del parenchima sano.
METASTASI
Provengono da:
• Polmone
• Mammella
• Stomaco
• Rene controlaterale
• Melanoma
Hanno l’aspetto di noduli multipli corticali, di piccole dimensioni e ben delimitati. Di solito la molteplicità e
la bilateralità sono i criteri che ne permettono la diagnosi differenziale con i tumori primitivi.
13.8 EMATURIA
Riconosce cause mediche e chirurgiche: nelle prime la diagnostica per immagini ha un ruolo limitato, nelle
seconde importante.
EMATURIE MEDICHE
EMATURIE CHIRURGICHE
• Patologia diffusa del parenchima di tipo Ematuria senza altri segni di coinvolgimento
glomerulare o tubulare, con ematuria, funzionale del rene.
albuminuria e cilindruria associate a globuli
rossi dismorfici.
Le cause di ematuria possono essere:
• Renali: rene policistico, calcoli, flogosi, infezioni, traumi, trombosi, neoplasie
• Ureterali: calcoli, flogosi, traumi, neoplasie
• Vescicali: calcoli, flogosi, traumi, neoplasie
• Prostatiche: ipertrofia, flogosi, neoplasie
• Uretrali: calcoli, flogosi, traumi, neoplasie
Diagnosi radiologica
Identificare la sede e le cause dell’ematuria e quantificare la sua estensione:
• Numero delle lesioni
• Rapporti con il parenchima, la via escretrice, la vescica e le pareti
• Lesioni associate
• Lesioni secondarie
•
• In caso di ematuria si usano TC, esame RX diretto, ecografia e RM con sequenze di uro-RM, e con ruolo
secondario pielografia ascendente e percutanea, arteriografia e flebografia renale.
Mencaroni Spartaco
163
Ecografia
Identificazione di una massa renale che provoca ematuria, calcoli o tumori endopielici.
L’eco ureterale è poco efficace per i motivi ricordati all’inizio del capitolo, e quindi si diagnosticano solo
calcoli nel tratto intermedio dell’uretere.
Non può definire la composizione del calcolo e da un giudizio approssimativo su forma e dimensioni
Nella vescica si possono meglio valutare i calcoli con diverse metodiche:
• Sovrapubica: permette di osservare calcoli e lesioni aggettanti nel lume (che possono essere direttamente
correlate con l’ematuria), diverticoli e vescica da sforzo (non direttamente correlabili con ematuria)
• Endocavitaria
• Endorettale
• Endouretrale
• Identifica con alta sensibilità (90%) il tumore vescicale.
• Comunque il “gold standard” rimane la cistoscopia
•
• L’ecografia prostatica è importante, e viene fatta sia per via sovrapubica che transrettale.
• L’esame transrettale ha bisogno anche di:
• Esplorazione digitale (nel senso del dito!)
• Esame di laboratorio su ALP
• Valutazione dell’antigene prostatico specifico (PSA)
RX diretto
Riconosce i soliti calcoli radiopachi e le calcificazioni patologiche di processi TBC o espansivi. Anche
alcuni aneurismi della renale e alcune malformazioni vascolari sono calcificate. Il valore di questo esame è
elevato nella calcolosi, basso in tutte le altre cause.
Urografia
Non è più l’esame di primo livello, anche se è la miglior forma di documentazione delle vie urinarie. Si deve
aspettare una settimana dopo l’ematuria (presenza di coaguli che possono essere interpretati come difetti di
riempimento da lesione vegetante, o al contrario mascherare eventuali lesioni).
Ha scarsa sensibilità nell’osservazione di lesioni espansive ma è importante per le lesioni intrinseche od
estrinseche dell’uretere.
TC
Nelle cause renali di ematuria è il gold standard, per via dell’elevata risoluzione di densità esaltata dal mezzo
di contrasto iodato idrosolubile. Possono essere dimostrate masse renali fino a 5 mm.
E’ l’esame migliore per lo studio dello spazio perirenale grazie al contrasto naturale dato dal tessuto cellulare
grasso attorno al rene che permette di visualizzare bene la fascia di Gerota e i vasi.
Buona possibilità di studio per il mezzo di contrasto di vasi renali, vena cava inferiore, vasi limitrofi.
Negli Stati Uniti la TC è l’indagine di prima istanza per la ricerca di tumori renali. In Europa è considerata
l’esame di elezione per:
• Cause di ematuria di origine renale con precedenti indagini negative
• Definizione di masse dubbie dopo ecografia
• Definizione di natura di difetti di riempimento dubbi all’ecografia renale
• Sospetta trombosi della vena renale
• Staging delle neoplasie di tutto l’apparato urinario
Arteriografia
Ruolo dimostrativo di malformazioni vascolari, fistole, preinterventistica nella PTA dell’arteria renale e nella
chemioembolizzazione delle neoplasie ipervascolarizzate che determinano ematurie non controllabili con
terapia medica.
Stesso discorso vale per le ematurie incontrollabili da neoplasie del basso apparato urinario o dopo
prostatectomie radicali.
Flebografia
Dimostra in maniera chiara la trombosi venosa, che però viene vista altrettanto bene con la meno invasiva
TC.
http://www.hackmed.org
[email protected] 164
Mencaroni Spartaco
Pielografia
Indicazione limitata nelle ematurie in cui il rene è escluso e dilatate le vie escretrici, e le indagini incruente
non sono diagnostiche
RM
Valutazione dettagliata di tutto l’apparato urinario con elevata risoluzione spaziale e di contrasto. Ruolo
complementare all’ecografia e alla TC in espansione.
Le nuove sequenze uro-RM e i nuovi mezzi di contrasto la rendono molto efficace.
In particolare la metodica uro-RM permette la visualizzazione dettagliata delle vie urinarie senza mezzo di
contrasto e senza radiazioni ionizzanti. Sequenze ultraveloci molto pesate in T2 con bande di saturazione in 3
piani. Il segnale del grasso viene soppresso, per migliorare il contrasto ed eliminare gli artefatti.
In genere si prende il piano coronale con campo visivo che include tutto l’apparato escretore.
La matrice è a media risoluzione, acquisizione in multistrato con spessore di strato sottile 2-4 mm o in
sezioni singole a 30-50 mm.
L’algoritmo MIP permette la ricostruzione 3d senza sovrapposizione delle strutture adiacenti.
Per via dell’elevato segnale in T2 dei liquidi si riconoscono molto bene dilatazioni dei dotti escretori e
l’idronefrosi.
Siccome un T2 intenso significa un tempo lungo, i flussi rapidi possono essere mal evidenziati o non
evidenziati affatto, e quindi viene provocata una dilatazione e una stasi delle vie urinarie, che risultano così
riempite di liquido statico.
Per far questo il paziente viene idratato, viene somministrata furosemide prima dell’esame, e viene applicata
una compressione sull’uretere distale: il risultato è un grande afflusso di urina nell’uretere e uno scarso
deflusso.
L’uro-RM ha le stesse indicazioni dell’urografia ed è preferibile per l’assenza di mezzo di contrasto iodato
(pesante in IRC) e di radiazioni ionizzanti, ma è costosa.
Algoritmo diagnostico dell’ematuria
Primo approccio ecografia e RX diretta addome. Da qui si può ottenere:
• Positività per calcolosi → metodiche di trattamento medico
• Positività per neoplasia renale → stadiazione con TC o RM
• Positività per neoplasia vescicale → urografia (o uro-RM dove possibile) e TC contemporanee (usando
lo stesso mezzo di contrasto), cistoscopia con biopsia per il grading, ecografia transrettale per lo staging
insieme alla TC.
• Negatività ad eco e RX
• Citologia urinaria positiva: → urografia o uro-RM per valutazione delle vie urinarie superiori, TC per
ricerca di neoplasie renali occulte, cistoscopia
• Citologia urinaria negativa: → ipotesi di flogosi urinaria → ricerca di sintomi e indici di flogosi.
• Flogosi positiva: diagnosi di natura
• Flogosi negative: indagini successive prima meno invasive (TC e uro-RM) infine se necessaria
cistoscopia.
• Se l’ematuria rimane ancora inesplicata si ricorre all’indagine angiografica per cause rare di ematuria
•
13.9 PATOLOGIA PROSTATICA
La prostata riconosce essenzialmente tre tipi di patologia che in ogni caso ne determinano aumento di
volume. Queste sono l’ipertrofia prostatica benigna, il carcinoma prostatico e le prostatiti.
L’esame di elezione per lo studio iniziale della prostata è l’ecografia, eventualmente eseguito in forma
transrettale, che permette la visione diretta senza preparazione della vescica, o in sede specialistica l’esame
per via transuretrale.
Tutte le metodiche hanno i loro pro e contro.
METODICA
VANTAGGI
SVANTAGGI
INDICAZIONI
Mencaroni Spartaco
Transaddominale
165
•
•
•
Semplice
Poco invasivo
Molto economico
•
•
•
•
Transrettale
•
•
•
Transuretrale
•
Studio completo
Ottima definizione
strutturale
Accurata valutazione
dei diametri
Studio
ad
alta
risoluzione
della
parete
e
della
struttura
•
•
•
•
Anse
intestinali
interposte
Difficile vedere la
parete caudale
Basa
definizione
strutturale
Scarsa valutazione
delle dimensioni
Invasività
Costo maggiore
Studio di base, approccio
iniziale alla patologia
prostatica
•
Valutazione
delle
masse
prostatiche,
follow
up
post
trattamento
Trasduttore costoso
•
Frequenti
lesioni
meccaniche uretrali
Casi estremamente
selezionati
La prostata normale è una formazione ovalare al di sotto della base vescicale, omogeneamente ipoecogena.
Per via transrettale si può valutare il decorso dell’uretra intraprostatica anche in senso dinamico durante la
minzione.
Ipertrofia prostatica benigna
Rappresenta senza dubbio una alterazione diffusa: 90% dei pazienti intorno agli 80 anni è portatore di una
ipertrofia microscopica, e di questi un 50% sperimenta sintomi di stenosi all’efflusso urinario.
Complessivamente la patologia interessa circa il 25% dei maschi adulti al di sopra dei 50 anni.
Non tutte le prostate significativamente ingrossate sono palpabili all’esplorazione rettale.
La patogenesi è senza dubbio multifattoriale, ma ci sono almeno due punti fermi importanti:
• La presenza di testicoli o di una fonte di androgeni
• L’invecchiamento
A differenza di altri organi sessuali maschili, la prostata conserva sempre i recettori per gli androgeni e
quindi continua a crescere per tutta la vita del paziente. Questo predispone fortemente tutti gli uomini con
genitali funzionanti allo sviluppo di questa patologia. Perché essa si sviluppi, però, non è sufficiente la
presenza di testicoli e il tempo: in altre parole i due fattori elencati prima sono necessari ma non sufficienti
a produrre l’ipertrofia
I due fattori principali, gli androgeni e gli estrogeni, sembrano esercitare un importante sinergismo nella
crescita della ghiandola: i primi promuovono la crescita dell’epitelio, i secondi quella dello stroma. Inoltre
il legame dei recettori per estrogeni al ligando promuove l’espressione dei recettori per androgeni
nell’epitelio ghiandolare e aumenta significativamente la 5 α reduttasi (che trasforma il T in DHT).
Nell’anziano c’è aumento relativo di estrogeni rispetto agli androgeni e si ha una proliferazione del tessuto
stromale in maggior quantità.
La neoplasia ha in genere una crescita eccentrica e non provoca stesi. La crescita riguarda le porzioni
ghiandolari peruretrali ma extrasfinteriche.
L’iperplasia ha una crescita concentrica e interessa le ghiandole uretrali intrasfinteriche provocando stasi al
flusso.
Nell’uno e nell’altro caso, la crescita avviene prevalentemente a carico delle ghiandole della zona di
transizione
L Esiste una frequente associazione fra ipertrofia e carcinoma prostatico, di significato non ben chiaro,
che riguarda il 10% delle ipertrofie. Molto probabilmente è una associazione causale di due entità ben
distinte, piuttosto che una progressione dell’ipertrofia verso il carcinoma.
http://www.hackmed.org
[email protected] 166
Mencaroni Spartaco
La prostata risulta aumentata di volume, con contorni regolari e simmetrici; a volte alla presenza di noduli di
ipertrofia si associa un reperto di calcificazione.
• Anamnesi: passaggio lento fra le varie fasi dell’ostruzione (rapido nel carcinoma)
• Esplorazione rettale: eseguire a vescica vuota, permetta la valutazione di molti parametri della
ghiandola.
o Volume della prostata
o Conformazione della ghiandola (situazione normale: dimensioni di una castagna con un
solco fra i due lobi. Ipertrofia: forma sferica e volume aumentato)
o Consistenza: nell’ipertrofia come nella situazione normale è teso-elastica come una pallina
da tennis, nel K è lignea
o Superficie: nell’ipertrofia è liscia e omogenea come una mela. Nel K può essere irregolare
o Limiti: ben delimitata dalla capsula (a meno di ipertrofie grandissime) a differenza del K
o Dolorabilità: alla palpazione stimolo a urinare (normale). Nella prostatite o nel carcinoma
da dolore
• Esame obiettivo addome: ottusità sotto l’ombelico a concavità verso il basso non variante con le varie
posizioni del paziente. Eventuale aumento del volume dei reni per idronefrosi
• Esami di laboratorio: esame urine non utile (rivela semmai la presenza di complicazione infettive).
Molto utile il dosaggio del PSA nella diagnosi differenziale con il K. (0-4: normale; 4-10: affezioni
prostatiche aspecifiche; >10 probabile carcinoma della prostata differenziato, l’indifferenziato non
produce PSA). Importante anche la fosfatasi acida, anch’essa prodotta solo dalla prostata. Bisogna
valutare il tasso ematico totale di PSA: la frazione libera su quella totale diminuisce in corso di neoplasia
maligna.
• Uroflussimetria: valori di flusso massimale > di 15 ml/s sono indicativi di assenza di ostruzione, < di 10
ml/sec sono indicativi di ostruzione.
• Determinazione del residuo vescicale postminzionale: con catetere o con ECO
• Ecografia sovrapubica e transrettale: utile per la valutazione delle zone della prostata inesplorate alla
palpazione.
• Urografia endovenosa: d’obbligo se è presente ematuria
• Cistouretrografia retrograda: eseguire se si sospetta una stenosi uretrale.
Alcuni segni urologici di ipertrofia prostatica:
• Distanziamento del fondo della vescica dal margine superiore del pube
• Impronta sul fondo vescicale
• Aspetto della vescica a colonne per ristagno di urina e ipertensione vescicale
• Diverticoli vescicali da pulsione
• Sollevamento del tratto terminale degli ureteri
• Residuo postminzionale abbondante
•
Adenoma prostatico benigno
Provoca una iperplasia nodulare con aumento di volume a contorni regolari e simmetrici. E’ possibile
identificare calcificazioni nello spazio fra i noduli; nelle forme conclamate il tessuto ghiandolare indenne si
organizza intorno all’adenoma come una pseudocapsula. Gli esami da eseguire sono gli stessi dell’ipertrofia
prostatica benigna.
Carcinoma della prostata
3°-4° posto per mortalità, 1° posto dopo 70-75 anni. Dipende anche dalla zona geografica a cui ci si riferisce
(minor incidenza in oriente per ambiente e alimentazione)
Fattori di rischio accertati sono:
• Razza
• Età (>50)
• Familiarità (rischio aumentato di 3 volte)
• Dieta: grassi, diminuzione dell’assorbimento di vitamine antiossidanti (A,D,C)
• Occupazione: industria tessile, chimica e della gomma
• Attività e infezioni sessuali
Mencaroni Spartaco
167
Si tratta nel 95% di adenocarcinomi. I carcinomi a cellule di transizione e squamoso, e i sarcomi occupano
insieme il restante 5%
→ Grading
Esiste una scala di gradazione detta scala di Gleason per valutare l’anaplasia delle cellule. Viene riferita ad
un sistema di punteggio da 1 a 5 in base alle alterazioni architetturali della 2 popolazioni cellulari più diffuse.
Sommati insieme questi due punteggi danno un grading da 2 a 10.
→ Staging
• T1: tumore non palpabile clinicamente, non visibile agli strumenti, di riscontro istologico nell’analisi di
tessuto asportato per iperplasia benigna (tumore nel contesto di un nodulo iperplastico)
o T1a: meno del 5% del tessuto osservato
o T1b: maggiore del 5% del tessuto osservato
o T1c: PSA elevato
• T2: tumore prostatico palpabile limitato dalla capsula
o T2a: 1 solo lobo
o T2b: ai 2 lobi
• T3: tumore extraprostatico
o T3a: oltre la capsula nel connettivo periprostatico
o T3b: esteso alle vescichette seminali
• T4: invasione del retto o della vescica
→ Clinica
Ipertrofia ad evoluzione molto più rapida rispetto a quella benigna, con evoluzione scarsamente stenosante e
principalmente diretta verso l’esterno della ghiandola. A volte ematuria ed emospermia
→ Diagnosi
• Biopsia ecoguidata: unico esame certo per dire se il paziente ipertrofico ha un cancro
• Ecografia transrettale: staging. All’ecografia la struttura è alterata da un’area parenchimale “a placca”
mal definibile, ipoecogena; negli stadi avanzati l’ecostruttura è disomogenea. L’esame è importante per
lo staging in quando dimostra l’infiltrazione extracapsulare e offre una guida alla biopsia.
• RMN addome e pelvi: staging
• RM prostatica: ottima risoluzione, superiore alla TC, in T2 dove è possibile una accurata
differenziazione fra uretra e parenchima, descrizione del tessuto prostatico circostante. Ha una capacità
migliore della TC nell’individuare lesioni focali, e ultimamente si usa anche per lo staging delle lesioni
extracapsulari in alternativa alla TC.
• TC prostatica: soprattutto estensione locoregionale (il tumore primitivo spesso non si vede nemmeno
dopo somministrazione di mezzo di contrasto). La TC ha bassa sensibilità per le lesioni intracapsulari e
se ne sconsiglia l’uso se non per lo staging.
• TC addome: metastasi epatiche e renali
• Scintigrafia ossea: metastasi ossee
Le metastasi sono spesso linfatiche o alle ossa.
→ Terapia
Viene scelta in base allo stadio clinico, età, condizioni cliniche del paziente. In genere esistono tre tipi di
terapia, con applicazioni differenti:
• Chirurgica: applicabile solo al tumore locale. Applicabile fino ai T2, poco ai T3 mai a T4 o se N+ o M+
• Radioterapia: applicabile ai margini della lesione. Viene usata fino a T3. No T4, N+, M+
• Medica: chemio molto poco sensibile; ormonoterapia per metastasi a distanza (M+).
Controindicazioni alla chirurgia sono paziente in età avanzata, condizioni scadenti. Alternative sono la
radioterapia e l’ormonoterapia.
http://www.hackmed.org
CAP 14 RADIOLOGIA
[email protected] 168
Mencaroni Spartaco
DELLO SCHELETRO E DELL’APPARATO MUSCOLOTENDINEO
L’ossificazione avviene in due modi: una prima fase, che costituisce il tessuto osseo iniziale, è detta anche
connettivale o diretta, e vi partecipano nell’ordine:
• Fibroblasti che si differenziano in osteoblasti e depongono tessuto su cui si depositano i sali.
• Questo tessuto diventa poi mesenchima e direttamente tessuto osseo
•
• Il tessuto osseo viene poi rimodellato con l’ossificazione per sostituzione, in cui il mesenchima diventa
cartilagine e poi tessuto osseo.
14.1 DIAGNOSTICA STRUMENTALE
Radiologia
E’ la tecnica fondamentale; l’osso è completamente radiopaco per l’elevato contenuto di sali di calcio; la
disposizione differente nel contesto dell’osso compatto (lamellare) e osso spugnoso (trabecolare) riescono a
dare una distinzione fra le varie componenti all’interno di un singolo osso.
La compatta delle ossa lunghe è una striscia periferica opaca che delimita il midollo (trasparente); la
spugnosa delle ossa corte si presenta come un intreccio di trabecole che talvolta, in particolari settori
sottoposti a forze di tensione sempre nella stessa direzione (calcagno), si dispongono lungo linee di forza.
Il periostio e l’endostio non sono normalmente visibili se non si calcificano, così come le cartilagini, i
legamenti e le capsule articolari.
Le ossa piatte infine sono costituite da uno strato centrale spugnosi circondato a sandwich da tavolati di osso
compatto.
La classifica di radiopacità fra i vari costituenti dell’osso è:
• Tessuto osseo
• Periostio (non visibile, solo con TC, a meno che è patologico)
• Cartilagine (non radiologicamente apprezzabile mai)
• Midollo (stessa consistenza delle parti molli, visibile a RM)
• Acqua libera e sangue
•
• L’osso è costituito da strutture di prim’ordine (compatta, spongiosa, corticale), di secondo ordine
(aggregati lamellari) di terzo ordine (lamelle)
TC
Studio accurato dell’osso e delle cartilagini, dei legamenti e delle capsule articolari. Importante specie in
alcuni distretti complessi come la rocca petrosa, le vertebre, le articolazioni e il piede. Sono ben distinte
compatta e spugnosa e ben evidenti come contorno il periostio e l’endostio.
Si fanno scansioni continue a strato sottile. E’ molto utile nella patologia traumatica, infiammatoria, infettiva
e neoplastica dell’osso.
La misura del valore di attenuazione in particolari settori è alla base della densitometria ossea.
RM
Sebbene l’osso non dia fondamentalmente segnale per via dell’assenza di protoni mobili, si riesce a
distinguere in esso la corticale dalla spugnosa, che ha all’interno il midollo.
Questo, assieme alla visione diretta di tessuti circostanti in maniera molto dettagliata, rende la RM indicata
per:
• Stadiazione di tumori ossei ancora meglio della TC
• Diffusione metastatica al midollo osseo (ancora più precoce della scintigrafia)
• Studio delle osteonecrosi
• Studio delle osteomieliti
Ecografia
Indagine di elezione nello studio di muscoli e tendini (vedi). Importante anche nello studio della displasia
dell’anca del neonato.
Nelle fratture controlla lo sviluppo del callo osseo evolutivo.
Mencaroni Spartaco
169
Scintigrafia
Importantissimo esame trattato nella parte di medicina nucleare. Indicazioni alla scintigrafia sono:
• Lesioni primitive e secondarie dello scheletro
• Stadiazione e follow up del carcinoma di mammella e prostata
• Identificazione del dolore osseo di origine sconosciuta
• Pianificazione della radioterapia
• Valutazione della patologia metabolica dell’osso (Paget)
• Patologia articolare e muscolare
• Valutazione delle fratture
• Selezione di aree per la biopsia ossea
Mineralometria
Si tratta di una serie di esami che permettono la determinazione quantitativa della massa ossea in pazienti
con sindrome osteopenica o osteoporosica, estremamente importanti sia per la diagnosi che per il controllo
evolutivo della malattia.
Si fanno o a livello periferico (in genere sul radio) o sul rachide, meglio correlabili alla sindrome clinica.
Ce ne sono varie tecniche:
• Mineralometria fotonica gamma a doppia energia: meglio nota con il termine improprio di MOC
(mineralometria ossea computerizzata), utilizza una sorgente radioattiva di fotoni gamma da 44 a 100
KeV. Fotoni di diversa energia rendono la misurazione indipendente dalla presenza di tessuti molli che li
assorbono. Permette, con una dose di radiazione molto bassa, di valutare con estrema precisione il
quantitativo di minerale presente nell’osso. Questo viene poi espresso come variazione in deviazioni
standard rispetto al valore per età e sesso, e rispetto al valore nel soggetto giovane
• La mineralometria ossea X a doppia energia è identica, ma con raggi X e permette di evidenziare i
risultati al computer con risoluzione anatomica molto alta.
14.2 ALTERAZIONI FONDAMENTALI DELL’OSSO
OSTEOPENIA
L’osteopenia è una condizione di diminuzione della quantità complessiva dell’osso che si manifesta con
diversi quadri clinici, racchiudibili in osteoporosi, rachitismo e iperparatiroidismo. Nel primo caso abbiamo
una riduzione della massa ossea complessiva, nel secondo un deficit della mineralizzazione della massa
neoformata, nel terzo un aumento del riassorbimento.
Dal punto di vista clinico ed eziologico queste patologie sono molto diverse fra di loro ed è fondamentale il
ruolo della diagnostica per immagini nell’identificare il tipo di osteopenia e ovviamente fornire una
valutazione quantitativa.
Osteoporosi
Si tratta di una perdita quantitativa di materiale osseo, nonostante rimangano normali sia il volume
dell’osso che il rapporto fra i minerali e la matrice organica che lo compongono.
Siccome questo è un processo fisiologico a partire dai 35 anni (soprattutto nelle donne) si definisce come
patologia la presenza di fratture spontanee oppure una diminuzione della massa ossea di oltre 2 DS dalla
media.
La diminuzione della massa ossea interessa meno la corticale della trabecolare, con riduzione della resistenza
al carico e aumento del rischio di fratture.
Osteoporosi postmenopausale
Sono numerosi i fattori che concorrono alla riduzione della massa ossea in fase post menopausale, e la
malattia si configura come un evento multifattoriale. Due aspetti sono importanti: il picco di massa ossea
raggiunto all’età matura, che ha un significato prognostico, e le modificazioni che intercorrono alla
cessazione dell’attività gonadica.
Il picco di massa ossea dipende da numerosi fattori:
• Assetto genetico (l’osteoporosi di tipo I è rara nelle donne di razza nera)
• Dieta carente di calcio o malassorbimento intestinale
• BMI (proporzionale al picco)
http://www.hackmed.org
•
•
[email protected] 170
Mencaroni Spartaco
Fumo di sigaretta, alcool, caffè, farmaci (diminuiscono il picco)
Attività fisica
La diminuzione degli estrogeni finisce per mettere in moto un meccanismo progressivo: gli estrogeni non
sostengono più il bilancio positivo del riassorbimento osseo, e questo a sua volta fa aumentare la calcemia.
Di conseguenza la produzione di PTH diminuisce, e diminuisce quindi la produzione di D3 e il
riassorbimento tubulare di calcio. La calcemia viene mantenuta elevata dal riassorbimento osseo, mentre la
fosfatemia si alza per via della diminuzione dell’attività del PTH, cosa che fa diminuire l’attività della 1α
idrossilasi e quindi a sua volte riduce ancora l’assorbimento di calcio.
Tutto questo agisce quindi in due modi:
• Diminuzione della sintesi di PTH
• Aumento del riassorbimento osseo per compensare le perdite renali e intestinali
Osteoporosi senile
Nell’anziano si mettono in moto diversi meccanismi che provocano diminuzione della produzione di tessuto
osseo:
• Riduzione dell’attività riproduttiva e sintetica degli osteoblasti
• Perdita di attività delle proteine della matrice e delle citochine stimolatorie (dovuta all’accumulo di
mutazioni genetiche)
• Riduzione della replicazione di cellule ossee progenitrici
• Riduzione dell’attività fisica e del turn-over metabolico: le ossa immobilizzate o di arti poco usati sono
significativamente atrofiche rispetto a quelle normali. Negli atleti le ossa sono meglio sviluppate e più
grandi
• Diminuzione di attività della α 1 idrossilasi e perdita di vitamina D, correlata ad una minor esposizione
al sole
Come conseguenza di questo, i livelli di PTH sono aumentati in questa forma di osteoporosi, poiché alla
base della malattia non c’è uno squilibrio ormonale, ma una diminuzione delle capacità sintetiche alle quali
l’organismo cerca di porre rimedio aumentando la secrezione di PTH. Questo permette una agevole diagnosi
differenziale fra l’osteoporosi di tipo I e II nella donna, permettendo quindi di stabilire se la terapia
estrogenica è efficace o meno.
I pazienti sono in genere asintomatici fino allo sviluppo di complicazioni. La prima di queste è la frattura¸
inizialmente piccola e legata a traumi modesti, in seguito anche spontanee. Le fratture riguardano la colonna
lombare e toracica, il collo del femore, l’avambraccio distale o le costole.
Le fratture delle vertebre toraciche sono a volte improvvise con un dolore che simula un quadro di infarto, e
lasciano modificazioni caratteristiche come la colonna a grande arco (estrema cifosi dorsale).
Fra tutte le forme, le donne sono colpite in misura nettamente maggiore degli uomini (20:1), per la
sommazione della menopausa e dell’età, e per la fisiologica minore massa ossea del sesso femminile. Nella
forma puramente senile, comunque, il rapporto //. si riduce a 2:1.
Inoltre:
• Nella forma menopausale il riassorbimento interessa per lo più ossa ad ampia superficie, come le coste o
i corpi vertebrali. In essi le trabecole sono ridotte di spessore e perdono le loro interconnessioni,
arrivando a microfratture e crolli ossei spontanei.
• Nelle forme senili, la corticale è assottigliata a causa di rimodellamento osseo subperiostale e i sistemi di
Havers sono espansi a tal punto che nei casi più gravi la corticale assomiglia a osso trabecolare, mentre
la parte centrale è di solito normale.
• Nelle forme senili, le fratture sono molto più frequentemente localizzate al femore, nelle forme di tipo I
alla colonna.
All’esame diretto radiografico si hanno alcune alterazioni fondamentali:
• Assottigliamento della compatta che si riduce progressivamente di spessore fino a diventare simile alla
trabecolata
• Ampliamento del canale midollare
• La corticale sottile spicca sulla spugnosa rarefatta come una striscia sottile
• Aumento della nitidezza delle trabecole della spongiosa (per la loro rarefazione)
Mencaroni Spartaco
•
•
•
•
•
•
•
•
•
•
•
•
171
Deformazioni ossee frequenti
Fratture patologiche (corpi vertebrali nell’osteoporosi I, polsi, omero e colli femorali nella II)
Soprattutto nelle vertebre è possibile fare una gradazione del processo:
Grado I: corpo vertebrale di forma normale ma con evidente perdita di massa (riduzione della
radiopacità, che si manifesta solo se la perdita di massa ossea è almeno del 40%)
Grado II: maggiore opacità delle limitanti vertebrali rispetto al centro del corpo, rarefatto
Grado III: strie verticali dovute al contrasto delle trabecole verticali sull’osso rarefatto
Grado IV: deformazione a “lente biconcava” o fratture a cuneo
Grado V: rarefazione intensa del corpo vertebrale che assume una opacità simile a quella dei tessuti
molli circostanti
La TC è sensibile e accurata nello studio di sedi delicate come la colonna che nella determinazione
mineralometrica della massa osseo.
La scintigrafia è molto importante perché differenzia le forme ad elevato ricambio osseo (Paget) da
quelle dell’osteomalacia (in cui c’è abbondante fissazione del tracciante per elevata produzione della
matrice) dall’osteoporosi nella quale invece il tracciante non viene fissato.
Rachitismo e osteomalacia
Gruppo di affezioni caratterizzato dalla mancanza di vitamina D e/o di fosfati organici, che si traducono in
un difetto di sintesi della matrice ossea.
Fra le molte cause che possono provocare questo (insufficienza renale, difetti enzimatici di idrossilazione del
colecalciferolo, mancanza di esposizione al sole, deficit dietetici) assumono particolare importanza due tipi
di affezione:
• Rachitismo vitamina D dipendente di tipo I: malattia autosomica recessiva caratterizzata dalla ridotta
attività dell’1α idrossilasi renale. Il deficit inizia a manifestarsi verso i 4-5 anni di vita in soggetti con
normale assunzione di calcio e vitamina D, normalmente esposti alla luce solare.
• Rachitismo vitamina D dipendente di tipo II: trasmessa anch’essa come autosomica recessiva, ed è un
disordine misto che interessa i recettori della vitamina D ma anche dei glucocorticoidi, ormoni tiroidei,
mineralcorticoidi (interessa infatti un dominio zinc-finger ricorrente in tutti i recettori per ormoni
steroidei)
A seconda dell’età di insorgenza, si distinguono due quadri fondamentali:
L Rachitismo (nel bambino) → insorge prima della saldatura delle cartilagini di congiunzione
Le alterazioni ossee sono prevalentemente a livello del cranio, con caratteristico rammollimento e ritardo di
chiusura delle fontanelle. In seguito, si hanno deficit della crescita degli arti inferiori che ostacolano la
deambulazione, difetti della dentizione, e deformità progressive delle ossa della pelvi e degli arti. Le forme
più gravi possono accompagnarsi a gravi ipocalcemie con tetania, spasmo della laringe e convulsioni.
L Osteomalacia (nell’adulto) → insorge dopo la saldatura delle cartilagini
Il quadro in genere non è così drammatico, a causa del ridotto fabbisogno di calcio e della minor attività
richiesta per il mantenimento, e non per la costruzione, della massa ossea.
Ci sono dolori ossei spontanei con dolorabilità alla pressione, e deformità spesso piccole e inosservate. Il
dolore all’articolazione coxofemorale può determinare andatura antalgica e debolezza muscolare che spesso
provoca difficoltà nei movimenti. A volte si può avere il quadro del bacino a cuore di carta da gioco,
fratture spontanee delle vertebre e infine anche collasso vertebrale.
Il rachitismo è facilmente diagnosticabile, l’osteomalachia un po’ meno a causa della minor gravità del
quadro. E’ importante una diagnosi eziologica.
• Deficit di vitamina D: livelli di calcio normali, ridotta fosforemia e aumento del PTH
• Insufficienza renale: iperfosfatemia con ipocalcemia di grado variabile,
I livelli di ALP e di OHPr urinaria sono di solito aumentati per via di un elevato turn over osseo. Le
alterazioni radiologiche più evidenti si hanno a livello della cartilagine di accrescimento. Nei casi
conclamati, le alterazioni delle ossa lunghe sono caratteristiche, e a differenza dell’osteoporosi interessano
sia la corticale che la trabecolare dell’osso.
http://www.hackmed.org
[email protected] 172
Mencaroni Spartaco
Elementi di diagnosi differenziale:
• Iperparatiroidismo: elevati livelli di calcio (il difetto è un eccessivo riassorbimento osseo, non una
diminuita produzione della matrice)
• Osteoporosi: difficile sulla base RX, più evidenti le differenze di esami di laboratorio
• Paget: agevole per la differenza della calcemia e fosfatemia
• Epilessia: in alcuni casi le convulsioni ipocalcemiche del rachitismo possono simulare gli accessi
tonico-clonici tipo grande male.
Diagnosi radiologica
E’ possibile separare nettamente due quadri, quello
adulta.
SEGNI RADIOLOGICI DI RACHITISMO
• Il meccanismo principale è la formazione di
tessuto osteoide in eccesso che sostituisce il
normale tessuto osseo mineralizzato
• Linea di calcificazione provvisoria, netta e
regolare normalmente, diviene sfumata e
irregolare
• La cartilagine di accrescimento si ispessisce
• Compaiono tardivamente e in maniera mal
definita i nuclei di ossificazione epifisari
• Si osserva a volte lo slittamento dei nuclei
epifisari verso l’interno
del rachitismo infantile da quello dell’osteomalacia
•
•
•
•
•
SEGNI RADIOLOGICI DI OSTEOMALACIA
disegno sfumato dell’osso spugnoso per la
presenza di tessuto osteoide
assottigliamento e sfrangiatura della compatta
(importante
diagnosi
differenziale
con
l’osteoporosi in cui la sfrangiatura è assente)
fratture da durata: sono linee di rottura
trasversali alle linee di carico dell’osso che
partono da intaccature nella compatta dell’osso
lungo, a riparazione lenta e completa
sindrome di Milkman, ossia la presenza di
numerose fratture da durata che caratterizza il
quadro dell’osteomalachia avanzata
deformazioni secondarie (bacino a cuore di carta
da gioco)
Iperparatiroidismo
Complessa alterazione metabolica, l’iperparatiroidismo si riassume in un aumento, primitivo o secondario, di
PTH che induce nell’osso un incremento dell’attività osteoclastica con conseguente aumento patologico del
riassorbimento osseo. Ci sono almeno tre quadri clinici:
• primario: raro, da adenoma (80%), iperplasia (15%) o carcinoma (5%) delle paratiroidi
• secondario: molto più frequente, che si instaura come una risposta di adattamento alla diminuzione della
calcemia (tipico da IRC)
• terziario: secondario all’iperplasia delle paratiroidi prodotta da una iperstimolazione perdurata nel tempo
(tipico dopo il secondario anche alla rimozione della causa)
•
Le modificazioni ossee in corso di iperparatiroidismo variano in relazione all’introduzione di calcio, alla funzionalità renale e al livello di paratormone. Le lesioni iniziali mostrano riduzione minima della densità ossea
• alla Rx. Tardivamente si ha la formazione di cisti, spesso inizialmente localizzate alla mandibola e alla
mascella. Microscopicamente la biopsia ossea mostra i cosiddetti tumori bruni, costituiti dalla
proliferazione di cellule giganti e cellule fusate, con deposizione di osteoide, aree di emorragia e depositi
di emosiderina che conferiscono il colorito brunastro alla neoplasia. Attualmente è più frequente
osservare una osteoporosi a carattere progressivo, mentre sono di raro riscontro le manifestazioni più
tipiche dell’osteite fibrocistica: deformazioni del bacino e fratture patologiche. La deposizione di sali di
calcio nei tessuti molli può provocare importanti manifestazioni cliniche. I tessuti più frequentemente
interessati sono la cornea, con cheratite a banda, e le strutture articolari e periarticolari con
condrocalcinosi, responsabile di artralgie.
•
• Alcuni quadri radiologici chiave sono:
• Assottigliamento di compatta e corticale
• Aumento delle strie intracorticali conseguente all’ampliamento dei canali di Havers
• Zone di riassorbimento vicino alla corticale
• Tumori bruni
• Calcificazioni metastatiche
Mencaroni Spartaco
173
OSTEOSCLEROSI
Aumento della radiopacità dell’osso per incremento della densità fisica. Ne esistono tre forme a seconda
della zona dell’osso interessata dal processo:
• Endostosi: ha una forma di placca, che deforma e restringe il canale midollare, fino a obliterarlo nella
forma detta osteopetrosi. La forma dell’osso è conservata.
• Periostosi: forme più comuni con colate ossee vicino alle diafisi, sovrapposte come la buccia della
cipolla. I contorni possono essere irregolari a colata di cera. In genere la forma ossea viene alterata per
l’associazione di una iperostosi
• Spongiosclerosi: area di opacità aumentata variabile molto nella forma.
•
• L’architettura dell’osso può essere conservata o alterata a seconda della gravità del quadro clinico. Può
essere pura o associata ad altre patologie, e generalizzata o localizzata ad uno o più distretti. Infine può
interessare le diafisi, metafisi o i nuclei epifisari. L’area interessata si riconosce bene per l’aumento della
sua opacità.
• L’osso va incontro facilmente a fratture da trauma che consolidano completamente e con facilità.
•
• Le cause di osteosclerosi sono:
• Idiopatiche
• Tossiche:
• Eccesso vitamina D, malattia di Paget, nefropatia
• Tumorali: carcinoma della prostata
OSTEONECROSI
L’osteonecrosi è la morte di porzioni più o meno estese dell’osso, determinate in ultima istanza
dall’ischemia, conseguente a diverse condizioni:
• Traumi
• Intossicazioni professionale (necrosi della mandibola da inalazione di vapori di fosforo)
• Fattori vascolari acuti (embolie e infarti)
• Agenti fisici
• Processi infiammatori acuti e cronici
• Infezioni
•
• Dal punto di vista clinico vengono distinte in infettive e asettiche, queste ultime da cause note o
idiopatiche.
• Radiologicamente il focolaio necrotico, do qualunque natura, attraversa quattro fasi:
• Non individuabilità: RX negativo
• Addensamento: si osserva un certo grado di addensamento osseo,
• Frammentazione: presenza di aree similcistiche con rarefazione (riassorbimento della necrosi) e aree di
sclerosi (riparazione fibrosa)
• Riassorbimento e risoluzione
•
• Le forme idiopatiche sono piuttosto importanti per la loro frequenza.
• I rilievi radiologici sono meglio dimostrati alla TC, mentre la scintigrafia ossea dimostra in genere la
presenza di zone fredde dovute alla riduzione dell’apporto ematico anche in presenza di radiologia
normale.
OSTEOLISI
Distruzione o riassorbimento di porzioni estese di osso. Riconoscono moltissime cause, di natura flogistica,
distrofica, granulomatosa, neoplastica, da compressione. Spesso sono presenti osteolisi di natura post
traumatica.
Il focolaio si presenta come un’area radiotrasparente dai contorni più o meno netti all’interno della quale non
è apprezzabile il normale disegno osseo.
http://www.hackmed.org
[email protected] 174
Mencaroni Spartaco
Le caratteristiche di forma, dimensioni, margini, contemporanea presenza di altre alterazioni consentono in
genere un orientamento diagnostico.
Le cause possono essere:
• Neoplasie:
• Flogosi
• Emolinfopatie
• Cistiche
• Reticolocitosi
• Neuropatie
• Meccaniche
• Traumi
• Acrosteolitiche
•
14.3 MALATTIE INFETTIVE DELL’OSSO
Osteomielite acuta
Stafilococco aureo nell’80% dei casi, che raggiunge l’osso per via ematogena, per contiguità o per traumi o
manovre invasive.
Massima frequenza adolescenza, ossa lunghe.
RX diretta
Positivo tardivamente rispetto alla clinica, e correlato all’evoluzione anatomica del quadro clinico. Poiché
dato l’uso tempestivo di antibiotici il quadro raramente si evolve a livelli eccessivi di danneggiamento, la
radiografia non è un mezzo diagnostico molto efficace.
Anatomopatologia
Quadro Rx
Necrosi del midollo
Negativo
Flogosi verso la corticale (osteite iniziale)
Osteopenia locale, osteolisi a focolai multipli con
aspetto “tarlato” dell’osso.
Osteonecrosi a focolai
Periostosi diffusa, endostosi che oblitera il canale
midollare, osteonecrosi di tratti lamellari addensati
Progressiva demarcazione dell’osso sano circostante Tratti necrotici delineati da un anello di osso
per demolizione del tessuto attorno all’infezione da rarefatto (segno del sequestro)
parte degli osteoclasti
Regressione (eliminazione dei sequestri più piccoli) Riparazione (mai completo nelle forme che si sono
evolute fino al sequestro)
Cronicizzazione (abbondante produzione di osso Segno della bara con il cadavere dentro
neoformato attorno al sequestro)
Scintigrafia
Precocemente positiva per iperafflusso e accumulo del tracciante, e differenzia il processo infettivo da
flogosi di altra natura e lesioni non infiammatorie
RM
Consente di evidenziare con assoluta precocità l’infiltrazione infiammatoria del midollo osseo, del canale
midollare e dell’osso spugnoso
Osteomielite cronica
Sono quadri in cui per qualsiasi motivo il processo non si risolve, e si forma la reazione di produzione di
nuovo osso per delimitare il quadro di osteomielite acuta.
Si forma periostosi ed endostosi e la compatta, stretta fra questi due processi proliferativi perde la sua
individualità; nell’osso iperostosico compaiono cavità delimitate. Questi aspetti possono persistere per tutta
la vita.
14.4 MALATTIA NEOPLASTICA DELL’OSSO
Mencaroni Spartaco
175
EMOLINFOPATIE
Nelle diverse emolinfopatie dell’osso il meccanismo di danno è abbastanza uniforme. In generale si
presentano tre aspetti:
• Osteoporosi diffusa da riassorbimento per via della fibrosi midollare
• Reazioni iperostosiche endostosiche e spongiosclerotiche da proliferazione delle componenti osteogene
• Lesioni osteolitiche per distruzione diretta del tessuto osseo
•
• Queste forme generali si associano in maniera diversa nelle diverse malattie mieloproliferative:
Malattia di Hodgkin
Sono interessati spesso i corpi vertebrali.
Il tessuto linfomatoso produce osteolisi distruttiva, inizialmente della spongiosa e poi anche della corticale;
spesso ne consegue frattura patologia. In altri casi meno frequenti predomina invece l’osteosclerosi e le
vertebre appaiono ispessite intensamente e uniformemente (vertebra d’avorio).
Eritremie e leucemie
L’interessamento si esplica in forma di tarlatura osteolitica inizialmente in prossimità delle cartilagini di
coniugazione delle grandi articolazioni.
Talassemia major
Osteoporosi secondaria all’iperplasia midollare (cranio a carta geografica, aspetto a palizzata dei corpi
vertebrali, quadrettatura della spongiosa nelle ossa lunghe). Oltre a questo si hanno aspetti di reazioni fibrose
a dente di pettine in verticale.
Tutti questi aspetti si vedono in particolare nel cranio.
Mielofibrosi
La fibrosi midollare e la sclerosi secondaria della spugnosa inducono aspetti ossei tipicamente e
uniformemente addensati.
TUMORI OSSEI PRIMITIVI
Aspetti generali di diagnosi
La diagnostica per immagini è importante per:
• Riconoscere la presenza della lesione
• Caratterizzare la sua natura
• Fare un bilancio dell’estensione
•
• La presenza della lesioni è quasi sempre riscontrabile esattamente all’esame radiografico che viene
quindi usato come esame di prima istanza. L’RX in molte circostanze può dare una indicazione
abbastanza precisa e veritiera sulla natura della lesione.
• La stadiazione e l’interessamento dei tessuti circostanti viene fatto con la TC o la RM.
•
• Un tumore viene agevolmente identificato all’RX solo quando induce una osteolisi non inferiore al 3040% del contenuto minerale dell’osso (specie se il tumore origina dalla spongiosa).
• Alcuni criteri radiologici indicano con buona approssimazione la natura del tumore.
•
• Criteri di benignità
• Criteri di malignità
• Dimensioni superiori a 6 cm
• Dimensioni inferiori di 3 cm
• Margini netti e regolari (spesso orletto • Margini mal definiti e irregolari
sclerotico)
• Assenza di orletto sclerotico
• Compressione della compatta ma non • Invasione della compatta e inducono reazioni
distruzione
periostali
• Non inducono reazioni di iperostosi
• Causa frequente di frattura patologica
• Non invadono le parti molli
• Periosti a velo di cipolla, perpendicolare all’osso
• Possono essere causa di frattura spontanea
(crescita del periostio che viene spostato dal
tumore)
•
http://www.hackmed.org
•
•
•
•
•
•
•
[email protected] 176
Mencaroni Spartaco
Valutare anche l’età (ad esempio il sarcoma di Ewing nel giovane) e la sede.
Ambedue i tipi di tumore si estrinsecano con aree osteolitiche, con aspetto a carta geografica per i tumori
benigni, a tarlatura o erosione per i tumori maligni.
Alcune lesioni in particolari sedi anatomiche (pelvi e rachide) sono meglio identificate con la TC, e il
riconoscimento di calcificazioni all’interno della lesione viene fatto meglio con la TC che non con
l’esame radiografico.
Anche la scintigrafia può dare informazioni importanti.
La RM ha la massima importanza nell’osservazione dell’estensione della lesione (soprattutto per quel
che riguarda l’estensione midollare).
Si possono vedere le parti solide e liquide
Rapporto della neoplasia con l’osso
Un tumore maligno ha di solito aree osteolitiche irregolari che infiltrano
Stadiazione
•
•
•
•
•
La TC osserva l’aumento del volume dell’osso, e la presenza di calcificazioni incluse ad esempio nei
condromi.
•
Tutti i paziente vanno poi alla biopsia per il grading e la diagnosi finale
Classificazione
In base al criterio di origine
• Primitivi
• Secondari
• Da strutture aberranti incluse
• Di origine tiroidea e corticosurrenale
• Cordomi
• Epidermoidi dello scheletro (colesteatomi e cisti)
• Di origine dentaria (adamantinomi, odontomi, cisti follicolari e radicolari)
•
• In base al criterio di evoluzione
• Benigni
• Maligni
•
• In base al criterio istologico
• Benigni
• Ossei
• Osteoma
• Osteoma osteoide
• Osteoblastoma benigno
• Condrali
• Condroma
• Condroblastoma
• Fibrosi
• Fibroma
• Fibroma non osseificante
• Vasali o adiposi
• Angioma
• Lipoma
• Tumore benigni a cellule giganti
• Maligni
• Ossei
Mencaroni Spartaco
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
177
Osteosarcoma
Intramidollare
Paraostale
Periostale
Teleangectasico
Secondario a morbo di Paget
Contrali
Condrosarcoma
Iuxtamidollare
Mesenchimale
A cellule chiare
Fibrosi
Istiocitma fibroso maligno
Fibrosarcoma
A cellule rotonde
Sarcoma di Ewing
Neuroectodermici
Linfomi maligni primitivi
Della notocorda
Cordoma
Sinoviali
Sarcoma sinoviale
Dei tessuti vascolari e del grasso
Emangioendotelioma
Emangioendoteliosarcoma
Angiosarcoma
Liposarcoma
Mixosarcoma
Adamantinoma delle ossa lunghe
Tm maligno a cellule giganti
Mieloma
Plasmocitoma
DESCRIZIONE DI ALCUNE FREQUENTI CISTI
•
•
•
Cisti ossea semplice: spesso sierosa, giovani maschi fra 1 e 2° decennio. Spesso nelle metafisi
dell’omero e del femore. Assume l’aspetto di un’area osteolitica centrale, uniforme, che interessa a pieno
spessore la metafisi colpita fino a dar luogo a fratture patologiche. Non invade l’epifisi per via della
presenza di cartilagine di coniugazione che lo impedisce; invece è la regola lo sconfinamento nella
diafisi.
Cisti ossea aneurismatica: lesione simile al tumore a contenuto ematico; sesso femminile nel secondo
decennio di vita, nelle metafisi e nelle diafisi delle ossa lunghe. Esiste una frequente forma eccentrica che
origina nel periostio come una lesione osteolitica radiotrasparente ed erode la compatta sottostante fino a
invadere anche il canale midollare. Nella forma centrale la lesione invade prevalentemente la spongiosa e
si confonde con la cisti ossea semplice.
Cisti epidermoide o epiteliale: rara lesione rivestita da tessuto epiteliale cheratinizzato, originante da
inclusioni osseo post-traumatiche di tessuto epiteliale. In genere si localizza nelle falangi distali delle
mani e nel tessuto frontale del cranio.
TUMORI BENIGNI
Osteoma
Origina da elementi della serie di rinnovamento dell’osso ed è costituito da osso ben differenziato. Specie età
adulta nei seni frontali e mascellari o nel tavolato cranico.
Ha una forma compatta, con area di osteosclerosi della stessa densità dell’osso compatto e nettamente
delimitata dall’osso sano, e una forma spongiosa con osteosclerosi diffusa e strutturata.
http://www.hackmed.org
[email protected] 178
Mencaroni Spartaco
Osteoma osteoide
Origine dagli stessi elementi dell’osteoma semplice. Tessuto osteoide e tessuto osseo reticolare immaturo;
determina una sintomatologia dolorosa notturna che risolve caratteristicamente dopo somministrazione di
aspirina. Radiologicamente appare come un nido centrale radiotrasparente e un’area centrale di osteosclerosi
reattiva, che si estende anche a distanza dall’area del tumore.
Osteoblastoma
Come l’osteoma osteoide, ma l’osteoblastoma si differenzia fino a produrre tessuto osseo vero e proprio. Si
localizza principalmente alla colonna vertebrale, e inizia come una lesione osteolitica pura. Successivamente,
per l’intensa attività degli osteoblasti, il tumore produce zone calcificate e ossificate nel contesto della
lesione, che viene delimitata da una intensa reazione fibrosa.
Osteocondroma
Origina da elementi cartilaginei, ed è costituito da cartilagine che maturando diventa osso: spesso la
cartilagine neoplastica si forma nel bambino, e ossifica nell’adulto.
All’RX assume l’aspetto di una escrescenza ossea peduncolata molto caratteristica, a struttura interna
spongiosa, che continua a crescere finché si arresta con il raggiungimento della maturità scheletrica. E’
frequente la trasformazione a condrosarcoma
Condroblastoma
Cartilagineo, elementi: condroblasi e cellule giganti. Appare come un’area di osteolisi eccentrica, ovale,
polilobata e sepimentata. Contiene aree calcificata. Talvolta è accompagnato da una reazione periostale
Fibroma
Origina da fibroblasti ed è costituito da tessuto fibroso compatto; spesso nel ginocchio nella seconda decade.
Appare come una osteolisi superficiale delimitata da un orletto compatto di sclerosi che la delimita. La
sclerosi comprime ma non infiltra l’osso circostante.
TUMORI MALIGNI
Osteosarcoma o sarcoma osteogenetico
Frequente (30%), importante e aggressivo tumore dell’osso, predilige il tratto metafisario del femore (80%),
in genere nel corso del secondo decennio di vita, spesso su un pregresso trauma.
Ha una sintomatologia dolorosa molto intensa e persistente, e prognosi estremamente grave per le frequenti e
precoci metastasi polmonari. Si può presentare in forma osteolitica pura (rara), in forma addensante pura, in
forma mista (frequente).
All’Rx la forma mista è costituita dall’associazione di lesioni osteosclerotiche più o meno dense, a margini
mal definiti, e di lesioni osteolitiche. Queste lesioni si raggruppano in un’area mal definita, eccentrica.
Invade facilmente e frequentemente il canale midollare, dando focolai a distanza nello stesso osso
rapidamente. La compatta viene precocemente distrutta con invasione del periostio e dei tessuti circostanti
(importante la valutazione alla TC e alla RM dell’interessamento di questi tessuti).
Nella compatta l’osteogenesi induce la comparsa di lesioni calcificate lineari, a “raggi di sole”. Il periostio
sollevato dalla massa del tumore produce invece osso normale a strati sovrapposti.
La TC rileva queste alterazioni in maniera molto accurata, evidenziando aree di osteolisi anche piccole e
alterazioni nella trabecolatura spongiosa mal definibili all’RX convenzionale.
La RM viene usata soprattutto nella visualizzazione dell’interessamento midollare e delle parti molli
circostanti.
Scintigrafia ossea sensibile per le localizzazioni metafocali nell’osso. L’angiografia serve a procedure
interventistiche di embolizzazione
Condrosarcoma
Segue a volte un osteocondroma, secondo in ordine di frequenza fra i tumori dell’osso (15%), e predilige
bacino e coste.
I rilievi radiologici sono importanti. Nella forma centrale appare come un’area osteolitica nel cui contesto
sono presenti aree di calcificazione caratteristiche a virgola o anulari; la compatta è erosa in più punti.
Nella forma periferica si ha la tumefazione della parti molle, di tenue densità e regolare. Raggiungendo
spesso dimensioni enormi (specie nelle ossa piatte), la diagnosi RX è agevole.
Mencaroni Spartaco
179
Fibrosarcoma
Trae origine da elementi fibrosi degli spazi midollari o degli strati profondi del periostio distinguendosi in
una forma centrale e una periferica. Non ha tendenza alla produzione di tessuto osseo, e compare come
un’area di osteolisi pura con segni di malignità ma senza elementi specifici e la diagnosi di natura è
puramente bioptica.
Sarcoma di Ewing
Origina da cellule midollari immature o neuroectodermiche secondo altre ipotesi. E’ in ordine di frequenza il
terzo fra i tumori maligni primitivi dell’osso.
Radiologicamente induce aree osteolitiche multiple a piccoli focolai, non confluenti, vicino alla diafisi.
Quando interessa la compatta, ne provoca disgregazione delle lamelle finché tutta la struttura ossea appare
lamellata.
Intorno, in ogni caso, si associa un’area di osteosclerosi reattiva, e la reazione periostale a sfoglia di cipolla
c’è sempre ed è molto caratteristica.
Per valutare l’estensione a distanza sono fondamentali TC e RM
Reticolosarcoma primitivo
Origina da cellule reticolari midollari differenziate, e spesso si caratterizza per l’assenza quasi completa di
sintomi clinici, anche in corso di quadri radiologici molto avanzati.
Induce aree osteolitiche multiple a piccoli focolai con una certa tendenza alla confluenza, e l’osso assume un
aspetto “tarlato”. La compatta viene in genere distrutta e si ha invasione della parti molli.
La componente reattiva sclerotica assume un aspetto “a zucchero candito”, ma è contenuta. E’ un tumore
molto radiosensibile.
Plasmocitoma osseo
Difficilmente il plasmocitoma interessa l’osso: quando lo fa, provoca, oltre alla sindrome clinica a lui
associata, una serie di lesioni caratteristiche:
• Osteolisi multiple rotondeggianti, di diametro variabile da pochi mm ad alcuni centimetri a limiti netti
senza orletto necrotico
• Aspetto risultante a “tarlatura” diffusa
• Erosione e distruzione della compatta, con invasione delle parti molli
• Mancanza di ogni reazione periostale
• A volte assume l’aspetto di un’area erosiva pseudocistica che rigonfia l’ossa e si apre nelle parti molli
Altri tumori
• Angiosarcoma osseo: tumore primitivo dell’osso, di riscontro eccezionale, a carattere osteolitico, rapido
e con metastatizzazione precoce.
• Liposarcoma
• osseo: origina da cellule adipose della cavità midollare, e si sviluppa come una lesione osteolitica
maligna ad elevata rapidità
• Cordoma: molto raro, lento ma inesorabile sviluppo osteolitico
• Adamantinoma osseo: di origine incerta, molto raro, osteolitico.
14.5 TUMORI METASTATICI DELL’OSSO
In circa il 25% dei pazienti oncologici compaiono metastasi all’osso. Il rischio maggiore viene da:
• Mammella (65%)
• Prostata e tiroide (40%)
• Polmone (35%)
• Utero, rene e pancreas
•
• La metastasi è frequentemente ematogena, e si insedia nella spongiosa (meno di frequente nella corticale)
generando tre tipi di quadri:
• Osteolitico
• Osteoblastico
• Misto
•
http://www.hackmed.org
•
•
•
•
•
•
•
•
•
[email protected] 180
Mencaroni Spartaco
Alcuni tumori si diffondono all’osso per contiguità, come quelli rinofaringei alla base cranica, o quelli
polmonari di Pancoast all’arco costale posteriore.
Le sedi più frequenti di localizzazione delle metastasi sono:
Colonna dorsolombare
Cranio
Coste
Bacino
Terzo medio del femore
Alcuni tumori che si distribuiscono per via linfatica hanno alcuni territori di distribuzione predefinita,
come quelli della prostata al bacino e alla colonna lombare.
Sintomatologia clinica
In genere sono asintomatiche alla diagnosi, e spesso vengono individuate nel corso degli esami più disparati.
Spesso queste metastasi permettono la successiva identificazione di un tumore primitivo ignoto.
La sintomatologia delle fasi avanzate è caratteristica:
• Dolore ingravescente non sedabile agli oppiacei
• Fratture patologiche
• Tumefazione localizzata
• Sindromi neurologiche
• Ipercalcemia, ipercalciuria, iperfosfatemia alcalina da riassorbimento osseo.
• Iperfosfatemia acida si osserva nei tumori della prostata
Indagine radiografica
Caratteristicamente si osservano sia aree osteolitiche che aree osteosclerotiche mescolate, le une e le altre
simultanee nelle forme miste. L’osso non è rigonfiato, non vi è alcuna reazione periostale, e l’usura della
corticale e l’espansione delle parti molli è rara.
Alcune metastasi da carcinomi (tiroide, crasso, rene), assumono un aspetto “soffiante” nel senso che l’area
osteolitica rigonfia l’osso e assottiglia fortemente la corticale come una bolla nel vetro soffiato.
Tumori della prostata e della mammella danno frequentemente metastasi osteoblastiche.
Altre metodiche di individuazione precoce
Assume molta importanza l’individuazione precoce dei tumori metastatici soprattutto di mammella e
prostata. In questo sono fondamentali la scintigrafia e l’RX, in seconda istanza la RM e la TC.
Alcune considerazioni:
• Una metastasi osteolitica non si rileva all’RX se non ha indotto una lisi della massa ossea di almeno il
30-40%
• LA METà DELLE METASTASI DELLA COLONNA VERTEBRALE NON SI VEDE ALL’RX (TC
E RM)
• La diagnosi scintigrafica di metastasi è più precoce ma meno specifica dell’RX; la scintigrafia rispetto
all’RX ha più FP e meno FN: un esame scintigrafico deve essere ricontrollato all’RX mirata delle zone
sospette
• Alcune zone “difficili” (bacino, sacro, colonna) in cui il tasso di errore dell’RX aumenta, richiedono TC
e RM in prima istanza
•
14.6 MUSCOLI E TENDINI
RX
Fornisce il più delle volte risultati molto scarsi, limitato alla presenza di lesioni ossee associate o
calcificazioni patologiche.
Ecografia
Esame di prima istanza. Ecostruttura ordinata, a dente di pettine per la distribuzione alternata della fibre; la
densità si attenua durante la contrazione per l0’ispessimento dei fasci muscolari.
Il tendine è iperecogeno con struttura di tipo fibrillare. Le tecniche color e power doppler valutano la
distribuzione del flusso con importanza particolare in corso di miopatie infiammatorie ed espansive.
Mencaroni Spartaco
181
TC
Elevata sensibilità nel valutare calcificazioni e ossificazioni patologiche associate ed estensione dei tumori,
valutazione delle distrofie e miopatie infiammatorie.
Il tessuto adiposo e quello fibroso hanno valori di attenuazione diversi da quello muscolare e offrono una
buona distinzione fra i piani.
RM
Elevata risoluzione di contrasto, multiplanarità, ottima identificazione di edema e emorragie, simultanea
capacità di valutare i tendini e i legamenti, lo rendono l’esame di elezione per la valutazione di tutta la
patologia muscolare.
Scintigrafia
Con Tc99pirofosfato assume rilievo nelle distrofie e nelle miositi. Si accumula dove il contenuto di calcio
aumenta, segno di danno del sarcolemma.
TRAUMI MUSCOLARI
Il loro riconoscimento è possibile con la ecografia e la TC. Lesioni minori come contratture o stiramenti
danno risultato negativo, anche se la RM può identificare edemi anche di minima entità usando sequenze
particolari dette STIR, con cancellazione del segnale del grasso.
L’ecografia può identificare l’interruzione di fasci muscolari nelle lacerazioni più o meno significative, e la
presenza di aree emorragiche (ipoecogene) o di ematomi diffusi lungo le fasce.
Gli ematomi di vecchia data possono calcificare ed essere visibili all’RX.
Anche la miosite ossificante si può identificare facilmente all’RX.
PATOLOGIA DEL TENDINE
Le lesioni del tendine si sviluppano su base traumatica, flogistica o degenerativa, e possono indebolire il
tendine fino alla rottura.
L’RX diretto offre una visione d’insieme e permette di ricavare alcune informazioni sulle emorragie. Vede
bene le calcificazioni.
L’ecografia dimostra direttamente alterazioni strutturali del tendine e della guaina, ematomi ed edemi
infiammatori. Il color doppler è l’ideale per osservare l’iperemia infiammatoria del tendine stesso.
TC e RM si usano per studiare lesioni anatomiche complesse.
DISTROFIE MUSCOLARI
Lo studio per immagini viene usato per monitorare la sostituzione del tessuto muscolare con quello adiposo e
connettivale. In questo la RM e l a tecnica più sensibile e consente di determinare prima ancora
dell’insorgenza dei sintomi clinici la presenza di aree focali con lieve e progressiva riduzione dell’intensità
del segnale (in T1 soltanto quando il processo è poco avanzato, anche in T2 nelle fasi finali).
Alla scintigrafia si osservano i gruppi muscolari interessati che sono ipercaptanti. L’ecografia è quasi inutile
e la TC permette il grading del processo di atrofia muscolare.
MIOPATIE INFIAMMATORIE
Ecografia, scintigrafia e RC forniscono dati utili per il riconoscimento del processo infiammatorio.
L’indagine di elezione resta comunque la RM, che permette anche la diagnosi differenziale con la
fibromialgia.
http://www.hackmed.org
CAP 15 CENNI
DI
[email protected] 182
Mencaroni Spartaco
NEURORADIOLOGIA
La neuroradiologia è una disciplina molto specialistica perciò ci limitiamo a qualche cenno sulle tecniche di
indagine.
La TC e la RM sono sempre le indagini di prima scelta. LA RM ha una elevata risoluzione di contrasto fra
sostanza bianca e grigia e permette l’esecuzione di importanti studi funzionali.
Esame radiografico diretto
Le strutture encefaliche sono tutte radiotrasparenti. Fornisce quindi informazioni indirette sui processi
patologici per alterazioni della forma e della struttura delle ossa craniche. L’esame si fa classicamente in tre
proiezioni:
• Proiezione sagittale PA (occipitale → nasale)
• Proiezione laterale (destra → sinistra)
• Proiezione assiale (sottomento → vertice cranico)
•
• Esistono poi proiezioni complementari che sono direzionate lungo assi intermedi fra le tre proiezioni
principali, e proiezioni speciali se si intende vedere particolari strutture (asse ottico, canale orbitario,
sella turcica, rocca petrosa).
• In questa maniera si riesce ad ottenere informazioni più o meno dettagliate su:
• Malformazioni craniche
• Malformazioni delle suture
• Anomalie endocrine come la sindrome della sella vuota
• Tumori meningei (erosione ossa parietali)
• Tumori ipofisari (erosione sella turcica)
• Tumori del nervo ottico (erosione orbita)
• Tumori dell’acustico (erosione rocca petrosa)
• Ipertensione endocranica con una notevole serie di segni
• Diastasi delle suture craniche
• Aumento di V del cranio (solo nel bambino)
• Accentuazione delle impronte vasali
• Modificazioni della sella turcica
• Calcificazioni endocraniche
TC
Tecnica fondamentale, che nelle situazioni di urgenza è preferibile alla RM per la sua rapidità di esecuzione.
Nello studio dei traumi cranici concentrazione l’esame di elezione.
L’indagine avviene in genere per scansioni seriate a fette sottili di 5-10 mm di spessore; nel 70% dei casi si
usa anche il mezzo di contrasto.
La TC è in grado di differenziare la sostanza bianca da quella grigia e dagli spazi liquorali; identifica molti
rilievi patologici direttamente o indirettamente:
• Aree ipodense
• Edema
• Necrosi
•
• Aree iperdense
• Lesioni ad alta densità cellulare
• Lesioni molto vascolarizzate
• Sangue stravasato
• Calcificazioni
• Coaguli freschi
RM
Utilizzata nello studio delle patologie encefaliche preferenzialmente alla TC quando è possibile ottenere la
collaborazione del paziente. Fornisce immagini ottime, con risoluzione delle diverse strutture decisamente
superiore alla TC, sia per il parenchima, per i ventricoli che per le meningi e lo spazio. Le diverse strutture
cerebrali hanno differenze di T1 e T2 molto significative:
Mencaroni Spartaco
STRUTTURA
Liquor
Sostanza grigia
Sostanza bianca
Lipidi
Sangue
Sangue in moto laminare
183
T1
Lunghissimo
Molto lungo
Lungo
Corto
Corto
Molto corto
T2
lunghissimo
Molto lungo
Lungo
Lungo
Molto lungo
Molto corto
Esistono oggi mezzi di contrasto paramagnetici da utilizzare per l’angiografia a RM che trova applicazioni
nello studio del circolo del Willis, dei seni venosi durali, degli aneurismi.
Angiografia
Non può essere sostituita dalla TC per lo studio preoperatorio dei tumori, ma per gli esami di diagnosi di
malformazioni vascolari, angiomi e patologia ischemica ha funzionalità secondarie a quelle della RM.
Viene fatta sulle vertebrali o sul circolo carotideo.
Scintigrafia
Importantissima. Trattata nella parte di medicina nucleare
Ecografia
Nel periodo neonatale e nella prima infanzia la sottigliezza della teca cranica e la presenza delle finestre
acustiche delle fontanelle rendono possibile il suo utilizzo, importante perché ottiene buone immagini del
cervello e con la tecnica doppler permette la diagnosi del flusso cerebrale.
Nell’adulto non viene praticamente utilizzata.
http://www.hackmed.org
[email protected] 184
Mencaroni Spartaco
CAP 17 MAMMELLA
La senologia ha grande importanza modera per l’epidemiologia del cancro del seno, alla cui prevenzione e
individuazione precoce è completamente dedicata.
Dal punto di vista dello screening di popolazione, esiste il seguente protocollo:
DONNA ASINTOMATICA
DONNA SINTOMATICA
• Screening in età compresa fra 40 e 50 anni con • Primo approccio: se prima dei 35 anni ecografia,
se dopo mammografia
mammografia annuale
• Screening fra 50 e 70 anni con mammografia • Se la prima indagine è negativa, si fa l’altra
(ecografia o mammografia a seconda di quella
biennale
eseguita per prima)
• Successivamente, agobiopsia del reperto
palpabile.
Agobiopsia, ecografia e mammografia sono i tre esami clinici di riferimento per la senologia. TC e RM sono
importanti come esami di complemento, mentre la scintigrafia (vedi medicina nucleare) è fondamentale per
lo studio del così detto linfonodo sentinella.
17.1 DESCRIZIONE DELLE TECNICHE DI INDAGINE
Mammografia
Tecnica principale con possibilità di identificare le distorsioni e le calcificazioni dell’architettura mammaria,
spesso prima spia di un carcinoma asintomatico.
Per l’esecuzione della radiografia al seno viene utilizzato un apparecchio detto mammografo, che ha la
possibilità, attraverso una collimazione molto attenta di fasci di radiazione, sia di ridurre la dose che di
ottenere immagini di alta risoluzione.
Si usa il classico schema a quattro quadranti, e dal superiore esterno si analizza anche il pilastro ascellare
della ghiandola mammaria. Le proiezioni normalmente usate sono due:
• Mediale → laterale obliqua a 45°
• Cranio caudale
• Per donne sintomatiche e per analizzare alcuni punti precisi dove vi sia un reperto palpabile, si usano
proiezioni speciali.
•
• La mammella viene sempre valutata sulla base della clinica. Si osserva nel mammogramma:
• Capezzolo
• Linea cutanea
• Spazio trasparente sottocutaneo
• Corpo ghiandolare
• Spazio trasparente retroghiandolare
• Piani muscolari
•
• E’ importante poi sia l’analisi comparativa nel tempo che il raffronto fra le due mammelle
•
• Si possono evidenziare con questa tecnica vari tipi fondamentali di lesione:
• Lesione nodulare radiotrasparente o mista: in genere espressione di patologie benigne o cisti. Il
fibroadenoma giovanile è misto
• Lesioni nodulari radiopache: correlate sia a lesioni maligne che benigne, e in una frazione di casi
significativa non possono essere indagate solo con la mammografia (agobiopsia). La regola che la
radiopacità si correla con la malignità ha le sue eccezioni!
• Distorsioni architettoniche, che possono essere:
• Centrifughe: di norma associate alla presenza di lesioni benigne
• Centripete: formazioni stellate senza nucleo centrale radiopaco, in genere associate a lesioni maligne.
• Calcificazioni: molto frequenti, spesso sono benigne, dovute a mutazioni fisiologiche del pH dei tessuti,
ma se si trovano nel contesto di una opacità ritenuta benigna bisogna approfondire.
•
Mencaroni Spartaco
•
185
Il mammogramma può anche valutare i linfonodi ascellari se sono calcificati o molto ingranditi.
Ecografia
La tecnica di seconda istanza, a meno che la donna non sia sintomatica in età inferiore a 35 anni o incinta.
Consente di:
• Differenziare formazioni cistiche da noduli solidi (cisti non sempre distinguibili da fibroadenomi)
• Analizzare la parete interna della cisti
• Classificare i noduli solidi sulla base della loro morfologia
• Valutare la vascolarizzazione dei noduli solidi
•
• Il segno ecografico di malignità più affidabile è l’irregolarità dei margini. Altri meno importanti sono:
• Presenza di un cono d’ombra posteriore (tumori scirrosi)
• Disomogeneità ecostrutturale
• Minore compressibilità e immobilità alla compressione manuale (segno di ancoraggio ai tessuti
circostanti)
Biopsia ecoguidata
Importante e spesso vi si ricorre per valutare un reperto mammario dubbio (eccetto che in alcuni casi che
possono essere chiariti alla RM, vedi).
Se il reperto è ecografico con sicura correlazione topografica si fa biopsia sotto guida ecografica, più sicura e
meno costosa. Se la posizione topografica del pezzo è incerta si fa una agobiopsia sotto guida mammografica.
In alternativa all’agoaspirato si può fare una biopsia con ago tranciante
Duttografia
Altro esame importante nell’iter diagnostico del carcinoma mammario, la duttografia consiste nella
valutazione della struttura interna del dotto in presenza di secrezioni dal capezzolo (ematiche, sierose,
lattiginose, eccetera).
Si usa un ago ultrasottile da 27G, inserito nel capezzolo, e si incannula l’estremità del dotto escretore. Si
inietta quindi mezzo di contrasto iodato a bassissima pressione in quantità di 1 ml circa, lasciando il catetere
in loco.
In condizioni normali l’albero galattoforo presenta ramificazioni regolari a partire dal dotto principale;
modificazioni di qualsiasi tipo di calibro, decorso, struttura e riempimento si osservano benissimo.
Cause di secrezione spontanea dal capezzolo:
BENIGNE
• Ectasia galattofora su base infiammatoria
• Papilloma singolo
• Papillomatosi multipla
•
•
•
MALIGNE
Carcinoma a sviluppo endocanalicolare
Carcinoma
invasivo con interessamento
secondario dei dotti
RM
Riveste un ruolo significativo nell’ambito senologico, essendo in grado di dare informazioni specifiche su
alcune situazioni in cui mammografia ed ecografia non sono di aiuto:
• Valutazione di integrità delle protesi
• Caratterizzazione di reperto palpatorio in presenza di protesi
• Sospetto di multifocalità (più foci nello stesso quadrante)
• Sospetto di multicentricità (più foci in quadranti diversi)
• Definizione di rapporti fra tumore e parete toracica
• Volumetria del tumore prima e dopo chemio neoadiuvante
• Ricerca di tumore mammario primitivo in soggetto con metastasi ascellari e mammografia ed ecografia
negative
TC
Ruolo importante nella ricerca delle metastasi regionali e lontane (encefalo, polmone, fegato). In alternativa
alla RM importante per la valutazione dell’invasione toracica locale.
http://www.hackmed.org
[email protected] 186
Mencaroni Spartaco
CAP 18 LINFOMI
18.1 MALATTIA DI HODGKIN (MH)
Comprende un gruppo di malattie che differiscono dai LNH (Linfomi Non-Hodgkin): la MH insorge in un
unico LN o in una stazione linfonodale e si estende sempre ai LN anatomicamente contigui, laddove i LNH
insorgono in sede extranodale e diffondono in maniera del tutto imprevedibile.
Nella MH è poi caratteristicamente sempre presente una cellula gigante neoplastica, la cellula di Reed –
Sternberg (RS), di origine sconosciuta e fenotipo peculiare, che induce l’accumulo di cellule reattive del
S.I.. Questa popolazione neoplastica però costituisce solo dall’1 al 5% dell’intera massa tumorale, a
differenza delle altre neoplasie linfoidi.
Ha una bassa incidenza complessiva (0,7% dei nuovi casi di neoplasia in USA) ma è importante perché e
assai più frequente nell’età giovane – adulta (età media alla diagnosi: 32 anni) ed è considerata curabile nella
maggior parte dei casi.
È ormai appurato che la MH è un disordine neoplastico e che la popolazione di cellule reattive si accumula in
risposta alle citochine secrete dalle cellule di RS: la peculiare combinazione delle citochine secrete è
responsabile delle specifiche caratteristiche istologiche delle principali varianti. Nel caso della variante a
predominanza linfocitica, l’origine delle cellule reattive è molto probabilmente B-cellulare.
Cellula di RS: è considerata un elemento istologico necessario per la diagnosi di MH; è una cellula di
discrete dimensioni (15-45 micron), binucleata o con nucleo bilobato formato da due metà speculari. Altre
volte contiene un nucleo multilobato. In ogni caso contiene ampi nucleoli circondati da un alone chiaro,
simili a corpi inclusi, che gli conferiscono l’aspetto cosiddetto “a occhio di civetta”. Essi sono simili per
grandezza a un piccolo linfocita.
→ Diffusione – stadiazione della malattia: la diffusione è sempre la stessa e pertanto facilmente
prevedibile: si parte dai Ln, poi vengono interessati nell’ordine la milza, il fegato, il MO e le sedi
perilinfonodali. Per questo la stadiazione non ha solo valore prognostico ma guida anche le scelte
terapeutiche. Per studiare la MH ci si avvale di alcune procedure diagnostiche come la TC addominopelvica,
l’Rx del torace e la biopsia del MO; l’interessamento splenico può invece essere appurato con certezza solo
con la laparotomia stadiativa, nel corso della quale si procede eventualmente alla splenectomia e alla biopsia
epatica.
Stadiazione clinica di Ann Arbor:
9 I – singola stazione LN coinvolta o singolo sito extralinfatico (IE)
9 II – 1 o più stazioni LN coinvolte, da sole o con interessamento limitato di organi o tessuti
extralinfatici (IIE), dallo stesso versante del diaframma
9 III – interessamento di stazioni LN, o milza (IIIS) o siti extralinfatici (IIIE), da ambedue i versanti del
diaframma
9 IV – focolai di interessamento multipli o disseminati di uno o più organi o tessuti extralinfatici, con o
senza interessamento linfatico
Sottotipi
1.
Sclerosi nodulare: è la variante più comune (65-75% dei casi), si caratterizza per la presenza di
cellule di RS lacunari (in verità assai rare rispetto alle altre forme) e di dense bande di collageno che
suddividono il tessuto linfoide in noduli circoscritti. Le cellule di RS, negative per i markers B- e Tcellulari, sono presenti su uno sfondo polimorfo, composto da molti tipi cellulari. È l’unica variante di
MH più comune nelle donne, con tendenza a interessare i LN cervicali bassi, sopraclavicolari e
mediastinici. La prognosi è eccellente.
2.
Cellularità mista: costituisce ¼ dei casi e si presenta con la sostituzione diffusa del tessuto
linfonodale da parte di un infiltrato cellulare polimorfo in cui sono frammiste le cellule neoplastiche
RS che sono assai numerose (soprattutto la variante mononucleata). I linfociti di contorno sono
soprattutto L.T e la malattia linfonodale precoce interessa per lo più la zona T paracorticale del LN.
Quando essi sono abbondanti sono necessarie analisi immunofenotipiche per fare la diagnosi
differenziale con il tipo a predominanza linfocitaria o con un LNH a fenotipo strano. Colpisce di più i
maschi, in età avanzata e si presenta a uno stadio più avanzato al momento della diagnosi, con
presenza di sintomi di tipo B (sistemici). Ciononostante la prognosi rimane buona.
3.
Predominanza linfocitica: rara variante (< 6% dei casi), caratterizzata da un infiltrato di piccoli
linfociti frammisti a un numero variabile di istiociti benigni, in cui le comuni cellule RS sono molto
Mencaroni Spartaco
187
difficili da reperire: per lo più si ritrova la variante linfoistiocitica (L+H) con nucleo multilobato “a
popcorn”. Scarsi o assenti sono gli altri tipi cellulari, compresi eosinofili, PMN e plasmacellule, come
scarsa è anche la reazione fibrogenica. A differenza delle altre varianti, questa sottopopolazione di
cellule di RS è positiva per il CD45 e il CD20 , un marcatore B-cellulare, e mostrano i riarrangiamenti
VDJ dei geni per le Ig. Questa forma colpisce individui giovani, e si presenta con un’estensione
limitata, per lo più ai LN cervicali e ascellari.
Clinica
La MH si presenta con una linfomegalia non dolente e può essere differenziata da un LNH ancor prima della
biopsia linfonodale in base ad alcuni caratteri clinici:
MH
LNH
+ spesso localizzata in un singolo gruppo di LN Interessamento multiplo di LN periferici
assiali (cervicali, mediastinici, paraortici)
Linfoadenopatia mediastinica
Linfoadenopatia sottodiaframmatica
Diffusione ordinata per contiguità
Diffusione casuale
Raramente interessa i LN mesenterici e l’anello di Interessa frequentemente queste sedi
Farre - Waldeyer
Interessamento extranodale raro
Frequente, e spesso localizzato al MO, GE, osso,
visibile con la RMN
I pazienti più giovani tendono a presentarsi in stadio I o II e senza sintomi B, che invece sono
invariabilmente presenti in pazienti anziani, con malattia in stadio avanzato e con sottotipo cellularità mista o
deplezione linfocitaria. Un sintomo curioso, molto indicativo ma non sempre presente è l’insorgenza di una
dolenza a carico dei LN interessati dopo assunzione di alcool.
Nella maggior parte dei casi è presente anche anergia cutanea dovuta alla depressione della CMI: essa però
tende inspiegabilmente a persistere anche dopo una terapia eseguita con successo.
Il fattore prognostico più importante, con i nuovi protocolli terapeutici è diventato la massa tumorale,
piuttosto che il tipo istologico: la sopravvivenza arriva al 90% per MH in stadio precoce e 60-70% in stadio
avanzato a 5 anni: la lunga sopravvivenza raggiunta però ha fatto emergere un nuovo inconveniente:
l’insorgenza di una seconda neoplasia, questa volta più grave, come la LAM, il carcinoma polmonare e una
sindrome mielodisplastica. L’insorgenza del carcinoma mammario probabilmente dipende da un trattamento
radioterapico eseguito in giovane età, mentre la LAM sembra correlata all’uso di agenti alchilanti in maniera
indiscriminata
LINFOMI NON HODGKIN
Definizioni
Innanzitutto va detto che il termine leucemia è riservato a neoplasie linfoidi con diffuso interessamento del
MO, di solito accompagnate da una linfocitosi massiva nel sangue periferico. Il termine linfoma invece è
adoperato per proliferazioni che insorgono sottoforma di masse tissutali apprezzabili all’esame obbiettivo o
strumentale. Tuttavia non sempre c’è una demarcazione così netta: spesso i linfomi mostrano un quadro
leucemico nel sangue periferico e finiscono per interessare il MO, evolvendo propriamente nella leucemia.
Tra i linfomi i LNH si distinguono nettamente dalla MH, come si è già visto.
Una terza categoria potrebbe essere le neoplasie plasmacellulari, tumori costituiti da cellule B a
differenziazione terminale a insorgenza nel MO con raro interessamento linfonodale e produzione di un
quadro leucemico periferico.
La presentazione clinica dei LNH è legata alla distribuzione anatomica della malattia: 2/3 dei casi
esordiscono con linfomegalia non dolente, localizzata o meno; la quota rimanente origina in sedi extranodali
(cute, stomaco ed encefalo soprattutto). Le leucemie invece insorgono per lo più con i segni di insufficienza
midollare e di infiltrazione spleno-epatica.
La classificazione è da sempre dibattuta: l’ultima accettata è la REAL (Revised European-American
Classification Of Lymphoid Neoplasms) che descrive neoplasie ritenute entità a sé stanti sulla base di criteri
clinici, morfologici, immunofenotipiche e genotipiche.
http://www.hackmed.org
[email protected] 188
Mencaroni Spartaco
La REAL elimina la precedente separazione tra le varie neoplasie linfoidi per distinguere invece 4 gruppi:
1. neoplasie dei precursori B-cellulari
2. neoplasie delle cellule B-periferiche
3. neoplasie dei precursori T-cellulari
4. neoplasie delle cellule T periferiche e delle cellule NK
Alcune considerazioni:
9 per la diagnosi di certezza di LNH è dirimente l’esame istologico
9 sebbene i linfomi siano maligni per definizione il comportamento clinico e la prognosi sono assai
variabili
9 le neoplasie B-cellulari sono di gran lunga le + frequenti, le forme a cellule NK invece sono rare
9 i linfomi interferiscono quasi sempre con una o più funzioni del SI, causando immunodeficienza o
disregolazione immunitaria
9 ciascun linfoma deriva da una singola cellula trasformata, cioè è monoclonale: questo lo si può
verificare analizzando i prodotti proteici dei geni perché il riarrangiamento dei geni per le Ig o per il
TCR si verifica prima della trasformazione neoplastica della cellula stessa; in questo modo i linfomi
sono differenziati da modificazioni reattive, policlonali
9 le cellule B e T neoplastiche tendono a insediarsi e a crescere nelle aree dove alberga la loro
controparte normale (rispettivamente follicolo linfoide e zona T paracorticale); inoltre sono
anch’essi dotati della capacità di ricircolare continuamente nel tessuto linfoide, andando a fare
casino dappertutto (utilizzando sensibili tecniche molecolari, si vede che le cellule neoplastiche
hanno una distribuzione pressoché ubiquitaria al momento della diagnosi)
DIAGNOSI RADIOLOGICA
Uno dei primi segni del LH è l’ingrossamento dei linfonodi laterocervicali. Questi spesso non sono visibili
all’RX per la sovrapposizione dei vasi aorta, arteria e vene polmonari. Se il mediastino è molto allargato è
interessato anche il timo.
Il reperto tipico è:
• Linfoadenopatia con slargamento bilaterale del mediastino (diagnosi differenziale con carcinoma
polmonare).
Può anche essere presente un versamento pleurico basso.
La linfoadenopatia sottodiaframmatica è possibile, ma è più frequente nei LNH. In questi assume
massimo rilievo nella regione mesenterica, mentre i LH sono massimamente interessati nel distretto celiaco,
splenico e dell’ilo epatico.
Come per tutte le patologie della zona intestinale, l’indagine di queste condizioni viene fatta con una TC con
mezzo di contrasto, per differenziare i vasi.
Le lesioni parenchimali sono comuni sia nel LH che nei LNH. Alcune considerazioni:
• Nel pericardio e nell’intestino è molto difficile capire la natura e l’origine della lesione
• Il coinvolgimento extralinfonodale è molto più comune nel LNH
• Nel 50% dei casi di LH c’è versamento pleurico
• I linfonodi si vedono anche all’ecografia, specialmente in regione sottodiaframmatica
• Stomaco: sede più frequente di linfoma GE sia primitivo che secondario. L’ispessimento sottomucoso
che si crea va differenziato con la gastrite iperplastica
• Colon retto: rarissimo il coinvolgimento
• Milza: nel 10% dei LH, ma un semplice aumento di volume non è significativo
• Fegato: epatomegalia può essere un indice di infiltrazione
• Genito urinario: il rene non varia la morfologia (diagnosi differenziale con carcinoma renale), ma può
esserci ispessimento della fascia di Gerota; l’interessamento della prostata è raro, quello della vescica e
soprattutto dei testicoli più frequente (nel testicolo il linfoma è il 5% delle neoplasie)
• Intestino: ispessimento della parete, invaginazione
• Utero: lesioni aspecifiche come nella vescica.
• Surrene
• SNC
Mencaroni Spartaco
•
•
•
189
MO: con mezzo di contrasto paramagnetico alla RM si vede l’interessamento del midollo. 20-40% dei
LNH alla presentazione, spesso al 4° stadio. I LH soltanto nel 5-15% dei casi, durante il corso della
patologia, interessano il midollo osseo.
Osso: primario 1% dei LNH, secondario 5-6% dei LH. Valutazione alla scintigrafia
Meningi: valutazione alla RM con mezzo di contrasto paramagnetico.
La RM è l’ideale per valutare le masse linfomatose nei tessuti molli del LNH, non sempre valutabili
all’ispezione. Nel MO si vede bianco il tessuto normale (iperintenso), scuro il linfoma (ipointenso).
In tratti come vescica, intestino, utero, le lesioni sono aspecifiche e prima di parlare di lesione
linfomatosa bisogna avere la certezza che il paziente ha un linfoma.