Istruzioni per l’Uso
Epstein-Barr virus
VCA IgM microcapture ELISA
Saggio immunoenzimatico per la determinazione qualitativa o quantitativa
degli anticorpi della classe IgM contro I’antigene virocapsidico (VCA) del
virus d’Epstein-Barr nel siero e plasma umani.
RE57361
96
2-8°C
I B L
I N T E R N A T I O N A L
Flughafenstrasse 52a
D-22335 Hamburg, Germany
Phone: +49 (0)40-53 28 91-0
Fax: +49 (0)40-53 28 91-11
G M B H
[email protected]
www.IBL-International.com
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
1.
ITALIANO
USO PREVISTO
Saggio immunoenzimatico per la determinazione qualitativa o quantitativa degli anticorpi della classe IgM
contro I’antigene virocapsidico (VCA) del virus d’Epstein-Barr nel siero e plasma umani.
2.
SOMMARIO E SPIEGAZIONI
La mononucleosi infettiva è una patologia linfoproliferativa acuta comune nei bambini e giovani adulti ed è
causata dal virus Epstein-Barr (EBV). L’EBV è una delle infezioni da gamma-herpesvirus tipo 4.
La sintomatologia clinica caratteristica include:
1. febbre, faringite e linfoadenopatia
2. una linfocitosi assoluta associata e con valori superiori al 50% contenenti almeno il 10% di linfociti atipici
nel sangue periferico
3. sviluppo di anticorpi eterofili transienti e presenza persistente di anticorpi anti EBV
4. test sull’alterazione della funzionalità epatica.
il 4% dei giovani adulti infetti presentano un ittero e il 50% presenta anche splenomegalia. L’EBV è inoltre
correlato al carcinoma rinofaringeo, al linfoma di Burkitt e di Hodgkin.
Una sindrome simile a quella della mononucleosi infettiva può essere causata dal citomegalovirus, dalla
toxoplasmosi e da altre infezioni virali; la diagnosi differenziata dipende dai risultati di laboratorio,
considerando solo l’EBV come stimolante della produzione di anticorpi eterofili.
L’EBV è presente nella saliva di pazienti che hanno contratto una mononucleosi infettiva acuta e la
secrezione del virus da parte dell’orofaringe, che continua per molti mesi dopo la fase acuta della patologia,
è una delle principali vie di trasmissione del virus. Il virus di Epstein-Barr, dopo aver contratto l’infezione,
rimane in circolo per tutta la vita, per quanto – in generale - a livello asintomatico. Nei Paesi in via di
sviluppo pratticamente l’intera popolazione è infettata; nei Paesi occidentali vi è una prevalenza circa dell’
80 – 90%. La trasmissione, probabilmente dalla madre, avviene già in età infantile e principalmente tramite
la saliva.
Di grande importanza per la diagnosi è il riscontro di un aumento del numero relativo ed assoluto di linfociti
e di linfociti atipici. Durante il decorso della malattia il 50 – 60% dei leucociti nel sangue periferico può
consistere di cellule linfatiche, delle quali normalmente il 10% consiste di linfociti atipici. Inoltre si osservano
test sulla funzionalità epatica anormali ed alti titoli di anticorpi eterofili.
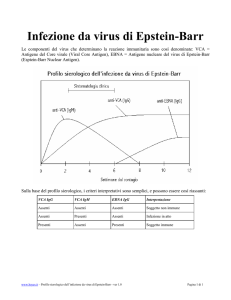
Test sierologici come Elisa sono molto utili per la determinazione di anticorpi anti-EBV, specialmente se gli
anticorpi eterofili sono assenti. Le diverse fasi di un’infezione EBV (primoinfezione acuta, infezione riattivata,
infezione passata) sono caratterizzate dalla comparsa di diversi anticorpi (IgA, IgG, IgM) anti-antigeni virali
diversi (antigene virocapsidico = VCA, antigene precoce = EA e l’antigene nucleare del virus di Epstein-Barr
= EBNA).
I sei parametri prodotti dall’IBL (VCA IgA / IgG / IgM, EA IgA / IgG und EBNA IgG) permettono di individuare
e differenziare tutte le fasi di un’infezione EBV. Con una selezione mirata di antigeni IBL EBV ELISA si
otterrà una straordinaria sensibilità e specificità ai fini della diagnosi di patologie acute e del riscontro di
infezioni passate.
I dosaggi per il rilevamento di anticorpi anti EA ed EBNA usano antigeni ricombinanti altamente specifici –
l’antigene EA p54 espresso in E. Coli e l’antigene EBNA-1 p72 espresso in cellule Sf9; VCA gp125
purificato da cellule P3HR1 è responsabile dell’alta sensibilità dei VCA ELISA.
Questa selezione di antigeni insieme ad una regolazione mirata delle caratteristiche del dosaggio porta ad
una chiara distinzione tra campioni positivi e negativi, vale a dire una piccola zona grigia.
L’altissima sensibilità del dosaggio VCA IgA e la specificità pari al 100% dell’EA IgA ELISA rivestono
particolare importanza; La combinazione di questi due dosaggi permette un rilevamento corretto,
estremamente affidabile, di infezioni riattivate.
Il principio di µ-cattura applicato ai risultati del dosaggio VCA IgM porta ad una maggiore specificità se
paragonato ai test IgM ELISA basati sul principio del sandwich; questo significa che i falsi risultati positivi
vengono minimizzati.
Nel capitolo PERFORMANCE, si trovano le informazioni sulle combinazioni di anticorpi tipiche delle diverse
fasi di un’infezione.
Version 2014-05
1/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
3.
ITALIANO
PRINCIPIO DEL TEST
Test dell’immunosorbente legato ad un enzima (ELISA) in fase solida, basato sul principio da µ-cattura.
Anticorpi anti-IgM umani si legano sulla superficie delle strip delle microprovette. Il siero diluito del paziente
o il calibratore ed i controlli pronti all’uso vengono pipettati nei pozzetti del vassoio delle microprovette.
Durante la prima incubazione gli anticorpi IgM del campione si legano all’anticorpi specifici de clase delle
microprovette.
Durante la seconda incubazione viene aggiunto il coniugato di antigeni pronto all’uso (l’antigene
virocapsidico EBV biotinilato, VCA gp 125 affinità purificato da cellule P3HR1 mescolato con perossidasa
anti-biotina) che si lega agli anticorpi IgM catturati nei pozzetti delle microprovette.
Successivamente si pipetta il substrato (TMB) che induce lo sviluppo di una colorazione blu nei pozzetti. Lo
sviluppo della colorazione viene bloccato da una soluzione stop che modifica il colore da blu a giallo. Ne
risulta una colorazione valutabile al lettore spettrofotometrico su una lunghezza d’onda di 450 nm. La
concentrazione degli anticorpi IgM è direttamente proporzionale all’intensità della colorazione.
4.
AVVERTENZE E PRECAUZIONI
1. Solo per uso diagnostico in-vitro. Solo per uso professionale.
2. Leggere attentamente le istruzioni prima di iniziare il test. Utilizzare il manuale fornito nel kit. Assicurarsi
di aver compreso tutte le indicazioni.
3. In caso di danneggiamento del kit contattare IBL o il Vostro fornitore entro 1 settimana dal ricevimento
della merce. Non utilizzare i componenti danneggiati ma conservarli per fornire prove del danno assieme
al reclamo che inoltrerete al produttore/fornitore.
4. Rispettare lotto e scadenze. Non scambiare o mescolare tra loro reagenti di lotti diversi. Non usare i
reagenti scaduti.
5. Attenersi alle Buone Pratiche di Laboratorio e alle direttive di sicurezza. Indossare camici, guanti in
lattice e occhiali protettivi se necessario.
6. Alcuni reagenti del kit contengono sostanze pericolose che potrebbero causare irritazioni a pelle ed
occhi. Consultare la sezione MATERIALE FORNITO e le etichette per i dettagli precisi. Schede di
sicurezza del prodotto sono disponibili sul sito web IBL o su richiesta specifica ad IBL/fornitore.
7. I reagenti preparati e usati e le sostanze chimiche del kit devono essere trattati come rifiuti pericolosi
secondo le normative di sicurezza e la legislazione vigente nel Paese in cui il prodotto viene usato.
8. Il personale delle pulizie dev’essere informato dal personale specializzato sui possibili rischi e sulle
procedure da adottare.
9. Evitare il contatto con la soluzione stop. Può causare irritazioni e ustioni della pelle.
10. Tutti i reagenti del kit contenenti siero umano o plasma sono risultati negativi rispetto a HIV I/II, HBsAg e
HCV. Si raccomanda tuttavia di trattarli come potenzialmente pericolosi poiché non si può escludere in
maniera assoluta la presenza di questi o di altri agenti infettivi.
5.
CONSERVAZIONE E STABILITÀ
Il kit è spedito e trasportato a temperatura ambiente e deve essere conservato a 2-8 °C. Non esporre a luce
solare diretta e ad alte temperature. L’informazioni relative a conservazione e stabilità di tutti i reagenti e dei
campioni sono riportate nel capitolo corrispondente.
La piastra microtitrata aperta è stabile fino a scadenza del kit se conservata nel suo involucro ben chiuso
riposta a 2–8 °C.
6.
PRELIEVO E CONSERVAZIONE DEI CAMPIONI
Siero, Plasma (EDTA, Citrato)
Osservare le classiche precauzioni durante il prelievo venoso. Conservare l’integrità del campione di
sangue dal momento del prelievo al momento dell’esecuzione del test. Non usare campioni emolizzati,
itterici o lipemici. I campioni torbidi devono essere centrifugati per rimuovere il materiale particolato al loro
interno.
Conservazione:
Stabilità:
Version 2014-05
2-8°C
7 giorni
-20°C
> 7 giorni
Non esporre alla luce solare diretta e al calore.
Evitare la ripetizione di cicli di congelamento/scongelamento.
2/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
7.
ITALIANO
MATERIALE FORNITO
Quantità
Simbolo
Componente
Micropiastra
1 x 12 x 8
MTP
1 x 12 mL
AG CONJ
1 x 200 µL
ENZ TRACER CONC
1 x 1.5 mL
CONTROL+
1 x 1.5 mL
CONTROL-
1 x 4 x 1.5 mL
CAL A-D
1 x 100 mL
DILBUF
1 x 100 mL
WASHBUF CONC
1 x 15 mL
TMB SUBS
Soluzione Substrato TMB
1 x 15 mL
TMB STOP
Soluzione Stop TMB
Strisce separabili. Rivestito con anticorpi contro umano IgM-Ab.
Coniugato dell’Antigene
Di colore rosso.
Contiene: EBV VCA antigene, stabilizzatori.
Tracciante dell’ Enzima Concentrato (100x)
Contiene: anticorpi contro antigene, coniugato a perossidase, stabilizzatori.
Controllo Positivo
Di colore rosso. Pronto/a all’uso. Contiene: IgM anticorpi contro EBV-VCA
(Siero umano), stabilizzatori.
Controllo Negativo
Di colore verde. Pronto/a all’uso. Contiene: IgM anticorpi contro EBV-VCA
(Siero umano), stabilizzatori.
Standard A-D
2; 20; 50; 200 U/mL.
Standard B = Controllo Cut-Off
Pronto/a all’uso.
Contiene: IgM anticorpi contro EBV-VCA (Siero umano), stabilizzatori.
Tampone Diluente
8.
Di colore blu. Pronto/a all’uso. Contiene: PBS Tampone, detergenti, BSA,
stabilizzatori.
Tampone Lavaggio, Concentrato (10x)
Contiene: PBS Tampone, detergenti.
Pronto/a all’uso. Contiene: TMB, Tampone, stabilizzatori.
Pronto/a all’uso. 0.5 M H2SO4.
MATERIALI NECESSARI MA NON FORNITI
1.
2.
3.
4.
5.
6.
7.
Micropipette (Multipette Eppendorf o similari, < 3 % CV). Volumi: 5; 100; 500 µL
Vortex mixer
Tubi per diluizione dei campioni
Incubatore, 37 °C
Micropipetta 8-Canali con contenitori per reagenti
Spruzzetta per lavaggi, lavatore per micropiastre automatico o semi automatico
Lettore per micropiastre in grado di leggere ad assorbanza di 450 nm (lunghezza d’onda di riferimento
600-650 nm)
8. Acqua bidistillata o deionizzata
9. Carta assorbente, puntali per pipette e timer
9.
NOTE PER LA PROCEDURA
1. Qualsiasi manipolazione impropria dei campioni o modifica alla procedura può compromettere i risultati.
Rispettare rigorosamente i volumi, i tempi e le temperature di incubazione e i passaggi di pretrattamento
dei campioni indicati in metodica. Utilizzare pipette calibrate.
2. Una volta iniziato il test completare tutti i passaggi senza interruzioni. Assicurarsi che tutti i reagenti
siano stati precedentemente preparati in tempo utile. Far raggiungere la temperatura ambiente ai
campioni e ai componenti del kit (18-25 °C) e mescolare delicatamente ciascun reattivo liquido e
campione prima dell’uso. Non creare schiuma durante il mescolamento.
3. Evitare la contaminazione di reagenti, pipette, pozzetti o provette. Usare puntali di plastica nuovi per
ogni reagente, standard e campione. Non scambiare i tappi tra loro. Tappare sempre i flaconi non
utilizzati. Non riutilizzare pozzetti/provette o reagenti.
4. Usare uno schema di pipettamento per realizzare un’appropriata distribuzione sulla piastra.
5. Il tempo di incubazione influisce sui risultati. Tutti i pozzetti dovrebbero essere dispensati nello stesso
ordine e sequenza temporale. Si raccomanda una pipetta multicanale a 8 canali per pipettare le
soluzioni in tutti i pozzetti.
Version 2014-05
3/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
ITALIANO
6. Il lavaggio della micropiastra è importante. Pozzetti lavati in modo inappropriato possono portare a
risultati erronei. Si raccomanda una pipetta multicanale o un lavatore automatico per piastre. Non far
asciugare i pozzetti tra le varie incubazioni. Non graffiare i pozzetti rivestiti durante risciacqui e
aspirazioni. Risciacquare e versare i reagenti con cura. Durante i risciacqui assicurarsi che i pozzetti
siano ben riempiti con la soluzione di lavaggio e che non ci siano residui nei pozzetti.
7. L’umidità influisce sui pozzetti/tubi rivestiti. Non aprire l’involucro finché non ha raggiunto la temperatura
ambiente. Riporre immediatamente i tubi/pozzetti non utilizzati nell’involucro con il disseccante.
10.
ISTRUZIONI PRE-TEST
10.1. Preparazione dei Componenti
Diluire /
Componente
dissolvere
100 mL
WASHBUF
CONC
Componente
ENZ TRACER
CONC
Diluente
Rapporto
Note
Conservazione
Stabilità
acqua
bidist.
1:10
Riscaldare a 37°C per
sciogliere i cristalli.
Mescolare energicamente.
2-8°C
8
settimane
fino a
1000 mL
da mescolare
sempre
con
AG CONJ
Rapporto
1:101
Note
Conservazione Stabilità
p.e. 10 mL AG CONJ
+ 100 µL ENZ TRACER CONC
2-8 °C
1 giorno
10.2. Diluizione dei Campioni
Campione
Siero / Plasma
da diluire
con
Rapporto
Note
sempre
DILBUF
1:101
p.e. 5 µL + 500 µL DILBUF
Campioni con concentrazioni superiori allo standard più alto devono essere ulteriormente diluiti.
11.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
PROCEDURA DEL TEST
Pipettare rispettivamente 100 μL di Standard, Controlli e campioni diluiti nei rispettivi pozzetti
della Micropiastra. Nel test qualitativo usare solo Standard B (Standard Cut-off). Per una maggiore
affidabilità dell’analisi si possono duplicare le determinazioni.
Coprire la piastra con pellicola adesiva. Incubare 60 min a 37°C.
Rimuovere la pellicola adesiva. Eliminare la soluzione d’incubazione. Lavare la piastra 3 volte con
300 µL di Tampone Lavaggio diluito. Rimuovere l’eccesso di soluzione picchiettando la piastra
capovolta su una salvietta di carta.
Pipettare 100 µL di Coniugato Enzimatico in ogni pozzetto.
Coprire la piastra con una nuova pellicola adesiva. Incubare 60 min a 37°C.
Rimuovere la pellicola adesiva. Eliminare la soluzione d’incubazione. Lavare la piastra 3 volte con
300 µL di Tampone Lavaggio diluito. Rimuovere l’eccesso di soluzione picchiettando la piastra
capovolta su una salvietta di carta.
Per aggiungere le Soluzioni Substrato e Stop usare, possibilmente, una micropipetta 8-canali.
Pipettare con intervalli di tempo costanti per le Soluzioni Stop e Substrato. Usare uno spostamento
positivo ed evitare la formazione di bolle d’aria.
Pipettare 100 µL di Soluzione Substrato TMB in ogni pozzetto.
Incubare 30 min a 18-25°C al buio (senza foglio adesivo).
Fermare la reazione substrato aggiungendo 100 µL di Soluzione Stop TMB in ogni pozzetto.
Mescolare delicatamente il contenuto agitando leggermente la piastra.
Misurare la densità ottica con un fotometro a 450 nm (Lunghezza d’onda di riferimento: 600-650 nm)
entro 60 min dopo aver pipettato la Soluzione Stop.
Version 2014-05
4/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
12.
ITALIANO
CONTROLLO DI QUALITA’
I risultati sono validi solo se si sono seguite le istruzioni d’uso del test. L’utilizzatore deve attenersi alle
Buone Regole di Procedura di Laboratorio (Good Laboratory Practice) o ad altri standard/regolamenti
applicabili. Tutti gli standards del kit devono rientrare nei limiti di accettabilità dichiarati sul certificato di
Controllo Qualità. Se i criteri non sono soddisfatti il test non è valido e dovrebbe essere ripetuto. Ogni
laboratorio dovrebbe usare campioni noti come ulteriori controlli.
In caso di deviazioni devono essere forniti i seguenti dati: Scadenza dei reagenti (preparati), condizioni di
conservazione, pipette, strumenti, condizioni di incubazione e metodi di lavaggio.
13.
CALCOLO DEI RISULTATI
L’evaluazione del test può essere eseguita qualitativamente o quantitativamente.
13.1. Qualitative Evaluation
Il valore di Cut-off (CO) è fornito dalla densità ottica (DO) dello Standard B (Standard Cut-off). L’indice Cutoff (COI) è calcolato sulla base della densità ottica media dei campioni e del valore Cut-off. Campioni la cui
densità ottica non differisca più del 10% dal Cut-off (zona grigia) vanno considerati dubbi. Campioni con DO
superiore sono positivi, campioni con DO inferiori sono negativi.
L’indice Cut-off (COI) dei campioni si ottiene con la
formula seguente:
COI =
DO CampioniValore misurati
CO
Esempio Tipico:
Cut-off = DO (Standard B, standard Cut-off) = 0.45
Campioni DO = 0.70
L’indice Cut-off (COI): 0.70 / 0.45 = 1.56. I Campioni vanni considerati positivi.
13.2. Evaluazione Quantitativa
Le DO ottenute per gli standards (asse y, lineare) sono messe in grafico rispetto alla loro concentrazione
(asse x, logaritmico) sia su carta per grafico semilogaritmico che con metodo automatico. Buoni risultati si
ottengono con grafici cubic spline, 4 Parametri Logistica o Logit-Log.
Per il calcolo della curva standard utilizzare ogni segnale degli standard (omettere ovviamente i valori dei
duplicati molto al di fuori dei risultati attesi e impiegare il valore singolo più plausibile).
La concentrazione dei campioni può essere ricavata dalla curva standard.
La diluizione iniziale è stata presa in considerazione quando si sono letti i risultati sul grafico. I risultati di
campioni con prediluizioni superiori devono essere moltiplicati per il fattore di diluizione.
I campioni con concentrazioni superiori al più alto degli standard devono essere diluiti come descritto nel
paragrafo ISTRUZIONI PRE-TEST e ritestati.
Tipica Curva di Calibrazione
(Esempio. Non usare per il calcolo!)
Standard
A
B
C
D
U/mL
2
20
50
200
Epstein-Barr virus VCA IgM
micro-capture ELISA
(OD)
2.500
DO Media
0.131
0.455
0.803
2.001
2.000
1.500
1.000
0.500
0.000
14.
INTERPRETAZIONE DEI RISULTATI
Metodo
Quantitativo
(Curva Standard):
Qualitativo
(Cut-off Index, COI):
Version 2014-05
Intervallo
> 22 U/mL
18 – 22 U/mL
< 18 U/mL
> 1.1
0.9 – 1.1
< 0.9
Interpretazione
positivo
dubbio
negativo
positivo
dubbio
negativo
1
10
100
1000
(U/mL)
I soli risultati non dovrebbero essere l’unica
motivazione alla base di una scelta
terapeutica. Devono essere correlati ad
altre osservazioni cliniche e test
diagnostici.
5/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
15.
ITALIANO
LIMITI DELLA PROCEDURA
La raccolta e conservazione dei campioni ha influenza significativa sui risultati del test. Vedere la sezione
PRELIEVO E CONSERVAZIONE DEI CAMPIONI per maggiori dettagli.
Azide e thimerosal a concentrazioni > 0.1 % interferiscono con questo test e possono portare a risultati non
veritieri.
2.0 mg/mL
I seguenti componenti del sangue non hanno effetto significativo Emoglobina
Bilirubina
0.3 mg/mL
(+/-20%) sui risultati del test fino ai livelli di concentrazione
Trigliceridi
2.5 mg/mL
riportati in tabella:
16.
PERFORMANCE
Non è stata riscontrata reattività- anticorpi contro Parvovirus B19, Hepatitis C, HSV 1/2,
crociate con: (n = 6-14):
Rubella, CMV, Influenza A/B, VZV, ANA
Cross-reactivities were found to
Epatite B (1/10), RF (1/15), Parotite (2/17),
(positive tested samples)
Morbillo (1/10)
CV
CV
CV
Intervallo ± 1xSD
Intervallo ± 1xSD
Intervallo ± 1xSD
Precisione
(%)
(%)
(%)
(U/mL)
(U/mL)
(U/mL)
4
3
8
Intra-Saggio (n = 20)
125 ± 5
19 ± 1
12 ± 1
7
10
21
Inter-Saggio (n = 20)
89 ± 6
20 ± 2
7±2
16
11
11
Inter-Lotto (n = 20)
100 ± 16
20 ± 2
18 ± 2
Intervallo
Intervallo di Diluizione
Intervalo di rec.
(U/mL)
(sample specific)
(%)
Linearità
7 – 98
1:32 – 1:512
97 – 121
Questo test è stato calibrato per: BEPIII (Dade Behring), TRITURUS (Grifols)
Automazione
Specificità Analitica
(Reattività Crociate)
Per determinare la sensibilità e specificità clinica di tutti i parametri 6 IBL EBV ELISA un pannello di 242
campioni è stato testato in tutti i dosaggi. Questo pannello contiene campioni delle diverse fasi di
un’infezione EBV:
Sieronegativa (compresi campioni di bambini)
Fase acuta di un’infezione
Infezione Riattivata
Infezione passata
n = 64
n = 48
n = 55
n = 75
La classificazione dei campioni è stata approvata da immunofluorescenza (IFA), in particolare i campioni
dell’infezione riattivata.
Version 2014-05
6/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
ITALIANO
Per la comparazione dei metodi tutto il pannello è stato misurato con ELISA per EBNA IgG, VCA IgG, VCA
IgM ed EA IgG approvati dalla FDA (Food and Drugs Administration, U.S.A.) Per EA IgA and VCA IgA non
esiste approvazione ufficiale del FDA.
Campioni determinati come positivi (compresi i border-line) con ELISA-IBL
*
**
n = 242
VCA
IgM
VCA
IgG
VCA
IgA
EA
IgA
EA
IgG
EBNA
IgG
fase acuta di un’infezione
n = 48
96%
90%
75%
65%
90%
0%
infezione riattivata
n = 55
0%
100%
96%
76%
93%
100%
infezione passata
n = 75
1%
89%
47%
0%
10%
100%
sieronegativo
n = 22
5% *
14% *
18% *
0%
0%
0%
bambini 0-12 mesi
n = 42
2%
36% **
2%
0%
2%
14% **
quasi 100% positivi
quasi 100% negativi
variabile positivi
Ac materni
il gruppo EBV sieronegativo può comprendere infezioni da EBV molto precoci ed asintomatiche che
portano a risultati positivi per VCA IgM, IgA ed IgG
gli anticorpi materni sono presenti, in concentrazioni molto basse, solo per VCA IgG ed EBNA IgG.
16.1. Sensibilità e specificità di IBL EBV-ELISA relativamente alle diverse fasi di un’infezione da
EBV
Infezione da EBV acuta: Come si vede nella tabella qui sopra, un’infezione acuta da EBV si può identificare
chiaramente in base a tre parametri che dovrebbero risultare positivi (VCA IgM, VCA IgG and EA IgG) ed
all’EBNA IgG, che è risultato chiaramente negativo, come previsto.
Infezione EBV riattivata: Diversamente da un’infezione acuta, si prevede che un’infezione EBV riattivata,
associata o meno allo sviluppo di un tumore, sia al 100% negativa per VCA IgM ma chiaramente positiva
per VCA IgG, VCA IgA, EA IgG ed EBNA IgG, come da tabella qui sopra.
Infezione passata: Le infezioni da EBV passate presentano solo due parametri esplicitamente positivi, il
VCA IgG e l’EBNA IgG. Tutti gli altri parametri dovrebbero esserequasi negativi conl’eccezione del VCA IgA
nelle infezioni passate che può persistere fino ad un anno.
I pazienti sieronegativi: dovrebbero avere risultati negativi in tutti e sei i parametri. Singoli risultati positivi di
VCA IgG, VCA IgA or VCA IgM possono indicare un’infezione EBV molto precoce ed ancora asintomatica.
Alternativamente, questi risultati positivi isolati sono il segnale di una leggera aspecificità dei dosaggi che, a
causa della loro sensibilità particolarmente elevata, possono riconoscere anticorpi di stimolazione
policlonale. Per ulteriori chiarimenti si suggerisce di ripetere il test dopo 7-10 giorni.
Anticorpi materni: Gli anticorpi materni si rilevano in concentrazioni molto basse solo durante i primi 6-9
mesi di vita e solo i due parametri di infezioni passate, VCA IgG ed EBNA IgG, dovrebbero risultare positivi.
Tutti gli altri anticorpi dovrebbero essere negativi, come da tabella di cui sopra. Il fatto che si possano
rilevare anticorpi materni dimostra la sensibilità particolarmente elevata degli IBL ELISA relativamente a
questi due parametri.
Version 2014-05
7/8
Epstein-Barr virus VCA IgM micro-capture ELISA (RE57361)
17.
ITALIANO
RIFERIMENTI BIBLIOGRAFICI SUL PRODOTTO
1. Aalto, S. M., Immunoreactivation of Epstein-Barr Virus Due to Cytomegalovirus Primary Infection,
Journal of Medical Virology 56:186-191 (1998)
2. Bailey, R. E. Diagnosis and treatment of infectious mononucleosis. Am. Fam. Physician 49:879-888.
(1994)
3. Bauer, G., Epstein-Barr Virus -- Bedeutung und Möglichkeiten der Labordiagnostik, Therapeutische
Umschau Bd. 51, Heft 8: 558- 562 (1994)
4. Bauer, G. Rationale und rationelle EBV-Diagnostik. Clin. Lab. 41:623-634. 1995.
5. Debyser, Z. et al. Comparative evaluation of three ELISA techniques and an indirect
immunofluorescence assay for the serological diagnosis of Epstein-Barr virus infection. Clin. Diagn.
Virol. 8: 71 (1997)
6. Dölken, G., Bross, K.J., Hecht, T., Brugger, W., Löhr, G.W., Hirsch, F.W., Increased incidence of IgA
antibodies to the Epstein-Barr virus-associated viral capsid antigen and early antigens in patients with
chronic lymphocytic leukemia, Int. J. Cancer. 38(1) :55-9 (1986)
7. Epstein, M. A., Achong., B. G., The EB virus. Annu. Rev. Microbiol. 27:413-436 (1973)
8. Fachiroh, J., Schouten ,T., Hariwiyanto, B., Paramita, D.K., Harijadi, A., Haryana, S.M., Ng, M.H.,
Middeldorp, J.M.., Molecular diversity of Epstein-Barr virus IgG and IgA antibody responses in
nasopharyngeal carcinoma: a comparison of Indonesian, Chinese, and European subjects, J. Infect. Dis.
190(1):53-62 (2004)
9. Gärtner, B. C., Hess, R. D., Bandt, D., Kruse, A., Rethwilm, A., Roemer, K., Mueller-Lantzsch. N.,
Evaluation of four commercially available Epstein-Barr virus enzyme immunoassays with an
immunofluorescence assay as the reference method. Clin. Diagn. Lab. Immunol. 10:78-82. (2003)
10. Gorgievski-Hrisoho, M., et al.: Serodiagnosis of infectious mononucleosis by using recombinant EpsteinBarr virus antigens and enzyme-linked immunosorbent assay technology. J. Clin. Mikrobiol. 28: 23052311 (1990)
11. Hess, R.D., Routine Epstein-Barr Virus Diagnostics from the Laboratory Perspective: Still Challenging
after 35 Years, J. Clin. Microbiol. 42(8), 3381–3387 (2004)
12. Linde A.: Diagnosis of Epstein-Barr virus-related diseases. Scand. J. Infect. Dis. Suppl. 100: 83-8 (1996)
13. Obel, N. et al. Serological and clinical findings in patients with serological evidence of reactivated
Epstein-Barr virus infection. APMIS, 104: 424 (1996).
14. Prang, N. S., Schwarzmann, F., Aktuelle Perspektiven in der Diagnostik Epstein-Barr Virus assoziierter
Erkrankungen, Immun. Infekt.: 144–151 (1997)
15. Zhang, C., Zong, Y., Huang, B., Sun, Y., Ye, Y., Feng, K., Li, J., Zhang, F., Enhancing the efficiency of
Epstein-Barr viral serologic test in the diagnosis of nasopharyngeal carcinoma, Zhonghua Zhong Liu Za
Zhi. 24(4):356-9 (2002)
Version 2014-05
8/8
Symbols / Symbole / Symbôles / Símbolos / Símbolos / Σύμβολα
REF
Cat.-No.: / Kat.-Nr.: / No.- Cat.: / Cat.-No.: / N.º Cat.: / N.–Cat.: / Αριθμός-Κατ.:
LOT
Lot-No.: / Chargen-Bez.: / No. Lot: / Lot-No.: / Lote N.º: / Lotto n.: / Αριθμός -Παραγωγή:
Use by: / Verwendbar bis: / Utiliser à: / Usado por: / Usar até: / Da utilizzare entro: /
Χρησιμοποιείται από:
No. of Tests: / Kitgröße: / Nb. de Tests: / No. de Determ.: / N.º de Testes: / Quantità dei tests: /
Αριθμός εξετάσεων:
CONC
LYO
IVD
Concentrate / Konzentrat / Concentré / Concentrar / Concentrado / Concentrato / Συμπύκνωμα
Lyophilized / Lyophilisat / Lyophilisé / Liofilizado / Liofilizado / Liofilizzato / Λυοφιλιασμένο
In Vitro Diagnostic Medical Device. / In-vitro-Diagnostikum. / Appareil Médical pour Diagnostics In
Vitro. / Dispositivo Médico para Diagnóstico In Vitro. / Equipamento Médico de Diagnóstico In
Vitro. / Dispositivo Medico Diagnostico In vitro. / Ιατρική συσκευή για In-Vitro ∆ιάγνωση.
Evaluation kit. / Nur für Leistungsbewertungszwecke. / Kit pour évaluation. / Juego de Reactivos
para Evaluació. / Kit de avaliação. / Kit di evaluazione. / Κιτ Αξιολόγησης.
Read instructions before use. / Arbeitsanleitung lesen. / Lire la fiche technique avant emploi. /
Lea las instrucciones antes de usar. / Ler as instruções antes de usar. / Leggere le istruzioni
prima dell’uso. / ∆ιαβάστε τις οδηγίες πριν την χρήση.
Keep away from heat or direct sun light. / Vor Hitze und direkter Sonneneinstrahlung schützen. /
Garder à l’abri de la chaleur et de toute exposition lumineuse. / Manténgase alejado del calor o la
luz solar directa. / Manter longe do calor ou luz solar directa. / Non esporre ai raggi solari. / Να
φυλάσσεται μακριά από θερμότητα και άμεση επαφή με το φως του ηλίου.
Store at: / Lagern bei: / Stocker à: / Almacene a: / Armazenar a: / Conservare a: / Αποθήκευση
στους:
Manufacturer: / Hersteller: / Fabricant: / Productor: / Fabricante: / Fabbricante: / Παραγωγός:
Caution! / Vorsicht! / Attention! / ¡Precaución! / Cuidado! / Attenzione! / Προσοχή!
Symbols of the kit components see MATERIALS SUPPLIED.
Die Symbole der Komponenten sind im Kapitel KOMPONENTEN DES KITS beschrieben.
Voir MATERIEL FOURNI pour les symbôles des composants du kit.
Símbolos de los componentes del juego de reactivos, vea MATERIALES SUMINISTRADOS.
Para símbolos dos componentes do kit ver MATERIAIS FORNECIDOS.
Per i simboli dei componenti del kit si veda COMPONENTI DEL KIT.
Για τα σύμβολα των συστατικών του κιτ συμβουλευτείτε το ΠΑΡΕΧΟΜΕΝΑ ΥΛΙΚΑ.
COMPLAINTS: Complaints may be submitted initially written or vocal. Subsequently they need to be filed including the
test performance and results in writing in case of analytical reasons.
WARRANTY: The product is warranted to be free from material defects within the specific shelf life and to comply with
product specifications delivered with the product. The product must be used according to the Intended use, all
instructions given in the instructions for use and within the product specific shelf life. Any modification of the test
procedure or exchange or mixing of components of different lots could negatively affect the results. These cases
invalidate any claim for replacement.
LIMITATION OF LIABILITY: IN ALL CIRCUMSTANCES THE EXTENT OF MANUFACTURER’S LIABILITY IS LIMITED
TO THE PURCHASE PRICE OF THE KIT(S) IN QUESTION. IN NO EVENT SHALL MANUFACTURER BE LIABLE
FOR ANY INCIDENTAL OR CONSEQUENTIAL DAMAGES, INCLUDING DAMAGES FOR LOST PROFITS, LOST
SALES, INJURY TO PERSON OR PROPERTY OR ANY OTHER INCIDENTAL OR CONSEQUENTIAL LOSS.
IBL International GmbH
Flughafenstr. 52A, 22335 Hamburg, Germany
Symbols Version 4.5 / 2015-12-07
Tel.:
E-MAIL:
WEB:
+ 49 (0) 40 532891 -0 Fax: -11
[email protected]
http://www.IBL-International.com