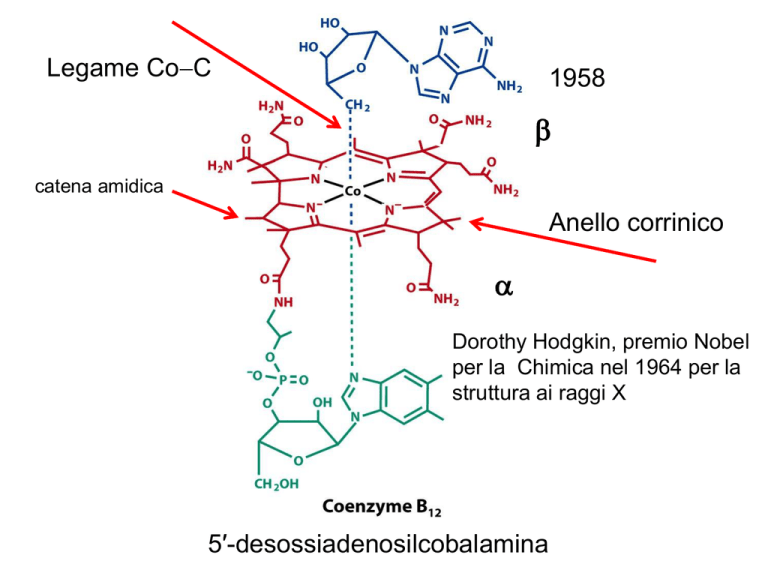
Legame Co-C
1958
b
catena amidica
Anello corrinico
a
Dorothy Hodgkin, premio Nobel
per la Chimica nel 1964 per la
struttura ai raggi X
5′-desossiadenosilcobalamina
2
b
a
1580 Da
7 catene amidiche laterali,
9 centri chirali
Distorsione nelle cobalamine
supernucleofilo
Co(I) d8
Co(III) d6
C. N. = 4
Co(II) d7
C. N. = 6
C. N. = 5
Reazioni catalizzate dal coenzima B12
R2
mutasi
H
H
H
C
C
H
R2
shift-1,2
R1
C
C
H
H
Enzima
Diolo
deidratasi
Etanolamina
deaminasi
Glutammato
mutasi
Glicerolo
deidratasi
R3
R1
R1
R2
R3
CH3
OH
OH
H
NH2
OH
H
CH(NH2)COO
H
OH
COOH
CH2OH
OH
R3
MetilMalonil-Coenzima A-Mutasi
(metabolismo degli amminoacidi nel fegato)
CO-S-CoA
H
MMCM
H
H
H
COOH
H
metilmalonil
Coenzima A
H
H
H
COOH
CO-S-CoA
succinil
H
CoIII CH2A
(coenzima B12)
R
C
C
II
Co + CH2A
(B12r)
R
+ CH2A
C
C
+ CH3A
R
R
shift-1,2
C
C
C
C
R
CH3A +
C
II
C
Co + CH2A
(B12r)
CH2A +
III
Co CH2A
(coenzima B12)
R
H
C
C
La rottura del legame Co-C è 1012 volte più veloce nell’enzima
completo rispetto al coenzima B12
Metilcobalamina: cofattore della Metionina Sintasi
S-adenosil-L-metionina
Metionina Sintasi
cisteina
N5-metiltetraidrofolato
Cap-Cob
S-adenosil-L-metionina
metilcobalamina
Metilcobalamina in Cap-Cob: base-off/His-on
Variazioni conformazionali della metionina sintasi
Modelli
Uptake e Trasporto della Cobalamina
RDA1-5 g/day
L-Methylmalonyl-CoA
Adotransferase
mutase
Cbl (I)
Ado-Cbl
Cbl in food
reductase
Succinyl-CoA
GS-Cbl
HC
Aptocorrina
(stomaco)
mitocondrion
Cbl-OH
Homocys
reductase
Cbl (II)
Cbl (I)
CH3 -FH4
CH3 -Cbl
HC-Cbl
IF
TC-Cbl
lysosome
R TC-Cbl
(gastric fluid)
Met
synthase
(duodenum)
fattore intrinseco
(intestino)
TC - Cbl
IF-Cbl
TC
(liver, etc.)
plasma
Transcobalamina
(sangue)
FH4
Struttura TC+Cobalamina (2006)
β-sheet domain
b
Cobalamin
a
α-helix domain
Coordinazione base-on/His-on (su b)
Complesso IF-Cbl (2007)
Coordinazione base-on
Confronto IF-Cbl e TC-Cbl
IF = rosso
TC = blu
Addotto IF-Cbl con CUB5-8
recettori della cubilina
CUB8
IF b domain
CUB7
Cbl
IF a domain
Ca2+
CUB6
CUB5
