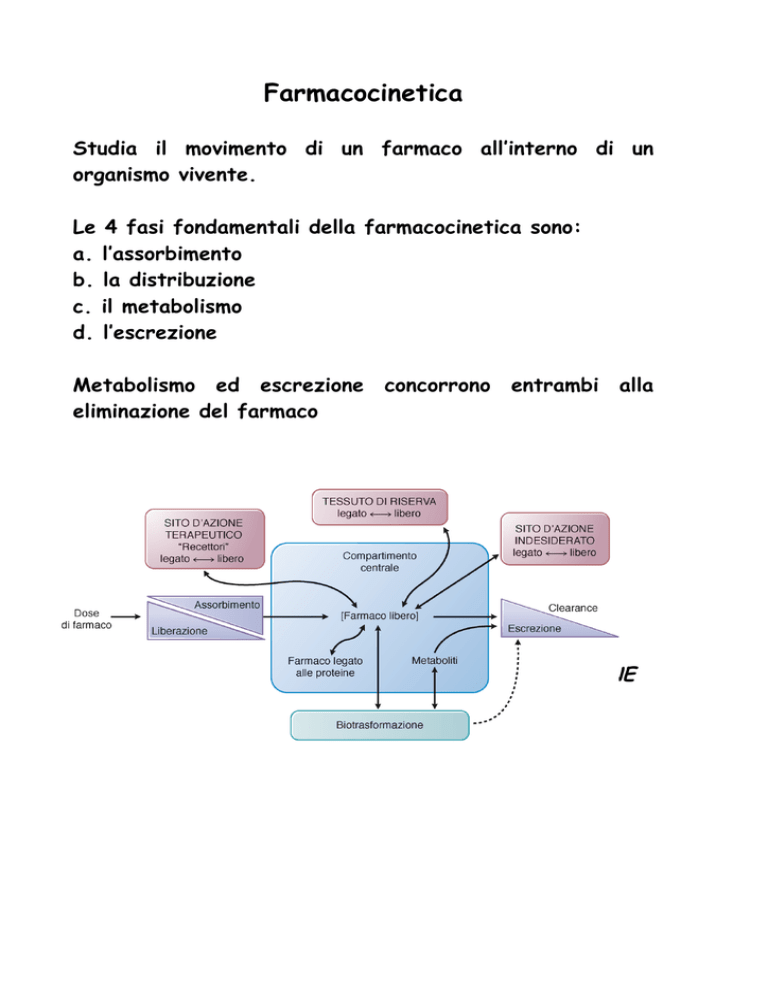
Farmacocinetica
Studia il movimento di un farmaco all’interno di un
organismo vivente.
Le 4 fasi fondamentali della farmacocinetica sono:
a. l’assorbimento
b. la distribuzione
c. il metabolismo
d. l’escrezione
Metabolismo ed escrezione
eliminazione del farmaco
concorrono
entrambi
alla
PASSAGGIO DEI FARMACI ATTRAVERSO MEMBRANE
Il passaggio di un farmaco attraverso la membrana può
verificarsi con vari meccanismi.
1) Diffusione passiva
E’ il meccanismo più frequentemente utilizzato.
-Avviene secondo gradiente di concentrazione e grazie
alla solubilità nei lipidi della membrana.
-Non richiede consumo di energia.
-E’ influenzata dal pH, dato che i farmaci sono per lo
più elettroliti deboli con la forma indissociata in
equilibrio con la forma indissociata.
-E’ influenzata dal gradiente elettrochimico per
l’assorbimento di molecole ionizzate.
Molecole piccole e solubili in H2O passano attraverso pori
(dimensioni circa 4 A°) soprattutto per motivi osmotici.
2) Trasporto attivo mediato da carriers
Ha le seguenti caratteristiche:
-consuma energia,
-avviene
contro
gradiente
elettrochimico
concentrazione,
-è saturabile e selettivo,
-è inibito da parte di congeneri.
e
di
E’ importante in membrane neuronali, di epatociti e di
cellule tubulari renali (esempio: pompa del sodio).
3) Diffusione facilitata
-E’ mediata da carriers, ma va secondo gradiente
elettrochimico e gradiente di concentrazione.
-Opera senza dispendio energetico.
-Accelera notevolmente la velocità di diffusione.
-Importante per sostanze polari (colina).
4) Pinocitosi e fagocitosi
Particelle fluide e solide inglobate
cellulari.
Scarsa importanza quantitativa.
dalle
membrane
5) Flusso di massa attraverso pori intercellulari
Importante per diffusione attraverso endoteli capillari.
L’ASSORBIMENTO
E’ la fase di passaggio del farmaco dalla sede di
somministrazione al torrente circolatorio.
L’assorbimento di un farmaco dipende da:
1. Caratteristiche intrinseche del farmaco
-peso molecolare
-costante di dissociazione (pKa)
-coefficiente di ripartizione acqua/lipidi
2. Forma farmaceutica utilizzata
-disgregabilità preparati solidi
-preparati ritardo
3. Caratteristiche anatomo-fisiologiche della superficie
assorbente.
-superficie assorbente
-flusso ematico
-superfici lesionate assorbono di più
Vie di somministrazione dei farmaci
Possono esser divise in naturali:
-Orale
-Sublinguale
-Rettale
-Cutanea
-Inalatoria
e artificiali:
-Endovenosa
-Intramuscolare
-Sottocutanea
-Intradermica
-Endoarteriosa
-Endorachidea
Vie naturali
Via orale:
E’ la via più frequentemente utilizzata
Vantaggi
Comodità, sicurezza, economicità
Svantaggi
-Richiede collaborazione del paziente
-Irregolare assorbimento in presenza di cibo
–Eliminazione presistemica per metabolismo
passaggio (sia epatico che intestinale)
-Incompatibile con emesi
di
primo
-Possibile distruzione del farmaco nello stomaco
(proteine, peptidi, composti danneggiabili dall’acidità
gastrica)
Via sublinguale:
Buon
assorbimento
per
molecole
liposolubili
(nitroglicerina, estrogeni).
Il sangue venoso dalla cavità orale fluisce nella vena cava
superiore, per cui il farmaco è protetto dal metabolismo
epatico di I passaggio.
Via rettale:
L’assorbimento è in genere irregolare ed incompleto.
Non è ben definita la quantità del farmaco assorbito che
arriva al fegato e quella che va direttamente alla vena
cava.
Vantaggi
-Somministrazione in caso di vomito o di paziente non
cosciente.
-Accettabile in bambini.
Svantaggi
L’assorbimento è piuttosto irregolare
Via inalatoria
Sono assorbiti gas o soluzioni di farmaci in aerosol.
Vantaggi:
-Assorbimento molto rapido,
-Viene evitato il metabolismo epatico di I passaggio.
Svantaggi:
-Scarsa maneggevolezza dei metodi di somministrazione
-Scarso controllo della dose,
-Irritazione dell’epitelio polmonare.
Altre vie naturali
Oltre all’assorbimento cutaneo, i farmaci possono esser
assorbiti per applicazione a
-Congiuntiva
-Orofaringe,
-Nasofaringe,
-Vagina,
-Uretra e vescica
Vie artificiali
Via endovenosa
Scavalca
i
fattori
che
limitano
l’assorbimento,
determinando una immediata biodisponibilità del farmaco.
Vantaggi:
precisione, immediatezza, possibile somministrazione di
sostanze irritanti.
Svantaggi:
sterilità, costo, personale esperto, problemi per
frequenti ripetizioni.
Non si possono usare sospensioni o soluzioni oleose.
Via intramuscolare e sottocutanea
L’assorbimento avviene per lo più per diffusione secondo
gradiente dal sito di iniezione al plasma.
Molecole grosse come le proteine arrivano alla
circolazione attraverso i vasi linfatici.
La via intramuscolare assicura assorbimento più rapido
rispetto alla sottocutanea.
Vantaggi:
assorbimento costante e che può essere prolungato nel
tempo (sospensioni, pellet)
Svantaggi:
Evitare sostanze irritanti (dolore e necrosi). Svantaggi
da iniezione.
Via endoarteriosa
Usata per somministrare agenti diagnostici o agenti
antineoplastici
al
fine
di
direzionarli
in
senso
“centrifugo”.
Via endorachidea
Si iniettano farmaci nello spazio subaracnoideo spinale.
E’ usata per anestesia spinale o trattamento infezioni
acute del SNC.
E’ usata soprattutto per farmaci che non attraversano la
barriera ematoencefalica.
Ha lo svantaggio di esaltare la possibile neurotossicità
dei farmaci. Richiede personale con specifica esperienza.
LA DISTRIBUZIONE
Distribuzione iniziale su base circolatoria
I stadio = Distribuzione in organi altamente irrorati:
cuore, fegato, rene, encefalo
II stadio = Maggior distribuzione del farmaco ai muscoli,
visceri, cute e tessuto adiposo.
Distribuzione successiva su base biochimica
Legame con costituenti cellulari, accumulo in siti di
deposito da cui il farmaco viene poi gradualmente ceduto.
Distribuzione nel SNC
Gli endoteli dei capillari nel SNC mancano di pori
intercellulari. Anche le cellule gliali pericapillari riducono
gli scambi fra sangue e SNC.
Pertanto la distribuzione nel SNC è funzione della
liposolubilità del farmaco.
Il trasporto attivo opera in alcuni casi.
Infiammazione meningea o encefalica aumentano la
permeabilità della barriera ematoencefalica.
Passaggio attraverso la placenta
I farmaci liposolubili passano
effetto di farmaci sul feto.
molto
bene.
Possibile
Siti di deposito
Richiedono all’inizio più elevate quantità di farmaco
perché si osservi l’effetto terapeutico.
Possono prolungare gli effetti del farmaco, cedendolo
gradualmente in forma libera
Tessuto adiposo
E’ un sito di deposito per sostanze liposolubili. Il deposito
è piuttosto stabile per la bassa irrorazione sanguigna.
Proteine plasmatiche
Albumina e α1-glicoproteina acida possono adsorbire una
percentuale del farmaco nel plasma
Il legame farmaco–proteico riduce:
-la concentrazione di farmaco nel sito di azione
-la filtrazione glomerulare
-la biotrasformazione del farmaco.
La frazione di farmaco legata dipende da:
-concentrazione del farmaco
-numero di siti di legame
-affinità per i siti di legame
Il legame dei farmaci con le proteine plasmatiche è
piuttosto non–selettivo (sostanza acide si legano
all’albumina, sostanze basiche alla α1-glicoproteina) per
cui ampia possibilità di competizione tra farmaci per tale
legame (possibilità di interazioni farmacocinetiche)
La capacità di legame delle proteine plasmatiche è più
bassa nel feto e nel neonato rispetto all’adulto.
Siti di deposito cellulare
Il deposito cellulare può esser dovuto a formazione di
legame con componenti cellulari. Ad esempio le ossa
legano tetracicline e piombo
METABOLISMO
Le sostanze farmacologicamente attive utilizzano vie
metaboliche per composti endogeni, grazie ad una certa
analogia strutturale con questi.
Sono interessate alle biotrasformazioni soprattutto
sostanze liposolubili, che quindi possono più facilmente
accedere a siti endocellulari
Conseguenze della biotrasformazione:
• Inattivazione del farmaco.
• Formazione di metabolita attivo.
Ad esempio il paracetamolo è più attivo della
fenacetina.
La L-Dopa inattiva (prodrug) genera dopamina attiva
• Formazione di metabolita attivo dotato di diversa
attività.
In genere i prodotti biotrasformati sono più idrosolubili e
perciò più facilmente eliminabili a livello renale.
Le biotrasformazioni sono influenzate da
-Età (neonati ed anziani hanno minor quantità di enzimi)
-Sesso (gli estrogeni influenzano i processi ossidativi, il
progesterone inibisce la glicuronoconiugazione).
-Stato di nutrizione (le biotrasformazioni sono ridotte in
caso di malnutrizione)
-Malattie epatiche (riducono le biotrasformazioni)
Sede delle biotrasformazioni
Gli enzimi biotrasformanti sono contenuti soprattutto nel
fegato. Ne sono ricchi anche il rene, muscoli e polmoni.
A livello cellulare le biotrasformazioni avvengono in
notevole misura nella frazione microsomiale del reticolo
endoplasmatico. E’ la porzione liscia del reticolo,
costituita da lipoproteine
Gli enzimi microsomiali sono responsabili della ossidazione
di sostanze lipofile. Hanno bassa selettività nei confronti
del substrato.
Oltre
agli
enzimi
microsomiali
biotrasformazioni da parte di:
possiamo
avere
-Enzimi citoplasmatici, ossidazioni di sostanze
idrosolubili.
-Enzimi mitocondriali. Ad esempio le Monoaminoossidasi
(MAO) responsabili della deaminazione ossidativa di
amine biogene e di numerosi farmaci.
-Enzimi plasmatici (esterasi)
Classificazione delle biotrasformazioni
Reazione di fase I
Comportano alterazioni della molecola del farmaco, senza
addizione di ulteriori specie molecolari. Comprendono:
-Ossidazioni
-Riduzioni
-Idrolisi
-Deaminazione ossidativa
CYP450
Le reazioni di ossidoriduzione sono catalizzate dal
sistema microsomiale del citocromo P 450 (CYP450)
Sono state identificate 12 famiglie di isoenzimi CYP450
nell’uomo. I più importanti in senso quantitativo sono:
1. CYP3A4 (metabolizza circa il 50% dei farmaci!!!)
2. CYP2D6
3. CYP2C9
4. CYP2C19
5. CYP1A2
6. CYP2E1
Il corredo dei citocromi è sottoposto a controllo
genetico, per cui possono esserci grosse differenze nella
capacità metabolica tra soggetti diversi.
Per questo il sistema dei CYP è oggetto di attento studio
da parte della farmacogenetica.
Se si conoscesse nel soggetto trattato la quantità di
enzima che metabolizza il farmaco somministrato, si
potrebbero evitare molte reazione avverse ai farmaci!!!!
Percentuale dei farmaci metabolizzati dagli enzimi
appartenenti alla classe del citocromo P450
CYP3A4 (36%,
secondo alcune
stime potrebbero
superare il 50%)
CYP2D6 (19%)
CYP2C19
CYP2C9
CYP1A2
CYP2E1
CYP2B6
CYP2A6
Induzione o inibizione enzimatica
Farmaci ed alimenti possono comportarsi da induttori
degli enzimi del sistema CYP (cioè ne aumentano la
produzione).
Sono induttori enzimatici fenobarbitale e rifampicina.
La rifampicina aumenta i CYP3A4, 1A2, 2C9, 2C19
Alcuni composti invece sono inibitori enzimatici in quanto
si legano ai CYP in modo irreversibile, ostacolandone la
attività. Ad esempio:
Alcuni macrolidi inibiscono il CYP3A4
I fluorochinoloni inibiscono il CYP1A2
Il succo di pompelmo contiene derivati cumarinici e
bioflavonoidi che inibiscono il CYP3A4.
L’induzione
enzimatica
comporta
un
più
veloce
metabolismo di tutti quei composti metabolizzati dal CYP
indotto, con riduzione della loro attività farmacologica
L’inibizione enzimatica comporta un più lento metabolismo
e perciò tende ad esaltare la risposta farmacologia ai
composti metabolizzati dall’enzima inibito.
Sia l’induzione che la inibizione enzimatica possono essere
causa di interazioni tra farmaci o tra farmaci ed
alimenti, potenzialmente di rilevanza clinica
METABOLIZZAZIONE LENTA
diminuita inattivazione
esagerata risposta
accumulo del farmaco
tossicità
METABOLIZZAZIONE RAPIDA
aumentata inattivazione
bassa risposta
Reazioni di fase II
Consistono in reazioni di sintesi. Comprendono:
-Coniugazione con:
-acido glicuronico
-acido acetico
-aminoacidi (glicina, cisteina, glutammina, serina, lisina)
-glutatione
-zolfo
Il residuo da trasferire al farmaco deve essere attivato
con legami energetici (con intervento in genere di ATP o
UTP).
La reazione di trasferimento è catalizzata da trasferasi
localizzate non solo a livello microsomiale.
Le glicuronoconiugazioni sono le reazioni di sintesi più
comuni. L’acido glicuronico si origina per catabolismo del
glicogeno.
A seguito della glicuronoconiugazione il farmaco perde in
genere la sua attività, inoltre i prodotti che si originano
sono idrosolubili e quindi eliminabili per escrezione.
I glicuronidi escreti nell’intestino possono essere scissi
rigenerando il farmaco originario che può essere
riassorbito (ricircolo entero-epatico)
ELIMINAZIONE ESCRETIVA
Comporta estrusione di farmaci dall’organismo
1) Escrezione renale
Il rene elimina soprattutto sostanze idrosolubili.
La eliminazione implica 3 diversi processi:
-filtrazione glomerulare,
-secrezione tubulare attiva,
-riassorbimento tubulare passivo.
L’acidificazione (con NH4Cl) o l’alcalinizzazione (con
NaHCO3) delle urine influenzano il riassorbimento tubulare
passivo, rispettivamente per le sostanza basiche ed acide)
2) Escrezione biliare e fecale
Per lo più trasporto attivo di glicuronidi o diffusione
secondo gradiente di concentrazione.
Nelle feci vanno sostanze eliminate nei vari succhi che si
riversano nel tratto gastrointestinale
3) Escrezione attraverso sudore, saliva, lacrime
Scarsa rilevanza quantitativa per saliva e lacrime.
Il meccanismo di eliminazione è la diffusione passiva.
4) Escrezione nel latte
Il latte è più acido del plasma per cui concentra sostanze
basiche. E’ importante per gli effetti sul lattante.
5) Escrezione polmonare
Importante per sostanze gassose e volatili.
VELOCITA’ DI ELIMINAZIONE
Cinetica di I ordine
La velocità di eliminazione può essere correlata alla
concentrazione di farmaco presente nel plasma (cinetica
di I ordine):
V = k C1
In altre parole, nell’unità di tempo viene eliminata una
frazione costante del farmaco, non una quantità
costante.
Una cinetica di I ordine si osserva in genere quando
l’eliminazione
1. non avviene tramite un sistema saturabile (carrier o
enzima metabolizzante)
2. vi è un sistema saturabile, ma il farmaco è usato a
dosi basse che non lo saturano (in genere dosi
terapeutiche di farmaco)
Cinetica di ordine zero
Quando il sistema saturabile (enzima o carrier) viene
saturato, la velocità di eliminazione è costante e non
dipende dalla concentrazione plasmatica del farmaco
(cinetica di ordine zero).
V = k C°
Nella cinetica di ordine zero si elimina una quantità
costante (non una frazione costante di farmaco)
CLEARANCE
La clearance è una misura di eliminazione
Viene definita come = velocità di eliminazione
conc. plasmatica del farmaco
Velocità eliminin. = mg/min
Concentrazione plasm. = mg/ml
Dal rapporto tra queste grandezze si ha ml/min
In base a tale rapporto la clearance può esser definita
anche come volume di plasma da cui il farmaco è
completamente rimosso nell’unità di tempo.
La clearance ha il vantaggio di essere piuttosto costante
nel tempo. Questo è dovuto al fatto che l’eliminazione
dei farmaci (a dosi terapeutiche) segue in genere una
cinetica del primo ordine.
Pertanto, al diminuire della concentrazione plasmatica del
farmaco diminuisce la velocità di eliminazione, ed il
rapporto sopra riportato (che definisce la clearance)
tende ad essere costante.
La clearance da parte di un organo è pari al prodotto di
Q (flusso sanguigno) per il valore
Ca (concentrazione arteriosa del farmaco) Cv (concentrazione venosa) fratto Ca.
CL organo = Q
Ca – Cv
Ca
La CL di organo presenta grosse modificazioni in
condizione patologiche (fegato e rene).
Se il farmaco è eliminato efficacemente da un organo, la
clearance del farmaco sarà determinata soprattutto dal
flusso sanguigno.
Se invece l’eliminazione di un farmaco da un organo è
modesta, allora non sarà molto influenzata dal flusso
sanguigno, bensì dalla clearance intrinseca.
Se il farmaco e’ eliminato da piu’ organi,
la clearance per mezzo di vari organi è additiva.
CL sistemica = CL renale + CL epatica + ….
Quando il farmaco viene somministrato ripetutamente ci
interessa stabilire uno stato stazionario per i livelli
plasmatici del farmaco.
Questo potrà essere ottenuto somministrando ripetuti
quantitativi di farmaco secondo la formula seguente:
Vel. di somm.farm = CL x Css
CL= clearance
Css= concentrazione allo stato stazionario
VOLUME DI DISTRIBUZIONE
Viene definito anche Volume Apparente.
Non si riferisce ad un volume fisiologico, ma indica il
volume di liquido che sarebbe necessario per contenere
tutto il farmaco (presente nell’organismo) alla
concentrazione del plasma.
V = quantità di farmaco nell’ organismo
concentrazione plasmatica
Fornisce una misura di quanto il farmaco è presente nel
plasma.
Il volume di distribuzione può anche essere di 1000 litri!!
Si tratta di un valore astratto, perché un soggetto di 70
kg ha 3 litri di plasma.
Se il volume di distribuzione è di 1000 litri significa che
il farmaco è localizzato elettivamente fuori dal torrente
circolatorio
1 FARMACOLOGIA GENERALE
Fig. 1.5. – Rappresentazione schematica dei fluidi dell’organismo.
© F. ROSSI – V. CUOMO – C. RICCARDI
FARMACOLOGIA
EDIZIONI MINERVA MEDICA
Il Volume di distribuzione dipende da:
-grado di ionizzazione del farmaco,
-legame alle proteine plasmatiche,
-ripartizione nei lipidi,
-legame ad altri tessuti,
Se il farmaco si distribuisce rapidamente nei tessuti, si
potrà
considerare
l’organismo
come
un
unico
compartimento (cinetica monocompartimentale).
Se
la
distribuzione
è
lenta
avremo
cinetica
bicompartimentale
TEMPO DI DIMEZZAMENTO
E’ detto anche tempo di emivita o emivita.
Indica l’intervallo di tempo in cui la concentrazione
plasmatica di farmaco nell’organismo si riduce del 50%.
Il tempo di dimezzamento dipende dalla clearance e dal
volume di distribuzione, secondo la seguente relazione:
T
1/2
= 0,693 V
CL
Il tempo di dimezzamento dà indicazioni circa:
-Durata di azione del farmaco.
-Intervallo posologico.
-Tempo richiesto a raggiungere lo stato stazionario.
-Tempo necessario per la eliminazione del farmaco
STATO STAZIONARIO
L’obiettivo di una terapia protratta nel tempo è in genere
quello di raggiungere una concentrazione stazionaria di
farmaco nel plasma.
Questo
obiettivo
viene
cercato
ricorrendo
a
somministrazioni ripetute di farmaco a periodi di tempo
tali da aspettare la eliminazione completa della dose
precedentemente somministrata.
Se la cinetica di eliminazione è del I ordine l’andamento
della concentrazione plasmatica sarà un ramo di iperbole
e porterà ad un plateau dopo 4-5 volte il T1/2.
1 FARMACOLOGIA GENERALE
Fig. 1.8. – Somministrazione multipla di un farmaco e raggiungimento dello stato stazionario.
© F. ROSSI – V. CUOMO – C. RICCARDI
FARMACOLOGIA
EDIZIONI MINERVA MEDICA
Esempio di costruzione di grafico relativo all’andamemto
della concentrazione plasmatica di un farmaco in caso di
T1/2 pari a 24 ore, di cinetica del I ordine e di
somministrazione ogni 24 ore (1 giorno)
ng/ml
Cine tic a I o rdine
[F]
T1/2 = 24 o re
5
4
3
2
1
0
0
1
2
3
4
5
6
7
te mpo
Se il T1/2 è troppo lungo in relazione alle esigenze
terapeutiche, si ricorre ad una dose iniziale di
saturazione (o di attacco) pari a
Vd x C
(doce C è la concentrazione plasmatica desiderata)
1. Il tempo necessario a raggiungere il plateau dipende
solo dal T1/2.
2. Il livello di concentrazione di farmaco allo stato
stazionario dipende da
-T1/2 e
-dose somministrata.
3. L’ampiezza della oscillazione tra concentrazione
plasmatica massima e quella minima è direttamente
proporzionale all’intervallo di dosaggio ed inversamente
proporzionale al T1/2.
Se la cinetica di eliminazione è di ordine zero e
seguitiamo a somministrare farmaco prima che sia stato
tutto eliminato, l’andamento della concentrazione
plasmatica del farmaco sarà una retta.
ng/ml
Cine tic a o rdine 0
[F]
5
4
3
2
1
0
0
1
2
3
4
5
6
7
te mpo
REGIMI POSOLOGICI
1) Livello bersaglio
Concentrazione allo stato stazionario desiderata del
farmaco.
2) Dose di mantenimento
Dose atta a mantenere lo stato stazionario. La sua
entità può essere calcolata a partire dalla concentrazione
bersaglio e dalla clearance.
DOSE mant. = Conc. Bersaglio x CL
e correggendo per la disponibilità del farmaco
3) Dose di attacco
Dose o serie di dosi usata all’ inizio della terapia per
raggiungere rapidamente la concentrazione bersaglio.
Pericoli legati alla dose di attacco.
4) Intervallo interdose
Serve a controllare fluttuazioni della concentrazione di
farmaco.
5) Individualizzazione del dosaggio
Serve a tener conto in un particolare paziente di
variazione dai parametri farmacocinetici medi.
6) Monitoraggio terapeutico dei farmaci
Serve a verificare il conseguimento ed il mantenimento
del livello bersaglio.
Il monitoraggio terapeutico è raccomandato per terapie
lunghe, farmaci a basso indice terapeutico e laddove ci
sia forte variabilità individuale nella risposta:
-antiepilettici
-glicosidi cardioattivi
-Antibiotici aminoglicosidici
-Ciclosporina
-Metotressato
-Litio etc
BIODISPONIBILITA’
Quota di farmaco che raggiunge in forma attiva il suo
sito d’ azione, o un liquido biologico da cui il farmaco può
accedere al sito d’ azione.
Nel concetto di biodisponibilità è implicita la valutazione
dell’andamento nel tempo di tale quota di farmaco.
La biodisponibilità assoluta è espressa dall’area sottesa
alla curva concentrazione–tempo.
L’AUC dopo dose singola = Dose____
Clearance
Possiamo esprimere la biodisponibilità (F) in senso
relativo come disponibilità sistemica al farmaco ottenuta
per una qualsiasi via di somministrazione (ad esempio la
orale), rispetto alla via di somministrazione endovenosa
La biodisponibilità dipende da:
1) Assorbimento del farmaco
Questo è influenzato da una molteplicità di fattori quali:
via di somministrazione, processi di biotrasformazione a
cui il farmaco va incontro prima dell’ assorbimento,
fattori patologici che possono influenzare l’assorbimento.
2) Legame farmaco–proteico.
Il farmaco legato alle proteine plasmatiche non è
biodisponibile.
3) Eliminazione del farmaco.
Tutti i fattori che modificano l’ eliminazione del
farmaco, ne influenzano la biodisponibilità.
4) Caratteristiche del preparato farmaceutico.
Disgregabilità delle compresse, grandezza delle particelle
di farmaco, forma cristallina.
Il legame farmaco–
proteina riduce:
• la concentrazione di
farmaco nel sito di
azione
• la biotrasformazione
del farmaco
• la filtrazione
glomerulare
BIOEQUIVALENZA O BIODISPONIBILITA’ RELATIVA
Ci si riferisce a diverse forme farmaceutiche contenti lo
stesso principio attivo, o diverse formulazioni di una
stessa forma farmaceutica.
Si parla di preparati bioequivalenti se danno luogo a
differenze non significative in termini di
-AUC,
-Cmax (concentrazione massima nel plasma) e
-Tmax (tempo dopo il quale si raggiunge la Cmax)
Preparati bioequivalenti si assume che debbano essere
terapeuticamente equivalenti.
ng/ml
AUC
tempo
ng/ml
C max
tempo
ng/ml
T max
tempo









