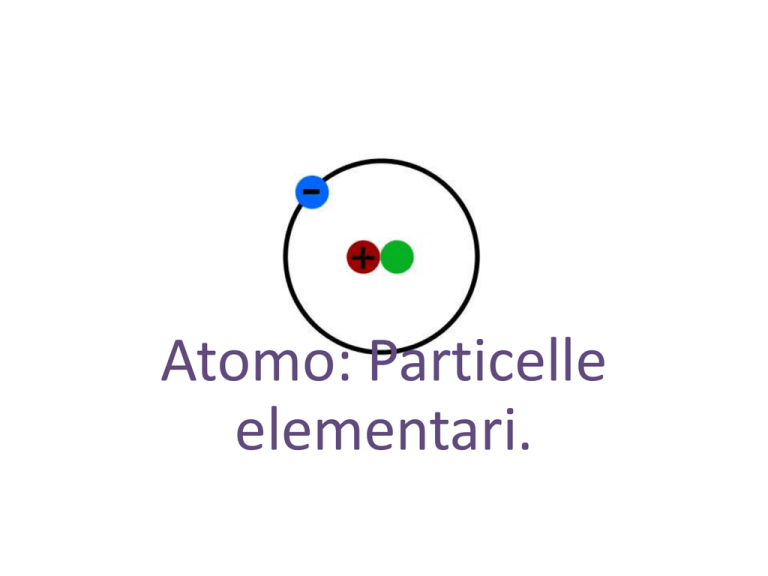
Atomo: Particelle
elementari.
Capitolo 7
Le particelle dell’atomo
1.
La natura elettrica della materia
2.
La scoperta delle proprietà elettriche
3.
Le particelle fondamentali dell’atomo
4.
La scoperta dell’elettrone
5.
L’esperimento di Rutherford
6.
Il numero atomico
7.
Il numero di massa e gli isotopi
8.
Le trasformazioni del nucleo
9.
I tipi di decadimento radioattivo
10.
Misura, effetti e applicazioni delle radiazioni
11.
L’energia nucleare
12.
Fissione e fusione nucleare
Copyright ©2009 Zanichelli
editore
Le idee della chimica
1. La natura elettrica della materia
Lo strofinio di qualsiasi oggetto provoca la
comparsa su di esso di una carica elettrica che
può attrarre piccoli oggetti.
La carica elettrica può essere positiva o negativa.
Cariche di segno opposto si attraggono, cariche di
segno uguale si respingono.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
1. La natura elettrica della materia
Un corpo è elettricamente neutro quando presenta
un uguale numero di cariche positive e negative.
Lo strofinio fa migrare da un corpo ad un altro
cariche negative chiamate elettroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
2. La scoperta delle proprietà elettriche
Il termine elettricità deriva dalla parola elektron
che gli antichi Greci utilizzavano per spiegare il
fenomeno dell’elettrizzazione dell’ambra per
strofinio con un panno di lana.
Fino alla fine del Settecento l’elettricità era
conosciuta solo la forma di elettricità detta statica.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
2. La scoperta delle proprietà elettriche
Fu l’americano Benjamin Franklin il primo a
parlare di fluido elettrico, costituito da particelle
repulsive, distinguendo l’elettricità positiva e
l’elettricità negativa.
Grazie all’invenzione della pila di Volta,
nell’Ottocento, si comprese che l’elettricità è una
corrente lenta capace di provocare trasformazioni
chimiche.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
2. La scoperta delle proprietà elettriche
Si deve poi al chimico svedese Berzelius il
collegamento tra elettrochimica e teoria atomica:
egli suggerì l’idea che ogni atomo possedesse sia
la carica positiva che la carica negativa e che
atomi diversi combinandosi neutralizzassero le
residue cariche elettriche.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
3. Le particelle fondamentali dell’atomo
Gli atomi sono formati da tre particelle
fondamentali:
•
l’elettrone con carica negativa;
•
il protone con carica positiva;
•
il neutrone privo di carica.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
3. Le particelle fondamentali dell’atomo
Neutroni e protoni non sono particelle elementari,
ma sono composte da altre particelle: i quark.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
particelle elementari
Higgs boson
particelle elementari (fermioni)
3. Le particelle fondamentali dell’atomo
Nel Novecento si è scoperto che l’atomo contiene
una zona piccola e densa, il nucleo, in cui si
trovano neutroni e protoni (i nucleoni).
Copyright ©2009 Zanichelli
editore
Le idee della chimica
http://www.youtube.com/watch?v=CsjLYLW_3G0
L’esperimento
didell’elettrone
Thomson con i tubi di Crookes ha
4. La scoperta
portato alla scoperta, nel 1897, degli elettroni,
particelle cariche negativamente che costituiscono le
radiazioni definite raggi beta o raggi catodici.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
raggi catodici
4. Le scoperta
dell’elettrone
Thomson
riuscì
a determinare il rapporto
carica/massa dell’elettrone (1,75x108 C/g),
misurando la deviazione che i raggi catodici
subivano al variare dell’intensità del campo
magnetico.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
http://www.youtube.com/watch?v=U1iWE2SVjEc&
ture=related
http://www.youtube.com/watch?v=0aXc34rcTi0&fe
ure=related
4. La
scoperta dell’elettrone
Nei
laboratori
dell’Università di Cambridge
Thomson dimostrò quindi la natura corpuscolare
dei raggi catodici. Il fisico George FitzGerald
propose il nome elettrone per la particella.
Nel 1909 Robert Millikan calcolò la carica elettrica
dell'elettrone, fu quindi possibile calcolare la
massa dell'elettrone .
Gli elettroni sono contenuti negli atomi di tutti gli
elementi. Quando vengono separati dagli atomi,
gli elettroni sono tutti uguali tra loro.
Fu presto chiaro che all’interno dell’atomo doveva
esistere una carica elettrica positiva
corrispondente a quella negativa degli elettroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
5. L’esperimento di Rutherford
Thomson propose come modello una sfera carica
positivamente con gli elettroni sparsi al suo
interno.
Nel 1910 Rutherford dimostrò che questo modello
era
errato.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
Wilhelm Roentgen
Nel 1895 Roentgen osservò
che in un tubo di Crookes
l’anodo colpito dai raggi
catodici emetteva raggi in
grado di illuminare schermi
a fluorescenza a metri di
distanza.
A questi raggi ad alta energia
che attraversavano la
materia fu dato il nome di
raggi X.
•
La prima radiografia eseguita da Roentgen il 22
dicembre 1895
Henry Becquerel
Nel 1896 Becquerel
osservò che Sali di
Uranio (conservati su
una scrivania) erano
in grado di
impressionare una
lastra fotografica
(conservata sulla
stessa scrivania) ben
protetta in un
contenitore di metallo.
•
La “Croce di Malta” impressa sulla lastra fotografica
Pierre Curie e Marie
Sklodowska-Curie
• I coniugi Curie
coniarono il termine
“radioattività” per
indicare le radiazioni
osservate da Bequerel,
e ne osservarono la
natura (alcuni atomi
sono instabili e
decadono,
trasformandosi).
Decadimento U 238 –Pb 206
periodo di dimezzamento di circa 4.5 miliardi di anni
8. Le trasformazioni del nucleo
Rutherford giunse a definire la natura dei diversi
tipi di radiazioni:
• raggi , corrispondenti a nuclei di elio
(carica 2+, massa 4);
• raggi , fasci di elettroni veloci
(carica –1,);
• raggi , radiazioni elettromagnetiche a grande
energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
8. Le trasformazioni del nucleo
Copyright ©2009 Zanichelli
editore
Le idee della chimica
5. L’esperimento di Rutherford
Per comprendere la natura degli atomi, essendo
ormai chiaro che erano capaci di dividersi ed
emettere radiazioni, li si incominciò a bombardare
con particelle radioattive.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
Hans Geiger e Ernest Rutherford
Rutherford determinò la natura delle particelle
5. L’esperimento di Rutherford
(atomi di elio privi di due elettroni) con le quali poi
bombardò una sottilissima lamina d’oro:
le particelle
dopo l’urto
con gli atomi
d’oro venivano
raccolte ed
evidenziate su
un apposito
schermo.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
http://www.youtube.com/watch?v=5pZj0u
_XMbc&feature=related
Studiando
il comportamento
delle particelle ,
5. L’esperimento
di Rutherford
Rutherford poté stabilire che:
•
gran parte di esse non subiva deviazioni e
attraversava la lamina;
•
alcune particelle subivano una deviazione con
angolature diverse rispetto alla direzione
iniziale;
•
un numero molto esiguo rimbalzava, tornando
indietro, violentemente.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
« Era quasi incredibile quanto lo
sarebbe stato sparare un
proiettile a un foglio di carta
velina e vederlo tornare indietro
e colpirti.
Pensandoci, ho capito che
doveva essere il risultato di una
sola collisione, e quando feci il
calcolo vidi che era impossibile a
meno di considerare un sistema
nel quale la maggior parte della
massa dell'atomo fosse
concentrata in un nucleo molto
piccolo.»
Ernest Rutherford
Thomson
Rutherford
Il raggio di un nucleo è dell'ordine di grandezza di
10-15 metri, l’atomo di 10-10 metri.
La materia è quasi del tutto “vuota”.
Se il nucleo assumesse la dimensione di una
arancia, l'elettrone, con la dimensione di una
lenticchia, si muoverebbe intorno ad esso in
un'orbita con un raggio di una trentina di
chilometri.
5. L’esperimento di Rutherford
Modello planetario dell'atomo
l’atomo è composto da un nucleo in cui sono
concentrate carica positiva e massa;
•
•
gli elettroni occupano lo
spazio vuoto intorno al
nucleo e vi ruotano
intorno come pianeti;
•
il numero di elettroni è
tale da bilanciare la
carica positiva del nucleo.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
• Il modello atomico di Rutherford, pur rappresentando un
notevole balzo in avanti, ebbe comunque vita breve, in quanto
non si accordava con altre osservazioni sperimentali:
soprattutto non era in grado di giustificare la stabilità degli
atomi.
• Secondo le leggi dell'elettromagnetismo, una carica elettrica
in movimento irradia energia sotto forma di radiazione
elettromagnetica, e l'elettrone, dotato di carica elettrica, nella
sua orbita intorno al nucleo avrebbe dovuto perdere
continuamente energia e finire col cadere sul nucleo.
• La contraddizione del modello atomico planetario di
Rutherford venne risolta nel 1913 dal fisico danese Bohr,
secondo le leggi della nascente fisica quantistica formulate da
Planck.
Henry Moseley
• Nel 1913 Moseley
scopre una legge fisica
che lega la frequenza
dei raggi X emessi con il
numero di cariche
positive contenute in un
metallo, il “numero
atomico”.
Protone
• Nel 1919 Rutherford riesce a spezzare nuclei di azoto,
bombardandole con particelle alpha, e mostra che
vengono emessi nuclei di idrogeno, per cui viene
coniato il termine protone, in quanto si pensava si
trattasse di particelle prime della materia.
James Chadwick - Neutrone
• Nel 1932, Chadwick
dimostra con
un’esperimento
l’esistenza, finora solo
ipotizzata, della
particella del Neutrone.
Numero atomico (Z) e Numero di
Massa (A)
6. Il numero atomico
I nuclei di atomi diversi presentano diversa carica
positiva, quindi contengono un diverso numero di
protoni.
Il numero di protoni presenti nel nucleo di un
atomo è detto numero atomico (Z).
Se l’atomo è neutro il numero dei protoni è uguale
al numero degli elettroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
6. Il numero atomico
Il numero atomico è caratteristico di ogni
elemento ed è la grandezza fondamentale che lo
identifica.
La posizione degli elementi nella tavola periodica
dipende dal numero di cariche positive presenti
nel nucleo, ovvero dal numero di protoni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
7. Il numero di massa e gli isotopi
Il numero di massa (A) è uguale alla somma del
numero di protoni (Z) e del numero di neutroni
(n°) contenuti nel nucleo
A = Z + n°
Copyright ©2009 Zanichelli
editore
Le idee della chimica
7. Il numero di massa e gli isotopi
Conoscendo il numero atomico e il numero di
massa di un elemento si può calcolare il numero di
neutroni contenuti nel suo nucleo:
n° = A - Z
Copyright ©2009 Zanichelli
editore
Le idee della chimica
isotopi
Gli isotopi sono atomi dello stesso elemento aventi
le stesse proprietà chimiche ma masse diverse,
perché contengono un diverso numero di neutroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
massa atomica relativa
La massa atomica relativa di un elemento che si
legge sulla tavola periodica è la media ponderata
delle masse dei suoi isotopi, calcolati secondo la
loro abbondanza percentuale, espressa in unità di
massa atomica (u).
Oggi le masse atomiche si determinano attraverso
lo spettrometro di massa.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
I due principali isotopi stabili del cloro, 35Cl (75,77%) e
37Cl (24,23%), conferiscono al cloro una Massa
Atomica Relativa di 35,5 u.
I principali isotopi dell’ossigeno e la loro abbondanza
percentuale in natura:
16O 99,8%
17O 0,03% e
18O 0,2 %
Conseils Solvay 1911 “La théorie du rayonnement et
les quanta”
Radioattività ed energia nucleare
8. Le trasformazioni del nucleo
Il decadimento radioattivo è un processo che
trasforma il nucleo di un elemento nel nucleo di un
elemento diverso.
II decadimenti radioattivi sono determinati da
instabilità interne dei nuclei.
La radioattività è il processo di emissione di una
particella o di una radiazione dal nucleo.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
8. Le trasformazioni del nucleo
Alcuni isotopi sono instabili ed emettono
spontaneamente una particella, trasformandosi
nel nucleo di un altro elemento.
In una trasformazione nucleare, ovvero quando
cambia la struttura del nucleo, gli atomi di un
elemento cambiano la propria identità.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
8. Le trasformazioni del nucleo
Tutti
i nuclei con Z > 83 sono instabili, cioè
radioattivi.
Sono inoltre instabili nuclei con eccesso o difetto
di neutroni, o con troppa energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
8. Le trasformazioni del nucleo
3 diversi tipi di radiazioni:
• raggi , corrispondenti a nuclei di elio
(carica 2+, massa 4);
• raggi , fasci di elettroni veloci (carica –1,);
• raggi , radiazioni elettromagnetiche a grande
energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
9. I decadimento
tipi di decadimento
Nel
radioattivo
il numero
atomico del nucleo di partenza
diminuisce di due unità e il suo
numero di massa di quattro unità.
Il decadimento è tipico dei nuclei con numero
elevato sia di protoni che di neutroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
- il numero
Nel
decadimento
9. I tipi di decadimento radioattivo
atomico del nucleo che si forma è
superiore di un’unità rispetto al
nucleo di partenza, ma rimane
inalterato il numero di massa.
Il decadimento è tipico dei nuclei troppo ricchi di
neutroni rispetto ai protoni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
Nell’emissione + (positroni) e nella
9. I tipi elettronica
di decadimento
radioattivo
cattura
il numero
atomico del nucleo che decade
diminuisce di un’unità rispetto al
nucleo di partenza, ma rimane
inalterato il numero di massa.
Il nuovo nuclide si trova spostato di
una posizione a sinistra nella tavola
periodica.
L’emissione + e la cattura elettronica si verificano
quando il numero di protoni è troppo elevato
rispetto a quello dei neutroni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
9. I tipi di decadimento radioattivo
Nell’emissione rimangono inalterati sia il
numero atomico che il numero di massa.
Il nuovo nuclide rimane nella stessa posizione
nella tavola periodica.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
9. I tipi di decadimento radioattivo
Il tempo di
dimezzamento è il
tempo occorrente per
ridurre della metà la
quantità di un isotopo
radioattivo.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
10. Misura, effetti e applicazioni delle radiazioni
Il contatore Geiger è lo strumento che misura la
radioattività.
Nel SI, l’unità di misura di una sostanza
radioattiva è il becquerel (Bq) che corrisponde a
una disintegrazione al secondo.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
10. Misura, effetti e applicazioni delle radiazione
Le radiazioni trasportano una grande quantità di
energia e perciò hanno potere ionizzante: questo
può provocare, per esempio, gravi alterazioni nei
tessuti corporei.
Le radiazioni provocano danni 20 volte maggiori
rispetto alle radiazioni e .
Copyright ©2009 Zanichelli
editore
Le idee della chimica
Energia nucleare
11. L’energia nucleare
L’energia nucleare è l’energia che si dovrebbe
spendere per separare fra loro i nucleoni.
La stessa quantità di energia viene ceduta nel
processo inverso di aggregazione dei nucleoni.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
11. L’energia nucleare
Il difetto di massa è la differenza tra la somma
delle masse dei nucleoni che si devono aggregare
per formare un nucleo e la massa nucleare
effettiva.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
11. L’energia nucleare
La relazione che calcola l’energia nucleare a
partire dal valore di difetto di massa del nucleo,
deriva dalla teoria della relatività di Einstein ed è:
Copyright ©2009 Zanichelli
editore
Le idee della chimica
11. L’energia nucleare
L’energia in gioco in una trasformazione nucleare
corrisponde alla differenza tra l’energia dei nuovi
nuclei prodotti e quella dei nuclei reagenti.
L’energia nucleare è circa un milione di volte
superiore all’energia di legame.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
12. Fissione e fusione nucleare
La fissione e la fusione nucleare sono le reazioni
nucleari di maggior interesse per la produzione di
energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
12. Fissione e fusione nucleare
La fissione nucleare è la divisione di un nucleo
instabile in due nuclei più piccoli con liberazione di
neutroni e di energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
12. Fissione e fusione nucleare
Le reazioni
di fissione
sono
sfruttate nei
reattori per
produrre
energia.
Copyright ©2009 Zanichelli
editore
Le idee della chimica
Trinity, New Mexico, 16/07/45
12. Fissione e fusione nucleare
Nella reazione di
fusione nucleare due
nuclei leggeri si fondono
per dare luogo a uno
più pesante.
Copyright ©2009 Zanichelli
editore
Le idee della chimica