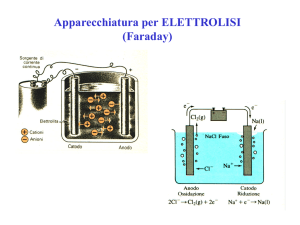
STRUTTURA ATOMICA
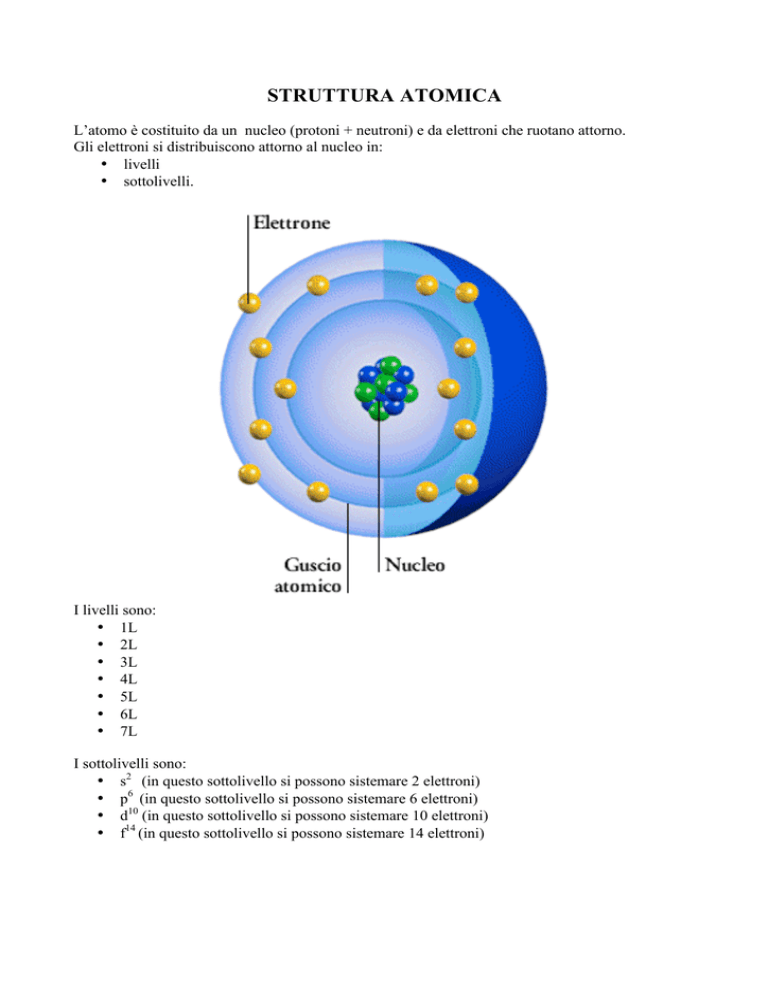
L’atomo è costituito da un nucleo (protoni + neutroni) e da elettroni che ruotano attorno.
Gli elettroni si distribuiscono attorno al nucleo in:
• livelli
• sottolivelli.
I livelli sono:
• 1L
• 2L
• 3L
• 4L
• 5L
• 6L
• 7L
I sottolivelli sono:
• s2 (in questo sottolivello si possono sistemare 2 elettroni)
• p6 (in questo sottolivello si possono sistemare 6 elettroni)
• d10 (in questo sottolivello si possono sistemare 10 elettroni)
• f14 (in questo sottolivello si possono sistemare 14 elettroni)
Livelli
Sottolivelli
1L
2L
3L
4L
5L
6L
7L
1s2
2s2
3s2
4s2
5s2
6s2
7s2
2p6
3p6
4p6
5p6
6p6
3d10
4d10
5d10
6d10
4f14
5f14
6f14
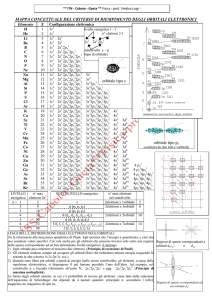
La configurazione elettronica è la sistemazione degli elettroni di un atomo nei vari sottolivelli.
ll numero degli elettroni da sistemare nei vari sottolivelli è dato dal numero atomico Z.
Adesso scrivo la configurazione elettronica degli elementi della tavola periodica.
Guardo la tavola periodica e leggo il numero atomico (Z) dei vari elementi.
Esempio H= idrogeno (il numero atomico Z=1, cioè l’idrogeno ha un elettrone da sistemare
nel sottolivello ). La configurazione elettronica sarà: 1s1
He= Elio (il numero atomico Z=2, cioè l’elio ha due elettroni da sistemare nel sottolivello). La
configurazione elettronica sarà: 1s2
Li = Litio (il numero atomico Z=3). La configurazione elettronica sarà: 1s2 2s1
Be 1s2 2s2
B 1s2 2s2 2p1
C 1s2 2s2 2p2
N 1s2 2s2 2p3
O 1s2 2s2 2p4
F 1s2 2s2 2p5
Ne 1s2 2s2 2p6
Na 1s2 2s2 2p6 3s1
Mg 1s2 2s2 2p6 3s2
Al 1s2 2s2 2p6 3s2 3p1
Si 1s2 2s2 2p6 3s2 3p2
P 1s2 2s2 2p6 3s2 3p3
S 1s2 2s2 2p6 3s2 3p4
Cl 1s2 2s2 2p6 3s2 3p5
Ar 1s2 2s2 2p6 3s2 3p6
K 1s2 2s2 2p6 3s2 3p6 4s1
Ca 1s2 2s2 2p6 3s2 3p6 4s2
Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1
I sottolivelli di tipo d non si riempiono nel livello in cui si trovano ma nel livello successivo dopo s
e prima del p per esempio il 3d si riempie dopo il 4 s prima del 4p.
Invece i sottolivelli di tipo f si riempiono dopo due livelli, dopo l’s e prima del d, per esempio il 4f
si riempie dopo il 6s prima del 5d.
L’ordine di riempimento è di tipo energetico.
Vengono riempiti prima i sottolivelli ad energia minore e poi quelli ad energia via via crescente.
Io riempio prima
1s2
2s2
3s2
4s2
3d10
5s2
6s2
7s2
4d10
5d10
6d10
4f14
5f14
2p6
3p6
4p6
5p6
6p6
Nella tavola periodica ci sono 4 blocchi:
• s
• p
• d
• f
Gli elementi sono stati sistemati nella tavola in base all’ordine di riempimento