Immunologia – 7/12/2011
Oggi vedremo i principali tipi di ipersensibilità e le ipersensibilità sono meccanismi di danno
immunomediato, provocati da abberranti attivazioni del sistema immunitario, e nello schema di
classificazione più accettato si distinguono quattro tipi principali di ipersensibilità: tre di queste
dipendono da anticorpi , di tipo diverso, mentre il quarto tipo, che è l’unico che abbiamo trattato
finora dipende da un’esagerata, aberrante risposta cellulomediata. Le ipersensibilità di cui ci
occupiamo oggi sono le cosiddette ipersensibilità di tipo due e di tipo 3, sono mediate entrambe da
anticorpi tipo IgG e IgM e vengono distinte in due reazioni diverse, a seconda della natura
dell’antigene contro cui queste IgG e IgM sono dirette. Nel senso che l’ipersensibilità di tipo 2 vede
anticorpi IgG e IgM diretti contro antigeni che sono presenti sulla superficie delle cellule o
all’interno dei tessuti, quindi mobilizzati in qualche modo, e il danno tissutale è focalizzato sul tipo
cellulare o sul tessuto che esprime l’antigene laddove gli anticorpi si vanno a legare.Invece
l’ipersensibilità di tipo 3 dipende sempre da IgG e IgM ma che sono dirette contro antigeni solubili
e quindi quello che succede, quello per cui nell’individuo si generano questa serie di anticorpi, è la
formazione di immunocomplessi solubili, circolanti se la distribuzione degli antigeni circolanti è
sistemica, e il danno tissutale avviene lì dove gli immunocomplessi si fermano. Quindi non è
comandato da dove viene espresso l’antigene, da quale tessuto o quale compartimento, ma dipende
da in quali tessuti e in quali compartimenti per tutta una serie di motivi, questi immunocomplessi si
vanno ad accumulare. Quali sono i meccanismi del danno nell’ipersensibilità di tipo 2 e di tipo 3: se
il protagonista immunologico è un anticorpo IgG o IgM quello a cui dobbiamo pensare e quelli che
richiameremo sono i meccanismi effettori comandati dagli anticorpi. Sono questi che provocano il
danno tissutale. All’interno di questo tipo particolare di ipersensibilità di tipo 2, che è la prima che
cominciamo ad affrontare, vengono classificate anche alcune malattie autoimmuni, che dipendono
non tanto dai meccanismi effettori delle IgG e IgM, da quei meccanismi effettori che dipendono
dalla regione costante, ma dipendono fisicamente da qual è l’antigene dov’è localizzato e qual è la
sua funzione contro cui questi anticorpi sono diretti. Quindi comprendono delle malattie in cui il
legame tra un anticorpo e un antigene self tipicamente, queste malattie sono anche autoimmuni, ad
un antigene self, che è per esempio un recettore di membrana, cambia il comportamento di quel
recettore e quindi l’alterato comportamento di quel recettore porta alla malattia. In questo tipo di
malattie il ruolo patogenetico che dipendono appunto da meccanismi non citotossici, il danno
tissutale è dovuto specificamente a qual è la specificità di legame, a qual è l’epitopo a qual è
l’antigene, al quale l’anticorpo si lega. Cominciando a descrivere il meccanismo dell’ipersensibilità
di tipo 2 come detto dobbiamo ispirarci a quelli che sono i meccanismi effettori che sono scatenati
dagli anticorpi, in particolare dagli anticorpi IgG e IgM riportati in questa slide. IgG e IgM sono le
classi anticorpali in grado di legare il complemento, la via classica perché una volta legati
all'antigene sono in grado di legare a loro volta il complesso del C1 che il primo step della cascata
della via classica e quello che sappiamo è che durante lo sviluppo della cascata complementare si
generano una serie di frammenti dotati di molteplici attività di biologiche, in particolare si genera ad
un certo punto della cascata il C3B che è una potente opsonina, cioè si fissa si lega covalentemente
alla superficie dell'antigene o comunque nelle vicinanze del immunocomplesso, cioè dove
l'anticorpo ha legato l'antigene e induce, potenzia la fagocitosi del immunocomplesso stesso.
L'attivazione del complemento è in grado di indurre immediatamente citolisi, vi ricordo che
l’ipersensibilità di tipo due dipende da anticorpi IgG e IgM diretti contro antigeni cellulari e
tissutali. Quindi è appropriato richiamare anche questa funzione del complemento cioè la capacità
del complemento di lisare, di provocare i buchi direttamente sulla membrana sulla superficie della
cellula sulla quale gli anticorpi si sono legati. Poi sappiamo che durante la cascata complementare si
generano dei frammenti C3a, C4a, C5a chiamati anafilotossine che hanno una potente azione
parainfiammatoria, questo sia perché inducono la degranulazione dei mastociti, che rilasciano
istamina che porta a sua volta vasodilatazione, aumento della permeabilità vascolare quindi alla
fuoriuscita di plasma e proteine plasmatiche del circolo verso il tessuto dove sta venendo
l'attivazione del complemento, e l'azione para infiammatoria delle anafilotossine, in particolare del
C5 a, dipende anche dal fattore C5a che è un fattore chemio tattico per i neutrofili. Quindi
produzione di C5a in un sito significa attrazione in quel tessuto di neutrofili dal circolo. E il
passaggio, l'uscita di neutrofili dal circolo verso il tessuto è facilitata dall'effetto dell'istamina,
quindi dalla vasodilatazione, dall'aumentata permeabilità vascolare che rende le cellule epiteliali un
po' meno diciamo attaccata l'un l'altra quindi è facilitato il passaggio di neutrofili richiamati dal
fattore chemio tattico. Altro meccanismo effettore scatenato da anticorpi questa volta IgG è la
fagocitosi, quindi non soltanto la fagocitosi viene aiutata dall'attivazione del complemento,
indirettamente attraverso la formazione di C3b, ma anche direttamente dagli anticorpi anti IgG
legata una particella d'una cellula, ne inducono la fagocitosi e questo mi ricordo succede perché i
fagociti, i principali fagociti professionisti, macrofagi, neutrofili, dendritiche, sono dotati di recettori
per la regione costante delle IgG di cui sentirete parlare oggi pomeriggio nel contesto dell'uso di
anticorpi monoclonali nella terapia contro tumori. Quindi fagociti sono dotati di recettori per la
regione costante delle IgG sono dotati di recettori per i C3B e per i fattori, i quali diciamo servono
per la degradazione dei C3B e un insieme di queste recettori attiva la funzione fagocitica. Altro
meccanismo effettore che è scatenato dalle IgG che può partecipare al danno immunomediato
nell'ipersensibilità di tipo due è la citotossicità anticorpo dipendente, cioè la capacità che hanno
molte cellule dell'immunità innata, le principali sono le cellule natural killer, l'abbiamo descritta
principalmente come una delle modalità di uccisione delle natural killer, ma di fatto la citotossicità
anticorpo dipendente è un'attività che possono mostrare anche altre cellule dell'immunità innata e in
generale i neutrofili e gli eosinofili e quindi un po' quasi tutti tipi di granulociti e i monociti
macrofagi e consiste nel fatto che tutte queste cellule sono dotati di recettori per la regione costante
delle IgG e il quando incontrano delle IgG aggregate e per aggregati intendiamo adese all'antigene
in forma particolata quindi per esempio IgG che ricoprono una cellula bersaglio, tutte queste cellule
sono indotte a degranulare ,quindi a rilasciare il contenuto di granuli che è diverso dal tipo cellulare
a tipo cellulare.
cosa c'è nel granuli delle natural killer? granzimi perforina e quindi rappresenta uno delle modalità
dei meccanismi di uccisione diciamo di linfociti citotossici, nei granuli dei neutrofili troviamo
grande presenza di enzimi proteolitici, nel granuli degli eosinofili oltre gli enzimi proteolitici
troviamo delle tossine cioè delle proteine ad alta attività tossica specifiche, ognuno di questi tipi
cellulari nel degranulare rilascia quello che è il suo corredo specifico di molecole tossiche che
hanno tutte, attraverso meccanismi diversi, la capacità di danneggiare ad uccidere la cellula che è
stata ricoperta dagli anticorpi e quindi questa viene chiamata citotossicità anticorpo dipendente.
Allora ho detto questo tipo di reazione, la reazione di ipersensibilità di tipo due, può essere
scatenata anche da anticorpi che riconoscono gli antigeni all'interno dei tessuti, per esempio
componenti della matrice extracellulare. allora anche qui per giustificare per spiegare il danno
tissutale nei confronti di antigeni che sono, non più sulla superficie di una cellula, ma dentro il
tessuto, dentro una matrice extracellulare, dobbiamo sempre far ricorso e meccanismi effettore e
scatenati dalle IgG e dalle IgM, ma ovviamente dobbiamo contestualizzarli per esempio,
l'attivazione del complemento che avviene quando l'anticorpo lega il suo antigene per esempio
all'interno della matrice extracellulare è importante per spiegare il danno immunomediato, ma non è
importante fra le funzioni del complemento la cito lisi, perché non si può fare citolisi sulla matrice
extracellulare, perché ovviamente la matrice extracellulare, la membrana basale, un tessuto non è
una membrana lipidica quindi non si possono fare buchi quindi in quel caso il danno tissutale è
dovuto più all'azione proinfiammatoria del complemento cioè rilascio di C3a, C5a, C4a, e
all'afflusso di fagociti dei macrofagi di neutrofili attivati nel tessuto che una volta arrivati nel
tessuto rilasciano i prodotti tossici sia prodotti tossici che hanno nei granuli, quindi enzimi
proteolitici si attivandosi cominciano a generare metaboliti attivi dell'ossigeno e dell'azoto e sono
questi i mediatori del danno tissutale. infatti quello che succede quando arrivano diciamo i fagociti
nel sito in cui anticorpi di tipo IgG si sono legati con antigeni immobilizzati nella matrice
extracellulare è che ovviamente la fagocitosi non è possibile, cioè i fagociti che arrivano in questo
sito incontrano le immunoglobuline IgG, incontrano i frammenti del C3B, che sono il prodotto della
attivazione del complemento, che sono in grado di essere legati dei recettori che stanno sulla
superficie del fagocita, e il fagocita quindi è indotto a cominciare quella che sarebbe la attività di
fagocitosi. ovviamente non è possibile fagocitare la matrice extracellulare non è possibile fagocitare
un tessuto perché non è una cellula, e quindi quello che succede è che fagociti invece che fagocitare
fanno quella che si chiama la fagocitosi frustrata, cioè rovesciano all'esterno tutto quello, prodotti e
metaboliti reattivi dell'ossigeno, enzimi proteolitici, tutto quello che in un evento di fagocitosi
normale sarebbe riversato all'interno del fagocita. non essendo più possibile completare, la
fagocitosi questi prodotti tossici vengono tutti riversati all'esterno è provocano quindi il danno
tissutale. quindi in entrambi i casi sia che l'antigene che sta scatenando la reazione di ipersensibilità
di tipo 2 sia un antigene di superficie della cellula, sia che sia un antigene tissutale, i meccanismi
del danno dipendono dalle reazioni effettrici delle immunoglobuline IgG e IgM con delle
differenze nei due casi, che dipendono da fattori fisici logistici perché avere un antigene sulla
superficie della cellula può permettere la fagocitosi di quella cellula cosa che non è possibile
quando l'antigene è mobilizzato all'interno della matrice extracellulare. Quali sono gli antigeni che
possono scatenare ipersensibilità di tipo due: in realtà qualunque tipo di antigene, poi se dobbiamo
dare una classificazione ci sono alcuni auto antigeni che possono dare origine a reazioni di
ipersensibilità di tipo due in questo caso significa che l'antigene scatena la produzione di auto
anticorpi, se l'antigene è un auto antigene, e quindi meccanismi di ipersensibilità di tipo due sono
alla base di alcune malattie autoimmuni mediata da anticorpi, cioè in alcune malattie autoimmuni il
danno tissutale è provocato dal sistema immunitario attraverso i meccanismi di danno derivato
dell'ipersensibilità di tipo due. per esempio l’anemia emolitica autoimmune o la trombocitopenia
autoimmune, sono provocate da meccanismi di ipersensibilità di tipo due, cioè la produzione di auto
anticorpi contro antigeni self localizzati sulla superficie dei globuli rossi e sulla superficie delle
piastrine scatena i meccanismi che abbiamo visto prima attivazione del complemento, fagocitosi,
citotossicità anticorpo dipendente, nel caso per esempio dell'linfopatia autoimmune, e sono questi
meccanismi che portano alla distruzione dei globuli rossi, di piastrine, e di alcuni popolazione di
linfociti e quindi portano alla malattie autoimmune. ma l'ipersensibilità di tipo 2 si può anche
scatenare in risposta ad alloantigeni, cioè antigeni che non sono self, ma che sono presenti in
maniera diversa in elementi della stessa popolazione e questo è il caso delle reazioni trasfusionali,
che sono reazioni di ipersensibilità di tipo 2 dove il danno tissutale è scatenato da anticorpi che sono
diretti contro alloantigeni , oppure l’eritroblastosi fetale, di cui parleremo fra un attimo, non solo,
ma danno provocato da ipersensibilità del tipo due, quindi danno provocato da anticorpi contro allo
antigeni sono coinvolti anche nel rigetto del radiante, cioè nella distruzione dei tessuti che vengono
trasferiti dall'individuo all'altro geneticamente diversi. si possono avere anche reazioni di
ipersensibilità di tipo 2 contro antigeni estranei, intendendo per antigeni estranei né antigeni self nè
antigeni diciamo posseduti dalla stessa popolazione, per esempio antigeni microbici possono
scatenare ipersensibilità di tipo 2 attraverso la cross reattività con antigeni self e lo richiameremo
esempi di questo quando abbiamo parlato del ruolo che le infezioni dei patogeni hanno nel
giustificare lo scatenamento di malattie autoimmuni. un antigene microbico può scatenare una
risposta anticorpale e laddove un antigene microbico cross-reagisce, cioè ha delle zone di omologia
con degli antigeni self, gli anticorpi prodotti in seguito all'infezione da parte di un microbo possono
andare a provocare reazioni di ipersensibilità di tipo due contro il tessuto self. oppure alcuni farmaci
sono in grado attraverso la loro capacità di modificare gli antigeni self, sono in grado di indurre la
produzione di anticorpi come la penicillina in cui la penicillina che ha un'alta reattività alla capacità
diciamo di stabilire prontamente legame chimico e quindi inattivare alcuni enzimi batterici e su
questo si basa la sua capacità antibiotica, però questo stesso legame reattivo che si rompe facilmente
e si può riformare può andar riformarsi con degli autoantigeni. Tipicamente con molecole presenti
sulla superficie dei globuli rossi e in questo modo quello che succede è che questo antigene self
questa molecola di superficie del globulo rosso, risulta modificata dall’aggiunta della penicillina, è
chimicamente diversa, e quindi può indurre la produzione di anticorpi contro l’epitopo modificato
contro il qual ovviamente non è stata a mai stabilita una tolleranza perché diciamo si può essere
tolleranti all'antigene di per sé ma non all'autoantigene modificato con la penicillina e quindi e la
produzione di queste auto anticorpi diretti contro l’antigene self modificato può provocare la lisi dei
globuli rossi e quindi la anemia, cioè una risposta di ipersensibilità di tipo due al farmaco. Riguardo
al fenomeno di ipersensibilità di tipo due che è alla base delle malattie indotte da infezioni
microbiche e questo lo avete già visto, il meccanismo attraverso il quale infezione da streptococco
beta emolitico di gruppo a, di cui insegue dall'infezione si può avere un danno tissutale tipicamente
una miocardite o un'artrite, è dovuta al fatto che c'è una cross reattività fra alcuni antigeni dello
streptococco e alcun antigene self per cui in seguito all'infezione con lo streptococco, l’individuo
monta la risposta anticorpale contro le antigene lo streptococco ma alcuni di questi anticorpi sono in
grado di legare anche degli antigeni self e quindi attraverso i meccanismi effettori scatenati dagli
anticorpi sono in grado di indurre danno tissutale in vari tessuti e quello diciamo più preoccupante
più grave è quella livello del miocardio. Ho detto che questo ipersensibilità di tipo due si possono
avere contro allo antigeni e un esempio tipo sono le reazioni trasfusionali. voi avete già sentito
parlare dei principali sistemi di gruppo sanguigno a AB0 quindi sapete che ognuno di noi a seconda
del genotipo ed degli alleli esprimono nel locus a livello di questo sistema di gruppo sanguigno può
essere fenotipicamente di gruppo a, questo significa che sul globuli rossi è espresso l'antigene a, o
eterozigote a B. oppure di gruppo zero, dove globuli rossi non esprimono né l'antigene A, né
l'antigene b. difatti geni per l'antigene a e per l'antigene b non codificano direttamente per l'antigene
a e per l'antigene b ma codificano per degli enzimi che sono in grado di modificare degli zuccheri
che si trovano sulla superficie dei globuli rossi generando gli epitopi antigenici. Allora quello che
succede è che a seconda dell'antigene di gruppo sanguigno che ognuno di noi esprime e che è
dettato del genotipo, quindi A, B, AB o 0, corrispondentemente ognuno di noi produce anticorpi
contro la controparte, l'altra antigene che non è espresso sui loro globuli rossi. quindi individui di
gruppo a che esprimono l'antigene A sul globulo rosso possiedono anticorpi contro gruppi b. Al
contrario individui di gruppo b possiedono anticorpi contro gruppo a. l'individuo eterozigote ab che
quindi esprimono entrambi gli antigeni sui globuli rosso non hanno anticorpi contro antigene di
nessun gruppo sanguigno e al contrario gli individui di gruppo zero che non esprimono né l'antigene
a né l'antigene b, possiedono anticorpi si anti-a che anti-b. ora gli anticorpi contro il sistema di
gruppo sanguigno AB0, sono anticorpi naturali, cosa vuol dire, che sono anticorpi che abbiamo dai
primi anni di vita più o meno, non sono stati indotti da un deliberato contatto con un antigene non
nativo cioè c'è l'abbiamo anche se non abbiamo mai subito una trasfusione con sangue
incompatibile, e sono fatti da quelle cellule, le b uno, che abbiamo visto hanno la capacità di
produrre spontaneamente, questo lo definiamo noi perché sappiamo che non è avvenuto un contatto
con un antigene esterno, sono in grado di produr anticorpi, in genere anticorpi IgM, anticorpi che
sono generati maniera t-indipendente, vi ricordo degli antigeni a e B sono antigeni di tipo glucidico
quindi sono tipici antigeni timo indipendenti non si può avere l’help dei linfociti T per indurre una
risposta a anticorpale contro a e contro B e che probabilmente la produzione di anticorpi contro gli
antigeni di questo gruppo sanguigno è stimolata per cross reattività contro antigeni dalla flora
batterica. Quindi è il riconoscimento e la stimolazione con zuccheri che sono portati cioè esposti sui
batteri della flora commensale che scatena la produzione di anticorpi che poi cross reagiscono con
gli antigeni del gruppo sanguigno che noi definiamo gli anticorpi anti a e anti b. domanda: ma
quindi appena nati non si hanno problemi cioè... Appena nati non sono non si hanno problemi. Ma
quindi appena nati noi siamo tolleranti all'esposizione di antigeni di gruppo sanguigno diverso dal
nostro. Questa cosa saprà sfruttare il senso terapeutico perché sebbene questa un sistema di antigeni
chiamato gruppo sanguigno non sono espresse solamente sul globuli rossi ma sono espressi su molti
tipi cellulari in particolare li riincontreremo quando parleremo di trapianti perché gli antigeni del
gruppo sanguigno AB0 sono espressi anche sulle endotelio dei vasi. quindi l'incompatibilità con
AB0 è da considerare quando si va a cercare un accoppiamento per un organo ricevente per un
trapianto. È quello che è stato sperimentato alcuni anni fa, è stato fatto un trapianto di cuore in utero
nel neonato, da donatore AB0 incompatibile quindi una situazione, questa situazione non è possibile
nell'età adulta perché non si può riuscire a far accettare a un individuo un qualunque organo o
tessuto che esprima antigeni del gruppo sanguigno incompatibile però proprio perché l'individuo
produce continuamente anticorpi contro il gruppo sanguigno AB0. ma questo non avviene nella fase
perinatale. quello che si è visto è che non solo o il trapianto di cuore in utero da un donatore AB0
incompatibile ha attecchito, ma il bambino che è nato e che poi è cresciuto e diventato tollerante al
gruppo sanguigno del donatore e quindi è proprio nella fase post natale che si impara chi è il nostro
gruppo sanguigno e quindi è permessa la produzione di anticorpi contro antigeni del gruppo
sanguigno che noi non esprimiamo ed è inibita invece quella rispetto agli antigene che noi
esprimiamo. “entra Familiari”. quindi gli anticorpi contro il gruppo sanguigno che sono responsabili
delle reazioni trasfusionali e cioè dell’emolisi di globuli rossi trasfusi laddove sono stati trafusi
trasfusi appunto in una situazione di incompatibilità sono anticorpi naturali, ognuno di noi li
possiede a prescindere pur non essendo mai venuto in contatto con antigeni del gruppo sanguigno
diverso e quindi prima di effettuare una trasfusione di sangue bisogna tipizzare il donatore e
ricevente cioè identificare che antigeni di gruppo sanguigno esprimono i globuli rossi del donatore e
la presenza o l'assenza di anticorpi contro gruppo sanguigno del donatore nel ricevente. Questo si
può fare effettuando un banalissimo test in vitro che metta a contatto il plasma o il siero meglio del
ricevente dove sono presenti eventualmente gli anticorpi con il globuli rossi del donatore. laddove
nel siero del ricevente sono presenti anticorpi che sono in grado di riconoscere, di legare i globuli
rossi del donatore, questi genereranno un'agglutinazione dei globuli rossi, un'aggregazione che ha
una reazione molto semplice visibile ad occhio nudo che rivela la presenza nel ricevente di anticorpi
contro il donatore. un altro sistema di antigeni di gruppo sanguigno che è coinvolto in reazioni di
ipersensibilità di tipo due e che poi sono alla base delle patologie è il sistema dell’Rh. Sapete che
sono tre antigeni che determinano lo Stato Rh, Rh positivo/Rh negativo, ma l'antigene principale è
l'antigene D che è quello dominante e quindi tutti gli individui che hanno alleli D grande sono Rh
positivi mentre tutti gli individui che hanno alleli D piccolo sono Rh negativi. La differenza al Rh
riveste un’importanza diciamo per la salute umana, la situazione particolare è una situazione di
gravidanza generata da una madre Rh negativa e da un padre Rh positivo. Allora il padre cosa può
essere Rh fenotipicamente positivo e può essere omozigote e avere alleli D grande in tutti due loci
o eterozigote D grande D piccolo e comunque fenotipicamente Rh positivo cioè i suoi globuli rossi
esprimono l'antigene Rh. cosa succede una gravidanza fra un padre Rh positivo e una madre Rh
negativa cioè omozigote per la alleli D piccolo D piccolo? Che a seconda se il padre sarà omozigote
o eterozigote o in tutte diciamo le gravidanze o almeno nella metà statisticamente delle gravidanze
il feto sarà Rh+ cioè avrà ereditato la alleli D grande dal padre e ovviamente avrà ereditato la alleli
non dominante dalla madre, ma fenotipicamente risulterà Rh positivo. Allora cosa succede la madre
che Rh negativo che non ha mai visto l'antigene D ha una gravidanza cioè un feto che sui suoi
globuli rossi porta l'antigene D. Allora durante la gravidanza gli scambi di sangue cioè l'entrata di
componenti del sangue fetale all'interno del sangue materno sono degli scambi molto piccole che
quindi non sono sufficienti ad innescare l'attivazione del sistema immunitario materno, quindi la
presenza di quest'antigene estraneo che pure c'è al livello del feto viene poco vista dal sistema
monetario materno. e invece c'è un momento in cui c'è un grosso scambio di sangue tra feto e madre
che è il parto. Al momento del parto molti globuli rossi del feto entrano a contatto col sangue
materno e quindi sono in grado di indurre l'attivazione del sistema immunitario della madre,
attivazione che comporta l'attivazione delle plasmacellule che fanno anticorpi contro l'antigene D
contro l’Rh e cellule memoria. ora durante la prima gravidanza non ci sono problemi per il feto
proprio perché non c'è il tempo e non ci sono le condizioni durante la gravidanza perchè si sviluppi
una potente risposta immunitaria della madre contro l'antigene Rh. i problemi nascono nelle
gravidanze successive perché nella gravidanza successiva se di nuovo il feto Rh positivo, anche il
piccoli scambi di sangue fra feto e madre che avvengono durante la gravidanza questa volta sono in
grado di indurre la riattivazione delle cellule B memoria che la madre ha fabbricato durante la prima
gravidanza. Quindi durante la prima gravidanza la madre è naive e quindi la poca presenza nel
corso della gravidanza dell'antigene Rh non è sufficiente a indurre una risposta immunitaria che
possa creare problemi. Nella seconda gravidanza la madre non è più naive, ha cellule memoria, e
sappiamo che le cellule memoria hanno una soglia di attivabilità molto più bassa delle cellule naive,
quindi basta molto meno antigene per riattivarle farle diventare plasmacellule e soprattutto visto che
stiamo parlando di una risposta secondaria, questa volta le plasmacellule che si riformano nella
madre durante la seconda gravidanza sono plasma cellule che producono IgG e non IgM come nella
risposta primaria e questa differenza è cruciale, perché è cruciale? Perché le IgG passano la placenta
e le IgM no. Quindi seppure nella prima gravidanza è avvenuta una limitata attivazione del sistema
immunitario materno questa riuscirà ad arrivare a formare una risposta di tipo primario con la
formazione di IgM che non sono problematiche le pericolose per il feto. Durante la seconda
gravidanza la madre fa una risposta immunitaria di memoria si riattivano le cellule B memoria
costruite la prima volta, si producono plasmacellule che fanno IgG, le IgG passano la placenta
vanno a trovare globuli rossi del feto provocando un’emolisi. questo provoca un rischio sia per la
sopravvivenza che per lo sviluppo del feto e del suo sistema nervoso centrale che è chiamata
eritroblastosi fetale, una condizione patologica. Se vi ricordate la diapositiva di prima la frequenza
degli alleli D grande D piccolo nella popolazione umana è diversa dalla popolazione umana diversa
di etnia etnia ma è comunque abbastanza frequente avere gravidanze in cui la madre Rh negativa il
padre Rh positiv,o quindi una condizione abbastanza frequente. Sentite parlare spesso eritroblastosi
fetale? Come si è risolto questo problema ? questa situazione di rischio molto frequente, come si
risolve? Il cesareo non ti mette al riparo. È vero che limita questo grosso afflusso di antigene nel
sistema immunitario della madre ma non lo elimina perché un po' durante la gravidanza c'è un
ripetuto scambio ma non ti mette al riparo da questa situazione. Risposta: gli anticorpi anti Rh.
quando glieli dà alla madre di anticorpi anti Rh? nel periodo intorno al parto verrà il momento in cui
c'è questo grosso afflusso di sangue e di antigene. Quindi cosa fanno questi anticorpi anti Rh
terapeutici che dai nella circolazione materna ? Inducono rapida degradazione dei globuli rossi
fetali che sono entrati nella circolazione materna e, accelerando la degradazione, limitano il tempo
in cui quest'antigene è visibile per il sistema immunitario materno e quindi il tempo che l'antigene
ha disposizione per attivare la risposta in uno mediata. Queste preparazioni di immunoglobuline di
tipo i IgG ad alta affinità per le Rh si chiamano ROGAM e dobbiamo darle a tutte le gravidanze di
un feto Rh positivo con madre Rh negativa, perché ogni volta che c'è una gravidanza c'è questo
momento di immunizzazione. Le immunoglobuline anti Rh che vengono somministrate hanno una
vita breve quindi riescono interferire con i globuli rossi che entrano in contatto col sistema
immunitario della madre in quella gravidanza e quindi ad ogni gravidanza devono essere
somministrate in caso di madre Rh negativa e feto Rh positivo come profilassi. Questo Solo per
dare un'idea di quanto fosse una causa frequente di morbilità e mortalità e di quanto questo è stato
abbattuto dall'introduzione della profilassi con ROGAM. sono IgM o sono i IgG questi anticorpi?
quando li dai? Subito dopo il parto nelle ventiquattr'ore intorno al parto. sono i IgG e perché sono
dei IgG. Sono anticorpi ottenuti da donatori e non sono prodotti la tecnologia del DNA
ricombinante sono pool di anticorpi presi da donatori immuni cioè donatori che hanno una risposta
contro le Rh. perché ci interessa prendere frazioni di IgG piuttosto del IgM? Perché hanno
un'affinità maggiore! ci interessa avere una preparazione di immunoglobuline che riescano a trovare
l'antigene Rh Anche quando questo è sperso a bassa concentrazione anche se sono passati tre
globuli rossi del feto quindi li vogliamo ad alta affinità quindi cerchiamo le IgG non le IgM.
Domanda: perché gli anticorpi anti A e anti B non sono un problema. Risposta: eppure la madre ce
li ha sicuri e sicuramente ci saranno un sacco di casi di gravidanze AB zero incompatibili cioè dove
il gruppo sanguigno del feto è diverso da quello della madre e quindi è matematico che la madre gli
anticorpi e ce li ha, eppure normalmente non si osserva eritroblastosi fetale contro la AB0. Che
anticorpi sono quelli contro la B0? IgM. passano la barriera placentare? no probabilmente quando
globuli rossi del feto passano perché quelli passano sempre al momento del parto, la madre ha
anticorpi contro il gruppo sanguigno nel suo circolo quindi che fanno un po' con tutte le differenze,
quello che fa la profilassi anti ROGAM. cioè la madre ce li ha gli anticorpi del distruggere globuli
rossi del feto, solo che può avere accesso ai globuli rossi e solo quelli che sono passati nel circolo
sistemico materno perché gli anticorpi materni e IgM non passano la barriera placentare. quindi
prima di tutto c'è questo, la natura dell'antigen,e l'antigene Rh non è zuccherino mentre l'antigene
AB0 si. Quindi indurre una risposta IgG contro la AB0 è molto più rare molto più difficile perché
una antigene T indipendente, quindi sebbene una madre possa essere esposta ripetutamente a
sistema di antigene al B0 diciamo incompatibili durante la gravidanza, questi antigeni potranno
anche andar a stimolare la produzione di anticorpi naturali ma generalmente potenzieranno una
risposta IgM a bassa affinità. Secondo motivo visto che la madre gli anticorpi anti AB0 ce li ha già
normalmente in circolo, quando al momento del parto i globuli rossi con gruppo sanguigno diverso
arrivano nel circolo della madre questi anticorpi le mascherano e distruggono quindi è un po' come
se avere gli anticorpi naturali fosse una profilassi del ROGAM ma solo che è endogena. Ora
giustamente come si monitorizza la possibilità del eritroblastosi fetale, cioè come si segue la
possibile presenza di anticorpi patogenetici nella madre che possono passar all'interno della
circolazione fetale e quindi provocare eritroblastosi fetale. Si fa attraverso un test che è il test di
Coombs e esistono due varianti del test: uno è il cosiddetto “diretto” è quello che si effettua su
globuli rossi del feto e vuole rispondere a questa domanda: esiste all'interno della circolazione fetale
anticorpi e questo implicitamente significa di derivazione materna in grado di distruggerli? Quindi
in questo caso nel caso del test diretto viene prelevato sangue fetale vengono studiati globuli rossi
fetali e viene messo in evidenza la presenza di eventuali anticorpi legati aggiungendo per rivelare
l'eventuale presenza un siero, cioè delle immunoglobuline di coniglio, dirette, specifiche per le
immunoglobuline umane. Se nella circolazione fetale sono passati anticorpi patogenici cioè antigeni
dei globuli rossi di derivazione materna si saranno attaccate ai globuli rossi e quindi a loro volta le
immunoglobuline di coniglio dirette contro le immunoglobuline umane si legheranno a ponte
questo indurrà la agglutinazione dei globuli rossi fetali, visibile a occhio nudo. Quindi se avviene
agglutinazione significa che sui globuli rossi del feto sono presenti anticorpi di origine materna che
sono in grado di danneggiare i globuli rossi. Alternativamente quello che si può fare è il test
indiretto di Coombs che serve a rispondere a una domanda leggermente diversa: la madre sta
producendo degli anticorpi patogenici, cioè degli anticorpi che sono diretti contro antigeni dei
globuli rossi del figlio? Quindi questa volta quello che analizziamo non sono globuli rossi del figlio
ma il siero materno cioè il luogo dove ci sono potenzialmente degli anticorpi anti Rh. e quindi il
siero della madre contenente gli eventuali anticorpi viene messo a contatto con dei globuli rossi Rh
positivi, quindi presi da un donatore che chiaramente è Rh positivo e anche qui se la madre ha
prodotto anticorpi anti Rh, e questo può essere un modo per monitorare l'efficienza della profilassi,
osserveremo la agglutinazione dei globuli rossi se avviene nel legame dei suoi anticorpi contro il
globuli rossi Rh positivi.
Quindi oltre ad antigeni
estranei o alloantigeni
presenti come quelli del
gruppo sanguigno, alcune
reazioni di ipersensibilità
di tipo due sono alla base
di malattie autoimmuni,
quindi in cui in alcuni
individui si osserva la
produzione
di
auto
anticorpi diretti contro
auto
antigeni
della
superficie cellulare per
esempio della superficie
dei globuli rossi e delle
piastrine o auto antigeni
diretti contro autoantigeni
tissutali,
come
nella
sindrome di Goodpasture.
quindi questo caso la
malattia autoimmune e il
danno tissutale ai tessuti self dell'organismo è dovuto al fatto che questi auto anticorpi scatenando
dei meccanismi effettori degli IgG e IgM portano alla distruzione o un certo tipo cellulare globulo
rosso o piastrina, o danneggiano un tessuto particolare come il glomerulo renale come nella
sindrome di Goodpasture.
Questo è solo per ricordare che sono i meccanismi che sappiamo, che abbiamo già visto. Quello che
dobbiamo immaginare è che in alcune situazioni, in individui geneticamente predisposti in cui non
funzionino perfettamente i meccanismi di tolleranza, ad un certo punto si comincino a fare anticorpi
per esempio contro antigeni dei globuli rossi, della superficie del globulo rosso. Il legame degli
anticorpi all'antigene produce da una parte l'attivazione del complemento, quindi la lisi diretta del
globulo rosso, dall'altra parte ha un effetto diciamo opsonizzante. Quindi il legame degli anticorpi al
globulo rosso combinato con il legame del c3b, che deriva dall'attivazione del complemento,
scatena la fagocitosi e la distruzione intracellulare dei globuli rossi . E in cronico questo porta ad
un'anemia, che è un 'anemia quindi emolitica dovuta quindi a distruzione dei globuli rossi, di natura
autoimmune, cioé scatenata da una produzione di autoanticorpi. Nel Pemfigo per esempio che è
un'altra malattia autoimmune che colpisce questa volta il compartimento della pelle, della cute, si
producono autoanticorpi contro le caderine epidermiche cioé contro quelle molecole di adesione che
regolano potentemente le giunzioni strette fra le varie cellule, i cheratinociti. Quindi quello che
succede è che questi anticorpi si vanno a legare, vedete il legame degli anticorpi messo in evidenza
in immunofluorescenza, come vedete gli anticorpi si legano tutti alle giunzioni al contorno fra una
cellula e l'altra, disturbano il funzionamento delle giunzioni strette quindi portano al distacco dei
cheratinociti e questo porta ad una disorganizzazione addirittura alla formazione di bolle cioé la
pelle si stacca perché c'è un disturbo diciamo dei meccanismi che regolano la giunzione stretta.
(Domanda: Scusi ma questa è proprio un'autoimmunità non un'ipersensibilità)
Allora, ipersensibilità indica il meccanismo di danno, autoimmunità indica la causa di quel
meccanismo di danno cioé sono due livelli diversi. Quando noi categorizziamo i danni che il
sistema immunitario può fare, li categorizziamo per tipo di danno per tipo di meccanismo, quelle
sono le ipersensibilità. In questo caso il sistema immunitario produce un danno al tessuto perché
produce autoanticorpi, i quali poi provocano il danno. se l'antigene è self questo meccanismo di
danno è alla base di una malattia autoimmune. Nel caso della reazione trasfusionale questo stesso
meccanismo di danno è alla base di una reazione contro l'allo, contro l'alloantigene. L'ipersensibilità
quindi è il meccanismo a seconda poi di dove si scatena, di qual'è la causa per cui produciamo gli
anticorpi e qual'è l'antigene contro cui li produciamo può essere alla base di una malattia
autoimmune. Bisogna distinguere i livelli.
(Domanda (supposta fra l'altro perché non si sente bene) : ma quando c’è una cross reattività con un
antigene esogeno, microbico, si parla di malattia autoimmune?)
Secondo me ci sarà una riclassificazione adesso. Lì è autoimmune perché il danno è contro il
tessuto self. Che poi la risposta iniziale non è stata scatenata direttamente contro l'antigene self, ma
contro un antigene che gli assomigliava, tutto sommato da un certo punto di vista è irrilevante.
Anche perché anche nelle malattie autoimmuni classiche, possiamo prendere anche il Pemfigo,
perché un individuo inizi a fare anticorpi contro le caderine, possiamo sempre sospettare che sia
successo qualcosa per cui ha visto magari un antigene microbico che assomiglia alla caderina. Cioè
noi in realtà della malattia autoimmune la causa scatenante non la sappiamo. Non sappiamo quindi
se il sistema immunitariuo è partito dicendo "Voglio fare una risposta contro l'autoantigene" o è
arrivato a fare una risposta contro l'autoantigene partendo da un'altra parte. Quindi in questo senso è
sempre una malattia autoimmune.
(Domanda: La togliamo la porzione FC o no? () ma infatti non devono solo mascherare, io non ho
detto mascherare ho detto distruggere. Cosa significa, che se i globuli rossi appena entrano nella
circolazione materna i globuli rossi del feto, del feto o del neonato vengono immediatamente
ricoperti di IgG, vengono efficacemente fagocitati, distrutti dal complemento, cioé tutto in maniera
molto rapida molto accelerata perché c'è questa sovrabbondanza di IgG che noi abbiamo inoculato.
Quindi l'effetto dipende molto dalla presenza delle FC non è solo un mascheramento. E' una
rimozione dell'antigene. Cioè l'obiettivo è di rimuovere dal circolo il più presto possibile l'antigene
prima che possa efficacemente attivare il sistema immunitario della madre.
Allora la sindrome di Goodpasture è un esempio di una malattia autoimmune che dipende da una
reazione di ipersensibilità di tipo II in cui gli autoanticorpi prodotti questa volta non sono
autoanticorpi che stanno sulla superficie delle cellule ma sono autoanticorpi diretti contro antigeni
che stanno sui tessuti. Nel caso della sindrome di Goodpasture si generano autoanticorpi contro il
collagene di tipo IV. Collagene di tipo IV che è un componente importante della matrice
extracellulare della membrana basale del glomerulo e a livello degli alveoli polmonari. Quindi in
questo caso quello che succede è che gli autoanticorpi prodotti si legano qui vedete che marcano
proprio il percorso della membrana basale, scatenano l'attivazione del complemento. Non dobbiamo
tener conto nel senso che non avviene una citolisi diretta da parte del complemento perché non c'è
nessuno da uccidere sulla membrana basale, ma avviene l'afflusso di fagociti attivati, il
reclutamento, quindi reazione infiammatoria dovuta all'arrivo di neutrofili, macrofagi attivati che
fanno la fagocitosi frustrata, cioé rovesciano all'esterno quindi sulla membrana basale enzimi
proteolitici, metaboliti reattivi dell'ossigeno e dell'azoto. Risultato: danno a livello della membrana
basale del glomerulo e degli alveoli polmonari.
Ho detto che all'interno dell'ipersensibilità di tipo II sono anche categorizzate delle malattie
autoimmuni in cui il meccanismo di danno provocato dagli autoanticorpi perché siamo dentro
l'ipersensibilità di tipo II quindi il meccanismo di danno che porta alla malattia autoimmune non
dipende almeno in maniera principale dai meccanismi effettori degli anticorpi che dipendono dalla
regione costante, dalle FC, ma dipende dal fatto che gli autoanticorpi prodotti vanno a modificare il
comportamento la fisiologia dei recettori che sono appunto importanti da un punto di vista della
corretta fisiologia. E i principali esempi di questo tipo di malattia sono il morbo di Graves che è un
ipertiroidismo e la Miastenia Gravis. Allora cosa succede in queste malattie? Nel morbo di Graves
si producono autoanticorpi contro il recettore del TSH e gli anticorpi prodotti hanno un effetto
agonista, cioé mimano il legame con il ligando fisiologico. Allora questo è solo per ricordarvi che la
produzione degli ormoni tiroidei da parte dei tirociti è sotto il controllo del TSH quindi i tirociti
hanno un recettore per il TSH , il legame dell'ormone al recettore stimola la produzione degli
ormoni tiroidei e il livelli degli ormoni tiroidei a feedback regolano il livello di produzione del
TSH. Quindi questo è un sistema che mantiene costanti i livelli degli ormoni tiroidei basandosi sul
feedback per la produzione del TSH. In alcuni individui si producono anticorpi contro il recettore
del TSH che si vanno a legare ai tirociti, ma, e questa è la qualità importante di questi autoanticorpi,
sono autoanticorpi che stimolano il recettore hanno un effetto agonista, mimano quello che farebbe
il ligando. Quindi stimolano la produzione di ormoni tiroidei. Ora a differenza di quello che è il
circuito fisiologico ovviamente in questo caso non c'è nessun feedback, cioé la produzione degli
ormoni tiroidei va a inibire il rilascio del TSH ma ovviamente non va a interferire con la produzione
di nuovi autoanticorpi per cui quello che succede è che i tirociti sono cronicamente stimolati, cioé
recettori del TSH dei tirociti è cronicamente stimolato dagli autoanticorpi, quindi si ha un
ipertiroidismo cioé iperproduzione degli ormoni tiroidei. Quindi in questo caso il danno tissutale,
inteso come alterazione della fisiologia della tiroide, non dipende tanto dall'attivazione del
complemento , dei fagociti, dell'infiammazione che poi a un certo punto intervengono pure, ma
dipende dal fatto che gli autoanticorpi prodotti sono autoanticorpi che interferiscono con la
fisiologia di un recettore importante. E ovviamente questo tipo di malattia così come altre malattie
che dipendono da meccanismi di ipersensibilità di tipo II, che dipendono quindi da anticorpi IgG,
sono trasferibili al feto, questo ad esempio come il morbo di Graves, perché ovviamente le IgG
possono passare attraverso la barriera placentare e quindi una madre che soffre di morbo di Greys
cioé che ha autoanticorpi contro il recettore del TSH può trasmette il morbo di Graves al bambino,
trasferendogli gli anticorpi. La differenza fondamentale tra morbo di Graves di cui soffre il neonato
e quello di cui soffre la madre, è che qui la malattia dura finché durano gli anticorpi materni che
hanno un loro catabolismo che può essere accelerato ad esempio da un scambio, da una trasfusione,
possiamo eliminare gli anticorpi materni dal ciclo e in concomitanza della scomparsa degli
anticorpi materni scompare la malattia. La madre invece siccome gli anticorpi li continua a
produrre, continua a soffrire della malattia.
Allora, la Miastenia Grave è un altro esempio di malattia autoimmune dovuta alla produzione di
autoanticorpi che vanno ad alterare la fisiologia di un recettore importante, in questo caso il
recettore coinvolto è quello dell'acetilcolina, a livello della placca neuromuscolare. A differenza del
morbo di Graves gli autoanticorpi che si producono nei pazienti con Miastenia Grave hanno un
effetto antagonistico, cioé vanno ad interferire col legame tra recettore e mediatore del segnale
nervoso. Quindi quello che succede è che l'impulso nervoso che si dovrebbe trasmettere, portare
alla contrazione muscolare non può più avvenire perché il recettore per l'acetilcolina sono bloccati
dal legame con gli anticorpi. Gli anticorpi, diciamo, non soltanto interferiscono fisicamente con il
legame con l'acetilcolina, ma inducono, legandosi al recettore, l'internalizzazione e la distruzione
del recettore. quindi fanno proprio scomparire il recettore per l'acetilcolina dalla membrana. Quindi
diciamo che la cellula muscolare diventa insensibile al segnale nervoso e quindi la patologia che ne
risulta è un progressivo indebolimento muscolare dovuto al fatto appunto che c'è un interferenza
nella trasmissione del segnale nervoso.
(Domanda: Non ci sono disturbi anche nella trasmissione del sistema nervoso autonomo?)
Questo non lo so, non so se è perché sono meno gravi o c'è una selettività diciamo del tipo di
recettore che viene coinvolto. Tipicamente diciamo interessa il muscolo scheletrico nella
trasmissione del segnale.
Allora quindi quello che abbiamo visto è che i principali meccanismi che giustificano, che spiegano
il danno tissutale in tutte quelle malattie, che siano autoimmuni o meno, che sono dovute a
meccanismi di ipersensiblità di tipo II, sono i principali meccanismi effettori degli anticopi IgG e
IgM. Quindi attivazione del complemento con la produzione di molecole ad azione
proinfiammatoria, a cascata quindi a valle attivazione dei fagociti con rilascio di prodotti tossici da
parte dei fagociti stessi; opsonizzazione e fagocitosi, questo è un altro meccanismo che può
giustificare, poi ovviamente il contributo dei diversi meccanismi è diverso nelle diverse malattie,
però collettivamente sono questi i meccanismi che permettono di spiegare una qualunque malattia
sostenuta da questa ipersensibilità. Quindi fagocitosi e distruzione intracellulare, citotossicità
anticorpo dipendente, e in alcuni casi, per un sottogruppo di malattie autoimmuni il danno tissutale
è spiegato non tanto dai meccanismi effettori FC dipendente degli anticorpi, ma dal fatto che gli
autoanticorpi prodotti vanno a modulare, ad alterare la funzione di recettori fisiologicamente
importanti.
Allora passiamo adesso a parlare dell'ipersensibilità di tipo III. Anche in questo caso l'effettore
immunitario sono gli anticorpi IgG e IgM però la differenza con la reazione precedente è che gli
antigeni contro cui questi anticorpi sono diretti sono solubili, quindi portano alla formazione di
immunocomplessi solubili, circolanti, se l'immunocomplesso si è formato nella circolazione
sanguigna, e quindi il danno e il distretto interessato dal danno immunomediato è il luogo dove
questi immunocomplessi si vanno a fermare. La probabilità che gli immunocomplessi si vadano ad
accumulare nel nostro corpo non è uguale per tutti i distretti e i compartimenti, ci sono dei siti
preferiti, che sono quelli dove tipicamente troviamo le manifestazioni di ipersensibilità di tipo III.
Che sono le pareti dei vasi, l'ambiente sinoviale, le articolazioni e la membrana basale del
glomerulo renale. Quindi le manifestazioni cliniche che sono tipicamente scatenate da una reazione
di ipersensibilità di tipo III sono vasculiti, infiammazioni all'interno delle pareti dei vasi, artriti,
quindi infiammazioni delle articolazioni, e glomerulonefrtiti. Può dare una reazione sistemica
perché dicevo là dove gli immunocomplessi si formano in circolo ovviamente tutti i vasi di
qualunque distretto o tutte le articolazioni più o meno di qualunque parte del corpo possono essere
interessante. Quindi non è un tipo di reazione immunitaria che si focalizza in un organo a livello d i
un certo tipo cellulare perché non è il luogo di dov'è originario l'antigene che è importante ma dove
si va a fermare l'immunocomplesso, è quello che detta dove avviene il danno.
Allora per cominciare a parlare dei danni provocati dall'accumulo di immunocomplessi dobbiamo
un attimo focalizzare come mai normalmente gli immunocomplessi non si accumulino. Cioè quello
che voglio dire è che ogni volta che facciamo una risposta anticorpale contro qualunque antigene
patogeno col quale entriamo in contatto, si generano degli immunocomplessi solubili. Cioé fra gli
antigeni che noi vediamo di un microbo ci sono anche per esempio le sue tossine o prodotti che lui
rilascia, quindi noi nel fare anticorpi contro questi antigeni rilasciati dal microbo generiamo degli
immunocoplessi circolanti, normalmente, fisiologicamente. Allora, cosa succede, normalmente c'è
un sistema che è deputato alla rimozione degli immunocomplessi nel circolo, cioé noi abbiamo un
meccanismo proprio per evitare che gli immunocomplessi, che pure si formano, che si devono
formare, è il modo in cui gli anticorpi funzionano quello di legare un antigene, non si accumulino al
punto tale di provocare danno. E il meccanismo fondamentale per la rimozione degli
immunocomplessi si basa sul complemento, sull'attivazione del complemento. Cosa succede,
quando l'immunocomplesso si forma, quindi stiamo parlando di un immunocomplesso solubile fatto
da un singolo antigene, immaginiamo una proteina, una tossina di un patogeno e gli anticorpi che
noi abbiamo fabbricato contro questo antigene. Il legame dell'anticorpo all'antigene induce la
formazione di quello che chiamiamo immunocomplesso, se fatto da IgG e IgM, il legame
dell'anticorpo all'antigene scatena l'attivazione della via classica del complemento.
Durante l'attivazione della via classica del complemento si arriva alla generazione del c3b, cioé al
taglio del c3 in c3a e c3b, il c3b sappiamo che ha un legame covalente che si rompe e si riforma
immediatamente, e permette l'immobilizzazione diciamo del c3b nelle vicinanze
dell'immunocomplesso. Quindi gli immunocomplessi circolanti sono decorati di C3b, cioé hanno
particelle c3b appiccicate. Che si possono attaccare sull'immunoglobulina, sull'antigene, abbiamo
detto che il c3b non sceglie dove attaccarsi, la prima cosa che incontra è quella a cui si lega. Allora,
questi immunocomplessi decorati di c3b, possono essere legati dai globuli rossi che sono dotati di
un recettore CR1 che è uno dei 4 recettori per il c3b e per gli iniziali prodotti delle reazioni del c3b.
Quindi ogni quanto un immunocomplesso si forma, imemdiatamente scatena l'attivazione del
complemento, poi il complemento continua la sua strada, diciamo la cascata, però
l'immunocomplesso risulta diciamo marcato dalla presenza del c3b e globuli rossi circolanti
possono legare gli immunocomplessi. Ora ovviamente i globuli rossi non hanno la capacità di
distruggere, quindi di rimuovere, nel senso di degradare, di far sparire gli immunocomplessi, li
possono però legare e li cedono ai fagociti professionisti quando passano attraverso la milza e il
fegato. Quindi passaggio dei globuli rossi attraverso milza e fegato, e il contatto con i fagociti
residenti, chi sono i fagociti che stanno nel fegato? Le cellule di Kupfer nel fegato e i macrofagi
splenici. Comunque, permette la cessione dell'immunocomplesso dal globulo rosso al fagocita.
Fagocita che acchiappa l''immunocomplesso legandolo attraverso recettori per le FC, vi ricordo che
i fagociti professionisti hanno diversi recettori per le FC delle IgG e recettori per il c3b, e poi sono i
fagociti quelli che distruggono l'immunocomplesso. Ora, questo meccanismo quindi permette
continuamente di togliere di mezzo l'eccesso di immunocomplessi che si formano in circolo e,
questo meccanismo che si basa sui globuli rossi, ha un altro ruolo importante e cioé che dato che i
globuli rossi tendenzialmente scorrono al centro del vaso, il fatto che i globuli rossi attraverso il
CR1 siano capaci di legare gli immunocomplessi fa anche sì che gli immunocomplessi che si
generano in circolo normalmente sono tenuti lontani dall'endotelio. Ora questo perché è importante?
Perché la superficie delle cellule endoteliali e molto di più la membrana basale endoteliale che si
può essere scoperta da eventi per esempio di retrazione delle cellule endoteliali, è una situazione, un
sito in cui è molto facile che gli immunocomplessi per questioni di carica, per questioni chimiche si
vadano ad appiccicare. Quindi il ruolo importante che svolgono i globuli rossi non è soltanto di
prendere gli immunocomplessi dal circolo e di portarli attraverso la milza per la degradazione, ma
anche per tutto il tempo del circolo, di tenere gli immunocomplessi lontani dalla parete del vaso,
quindi minimizzare la probabilità che l'immunocomplesso si posso andare a legare o sulla superficie
della cellula endoteliale o ancora di più sulla membrana basale. Per esempio quand'è che si scopre
la membrana basale? Se immaginiamo, nelle prime fasi dell'infiammazione c'è il rilascio di
istamina, l'istamina provocando la retrazione delle cellule endoteliali, e la rottura delle giunzioni
strette, induce l'aumento di permeabilità del vaso, l'aumento del calibro, questo porta a un parziale
diciamo, si scopre parzialmente la membrana basale che per questioni di carica ha una grossa
capacità diciamo di far appiccicare gli immunocomplessi. Ora non solo ma immunocomplessi che si
formano in una qualunque risposta anticorpale, a seconda dell'abbondanza dell'antigene e degli
anticorpi prodotti, possono essere di grandezza e caratteristiche diverse. In particolare se
immaginiamo un qualunque antigene multivalente, cioé un antigene che presenti più e più epitopi e
che quindi possa legare contemporaneamente più anticorpi, quello che si osserva è che quando la
quantità di antigene e la quantità di anticorpi prodotti sono più o meno equivalenti, questo favorisce
la formazione di immunocomplessi ad alto peso molecolare in cui un anticorpo lega con i suoi due
siti combinatori lo stesso epitopo su due molecole di antigene diverse, e ogni antigene lega con i
suoi epitopi diverse molecole anticorpali. Questo porta alla formazione di una rete, di un
immunocomplesso diciamo a rete, che ha un peso molecolare più grande. Ora invece, quando la
situazione è quantitativamente squilibrata o perché abbiamo poco antigene rispetto agli anticorpi
circolanti, o al contrario quando abbiamo pochi anticorpi rispetto all'antigene presente questo
favorisce la formazione di immunocomplessi che sono nettamente più piccoli. Non solo ma nelle
due situazioni di squilibrio non solo si conta in entrambe le situazioni immunocomplessi piccoli, ma
immunocomplessi che sono qualitativamente diversi. Perché nella situazione in cui c'è poco
antigene rispetto agli anticorpi prodotti, gli immunocomplessi piccoli che si generano sono
propozionalmente più ricchi di anticorpo, quindi di regioni FC; nella situazione opposta, cioé
quando abbiamo pochi anticorpi rispetto alla quantità di antigene presente, si generano sempre
immunocomplessi piccoli, ma che oltre ad essere piccoli hanno un basso contenuto di FC. Allora
questo fa differenza, perché siccome ciò che induce l'attivazione del complemento e quindi mette in
moto il meccanismo che poi permette ai globuli rossi di portarsi dietro gli immunocomplessi
dipende dalle regioni FC degli anticorpi, vi ricordo che per attivare la via classica se stiamo
pensando a degli anticorpi di tipo IgG servono almeno due regioni FC vicine, che leghino due teste
globulari del C1q perché possa partire la via classica. Quindi ovviamente questi immunocomplessi
qui che si generano in presenza di tanto antigene e poco anticorpo non sono solo piccoli ma sono
anche quelli che più difficilmente attivano il complemento e quindi sono quelli più pericolosi nel
senso che sono quelli più difficili da smaltire. Cioé mentre gli immunocomplessi grandi possono
essere direttamente presi dai fagociti e degradati, gli immunocomplessi piccoli ma che attivano bene
il complemento vengono ben portati via dai globuli rossi, gli immunocomplessi più pericolosi nel
senso di pericolo diciamo di permanenza, sono quelli che sono piccoli ma che attivano male il
complemento. E quindi questo è solo per ripetere lo stesso concetto cioé la dipendenza non solo
dalla grandezza dell'immunocomplesso, ma anche dalla sua composizione, dalla suar icchezza di
FC immunocomplessi diversi vengono smaltiti più o meno efficacemente, quindi persistono nel
circolo, nel sistema, per tempi diversi. Allora, qual'è la situazione in cui si può avere un eccesso di
questi immunocomplessi piccoli e che attivano male il complemento cioé la situazione che può
favorire il loro accumulo e quindi lo scatenamento dell'ipersensibilità di tipo III? Allora ci sono due
tipi di situazioni, da una parte possiamo immaginare quelle situazioni in cui ci sia una produzione
bassa di anticorpi o almeno insufficiente, e una persistenza dell'antigene quindi se per motivi vari
abbiamo una continua presenza di antigene e abbiamo una risposta anticorpale debole, questa è una
situazione che favorisce la formazione e l'accumulo di immunocomplessi piccoli. Allora, quali sono
le situazioni che possiamo immaginare in cui abbiamo persistenza dell'antigene e debole risposta
anticorpale? Da una parte le infezioni croniche. Ovviamente se il patogeno è un patogeno di cui non
ci riusciamo a liberare, l'antigene del patogeno continuano a persistere nel nostro organismo e il
fatto che il patogeno sia presente cronicamente è indice di una risposta immunitaria probabilmente
insufficiente, che è stata insufficiente e che è tuttora insufficiente per eradicarlo. L'altra situazione
che può portare al quadro che dicevamo prima sono le malattie autoimmuni: per definizione gli
autoantigeni non spariscono mai, quindi quegli antigeni che sono presenti cronicamente sono
autoantigeni e uno non si può mai liberare di un autoantigene. Quindi in una situazione di una
risposta anticorpale contro un autoantigene probabile che si generi una situazione come quella che
dicevo prima, cioé tanto antigene e debole o comunque inferiore produzione di anticorpi. Un terzo
tipo di situazione è quello in cui si ha un'esposizione cronica per esempio per inalazione ad antigene
ambientale quindi non stiamo nel campo delle malattie autoimmuni qui stiamo parlando di una
risposta anticorpale contro antigeni estranei che entrano per inalazione e in cui l'esposizione cronica
favorisce, ovviamente questa volta non a livello circolare, m a livello degli alveoli polmonari, la
continua formazione di immunocomplessi. Ora oltre alle situazioni che dipendono da chi è
l'antigene e da che tipo di risposta anticorpale noi facciamo contro questo antigene, quali sono le
altre condizioni che favoriscono l'accumulo degli immunocomplessi e quindi lo scatenamento
dell'eventuale ipersensibilità di tipo III? Sono quei fattori da parte dell' ospite che possono rendere
meno efficiente il sistema di smaltimento. Quindi cosa possiamo avere? Accumulo di
immunocomplesso perché ne facciamo troppi per troppo tempo, situazioni di malattia autoimmuni,
infezioni cronica e quindi il sistema non ce la fa a smaltirli, oppure al contrario perché magari
abbiamo un difetto nel sistema di smaltimento, in entrambi i casi ci può essere diciamo un
accumulo. Allora difetti nel sistemi di smaltimento, possono essere difetti a livello genetico. Se
abbiamo detto che questo sistema di rimozione continua si fonda sull'attivazione del complemento,
sul ruolo che i globuli rossi tramite il recettore cr1 hanno per acchiappare gli immunocomplessi e
sui fagociti nella milza e nel fegato che devono ricevere questi immunocomplessi e degradarli, se ci
sono dei polimorfismi per esempio genetici a livello dei recettori per le FC delle IgG che modulano
la capacità di questi recettori di legare gli immunocomplessi o difetti che dipendono sempre da
variazioni genetiche nella produzione e quindi nella concentrazione dei primi componenti della via
classica, cioé quelli che servono per generare il c3b e quindi per rendere l'immunocomplesso
legabile dai globuli rossi; o polimorfismi a livello del cr1 cioé dei recettori che stanno sui globuli
rossi quindi polimorfismi che possono cambiare l'affinità con cui il cr1 lega il c3b, queste variazioni
possono avere un impatto una conseguenza sull'efficienza del sistema, quindi rendere il sistema che
normalmente deve eliminare questi immuncompmplessi meno efficace e a lungo andare in
corrispondenza con altre situazioni ambientali portare ad un accumulo.
Allora, se adesso abbiamo visto quali sono i motivi per cui una cosa che avviene normalmente, la
formazione di immunocomplessi circolanti, normalmente non porta a danno perché c'è un sistema
per smaltirli e quali possono essere alcune caratteristiche per cui il sistema non funziona, e che
quindi porta a un accumulo di questi immunocomplessi, vediamo adesso cos'è che detta, che regola
dove questi immunocomplessi si vanno ad accumulare, perché abbiamo detto che il danno ce
l'abbiamo là dove si fermano. Allora sono tanti i fattori che possono influenzare la capacità di un
immunocomplesso di andarsi a fermare da una parte piuttosto che da un'altra, che dipendono dalla
grandezza dell'immunocomplesso, dalla carica (anche dell'antigene per esempio che è diversa da
immunocomplesso a immunocomplesso), abbiamo detto che la capacità dell'antigene di fermarsi a
livello dei vasi dipende se per esempio è accessibile o meno la membrana basale quindi com'è lo
stato di vaso-permeabilità in quel momento perché l'esposizione della membrana basale è un fattore
che favorisce il deposito degli immunocomplessi, altri fattori che possono determinare dove gli
immunocomplessi circolanti si possono andare a fermare sono la turbolenza del flusso quindi
preferenzialmente la deposizione a livello dei vasi avviene nei punti dove c'è per esempio la
biforcazione delle arterie e dove c'è turbolenza nel flusso, e per esempio la pressione quindi la
deposizione a livello del glomerulo renale dipende dal fatto che quello è un sito da pressione
positiva ad alta pressione. Quindi sono tanti i fattori all'interno del circolo possono favorire il fatto
che un immunocomplesso si fermi in un luogo o in un altro. Allora nel momento in cui
l'immunocomplesso si ferma comunque a livello per esempio della parete di una vaso, il
meccanismo con cui scatena il danno ricorda molto quello che abbiamo visto principalmente
nell'ipersensibilità di tipo II per il danno provocato da anticorpi contro antigeni tissutali. Nel senso
che là dove l'immunocomplesso si ferma scatena l'attivazione del complemento, la cascata
complementare porta la generazione di cosa, dei frammenti proinfiammatori c3a c4a c5a che
inducono vaso permeabilità perché inducono la degranulazione dei mastociti e quindi di istamina,
l'aumento della vaso permeabilità porta a scoprire altra membrana basale e quindi a favorire l'arrivo
e la deposizione di altri immunocomplessi, il c5a induce il reclutamento e attivazione dei fagociti
quindi i macrofagi dal tessuto e neutrofili dal circolo, questo fagociti attivati che arrivano nel sito di
deposizione degli immunocomplessi incontrano l'immunocomplesso stesso quindi regione FC che
possono legare immunorecettori, incontrano il c3b perché hanno portato ad attivazione del
complemento e quindi si ha deposizione di c3b nelle vicinanze di dove l'immunocomplesso si è
fermato, si attivano, legano l'immunocomplesso, cercano di fare la fagocitosi ma non ci riescono
perché l'immunocomplesso è fissato sulla superficie dell'endotelio e sulla membrana basale e
quindi fanno la fagocitosi frustrata, rilasciano cioé enzimi proteolitici, metaboliti reattivi
dell'ossigeno e dell'azoto. Quindi il meccanismo di danno è un danno infiammatorio, la vasculite
che risulta dipende dalla distruzione del letto del vaso dovuta ai mediatori che vengono secreti,
prodotti dai fagociti attivati e in questo senso ricorda molto quello che abbiamo visto
nell'ipersensibilità di tipo II contro gli antigeni tissutali. Qual'è la differenza principale? E' che lì
l'attacco in un certo tessuto era dovuto al fatto che quel tessuto per esempio collagene di tipo IV
nella membrana basale del glomerulo, che in quel tessuto c'era l'autoantigene, quindi anticorpi che
poi provocano il danno si vanno a legare a quel tessuto e non ad un altro perché è lì che c'è
l'antigene; nell'ipersensibilità di tipo III il danno in un certo sito, per esempio la parete di un vaso in
un certo punto non è dovuto al fatto che lì si è espresso un autoantigene particolare , ma lì si sono
andati a fermare immunocomplessi circolanti.
Questo è quello che dobbiamo immaginarci avvenga all'interno di una vaso, che porta alla vasculite,
la formazione dell'immunocomplesso, l'attivazione del complemento, reclutamento e attivazione
dei neutrofili e dei macrofagi, rilascio dei prodotti tossici che danneggiano l'endotelio e portano a
scoprire la membrana basale che porta ad un ulteriore arrivo di altri immunocomplessi, il danno
all'endotelio del vaso può scatenare formazione di trombi quindi la coagulazione. In maniera un
pochino simile abbiamo detto che uno degli altri siti preferiti diciamo dove si ha preferibilmente
l'accumulo dell'immunocomplesso sono la parete del vaso a livello del glomerulo renale, la
membrana basale del glomerulo renale, dove gli immunocomplessi possono fermarsi per questioni
di carica, fisiche di pressione, e dove gli immunocomplessi si fermano o sulla membrana basale
dell'endotelio o quelli più piccoli possono addirittura attraversare la membrana basale dell'endotelio
e andarsi a fermare dall'altra lato all'interno del glomerulo renale. Anche qui danno a livello della
membrana basale del glomerulo avviene per i mecanismi che l'immunocomplesso scatena cioé
attivazione del complemente e induzione delle anafilotossine, arrivo ed attivazione dei fagociti
macrofagi e neutrofili che distruggono attraverso il contenuto dei loro granuli e i loro apparati
enzimatici. E di fatto praticamente quasi tutte le glomerulonefriti, quindi infiammazione a livello
del glomerulo renale, sono di natura immunitaria, cioé dipendono dal fatto, diciamo da
immunocomplessi che si fermano a livello del glomerulo renale e scatenano l'infiammazione che
danneggia il glomerulo. Un tipo di malattia che dipende da meccanismi di ipersensibilità di tipo III
è quella detta malattia da siero. Un pò ci ricollega alla lezione dell'altra volta che è una
manifestazione patologica che può colpire per esempio gli individui che sono stati trattati con la
vaccinazione passiva. Abbiamo detto che la vaccinazione passiva è il trasferimento di effettori
immunologici, tipicamente anticorpi, da un individuo all'altro, quindi conferisce immunità al
ricevente perché gli diamo direttamente gli anticorpi diretti contro un certo batterio o una certa
tossina. Questa è una pratica che era molto più diffusa prima di quanto non sia adesso e uno dei
rischi di questa pratica è appunto la malattia da siero perché la fonte principale di queste
immunoglobuline che venivano usate per questa immunizzazione passiva erano immunoglobuline
di un'altra specie per esempio del cavallo. Quindi ovviamente nel momento in cui l'individuo riceve
l'immunoglobulina del cavallo essendo le immunoglobuline del cavallo un antigene estraneo può
indurre una risposta anticorpale contro le proteine sieriche del cavallo. E quindi questo ovviamente
non crea problemi alla prima immunizzazione passiva ma se uno per sua sfortuna ha bisogno di
questo trattamento più di una volta perché incontra diciamo la stessa vipera più di una volta quello
che succede è che all'inoculazione successiva l'inoculazione delle immungolobuline di cavallo,
quindi delle proteine plasmatiche del cavallo in un individuo immunizzato, induce la brusca e
massiccia formazione di immunocomplessi. Cioé l'individuo ha gli anticorpi per le proteine di
cavallo, se io inoculo proteine del cavallo immediatamente nel circolo di questo individuo si forma
una quantità enorme di immunocomplessi dovuti al fatto che ho dato tanto antigene in un individuo
che aveva gli anticorpi.
Allora in questo caso scateno un'infiammazione che colpisce tipicamente le articolazioni, la sinovia
è il terzo diciamo distretto in cui avviene preferenzialmente l'accumulo e la deposizione degli
immunocomplessi, quindi artrite, glomerulonefriti e vasculiti che intervengono per questa massiccia
formazione di immunocomplessi, in questo caso non c'è un difetto genetico nell'individuo è
semplicemente che il sistema si trova temporaneamente sovraccaricato, cioé ci sono più
immunocomplessi di quanto il sistema non possa gestire e infatti la malattia del siero è una malattia
transiente cioé le manifestazioni scompaiono a mano a mano che l'antigene diminuisce per il suo
catabolismo, viene perso dal circolo e mano a mano che il sistema di smaltimento riesce a togliere
di mezzo gli immunocomplessi che si sono formati. Quindi le manifestazioni avvengono proprio
nella fase centrale di picco in cui c'è un sovraccarico enorme nella formazione contentemporanea di
tantissimi immunocomplessi dovuti all'introduzione dell'antigene. Reazione di ipersensibilità di tipo
III fino ad adesso le abbiamo viste proprio nelle reazioni sistemiche cioé in cui il luogo in cui gli
immunocomplessi si formavano era il circolo e quindi il danno colpiva quei distretti dove questi
immunocomplessi si vanno a fermare. Ora però esistono delle malattie che dipendono da reazioni
di ipersensibilità di tipo III che avvengono a livello dei tessuti cioé dove l'antigene che scatena la
reazione viene introdotto a livello del tessuto. Con un meccanismo assolutamente simile. Vi ricordo
che nelle IgG la ragione per cui si può avere una reazione di ipersensibilità di tipo III non
necessariamente in circolo ma anche in un tessuto dipende dal fatto che le IgG sono in grado di
passare, di uscire dal circolo e quindi sono presenti anche nel tessuto interstiziale. Quindi
l'individuo immune, che cioé ha gli anticorpi contro un certo antigene e che ha anticorpi IgG, questi
anticorpi non sono soltanto in circolo ma anche nei tessuti. Se viene introdotto l'antigene all'interno
del tessuto si ha la formazione degli immunocomplessi nel tessuto e se per ragioni varie che
abbiamo visto prima il sistema di smaltimento che in questo caso ovviamente non si può fondare sui
globuli rossi che nel tessuto non ci stanno ma si deve fondare sui fagociti e sui macrofagi che
devono acchiappare gli immunocomplessi e distruggerli, se il sistema non ce la fa a smaltire gli
immunocomplessi, questi immunocomplessi scatenando l'attivazione del complemento, inducendo
quindi l'arrivo di fagociti attivati, la degranulazione dei mastociti e l'aumento quindi gli effetti sui
vasi che irrorano il tessuto, induce una reazione, un danno tissutale a livello del tessuto. In questo
caso la reazione è tissutale perché il sito di inoculazione dell'antigene è a livello del tessuto, questo
può avvenire a livello della pelle od oppure in malattie come la polmonite del contadino, si può
avere a livello degli alveoli polmonari in individui che sono stati cronicamente stimolati con
l'antigene, in questo caso per esempio ad antigeni inalati come ad esempio spore fungine che quindi
hanno montato una risposta IgG potente contro questi antigeni. Se continuano a trovarsi un
ambiente esposto e continuano ad inalare l'antigene, questo passa a livello degli alveoli polmonari,
trova le IgG, forma gli immunocomplessi, gli immunocomplessi inducono l'attivazione del
complemento e dei fagociti, prima di quelli residenti quindi i macrofagi alveolari che trovano
l'immunocomplesso, legano quindi l'immunocomplesso attraverso recettori per le FC e recettori per
le c3b, produzione di citochine cinfiammatorie che portano al reclutamento di altre cellule
infiammatorie del circolo che arrivano a livello dell'alveolo che attivandosi e trovandosi tutte le
condizioni per attivarsi cioé: gli immunocomplessi, le anafilotossine e le citochine
profinfiammatorie, rilasciano il contenuto dei granuli e danneggiano il tessuto.
Allora, questo è solo per dire che si può dosare la presenza di immunocomplessi e quindi l'eventuale
accumulo di immunocomplessi in circolo attraverso un test in vitro radio immune assay sfruttando
diciamo un reagente naturale che ha una fortissima affinità per gli immunocomplessi che è il c1q.
Se noi abbiamo del c1q immmobilizzato su una superficie solida e lo incubiamo con il siero
dell'individuo di cui dobbiamo capire se ha un'alterata capacità di smaltire gli immunocomplessi,
eventuali immunocomplessi in circolo verranno trattenuti dal c1q che è immobilizzato sulla piastra
e noi potremo mettere in evidenza la presenza di questi immunocomplessi e anche quantificarli
svelandoli, diciamo, rivelandoli attraverso un reagente per esempio un'immonuglobulina anti
immunoglobulina umane che sia collegata ad un isotopo radioattivo, una sostanza che emetta luce,
qualunque cosa che sia diciamo misurabile. In questo modo possiamo quantificare la presenza di
immunocomplessi nel siero dell'individuo. Ora, anche per quello che riguarda le reazioni di
ipersensibilità di tipo III che dipendono quindi dall'accumulo di immunocomplessi, sono tanti gli
antigeni che possono scatenare questo tipo di reazione, abbiamo detto che l'unico requisito è che
siano antigeni solubili, che quindi portino alla formazione di immunocomplessi circolanti e quindi
abbiamo quelle reazioni per esempio di ipersensibilità di tipo III alla penicillina, di nuovo, sempre
con il meccanismo che abbiamo visto prima: alcuni farmaci in particolare la penicillina possono
modificare gli antigeni self. Nel caso che abbiamo invocato prima gli antigeni self modificati erano
antigeni di superficie delle cellule, ma la penicillina può modificare anche autoantigeni plasmatici e
in questo modo può indurre la produzione di autoanticorpi contro le proteine solubili e quindi nel
momento in cui l'individuo è ri-sottoposto, riviene al contatto con il farmaco questi anticorpi
prodotti si legano agli autoantigeni modificato e gli immunocomplessi andandosi a depositare nei
distretti che abbiamo detto possono indurre danno tissutale. Si possono avere reazioni di
ipersensibilità di tipo III quindi vasculiti, glomerulonefriti, artriti post infettive cioé dovute a tutta
una serie di patogeni tipicamente molti di questi sono patogeni cronici che danno infezioni croniche
e che quindi favoriscono l'accumulo degli immunocomplessi per uno di quei meccanismi che
abbiamo detto prima, cioé la continua presenza di antigene in un individuo che fa una risposta
anticorpale debole tant'è vero che non riesce a eradicare il patogeno, questo può portare a
un'eccessiva produzione di immunocomplessi che il sistema ha difficoltà a smaltire e quindi si può
avere in concomitanza con queste infezioni di nuovo glomerulonefrite oppure artrite. E poi il
meccanismo di ipersensibilità di tipo III è alla base anche di malattie autoimmuni, cioé malattie in
cui si ha produzione di autoanticorpi diretti contro autoantigeni solubili e il danno in questa risposta
immunitaria errata si localizza a livello del glomerulo renale, dei vasi, principalmente delle
articolazioni e le malattie diciamo che più chiaramente mostrano questo tipo di meccanismo alla
base sono il LES e l'artrite reumatoide. L'artrite reumatoide in particolare è una malattia che ha
recentemente cambiato classificazione. Fino a pochi anni fa era considerata essenzialmente una
malattia da immunocomplessi, è un'artrite quindi si ha un danno a livello delle articolazioni e si
pensava fino ad alcuni anni fa che il danno fosse essenzialmente dovuto ai meccanismi che ho detto
sino adesso quindi i meccanismi scatenati dall'accumulo degli immunocomplessi a livello delle
sinovie. Quello che si è ormai visto chiaramente è che c'è un grosso contributo anche di
un'attivazione impropria di una popolazione di linfociti T che con le loro citochine mettonono in
moto, attivano i macrofagi e le cellule del tessuto e quindi l'artrite reumatoide è ormai vista come
una malattia autoimmune che dipende sì da meccanismi di ipersensibilità di tipo III ma anche da
meccanismi di ipersensiblità di tipo IV. Ovviamente la realtà diciamo, noi tendiamo a classificare le
cose come esempi di una cosa o dell'altra ma probabilmente molte delle malattie che abbiamo
semplicisticamente assegnato a uno o all'altro dei meccanismi di danno immunomediato dipendono
invece dalla partecipazione di meccanismi diversi. Così come le risposte immunitarie protettive non
dipendono mai solo dagli anticorpi o dai linfociti T citotossici, anche le risposte aberranti sono
probabilmente quasi sempre la cooperazione di meccanismi immunologici differenti.
Simone Lo Baido – Alessandro Caioli



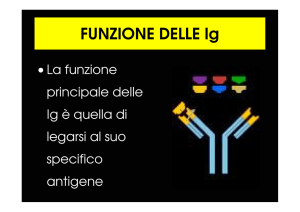


![MANCA LA PRIMA PARTE [IN ATTESA DI MARCHESINHO] [cical](http://s1.studylibit.com/store/data/000089912_1-3149b4229dde4d130c370bb4e7c60117-300x300.png)