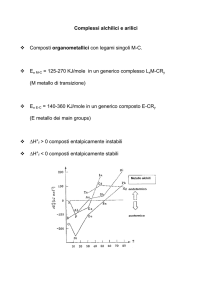
Complessi carbenici
¾ i complessi carbenici sono complessi in cui un gruppo :CR2 è coordinato
ad un metallo.
¾ la reattività dei complessi carbenici, LnMCR2 , dipende dalla natura del
legame M-C , che a sua volta dipende dalla natura dei sostituenti sul
carbene ( R), del metallo (M) e degli altri leganti nel complesso (L).
¾ i complessi carbenici vengono classificati, in base al carattere del carbonio
carbenico, in due principali categorie:
elettrofilo (carbeni di Fischer), nucleofilo (carbeni di Schrock)
♦ il carbonio carbenico dei leganti “liberi” ha carattere elettrofilo quando i
sostituenti R sono molto elettronegativi (es. :CF2), mentre ha carattere
nucleofilo quando i sostituenti sono meno elettronegativi (es. :CH2).
Complessi carbenici di tipo Fischer
(Complessi eterocarbenici)
¾ l’atomo di carbonio carbenico elettrofilo è polarizzato positivamente
Mδ-⎯ Cδ+ , (forma a):
(a)
(b)
(c)
¾ i leganti L sono buoni π-accettori (es. CO)
¾ il metallo è in basso stato di ossidazione formale
¾ almeno un sostituente sul carbonio carbenico è un buon π-donatore (es. F,
Cl, OR, NR2), ossia possiede doppietti disponibili per legami π-dativi
(forme b o c)
per il conteggio elettronico il legante carbenico di Fischer viene
considerato neutro :CR2 (donatore di 2e-) (modello covalente) oppure
ionico [CR2]+ (donatore di 1e-) (modello ionico)
in genere i complessi carbenici di Fischer hanno 18e- di valenza
Schema di legame M-CXY (X=R, Y=OR)
C sp2 ⇒ 2 orbitali (2e-) per le interazioni σ con i gruppi X e Y
⇒ 1 orbitale (2e-) per la donazione σ al M
Cp
⇒ 1 orbitale (vuoto) per l’interazione π con Y
donazione Y → C (forte)
retrodonazione M → C (debole)
la deficienza elettronica sul carbonio carbenico, dovuta alla donazione σ al
M , viene compensata dalla donazione π da parte del sostituente Y e non
dalla retrodonazione π da parte del metallo M.
a causa della differente stabilità tra gli orbitali (pieni) dxz o dyz del M e
l’orbitale (vuoto) pz del C, la coppia elettronica dell’interazione π M-C
rimane prevalentemente sul M.
Legame M-C
da raggi X: il legame M-C è leggermente più corto di un legame
singolo ma è ben più lungo di un legame doppio.
da NMR: la barriera energetica alla rotazione del gruppo –CXY
intorno all’asse di legame M-C è piccola.
Legame C-X
da raggi X: il legame C-X e/o C-Y è intermedio tra legame singolo e
legame doppio.
da NMR: la barriera energetica alla rotazione del gruppo X o Y
intorno all’asse di legame C-X o C-Y è rilevante.
Legame M-L
da raggi X: il legame M-L è molto più corto di un legame singolo
(buona retrodonazione π M→L).
Struttura molecolare di [CrC(OEt)(NMe2)(CO)5]
¾ gli atomi Cr , C , O , N sono coplanari e gli angoli α = 126°, β = 128°, γ =
105° indicano una ibridizzazione C sp2.
¾ le distanze dC-O (C sp2) = 1,35 Å e dC-N (C sp2) = 1,33 Å sono più corte di
quelle attese per un legame singolo (dC-O (C sp2) = 1,41 Å ; dC-N (C sp2) =
1,45 Å).
Metodi di sintesi
1) attacco di un nucleofilo sul carbonio di un legante carbonilico, seguito dall’
attacco di un elettrofilo sull’ossigeno del legante carbonilico (sintesi di
Fischer):
-
[W(CO)6] + CH3
→
[W{C(=O)CH3}(CO)5]-
↔
[W{=C(O)CH3}(CO)5]-
[W{=C(O)CH3}(CO)5]- + (CH3)3O+ → [W{=C(OCH3)CH3}(CO)5] + (CH3)2O
2) alchilazione sull’ossigeno di un complesso acilico:
[Re{C(=O)R}L3] + CH3+ → [Re{=C(OCH3)R}L3]+
Reattività generale dei carbeni di Fischer
1) attacco di nucleofili sul C carbenico.
2) attacco di elettrofili sul M.
3) attacco di elettrofili sull’eteroatomo X (es. O, N).
4) quando Y è un gruppo alchilico, gli idrogeno in α al C carbenico hanno
carattere debolmente acido e quindi sono soggetti ad attacco basico.
Complessi carbenici di tipo Arduengo
(Complessi carbenici N-eterociclici)
¾ sono un caso particolare dei complessi carbenici di Fischer
¾ i leganti sono gli NHCs (N-heterocyclic carbenes):
Schema di legame M-CNN
C sp2 ⇒ 2 orbitali (2e-) per le interazioni σ con gli atomi N
⇒ 1 orbitale (2e-) per la donazione σ al M
Cp
⇒ 1 orbitale (vuoto) per le interazioni π con N
donazione N → C (forte)
retrodonazione M → C (debole)
Complessi carbenici di tipo Schrock
(Complessi alchilidenici)
¾ l’atomo di carbonio carbenico nucleofilo è polarizzato negativamente
Mδ+⎯ Cδ- , (forma e):
(d)
(e)
¾ i leganti L sono buoni σ- e/o π-donatori (es. Cl , Cp, alchili)
¾ il metallo è in alto stato di ossidazione formale
¾ i sostituenti R sul carbonio carbenico non sono π-donatori (es. H, CH3)
ossia non possiedono doppietti disponibili per legami π-dativi
per il conteggio elettronico il legante carbenico di Schrock viene
considerato neutro :CR2 (donatore di 2e-) (modello covalente) oppure
ionico [CR2]2- (donatore di 4e-) (modello ionico)
in genere i complessi carbenici di Schrock hanno 10-16e- di valenza
Schema di legame M-CR2 (R=H)
C sp2 ⇒ 2 orbitali (2e-) per le interazioni σ con i gruppi R
⇒ 1 orbitale (1e-) per l’interazione σ con M
Cp
⇒ 1 orbitale (1e-) per l’interazione π con M
la deficienza elettronica sul metallo viene compensata dalla donazione da
parte degli altri leganti e da eventuali interazioni agostiche.
a causa della differente stabilità tra gli orbitali dxz o dyz del M e l’orbitale pz
del C, la coppia elettronica dell’interazione π M-C si trasferisce
prevalentemente sul C.
Legame M-C
da raggi X: il legame M-C è nettamente più corto di un legame
singolo.
da NMR: la barriera energetica alla rotazione del gruppo –CXY
intorno all’asse di legame M-C è rilevante.
¾ In tal caso il legante carbenico è un carbanione stabilizzato,
analogamente a quanto osservato nei metilenfosfani (fosforilidi,
reagente di Wittig) :
Ph3P=CH2
↔
Ph3P+⎯ CH2-
Struttura molecolare di [Ta=CH2(CH3)(η5-Cp)2]
(18e- di valenza)
¾ la distanza dTa-CH3 = 2,24 Å è più lunga della distanza dTa-CH2 = 2,03 Å
Struttura molecolare di [Ta=CHC(CH3)3Cl3(PMe3)]
(12e- di valenza)
¾ l’angolo HCCHTa = 84° indica una forte interazione agostica Ta—HCH.
Metodi di sintesi
1) deprotonazione di un legante alchilico (sintesi di Schrock):
[Ta(CH3)2(η5-Cp)2]+ + RO-
→
[Ta(=CH2)(CH3)(η5-Cp)2] + ROH
2) intercettazione di carbeni generati “in situ” dal diazometano:
[OsCl(NO)L3] + CH2N2 → [Os(=CH2)Cl(NO)L2] + N2 + L
CH2=N(+)=N(-)
→
CH2 +
N2
Reattività generale dei carbeni di Schrock
1) attacco di elettrofili sul C carbenico.
2) attacco di nucleofili sul M.
3) attacco acido sugli atomi di idrogeno presenti sul C in α al C carbenico.
Complessi con leganti carbenoidi
¾ i leganti carbenoidi (gruppi 13,14,15) sono specie a 6e- di valenza che
recano un doppietto elettronico di non legame.
¾ in molti casi sono frammenti instabili, tuttavia, coordinati ad opportuni
metalli e con sostituenti aventi determinate caratteristiche steriche ed
elettroniche, acquistano una dicreta stabilità.