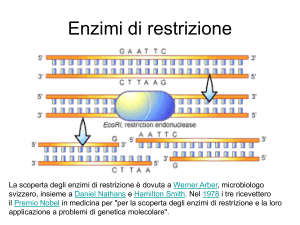
NEXT-­GENERATION DNA SEQUENCING Introduzione Fino a pochi anni fa i metodi utilizzati per il sequenziamento si basavano sul metodo di Sanger, il quale però risulta avere notevoli svantaggi soprattutto per quanto riguarda la necessità di utilizzare gel per la corsa elettroforetica dei frammenti, il basso numero di campioni analizzabile in parallelo e la difficoltà di automatizzazione del processo. Numerosi sforzi sono stati fatti per risolvere queste problematiche. Oggi le tre piattaforme di sequenziamento di nuova generazione che stanno avendo maggiore impatto sul mondo scientifico sono il 454 della Roche, il Solexa dell’Illumina ed il Solid dell’Applied Biosystem. Rispetto alle tecniche basate sul metodo di Sanger, queste nuove tecniche di sequenziamento sono caratterizzate da una più alta velocità ed elevate prestazioni che permettono di ridurre drasticamente i tempi ed i costi di sequenziamento. Inoltre, con questi nuovi sistemi è possibile ottenere sequenze da singoli frammenti di DNA o da frammenti amplificati mediante PCR aggirando la necessità di effettuare il clonaggio in sistemi batterici, un procedimento che sarebbe più lungo e problematico. Nonostante la minore lunghezza dei frammenti analizzati, la possibilità di effettuare un gran numero di letture in parallelo permette di ottenere in poco tempo una grande mole di dati; è infatti necessario il ricorso ad avanzati sistemi bioinformatici per la gestione dell’informazione ottenuta dal sequenziamento. 454 GenomeSequencer FLX Instrument (Roche Applied Science) Questo rappresenta il primo modello di nuova generazione introdotto nel mercato nel 2005. Il metodo consiste in: 1. Preparazione della libreria di DNA Il materiale di partenza che si vuole sequenziare può essere costituito da DNA genomico, da prodotti PCR, o cDNA. Il DNA genomico di grandi dimensioni viene frammentato mediante nebulizzazione in pezzi da 300/500bp. Per i frammenti di piccole dimensioni come i prodotti di PCR e small RNA non è necessaria la frammentazione. Non si effettua il clonaggio e il colony picking Vengono aggiunti e ligati due diversi piccoli adattatori a doppio filamento alle estremita 5’ e 3’ del DNA frammentato. L’adattatore B (in rosso nella figura) contiene Biotina al 5’ che permette il legame del DNA alle palline rivestite di streptavidina. Dalla reazione di ligazione si possono generare 3 diverse popolazioni di frammenti: A\B che si legano alla biglia con un solo filamento B\B si legano con tutti e due i filamenti A\A non si legano perché mancano di biotina e vengono persi con il lavaggio. Si effettua la selezione dei frammenti A/B tramite purificazione con la streptavidina Dopo denaturazione si ottiene il rilascio dei filamenti non biotinilati che serviranno da templati per la libreria (sstDNA) Gli adattatori verranno usati come annealing sia per i primers di amplificazione che per per quello di sequenziamento 2. PCR in Emulsione La libreria di single strand DNA funge da templato per la PCR in emulsione; questa permette di amplificare all’interno della stessa provetta ma in maniera fisicamente separata una grande quantità di frammenti di DNA. Per Questo passaggio vengono utilizzate apposite biglie sulla cui superficie sono presenti sequenze oligonucleotidiche complementari all’adattatore B dei single strand. I frammenti della libreria vengono mescolati con un eccesso di biglie in modo tale che ogni biglia si legherà ad un solo frammento di sstDNA. L’emulsione viene creata mescolando opportunamente la mix di PCR con olio minerale; si creano così delle micelle di pochi µl di mix di PCR in emulsione nell’olio: ogni micella contenente una biglia si comporta da micro reattore. Alla fine sulla superficie della biglia saranno presenti fino a 10 milioni di copie del frammento. Cosi facendo si può ottenere l’amplificazione di uno specifico frammento senza la necessità di effettuare clonaggio in batteri, infatti l’intera collezione di frammenti viene amplificata contemporaneamente in una stessa provetta. Successivamente saranno purificate tutte le biglie “produttive” ovvero quelle che effettivamente hanno legato il frammento di sstDNA e che sono andate incontro ad amplificazione 3. Reazione di Sequenziamento Le biglie vengono deposte in una piastra Pico Titer costituita da circa 1,6 milioni di pozzetti che hanno un diametro tale da poter accomodare un’unica biglia. A questo punto viene aggiunta la DNA polimerasi ed altre sferette di dimensioni minori a cui sono legati covalentemente gli enzimi responsabili della reazione di pirosequenziamento. Dopo aver caricato le biglie ed i reagenti nella PTP(Pico Titer Plate), questa viene posizionata nello strumento di fronte ad una fotocamera ad alta risoluzione (CCD Camera). Nello stumento è presente una camera di flusso che fa fluire i deossinucleotidi (dATP, dCTP, dGTP, dTTP) perpendicolarmente ai pozzetti della PTP, sequenzialmente in ordine prefissato (TACG). Ogni qualvolta avviene l’incorporazione di un nucleotide in un pozzetto si ha un emissione luminosa che passa attraverso il fondo dei pozzetti e viene catturata dalla CCD camera. Le reazioni che avvengono in ogni pozzetto della PTP vengono rilevate e registrate in continuo ed in contemporanea per tutti i pozzetti. Ciascun flusso (passaggio di un nucleotide) viene quindi tradotto in immagine. L’analisi delle immagini associata all’ordine dei flussi permette di costruire il fluogramma di ciascun pozzetto. In altre parole, durante il flusso di T, ci sono pozzetti in cui la T, risultando complementare, viene incorporata; di conseguenza la reazione di pirosequenziamento emetterà una luce che viene registrata dalla CCD camera. A questo seguirà il flusso di A, C e G che generano a loro volta le rispettive immagini. Infine, ll software elabora tutte le immagini e converte i dati grezzi in un fluogramma in cui l’intensità della luce emessa è proporzionale al numero di nucleotidi incorporati. Illumina (SOLEXA) genome analyzer Questo sistema prevede come per il 454 della Roche la frammentazione del DNA da sequenziare. Alle 2 estremità vengono legati adattatori che ne permettono l’ancoraggio ad una superficie piana fungendo così da sito di legame per i primer della PCR. L’amplificazione dei frammenti viene effettuata mediante bridge PCR. Vengono cosi generati dei cluster contenenti circa 1000 copie dello stesso frammento da sequenziare (chiamati DNA polonies). L’amplificazione mediante bridge PCR, come nel caso della PCR in emulsione per la 454 della Roche, è necessaria per rendere il segnale abbastanza forte da poter essere catturato dalla CCD Camera. La Mix di reazione per il sequenziamento e la polimerizzazione viene depositata sulla superficie del supporto e contiene: primers, 4 nucleotidi marcati rispettivamente con 4 fluorofori in grado di interrompere temporaneamente la polimerizzazione e la DNA polimerasi. Una volta incorporato il nucleotide avviene la lettura; successivamente viene eliminato il fluoroforo ed il gruppo terminatore al 3’ (che impedisce l’attacco di un altro nucleotide) e il ciclo si ripete. Questo sistema è in grado raggiungere letture di circa 35 nucleotidi. 1. Preparazione della libreria 2. Bridge PCR 3. Sequenziamento ABI SOLiD System In questo sistema, come per il 454 della Roche, ai frammenti da sequenziare sono legati degli adattatori necessari per il legame alle biglie. I frammenti vengono successivamente amplificati mediante PCR in emulsione. Dopo la denaturazione le biglie vengono depositate su di un suppotrto di vetro. Nel primo step il primer si ibridizza con la sequenza adattatrice, successivamente viene aggiunta la Mix contenente ottameri di DNA che si ibridizzano al frammento di DNA stampo che vengono legati per aggiunta di una ligasi. Questi ottameri sono caratterizzati da un doppietto di basi noto, ognuno accoppiato ad un fluoroforo. Dopo la rivelazione della marcatura si ha la determinazione della sequenza di 2 delle 8 basi appaiate. All’ottamero ligato vengono rimosse le ultime tre basi e quindi rimossa anche la marcatura. Il ciclo di Ibridizzazione e taglio si ripete permettendo la determinazione delle successive 2 basi note del seguente ottamero in sequenza. Quindi ad ogni ciclo si potranno sequenziare solamente 2 basi su 5. Per ottenere la sequenza completa e necessario ripetere il ciclo di sequenziamento utilizzando anche primers più corti. La lettura può arrivare fino a circa 35 nucleotidi. Questo sistema permette di minimizzare ulteriormente errori nella lettura della sequenza. Heliscope Questo sistema, differentemente da tutti gli altri, permette di effettuare il sequenziamento senza la necessità di amplificare il frammento della libreria. Funziona sfruttando un sistema di rivelazione del segnale fluorescente altamente sensibile in grado di riconoscere l’incorporazione del nucleotide in un unico frammento non amplificato. Evitando l’amplificazione del frammento che potrebbe alterare la sequenza originale (per l’incorporazione di nucleotidi scorretti) questo sistema garantisce una maggiore affidabilità di lettura. I frammenti da sequenziare sono legati a code di poly-­‐A che si legano sul supporto solido mediante ibridizzazione con poly-­‐T. Il sequenziamento avviene in modo asincrono per i differenti frammenti, in maniera simile al sistema della 454 in cui i nucleotidi vengono aggiunti a rotazione. Tutti i nucleotidi sono marcati con un unico fluoroforo (Cy3)che puo essere eliminato dopo l’incorporazione, ad ogni ciclo viene aggiunto il nucleotide marcato e viene effettuata la lettura. Poi, una volta eliminato il fluoroforo si ripete il ciclo con gli altri nucleotidi. Conclusioni I sistemi di sequenziamento di nuova generazione hanno le potenzialità di accelerare notevolmente la ricerca biologica e biomedica, rendendo possibile una più approfondita analisi di genomi, trascrittomi e delle sequenze di interazione tra DNA e proteine. Queste nuove tecniche hanno il vantaggio di ridurre costi e tempi, ma soprattutto di ottenere grandi quantità di informazioni con un unico ciclo di sequenziamento. A questo, però, segue la necessità di sviluppare algoritmi bioinformatica avanzati per gestire la grande mole di dati e permetterne una più immediata analisi ed interpretazione biologica. Bibliografia N Biotechnol. 2009 Apr;25(4):195-203. Epub 2009 Feb 3.
Next-generation DNA sequencing techniques.
Ansorge WJ.
Nat Biotechnol. 2008 Oct;26(10):1135-­‐45.
Next-generation DNA sequencing.
Shendure J, Ji H.