Q
U
Per la spiegazione delle schede e le abbreviazioni, cliccare Q
QU
UIII
Q
U
QU
UIII
Per il glossario, cliccare Q
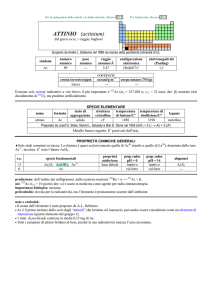
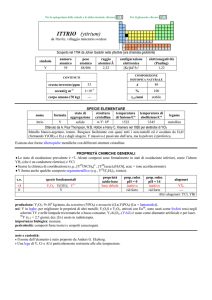
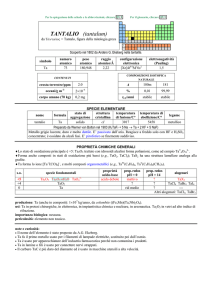
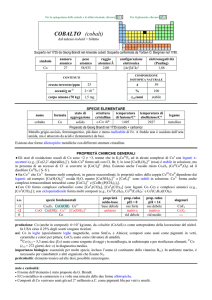
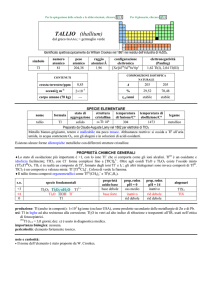
AFNIO (hafnium)
dal latino Hafnia = Copenhagen
*
**
*
**
Scoperto a Copenhagen nel 1923 nello zircone mediante spettroscopia a raggi X da Dirk Coster e György Hevesy (ungherese,
comunemente citato come Georg K.von Hevesy o George C. de Hevesy).
numero
atomico
72
simbolo
Hf
peso
atomico
178,49
raggio
atomico/�
2,23
CONTENUTI
crosta terrestre/ppm
oceani/g m
3
elettronegatività
(Pauling)
1,3
COMPOSIZIONE ISOTOPICA NATURALE
3,0
7×10
corpo umano (70 kg)
configurazione
elettronica
[Xe]4f145d26s2
A
6
0,16
2,0×1015
t1/2/anni
decadimento
��
formula
afnio
Hf
176
177
178
179
180
5,26
18,60
27,28
13,62
35,08
stabile
stabile
stabile
stabile
stabile
%
---
nome
174
SPECIE ELEMENTARE
stato di
struttura
temperatura
aggregazione cristallina di fusione/C°
�-Hf: hP
solido
2233
temperatura di
ebollizione/C°
4603
legame
metallico
Preparato da Anton E. van Arkel e Jan H. de Boer nel 1925 (HfI 4 + W � Hf + WI4)
Metallo bianco-argenteo, duttile, moderatamente duro. Resiste alla corrosione perché passivato, ma è
attaccato da HF e dagli alogeni. E piroforico se finemente suddiviso.
Esistono due forme allotropiche metalliche con differenti strutture cristalline.
PROPRIETÀ CHIMICHE GENERALI
�Lo stato di ossidazione principale è +4, la cui chimica è praticamente uguale a quella di ZrIV; i composti solubili sono pochi.
Hf III riduce H2O e quindi non ha una chimica in soluzione.
�HfIV forma complessi ad alto numero di coordinazione, come [Hf F 7]3 e [Hf F 8]4.
�HfIV forma composti ciclopentadienilici, come Hf ( C5H5)4 e Hf ( C5H5)2X2 (X = alogeno).
s.o.
specie fondamentali
+4
0
HfO2 HfO2·nH2O Hf4+
Hf
proprietà
acido-base
base debole
prop. redox
pH = 0
inattivo
rid forte
prop. redox
alogenuri
pH = 14
inattivo
HfX4
rid forte
--Altri alogenuri: HfCl3, HfBr3, HfI3
produzione: prodotto secondario della metallurgia di Zr; la disponibilità (8�104 kg/anno nellemisfero occidentale) supera la
domanda [20].
usi: Hf in leghe ed in ceramiche resistenti alle alte temperature. HfO2 è usato in elettronica.
importanza biologica: nessuna.
pericolosità: bassa tossicità.
note e curiosità:
� Il nome dellelemento è stato proposto da D. Coster e G. Hevesy.
� Hf ha lo stesso raggio atomico di Zr, nonostante che abbia 32 elettroni in più.
� La maggior parte dellafnio prodotto è usato nei motori dei sottomarini nucleari.
� Il carburo di tantalio e afnio (Ta4HfC5) ha la più alta temperatura di fusione (4215 °C) di tutti i composti noti.