Corso di Fisica per il CdS in Scienze Biologiche – IV esonero 25 Maggio 2012
A.A. 2011/2012 – Prof.ssa Maria Pia De Pascale [A-L] e Prof.ssa Annalisa D’Angelo[M-Z]
A-L
M-Z BCM ECO BU
Cognome e Nome: _________________________________________
E1) In una massa di acqua m=250g, inizialmente alla temperatura di 20 C, vengono immessi tre cubetti di
ghiaccio, ciascuno di massa pari a 40g, provenienti dal freezer, inizialmente alla temperatura di -15C.
A)Calcolare la temperatura finale dell’acqua e del ghiaccio, quando raggiungono l’equilibrio termico.
(=80 cal/g ; cghiacccio=0,53 cal/gK, cacqua=1 cal/gK)
B) Nelle condizioni di equilibrio termico, quali sono le masse finali di ghiaccio e di acqua?
E2) Una mole di gas ideale poliatomico è sottoposta ad una espansione isobara dalla temperatura iniziale
Tf=200 K, alla temperatura finale Tc=350 K.
A) Calcolare il lavoro compiuto dal gas nella trasformazione.
B) Se il gas è successivamente sottoposto ad una espansione adiabatica, che riporta il gas alla temperatura
iniziale Tf=100 K, calcolare il lavoro effettuato dal gas in tale seconda trasformazione.
C) Il gas viene infine compresso in una trasformazione isoterma che lo riporta allo stato iniziale, con una
riduzione di volume pari ad un fattore 2. Calcolare il lavoro effettuato dal gas in questa ultima trasformazione.
D) Determinare il calore assorbito dal gas nel ciclo ed il rendimento del ciclo stesso.
E
1A
1B
2A
2B
2C
2D
R
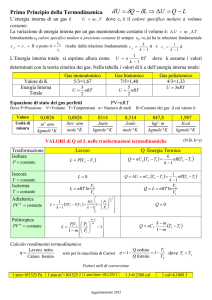
D1) Per un gas che si espande adiabaticamente:
1.
2.
3.
4.
La temperatura riamane costante
La temperatura aumenta
La temperatura diminuisce
La pressione aumenta
D2) Un corpo di capacità termica pari a 0.35 Kcal/C alla temperatura di 5C, viene immerso in acqua alla
temperatura di 25/C. Raggiunto l’equilibrio termico, la temperatura dell’acqua è di 21C. Il volume
dell’acqua presente è:
1.
1.4 dm3
2.
3.
4.
14 dm3
25 dm3
2.5 dm3
D3) Se la temperatura di un gas perfetto aumenta da 200K a 1000K, l’energia cinetica media delle molecole
aumenta di un fattore:
1.
2.
3.
4.
2
3
4
5
D4) Se un sistema termodinamico evolve secondo un ciclo composto da trasformazioni reversibili, allora:
1.
2.
3.
4.
il lavoro effettuato è sempre positivo
il lavoro effettuato è sempre nullo
il calore assorbito è sempre nullo
l’energia interna non varia
D5) Una macchina di Carnot lavora tra le temperature di 250 C e 70C. Per raddoppiare il suo rendimento,
mantenendo la sorgente fredda alla stessa temperatura, occorre portare la sorgente calda alla temperatura:
1. 224C
2. 828C
3. 102C
4. 1101C
D6) Due cariche elettriche di segno opposto sono inizialmente alla distanza relativa di 1 m. Vengono
successivamente avvicinate alla distanza di 10 cm. La forza elettrostatica:
1.
2.
3.
4.
aumenta di 100 volte
aumenta di 10 volte
diminuisce di 10 volte
diminuisce di 100 volte
D7) Il potenziale elettrico in un punto dello spazio è definito come:
1.
2.
3.
4.
l’energia potenziale elettrica posseduta dalla carica di 1 C posta in quel punto
l’energia potenziale elettrica posseduta da un elettrone in quel punto
il lavoro necessario per portare un elettrone da distanza infinita in quel punto
la forza agente sulla carica di 1C in quel punto
D8) Una mole di gas perfetto alla temperatura di 0C, contenuto in un recipiente di 1 litro, ha la pressione:
1.
2.
3.
4.
2 atm
1 atm
22.4 atm
8.31 atm
D9) Indicando con cp il calore specifico a pressione costante e con cv il calore specifico a volume costante di
gas perfetto costituito da molecole monoatomiche, quale delle seguenti affermazioni è FALSA?
1.
2.
3.
4.
Cp/ Cv = R
Cp- Cv =R
Cp = 5/2 R
Cv = 3/2 R
D10) La variazione di entropia di un gas isolato sottoposto ad una espansione libera:
1.
2.
3.
4.
Non è calcolabile perché la trasformazione è irreversibile
E’ pari alla variazione di entropia calcolata per di una trasformazione isoterma reversibile tra gli stessi stati iniziale e finale
E’ nulla, essendo il sistema isolato
E’ negativa, poiché nell’espansione il gas cede energia al suo contenitore.
D
R
1
2
3
4
5
6
7
8
9
10
Soluzioni esercizi
E1)
A)
Qg=m cghiacccio T= - 3x40 g x0,53cal/gKx15 K = - 954 cal Qftot= 80 cal/g 120 g = - 9600 cal
Qa= m cacqua T = 200g x1cal/gK x 20 K = 4000 cal
Qg + Qftot + Qa <0 e Qg + Qa > 0 => T eq = 0 C
B)
Qf + Qg + Qa =0 ; Qg + Qa + mf = 0 ; mf = (Qg + Qa)/ = (4000-954)/80 g = 38 g
M ghiacccio = 120 -38 = 82 g ; macqua= 200 + 38 g = 238 g
E2
A)
L = Q -E = ncpT – ncvT= nR T = 1 x 8.31 J/m K x 150 K = 1246,5 J
B)
L= -E = – ncvT = 1 x 3 x 8.31 J/m K x 150 K = 3739 J
E3
A)
L = nRTf ln (Vfin/Vin) = - 1 x 8,31 J/mol K x 200 K x ln 2 = -1152 J
B)
Qass = Q isobara = n cp T = 1 x 4 x 8.31 J/m K x 150 K = 4986 J
= Ltot / Qass = (4986 J-1152 J) /4986 J = 1 – 1152/4986 = 0.768
Soluzioni Domande
D1) 3
D2) 1
D3) 4
D4) 4
D5) 2
D6) 1
D7) 1
D8) 3
D9) 1
D10) 2