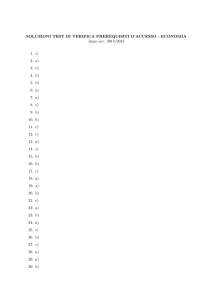Scheda di Programmazione Scienze Integrate
Chimica Classe 1F BID
Anno Scolastico 2016-2017
- LE COMPETENZE
1.
Osservare, descrivere ed analizzare fenomeni appartenenti alla realtà naturale e artificiale e riconoscere nelle
sue varie forme i concetti di sistema e di complessità
2. Analizzare qualitativamente e quantitativamente fenomeni legati alle trasformazioni di energia a
partire dall’esperienza
3. Essere consapevoli delle potenzialità e dei limiti delle tecnologie nel contesto culturale e sociale in cui
vengono applicate
- LE ABILITA'
1.
Individuare le grandezze che cambiano e quelle che rimangono costanti in un fenomeno (abilità minima)
2. Effettuare misure di massa, volume, temperatura, densità, temperatura di fusione, temperatura di
ebollizione ed esprimere il risultato utilizzando correttamente la terminologia di base del linguaggio disciplinare
(abilità minima)
3. Conoscere i simboli di pericolosità presenti sulle etichette dei materiali per un loro utilizzo sicuro.
(abilità minima)
4. Effettuare investigazioni in scala ridotta con materiali non nocivi, per salvaguardare la sicurezza
personale e ambientale (abilità minima)
5. Effettuare separazioni tramite filtrazione, distillazione, cristallizzazione, centrifugazione,
cromatografia, estrazione con solventi (abilità minima)
6. Utilizzare il modello cinetico e molecolare per spiegare le evidenze delle trasformazioni fisiche e
chimiche (abilità minima)
7. Determinare la quantità chimica in un campione di una sostanza ed usare la costante di Avogadro
(abilità minima)
8. Usare il concetto di mole come ponte tra il livello macroscopico delle sostanze ed il livello microscopico
degli atomi, delle molecole e degli ioni (abilità minima)
9. Spiegare la forma a livelli di energia dell’atomo sulla base delle evidenze sperimentali, come il
saggio alla fiamma (abilità minima)
10. Spiegare la forma delle molecole e le proprietà delle sostanze
11. Utilizzare le regole della nomenclatura IUPAC.
12. Preparare soluzioni di data concentrazione (percento in peso, molarità, molalità). (abilità minima)
13. Spiegare le trasformazioni chimiche che comportano scambi di energia con l’ambiente (abilità minima)
14. Determinare la costante di equilibrio di una reazione dalle concentrazioni di reagenti e prodotti
15. Spiegare l’azione dei catalizzatori e degli altri fattori sulla velocità di reazione (abilità minima)
16. Riconoscere sostanze acide e basiche tramite indicatori, anche di origine vegetale, e misure di pH.
17. Bilanciare le reazioni di ossido riduzione col metodo ionico elettronico
18. Disegnare e descrivere il funzionamento di pile e celle elettrolitiche
19. Descrivere le proprietà fisiche e chimiche di idrocarburi, dei diversi gruppi funzionali e delle biomolecole
- LE CONOSCENZE
1.
Grandezze fisiche fondamentali e derivate, strumenti di misura, tecniche di separazione dei sistemi omogenei
ed eterogenei (conoscenza minima)
2. Il modello particellare (concetti di atomo, molecola e ioni) e le spiegazioni delle trasformazioni fisiche (passaggi
di stato) e delle trasformazioni chimiche (conoscenza minima)
3. Le leggi ponderali della chimica e l’ipotesi atomico – molecolare (conoscenza minima)
4. Le evidenze sperimentali di una sostanza pura (mediante la misura della densità, del punto di fusione e/o del
punto di ebollizione) e nozioni sulla lettura delle etichette e sui simboli di pericolosità di elementi e composti.
(conoscenza minima)
5. La quantità chimica: massa atomica, massa molecolare, mole, costante di Avogadro
6. L’organizzazione microscopica del gas ideale, le leggi dei gas e volume molare (conoscenza minima)
7. Le particelle fondamentali dell’atomo: numero atomico, numero di massa, isotopi (conoscenza minima)
8. Le evidenze sperimentali del modello atomico a strati e la organizzazione elettronica degli elementi.
(conoscenza minima)
9. Il modello atomico ad orbitali
10. Forma e proprietà del sistema periodico: metalli, non metalli, semimetalli
11. Il legame chimico: regola dell’ottetto, principali legami chimici e forze intermolecolari, valenza, numero
ossidazione, scala di elettronegatività, forma delle molecole
12. Sistemi chimici molecolari e sistemi ionici: nomenclatura
13. Le soluzioni: percento in peso, molarità, molalità, proprietà colligative (conoscenza minima)
14. Le reazioni chimiche, bilanciamento e calcoli stechiometrici (conoscenza minima)
15. Energia e trasformazioni chimiche (conoscenza minima)
16. L’equilibrio chimico, la costante di equilibrio, l’equilibrio di solubilità, il principio di Le Châtelier
17. I catalizzatori e i fattori che influenzano la velocità di reazione (conoscenza minima)
18. Le teorie acido-base: pH, indicatori, reazioni acido-base, calore di neutralizzazione, acidi e basi forti e deboli,
idrolisi, soluzioni tampone
- LE VERIFICHE
Verifiche formative in itinere scritte e orali ( almeno 2) e verifica sommativa alla fine del modulo
- ALTRE INDICAZIONI
Saranno acquisite come primo livello per poi essere completate e consolidate nel secondo corso:
- le abilità 1, 5, 6, 7, 8, 9, 12, 13 e 15
- le conoscenze 6, 7, 8,13, 14, 15 e 17
Sono rinviate al secondo corso:
- le abilità 11, 14, 16 e 18,
- le conoscenze 5, 10, 12,, 16, 18 e 19
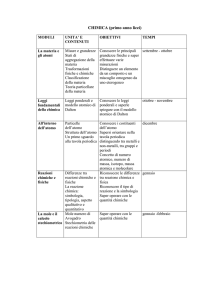
- Modulo 1: Introduzione al Laboratorio
N° ore: 4
Periodo: 1^ periodo Prerequisiti
Non Richiesti
Abilità
3
Conoscenze
U.D. 1.1 ATTREZZATURE DI LABORATORIO E LORO USO
U.D. 1.2 NORME DI SICUREZZA NEL LABORATORIO
U.D. 1.3 LA RELAZIONE DI LABORATORIO
Metodologia e Strumenti
Lettura e discussione del manualetto di laboratorio Il
manualetto di laboratorio
- Modulo 2: Grandezze e misure
N° ore: 10
Periodo: 1^ periodo
Prerequisiti
Conoscere le formule per calcolare area e volume di figure geometriche
Saper eseguire calcoli con le proprietà delle potenze
Saper ricavare le formule inverse
Abilità
1, 2
Conoscenze
1
U.D. 2.1
U.D. 2.2
U.D. 2.3
U.D. 2.4
U.D. 2.5
IL METODO SPERIMENTALE.
IL SISTEMA INTERNAZIONALE
L’ELABORAZIONE DEI DATI SPERIMENTALI
IL CALCOLO CON LE CIFRE SIGNIFICATIVE
IL CALCOLO CON LA NOTAZIONE SCIENTIFICA
- Modulo 3: Gli stati di aggregazione
N° ore: 8
Periodo: 1^ periodo
Prerequisiti
Conoscere le principli grandezze fisiche e le loro unità di misura
Saper eseguire le equivalenze per le grandezze fisiche usate Conoscere
le scale termometriche
Saper operare con i grafici cartesiani
Abilità
6
Conoscenze
2, 4, 6
U.D. 3.1 STATO SOLIDO, LIQUIDO ED AERIFORME
U.D. 3.2 LE LEGGI DEI GAS
- Modulo 4: Miscugli e sostanze
N° ore: 10
Periodo: 1^ periodo
Prerequisiti
Conoscere il concetto di materia e le caratteristiche degli stati fisici della materia
Abilità
2, 4, 5
Conoscenze
1, 2, 4
U.D. 4.1 CLASSIFICAZIONE DELLA MATERIA
U.D. 4.2 I MISCUGLI E LE SOSTANZE PURE E LE LORO PROPRIETÀ CARATTERIZZANTI
U.D. 4.3 METODI DI SEPARAZIONE: SETACCIATURA, FILTRAZIONE, DECANTAZIONE, CENTRIFUGAZIONE,
CROMATOGRAFIA, DISTILLAZIONE, ESTRAZIONE CON SOLVENTE
- Modulo 5: La temperatura e i passaggi di stato
N° ore: 9
Periodo: 1^ periodo
Prerequisiti
Conoscere le scale termometriche
Saper operare con i grafici cartesiani
Abilità
1, 2, 4, 6
Conoscenze
1, 2, 4
U.D. 5.1 TEMPERATURA E TERMOMETRI: LA SCALA CELSIUS E LA SCALA KELVIN.
U.D. 5.2 GRANDEZZE CARATTERISTICHE E CARTA D’IDENTITÀ DELLE SOSTANZE: TEMPERATURE FISSE E
DENSITÀ
U.D. 5.3 L’ANALISI TERMICA DI UNA SOSTANZA E LE SUE TEMPERATURE CARATTERIZZANTI
- Modulo 6: le soluzioni
N° ore: 12
Periodo: 2^ periodo
Prerequisiti
Conoscere i miscugli omogenei
Saper effettuare calcoli con le percentuali
Conoscere il concetto di densità
Abilità
1, 2, 4, 6, 12
Conoscenze
1, 2, 13
U.D. 6.1 IL FENOMENO DELLA DISSOLUZIONE, DISSOLUZIONI CHE SCALDANO E CHE RAFFREDDANO, LA
MASSA E IL VOLUME DELLE SOLUZIONI.
U.D. 6.2 CHE COSA È LA CONCENTRAZIONE, SOLUZIONI SATURE E SOLUBILITÀ.
U.D. 6.3 LA CONCENTRAZIONE DELLE SOLUZIONI: MASSA SU VOLUME, PERCENTUALE IN MASSA,
PERCENTUALE IN VOLUME
U.D. 6.4 PROPRIETÀ DELLE SOLUZIONI: DENSITÀ, COLORE, CONDUCIBILITÀ ELETTRICA,
L’ABBASSAMENTO CRIOSCOPICO, L’INNALZAMENTO EBULLIOSCOPICO, L’OSMOSI
U.D. 6.5 SOLUBILITÀ DI UNA SOSTANZA E TEMPERATURA
- Modulo 7: La trasformazione chimica
N° ore: 11
Periodo: 2^ periodo
Prerequisiti
Conoscere la differenza tra proprietà fisiche e proprietà chimiche
Conoscere il concetto di energia
Abilità
1, 6, 7, 8, 13, 15
Conoscenze
1, 2, 3, 14, 15, 17
U.D. 7.1 LE TRASFORMAZIONI DELLA MATERIA: TRASFORMAZIONI CHIMICHE E TRASFORMAZIONI
FISICHE.
U.D. 7.2 LA CONSERVAZIONE DELLA MASSA NELLE REAZIONI CHIMICHE: LA LEGGE DI LAVOISIER E LE
SUE APPLICAZIONI
U.D. 7.3 COME SI RAPPRESENTA UNA REAZIONE CHIMICA
U.D. 7.4 REAZIONI CHIMICHE ED ENERGIA
U.D. 7.5 LA VELOCITÀ DI UNA REAZIONE CHIMICA E I FATTORI CHE LA INFLUENZANO
- Modulo 8: Elementi e composti
N° ore: 8
Periodo: 2^ periodo
Prerequisiti
Conoscere il concetto di sostanza pura e distinguerla dai miscugli
Conoscere il concetto di temperatura di fusione e di ebollizione e di densità
Abilità
4, 1, 6
Conoscenze
1, 2, 3, 4, 14
U.D. 8.1 SOSTANZE SEMPLICI E SOSTANZE COMPOSTE
U.D. 8.2 REAZIONI DI ANALISI E REAZIONI DI SINTESI.
U.D. 8.3 GLI ELEMENTI: L’ALFABETO DELLA MATERIA, I SIMBOLI DEGLI ELEMENTI
U.D. 8.4 LA TAVOLA PERIODICA E LA CLASSIFICAZIONE IN METALLI, NON METALLI, SEMIMETALLI
U.D. 8.5 LE FORMULE DEGLI ELEMENTI E DEI COMPOSTI
- Modulo 9: Leggi ponderali e teoria atomica
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Conoscere la differenza tra elemento e composto
Conoscere i nomi e i simboli degli elementi chimici
Riconoscere la formula di un elemento da quella di un composto
Abilità
1, 2, 4
Conoscenze
1, 3, 14
U.D. 9.1 LA LEGGE DI PROUST E LE SUE APPLICAZIONI.
U.D. 9.2 LA TEORIA ATOMICA DELLA MATERIA
U.D. 9.3 LE FORMULE DELLE SOSTANZE: LE FORMULE DEGLI ELEMENTI E QUELLE DEI COMPOSTI
U.D. 9.4 DALLA CONSERVAZIONE DELLA MASSA ALLA CONSERVAZIONE DEGLI ATOMI: LE EQUAZIONI
CHIMICHE
U.D. 9.5 IL BILANCIAMENTO DELLE REAZIONI CHIMICHE
- Modulo 10: Le particelle subatomiche
N° ore: 8
Periodo: 2^ periodo
Prerequisiti
Conoscere il concetto di atomo inteso come la più piccola entità di un elemento che ne conserva le caratteristiche
Abilità
9
Conoscenze
7, 8
U.D. 10.1 LA CARTA D’IDENTITÀ DEGLI ATOMI: IL NUMERO ATOMICO, IL NUMERO DI MASSA E GLI ISOTOPI
U.D. 10.2 I MODELLI ATOMICI DI RUTHERFORD E DI BOHR E IL MODELLO A GUSCI DI ELETTRONI
U.D. 10.3 LE TRANSIZIONI ELETTRONICHE
Metodologia e Strumenti
Lezioni frontali, attività di laboratorio Libro di
testo, mappe concettuali, appunti
pag. 2
pag. 3
pag. 4
U.D. 7.5 LA VELOCITÀ DI UNA REAZIONE CHIMICA E I FATTORI CHE LA INFLUENZANO
- Modulo 8: Elementi e composti
N° ore: 8
Periodo: 2^ periodo
Prerequisiti
Conoscere il concetto di sostanza pura e distinguerla dai miscugli
Conoscere il concetto di temperatura di fusione e di ebollizione e di densità
Abilità
4, 1, 6
Conoscenze
1, 2, 3, 4, 14
U.D. 8.1 SOSTANZE SEMPLICI E SOSTANZE COMPOSTE
U.D. 8.2 REAZIONI DI ANALISI E REAZIONI DI SINTESI.
U.D. 8.3 GLI ELEMENTI: L’ALFABETO DELLA MATERIA, I SIMBOLI DEGLI ELEMENTI
U.D. 8.4 LA TAVOLA PERIODICA E LA CLASSIFICAZIONE IN METALLI, NON METALLI, SEMIMETALLI
U.D. 8.5 LE FORMULE DEGLI ELEMENTI E DEI COMPOSTI
- Modulo 9: Leggi ponderali e teoria atomica
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Conoscere la differenza tra elemento e composto
Conoscere i nomi e i simboli degli elementi chimici
Riconoscere la formula di un elemento da quella di un composto
Abilità
1, 2, 4
Conoscenze
1, 3, 14
U.D. 9.1 LA LEGGE DI PROUST E LE SUE APPLICAZIONI.
U.D. 9.2 LA TEORIA ATOMICA DELLA MATERIA
U.D. 9.3 LE FORMULE DELLE SOSTANZE: LE FORMULE DEGLI ELEMENTI E QUELLE DEI COMPOSTI
U.D. 9.4 DALLA CONSERVAZIONE DELLA MASSA ALLA CONSERVAZIONE DEGLI ATOMI: LE EQUAZIONI
CHIMICHE
U.D. 9.5 IL BILANCIAMENTO DELLE REAZIONI CHIMICHE
- Modulo 10: Le particelle subatomiche
N° ore: 8
Periodo: 2^ periodo
Prerequisiti
Conoscere il concetto di atomo inteso come la più piccola entità di un elemento che ne conserva le caratteristiche
Abilità
9
Conoscenze
7, 8
U.D. 10.1 LA CARTA D’IDENTITÀ DEGLI ATOMI: IL NUMERO ATOMICO, IL NUMERO DI MASSA E GLI ISOTOPI
U.D. 10.2 I MODELLI ATOMICI DI RUTHERFORD E DI BOHR E IL MODELLO A GUSCI DI ELETTRONI
U.D. 10.3 LE TRANSIZIONI ELETTRONICHE
Metodologia e Strumenti
pag. 5
Lezioni frontali, attività di laboratorio Libro di testo,
mappe concettuali, appunti
pag. 1
Scheda di Programmazione Scienze Integrate Chimica
Classe 2 BID
Anno Scolastico 2016-2017
- LE COMPETENZE
1.
Osservare, descrivere ed analizzare fenomeni appartenenti alla realtà naturale ed artificiale e riconoscere nelle
sue varie forme i concetti di sistema e di complessità
2. Analizzare qualitativamente e quantitativamente fenomeni legati alle trasformazioni di energia a partire
dall’esperienza
3. Essere consapevoli delle potenzialità e dei limiti delle tecnologie nel contesto culturale e sociale in cui vengono
applicate
- LE ABILITA'
1.
Individuare le grandezze che cambiano e quelle che rimangono costanti in un fenomeno (abilità minima)
2. Effettuare misure di massa, volume, temperatura, densità, temperatura di fusione, temperatura di ebollizione (da
usare per identificare le sostanze). (abilità minima)
3. Conoscere i simboli di pericolosità presenti sulle etichette dei materiali per un loro utilizzo sicuro (abilità
minima)
4. Effettuare investigazioni in scala ridotta con materiali non nocivi, per salvaguardare la sicurezza personale e
ambientale (abilità minima)
5. Effettuare separazioni tramite filtrazione, distillazione, cristallizzazione, centrifugazione, cromatografia,
estrazione con solventi. (abilità minima)
6. Utilizzare il modello cinetico e molecolare per spiegare le evidenze delle trasformazioni fisiche e chimiche e
costruire grafici temperatura / tempo per i passaggi di stato. (abilità minima)
7. Determinare la quantità chimica in un campione di una sostanza ed usare la costante di Avogadro. (abilità
minima)
8. Usare il concetto di mole come ponte tra il livello macroscopico delle sostanze ed il livello microscopico degli
atomi, delle molecole e degli ioni. (abilità minima)
9. Spiegare la forma a livelli di energia dell’atomo sulla base delle evidenze sperimentali, come il saggio alla
fiamma. (abilità minima)
10. Spiegare la forma delle molecole e le proprietà delle sostanze
11. Utilizzare le regole della nomenclatura IUPAC. (abilità minima)
12. Preparare soluzioni di data concentrazione (percento in peso, molarità, molalità). (abilità minima)
13. Spiegare le trasformazioni chimiche che comportano scambi di energia con l’ambiente. (abilità minima)
14. Determinare la costante di equilibrio di una reazione dalle concentrazioni (abilità minima)
15. Spiegare l’azione dei catalizzatori e degli altri fattori sulla velocità (abilità minima)
16. Riconoscere sostanze acide e basiche tramite indicatori, anche di origine vegetale, e misure di pH. (abilità
minima)
17. Bilanciare le reazioni di ossido riduzione col metodo ionico elettronico.
18. Disegnare e descrivere il funzionamento di pile e celle elettrolitiche (abilità minima)
19. Descrivere le proprietà fisiche e chimiche di idrocarburi, dei diversi gruppi funzionali e delle biomolecole.
- LE CONOSCENZE
1.
Grandezze fisiche fondamentali e derivate, strumenti di misura, tecniche di separazione dei sistemi omogenei
ed eterogenei (conoscenza minima)
pag. 1
2. Il modello particellare (concetti di atomo, molecola e ioni) e le spiegazioni delle trasformazioni fisiche (passaggi
di stato) e delle trasformazioni chimiche (conoscenza minima)
3. Le leggi ponderali della chimica e l’ipotesi atomico – molecolare (conoscenza minima)
4. Le evidenze sperimentali di una sostanza pura e nozioni sulla lettura delle etichette e sulla pericolosità di
elementi e composti. (conoscenza minima)
5. La quantità chimica: massa atomica, massa molecolare, mole, costante di Avogadro. (conoscenza minima)
6. L’organizzazione microscopica del gas ideale, le leggi dei gas e volume molare (conoscenza minima)
7. Le particelle fondamentali dell’atomo: numero atomico, numero di massa, isotopi (conoscenza minima)
8. Le evidenze sperimentali del modello atomico a strati e la organizzazione elettronica degli elementi.
(conoscenza minima)
9. Il modello atomico ad orbitali
10. Forma e proprietà del sistema periodico: metalli, non metalli, semimetalli (conoscenza minima)
11. Il legame chimico: regola dell’ottetto, principali legami chimici e forze intermolecolari, valenza, numero
ossidazione, scala di elettronegatività, forma delle molecole.
12. Sistemi chimici molecolari e sistemi ionici: nomenclatura (conoscenza minima)
13. Le soluzioni: percento in peso, molarità, molalità, proprietà colligative (conoscenza minima)
14. Le reazioni chimiche, bilanciamento e calcoli stechiometrici (conoscenza minima)
15. Energia e trasformazioni chimiche (conoscenza minima)
16. L’equilibrio chimico, la costante di equilibrio, l’equilibrio di solubilità, il principio di Le Châtelier. (conoscenza
minima)
17. I catalizzatori e i fattori che influenzano la velocità di reazione (conoscenza minima)
18. Le teorie acido-base: pH, indicatori, reazioni acido-base, calore di neutralizzazione, acidi e basi forti e deboli,
idrolisi, soluzioni tampone (conoscenza minima)
19. Reazioni di ossidoriduzione e loro bilanciamento: pile, corrosione, leggi di Faraday ed elettrolisi (conoscenza
minima)
20. Idrocarburi alifatici ed aromatici, gruppi funzionali, nomenclatura e biomolecole
- LE VERIFICHE
Verifiche formative in itinere scritte e orali ( almeno 2) e verifica sommativa alla fine del modulo
- PROVE IN INGRESSO
Non previste
- ALTRE INDICAZIONI
Nel primo corso sono già state acquisite:
- le abilità 2, 3 e 4
- le conoscenze 1, 2, 3 e 4
e sono state acquisite come primo livello ma saranno completate e consolidate nel secondo corso:
- le abilità 1, 5, 6, 7, 8, 9, 12, 13 e 15
- le conoscenze 6, 7, 8,13, 14, 15 e 17
Il Dipartimento non ritiene realistico per il primo biennio perseguire:
- le abilità 10, 17 e 19
- le conoscenze 9, 11 e 20
- I MODULI
- Modulo 1: LE PARTICELLE SUBATOMICHE
N° ore: 8
Periodo: 1^ periodo
Prerequisiti
Conoscere il concetto di atomo inteso come la più piccola entità di un elemento che ne conserva le caratteristiche
Abilità
9
Conoscenze
7, 8
pag. 2
U.D. 1.1 LA CARTA D’IDENTITÀ DEGLI ATOMI: IL NUMERO ATOMICO, IL NUMERO DI MASSA E GLI ISOTOPI
U.D. 1.2 I MODELLI ATOMICI DI RUTHERFORD E DI BOHR E IL MODELLO A GUSCI DI ELETTRONI
U.D. 1.3 LE TRANSIZIONI ELETTRONICHE
Metodologia e Strumenti
- Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte:
Analisi alla fiamma
- Modulo 2: LA MOLE
N° ore: 18
Periodo: 1^ periodo
Prerequisiti
Conoscere i concetti di atomo e molecola e di elemento e composto
Conoscere le leggi ponderali di combinazione e la legge di conservazione di massa
Saper bilanciare una reazione chimica
Saper usare la notazione esponenziale
Conoscere le soluzioni e le principale unità di misura per esprimere la concentrazione
Abilità
7, 8, 12
Conoscenze
5, 6, 13, 14
U.D. 2.1 LA MASSA DELLE MOLECOLE E DEGLI ATOMI: L’UNITÀ DI MASSA ATOMICA.
U.D. 2.2 IL PESO ATOMICO E IL CALCOLO DEL PESO MOLECOLARE
U.D. 2.3 LA MOLE: L’INTERPRETE TRA GLI ATOMI E LA BILANCIA
U.D. 2.4 IL NUMERO DI AVOGADRO
U.D. 2.5 LA STECHIOMETRIA DELLE REAZIONI
U.D. 2.6 LE SOLUZIONI: MOLARITÀ
U.D. 2.7 IL VOLUME MOLARE
Metodologia e Strumenti
- Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Determinazione della massa di una mole di semi
Determinazione delle moli di acqua di cristallizzazione di un sale idrato
Determinazione sperimentale del rapporto tra le moli in una reazione chimica
- Modulo 3: LA TAVOLA PERIODICA E LA NOMENCLATURA
N° ore: 12
Periodo: 2^ periodo
Prerequisiti
Conoscere i simboli degli elementi chimici
Classificare le sostanze in elementi e composti
Conoscere il numero di elettroni esterni di un atomo
Abilità
11
Conoscenze
10, 12
Metodologia e Strumenti
Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Reazione di doppio scambio
Reazioni di formazione di ossidi ossiacidi idrossidi e sali
- Modulo 4: SCAMBI DI ENERGIA NELLE REAZIONI
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Conoscere i concetti di energia e di calore
Conoscere le definizioni di acido e di base
pag. 3
Saper scrivere una reazione di neutralizzazione
Conoscere il concetto di mole e di molarità
Risolvere semplici problemi di stechiometria
Abilità
13
Conoscenze
14, 15
U.D. 4.1 REAZIONI CHIMICHE ED ENERGIA
U.D. 4.2 REAZIONI ESOENERGETICHE, REAZIONI ENDOENERGETICHE, REAZIONI REVERSIBILI
Metodologia e Strumenti
- Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Calore molare di solubilizzazione e di reazione
- Modulo 5: LA VELOCITA' DELLE REAZIONI
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Conoscere i concetti di temperatura, concentrazione,
Conoscere le principali unità di misura della concentrazione
Distinguere i reagenti dai prodotti
Conoscere il concetto di energia
Abilità
1, 15
Conoscenze
17
Metodologia e Strumenti
Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Studio dei fattori che influenzano la velocità di reazione
- Modulo 6: L'EQUILIBRIO NELLE REAZIONI CHIMICHE
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Conoscere il concetto di velocità di reazione diretta e inversa
Conoscere i fattori che influenzano la velocità di una reazione
Abilità
1, 14
Conoscenze
16
U.D. 6.1
U.D. 6.2
U.D. 6.3
U.D. 6.4
I SISTEMI IN EQUILIBRIO
L’EQUILIBRIO CHIMICO
LA COSTANTE DI EQUILIBRIO
EQUILIBRIO MOBILE
Metodologia e Strumenti
Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Studio dell’equilibrio di una reazione chimica
- Modulo 7: ACIDI E BASI
N° ore: 12
Periodo: 2^ periodo
Prerequisiti
Conoscere la nomenclatura dei principali composti inorganici
Conoscere le soluzioni e le principali unità di misura della concentrazione
pag. 4
Saper bilanciare una reazione
Saper usare la notazione
scientifica Abilità
16
Conoscenze
18
U.D. 7.1 ELETTROLITI FORTI E DEBOLI, NON ELETTROLITI
U.D. 7.2 ACIDI E BASI IN SOLUZIONE ACQUOSA, LA REAZIONE DI NEUTRALIZZAZIONE, LA
TITOLAZIONE ACIDO-BASE,
U.D. 7.3 NEUTRALITÀ DELL’ACQUA E SCALA DI PH.
U.D. 7.4 ACIDI FORTI E ACIDI DEBOLI, BASI FORTI E BASI DEBOLI
U.D. 7.5 CALCOLO DEL PH DI SOLUZIONI ACQUOSE
U.D. 7.6 LA PERICOLOSITÀ DELLE SOLUZIONI ACIDE E BASICHE
Metodologia e Strumenti
Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali, appunti
Attività pratiche proposte
Conducibilità elettrica di sostanze e soluzioni
Classificazione di sostanze in acidi e basi con l’uso di indicatori
Titolazione acido forte-base forte
Acidità del latte
Titolazione di un aceto commerciale
Titolazione dei cloruri dell’acqua di rubinetto
- Modulo 8: LE PILE
N° ore: 10
Periodo: 2^ periodo
Prerequisiti
Assegnare correttamente il numero di ossidazione ad ogni elemento di un composto
Conoscere la nomenclatura dei composti
Conoscere l’unità di misura della corrente elettrica e della ddp
Abilità
18
Conoscenze
19
U.D. 8.1 LE REAZIONI DI OSSIDORIDUZIONE: REAZIONI CON TRASFERIMENTO DI ELETTRONI
U.D. 8.2 LA SCALA DEI POTENZIALI STANDARD
U.D. 8.3 LE PILE
Metodologia e Strumenti
- Lezioni frontali, attività di laboratorio
- Libro di testo, mappe concettuali,
appunti Attività pratiche proposte
Reazioni di ossido-riduzione
Costruzione di una pila
rame/zinco
pag. 5