LA STRUTTURA
DELL’ATOMO
E
LA TAVOLA
PERIODICA
DEGLI
ELEMENTI
Quando gio
co col mio g
atto,
chissà se s
ono io che m
i sto
divertendo
con lui,
o lui con m
e.
(Montaigne
)
Lagonegro, 17/12/2009
Tutto ciò che può essere detto, può essere detto chiaramente.
(Wittgenstein)
Anche un orologio fermo segna l'ora giusta due volte al giorno.
(H. Hesse)
La scienza è costruita di fatti, come una casa è costruita di mattoni; ma un
accumulo di fatti non è una scienza di più che un mucchio di mattoni.
(H. Poincaré)
H
Fe
He
Na
Cr
Ca
ovvero
“L’UNIVERSO IN UN GUSCIO DI NOCE”
C
Molti si erano accorti che
alcune sostanze avevano proprietà simili e molti elementi
avevano un comportamento caratteristico nelle varie
reazioni (stessa reattività):
ESEMPIO:
Cloruro di sodio
Cloruro di potassio
solfato di calcio
Sodio
Potassio
…….
calcio
bario
……..
solfato di rame
solfato di bario
rame
……
…….
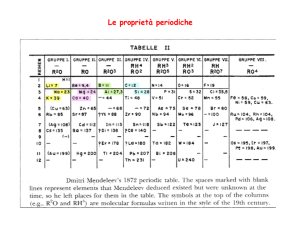
La Tavola Periodica fu ideata dal chimico russo Dimitrij Mendeleev nel 1869,
inizialmente contava numerosi spazi vuoti, previsti per gli elementi che
sarebbero stati scoperti in futuro, taluni nella seconda metà del 1900.
In suo onore, la tavola periodica degli elementi è anche detta
tavola periodica di Mendeleev.
Sulla base delle
carattestiche chimicochimicofisiche simili, Mendeleev
dispose gli elementi
allora conosciuti (63),
secondo la loro massa
atomica crescente e
previde che gli spazi
vuoti sarebbero stati
riempiti in futuro.
fino alla seconda metà del settecento:
chimica qualitativa
fino alla seconda metà dell’ottocento:
chimica quantitativa
nel novecento:
chimica analitica
Nel 1897 Thomson (fisico inglese) scopre l'elettrone
Elettrone (simbolo e)
Protone (simbolo p)
Neutrone (simbolo n)
massa = 9,10 10−31 kg
carica elettrica negativa = 1,602 10−19 C
massa = 1,67 × 10-27 kg (1850 volte l’elettrone)
carica elettrica positiva = 1,602 10−19 C
massa leggermente superiore a quella del protone
carica elettrica nulla
Il neutrone fu scoperto nel 1926; da allora sono state
scoperte numerose altre particelle elementari:
Nel Modello Standard le particelle fondamentali sono
raggruppate in due categorie:
1. particelle costituenti la materia, dette fermioni
2. particelle mediatrici delle forze, dette bosoni
I fermioni sono costituiti da quark e leptoni.
l’elettrone è un leptone
Il protone è formato da tre quark uud
Il neutrone è formato da tre quark udd
Nel 1911 Rutherford bombardò un
sottilissimo foglio di oro con raggi alfa
(atomi di elio completamente ionizzati,
ciò privati degli elettroni). L'esperimento
mostrò che i raggi alfa non erano quasi
mai deviati. Essi attraversavano il foglio di
oro senza quasi mai esserne disturbati.
Solo alcuni raggi alfa (1 %) erano deviati
dal foglio di oro e lo erano in modo
notevole (alcuni, addirittura,
venivano completamente. respinti).
Rutherford concluse che
l’atomo doveva avere un
nucleo centrale molto
compatto circondato da
cariche negative
(elettroni) distribuite in
uno spazio molto grande
rispetto al nucleo.
La teoria di Rutherford aveva un difetto: gli elettroni,
ruotando sulle orbite, dovevano perdere energia e
cadere sul nucleo provocando la distruzione dell’atomo.
Nel 1911 il fisico danese N. Bohr propose una nuova
teoria atomica, dando inizio ad una nuova branca della
fisica: la meccanica quantistica.
Un elettrone emette od assorbe energia sotto forma di onde elettromagnetiche
se "salta" da un'orbita all'altra. L’energia è quantizzata cioè si trasmette
pacchetti discreti.
solo
per
Si possono immaginare le orbite come le gradinate di un anfiteatro romano.
Finchè
l’elettrone si muove su un gradino è stabile (stato stazionario), per passare al gradino superiore
o inferiore deve fare un salto.
Secondo la
Principio di
meccanica quantistica, ed in particolare del
indeterminazione di Heisenberg:
“E’
impossibile determinare con eguale precisione la velocità
e la
posizione dell’elettrone”. Si può solo conoscere la
probabilità
di trovare l'elettrone in un certo punto dello spazio.
Un orbitale non è una traiettoria in cui un
elettrone può stare, è invece una "nuvola" di
probabilità
DALL’ ESPERIMENTO AL MODELLO
L’atomo di idrogeno
Secondo la fisica classica
l’atomo dovrebbe essere
instabile perché
l’elettrone ruotando
attorno al nucleo
dovrebbe perdere energia
e collassare sul nucleo.
Per spiegare le righe nello spettro dell’atono di idrogeno, Bohr ipotizza che
Ad ogni
salto quantico corrisponde una determinata energia e ad
l’elettrone possa stare solo su orbite fisse, sulle quali non irradia. Quando passa
ogni determinata
energia
determinata
frequenza
da una traiettoria
all’altra corrisponde
irradia un fotoneuna
con frequenza
proporzionale
alla sua
della radiazione (colore nel visibile).
L’elettrone
può
trovarsi
su
ben
energia.
precise orbite, non può trovarsi …………..qui in mezzo
Il Modello spiega lo spettro dell’atono di idrogeno ma introduce
ipotesi fisiche che non hanno un fondamento teorico solido!
Anzi, aggiunge Heisenberg, non si tratta di orbite
ma di orbitali, cioè zone o regioni dello spazio dove
è massima la probabilità di trovare l’elettrone.
Ogni elettrone può
essere individuato
univocamente
mediante 4 numeri
n : numero quantico principale
(livello energetico–distanza dal
nucleo)
l: numero quantico secondario
(forma dell’orbitale)
m: numero quantico magnetico
(orientamento dell’orbitale nello
spazio)
ms: numero quantico di spin
(senso di rotazione intorno al proprio
n
nucleo): valori 1,2,...7
numero quantico secondario o azimutale l (forma
dell’orbitale): valori da 0 a n-1
l= 0
sferica (s)
l= 1
forma a otto (p)
l= 2
(d)
numero quantico magnetico m (orientamento nello spazio):
valori da – l, 0, l
numero quantico di spin ms
QUINDI:
n= 1
n= 2
livello
l=0
l=0
l=1
m=0
primo orbitale sferico
m=0
secondo orbitale sferico
m=-1
m=0
m=1 tre orbitali p al secondo
ed eccoli tutti
s
p
d
f
Atomo di idrogeno
Numero atomico (Z): rappresenta il numero
di protoni contenuti nel nucleo di un atomo.
Numero di massa (A): rappresenta il numero
complessivo di protoni e neutroni contenuti nel nucleo di un
atomo.
Il numero atomico determina le proprietà chimiche di un atomo,
ovvero le sue varie possibilità di combinarsi con gli altri atomi.
Nello stato fondamentale ogni atomo è elettricamente neutro, cioè
numero di protoni = numero di elettroni.
Isotopi: sono atomi con stesso
numero atomico e diverso
numero di massa.
(in greco significa che occupano lo stesso posto
nella tavola periodica).
12 C, DEL
13 C,
ISOTOPI
CARBONIO:
6
14
6C)
6
Iniziamo la costruzione della configurazione
elettronica(Aufbau) degli atomi o elementi, tenendo presente
che nella tavola periodica, essi sono ordinati in ordine
crescente di numero atomico
L’ordine di riempimento è determinato dal concetto:
massima stabilità = minima energia
LO SCHEMA DI RIEMPIMENTO DEGLI ORBITALI E’:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s
Oppure graficamente:
Quali regole o princìpi usare per l‘AUFBAU?
1.principio di minima energia: ogni elettrone occupa
l'orbitale disponibile a energia più bassa.
2. principio di Pauli (W. Pauli, 1900-1958; premio Nobel nel 1945):
in un atomo non possono esistere 2 elettroni con i
4 numeri quantici eguali; perciò, nello stesso orbitale,
possono esserci 2 soli elettroni purché con ms (momento
di spin) diverso (antiparalleli).
3. Regola di Hund o della massima molteplicità: se due o più
elettroni occupano orbitali degeneri (cioè a eguale energia), essi
occupano il maggior numero possibile di questi orbitali, e con spin
paralleli.
INIZIAMO LA
COSTRUZIONE
Gruppo
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Periodo
1
1
H
2
He
2
3
4
Li Be
5
B
6
C
7
N
8
O
9
F
3
11 12
Na Mg
13
Al
14
Si
15
P
16
S
17 18
Cl Ar
4
19 20 21
K Ca Sc
22
Ti
10
Ne
23 24 25 26 27 28 29 30 31 32 33 34 35 36
V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
Z=1 idrogeno
Z=2 elio
un protone
un elettrone
L’elettrone occupa l’orbitale 1s
La configurazione si indica:
due protoni
due elettroni
Gli elettroni occupano l’orbitale 1s
La configurazione si indica:
1s1
1s2
oppure
oppure
Z=3 litio
3 elettroni
3 protoni
La configurazione elettronica è:
Z=4 berillio
4 protoni
4 elettroni
La configurazione elettronica è:
1s2 2s1
1s2 2s2
Oppure
Oppure
n=2
n=1
Z=5 boro
5 elettroni
5 protoni
La configurazione elettronica è:
1s2 2s2 2p1
Oppure
Il carbonio
merita una
pagina a parte
Z=6 carbonio
6 elettroni
6 protoni
La configurazione elettronica è:
1s2 2s2 2p2
Oppure
Oppure
Oppure
Z=7 azoto
7 elettroni
7 protoni
La configurazione elettronica è:
Z=8 ossigeno
8 protoni
8 elettroni
La configurazione elettronica è:
1s2 2s2 2p3
Oppure
1s2 2s2 2p4
Oppure
Z=9 fluoro
9 elettroni
9 protoni
La configurazione elettronica è:
Z=10 neon
10 elettroni
10 protoni
La configurazione elettronica è:
1s2 2s2 2p5
Oppure
1s2 2s2 2p6
Oppure
Z=10 neon
10 protoni
10 elettroni
La configurazione elettronica è:
1s2
2s2
Z=11 sodio
11 protoni
11 elettroni
La configurazione elettronica è:
1s2 2s2 2p6 3s1
2p6
Oppure
il neon ha raggiunto l’OTTETTO a livello
energetico n=2
cioè si trova in condizioni di stabilità
(gas nobile = non reagisce con nessuno)
Oppure
Il sodio può essere scritto anche
(Ne) 3s1
Possiamo proseguire in questo modo ma:……
Z=20 calcio
20 protoni
20 elettroni
Z=21 scandio
21 protoni
21 elettroni
La configurazione elettronica è:
La configurazione elettronica è:
1s2 2s2 2p6 3s2 3p6 4s2
1s2 2s2 2p6 3s2 3p6 4s2 3d1
Oppure
Oppure
n=4
d
n=3
n=2
n=1
iniziano a riempirsi gli orbitali d
(ELEMENTI DI TRANSIZIONE)
quando comincia a riempirsi il 4f (N=57)
iniziano gli elementi di transizione interna
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f 1
’
i
CURIOSITA
metallico, d
o
t
n
e
m
le
è un e
eabile e
ll
a
m
il lantanio
,
to
n
e
co-arg
uò
colore bian
to che si p
n
ta
,
o
r
e
n
lto te
i trova in
S
.
duttile, mo
o
ll
e
lt
o
n un c
in
tagliare co
e, di solito
r
a
r
e
r
r
e
t
i
erali d
e altri
io
r
e
alcuni min
c
il
n
o
ne c
metalli
i
v
ti
combinazio
t
a
e
r
iù
e
uno dei p
idamente s
p
a
lantanidi. È
r
a
id
s
s
rare: si o
utilizzato
e
delle terre
n
ie
V
.
ia
r
'a
nti e come
esposto all
le
e
ll
e
d
i,
tr
ria dei ve
olifera.
tr
e
p
ia
nell’indust
tr
s
u
re nell’ind
catalizzato
1
30
13
40
28
1
QUESTA E’ LA
TAVOLA
COMPLETA
Gruppo
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Periodo
gli elementi numerati in blu sono liquidi a T = 298 K e p = 1 bar;
quelli in verde sono gas a T = 298 K e p = 1 bar;
quelli in nero sono solidi a T = 298 K e p = 1 bar;
quelli in rosso sono artificiali e non sono naturalmente presenti
sulla Terra (sono tutti solidi a T = 298 K e p = 1 bar).
quelli in grigio non sono ancora stati scoperti.
1
1
H
2
He
2
3
Li
4
Be
3
11
Na
12
Mg
4
19
K
20
Ca
21
Sc
22
Ti
23
V
24
Cr
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
5
37
Rb
38
Sr
39
Y
40
Zr
41 42
Nb Mo
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
6
55
Cs
56
Ba
7
87
Fr
88
Ra
57 * 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
La
Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
89 ** 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
Ac
Rf Db Sg Bh Hs Mt Ds Rg Uub
5
B
6
C
7
N
8
O
9
F
10
Ne
13
Al
14
Si
15
P
16
S
17
Cl
18
Ar
30
Zn
31
Ga
32
Ge
33
As
34
Se
35
Br
36
Kr
48
Cd
49
In
50
Sn
51
Sb
52
Te
53
I
54
Xe
* Lantanoidi
58
Ce
59
Pr
60
Nd
61
Pm
62
Sm
63
Eu
64
Gd
65
Tb
66
Dy
67
Ho
68
Er
69
Tm
70
Yb
71
Lu
** Attinoidi
90
Th
91
Pa
92
U
93
Np
94
Pu
95
Am
96
Cm
97
Bk
98
Cf
99
Es
100
Fm
101
Md
102
No
103
Lr
Metalli alcalini
Metalli alcalino
terrosi
Lantanoidi
Attinoidi
Metalli del blocco
d
Metalli del
blocco p
Semimetalli
Nonmetalli
Alogeni
Gas nobili
IL RIEMPIMENTO COMPLETO DEL 7° PERIODO
PORTA AD UN NUMERO TOTALE DI ELEMENTI
PARI A 118…
IL FISICO ITALIANO MASSIMO CORBUCCI NEL 2000 HA
REALIZZATO UNA NUOVA TAVOLA PERIODICA BASATA
SULLA DISPOSIZIONE BARIONICA DEL NUCLEO
ATOMICO.
LE CONSEGUENZE DELLA NUOVA TAVOLA SONO:
LA SCOPERTA DEL VUOTO QUANTOMECCANICO
IL NUMERO TOTALE DEGLI ELEMENTI E’ PARI A 112.
IN ATTESA DI ULTERIORI RICERCHE E CONFERME,
RIPRENDIAMO IL DISCORSO:
Ai fini della reattività chimica e della formazione dei legami sono
importanti solo gli elettroni esterni o periferici dell’atomo, quindi
rappresentiamo solo quelli (puntini rossi):
1° gruppo
2° gruppo
3° gruppo
4° gruppo
5° gruppo
6° gruppo
7° gruppo
8° gruppo
1° gruppo
Gruppo
1
2
3
4
5
6
7
Periodo
1
1
H
2
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
3
11
Na
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
4
19
K
20
Ca
31
Ga
32
Ge
33
As
34
Se
35
Br
5
37
Rb
38
Sr
49
In
50
Sn
51
Sb
52
Te
53
I
8
1
2
3
4
5
6
7
-
-
-
-
-
-
H
2,21
Li
0,97
Be
1,47
B
2,01
C
2,50
N
3,07
O
3,50
F
Na
1,01
Mg
1,23
Al
1,47
Si
1,74
P
2,06
S
2,44
K
0,91
Ca
1,04
Ga
1,82
Ge
2,02
As
2,20
Se
Rb
0,89
Sr
0,99
In
1,49
Sn
1,72
Sb
1,82
Cs
0,86
Ba
0,97
Tl
1,44
Pb
1,55
Bi
1,67
Fr
0,86
Ra
0,97
-
-
-
8
He
-
4,10
Ne
-
Cl
2,83
Ar
-
2,48
Br
2,74
Kr
-
Te
2,01
I
2,21
Xe
-
Po
1,76
At
1,90
Rn
-
-
-
-
come dice
Einstein:
L'arte suprema dell'insegnante è
quella di risvegliare la gioia della
creatività e della conoscenza.