Struttura degli alogenuri alchilici
L’alogeno è più elettronegativo del carbonio. Il legame C-X
è polarizzato con maggiore densità elettronica sull’atomo di
alogeno.
Polarizzazione del legame C-alogeno
Il carbonio avendo una parziale carica positiva si
comporterà da elettrofilo.
La reattività degli alogenuri alchilici
I composti organici in cui è presente
un atomo (o gruppo) elettronegativo
legato ad un carbonio sp3 possono
subire reazioni di:
-sostituzione
-eliminazione
Reazioni di sostituzione nucleofila (SN): SN2 ed SN1
Per la reazione di sostituzione possiamo avere due meccanismi::
SN2
•avviene in un singolo stadio
•Porta ad inversione di
configurazione
SN1
•avviene in due stadi
•Porta alla formazione di
miscela racemica
Reazione di sostituzione nucleofila perché un nucleofilo sostituisce un alogeno.
Riepilogo della reattività degli
alogenuri alchilici
Per gli alogenuri alchilici 2 °dipende dal Nucleofilo:
Alogenuro alchilico 2°+ Nu deboli (H2O, ROH, NH3)
Alogenuro alchilico 2° + Nu forti (OH- , RO-, NH2-)
SN1
SN2
Ma poiché la maggior parte dei
nucleofili
agiscono anche da basi e viceversa,
va tenuto presente che gli alogenuri alchilici
possono subire oltre alla reazione di sostituzione
anche la reazione di b eliminazione.
In molti casi le due tipologie di reazione sono in
competizione tra loro, ovvero possono generare
entrambe i loro prodotti
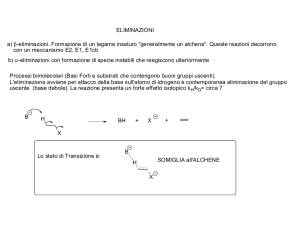
reazioni di b eliminazione
b a
Y- si comporta da Nucleofilo
Y- si comporta da Base
La reazione di eliminazione è una reazione in cui l’atomo elettronegativo
(X) è eliminato insieme ad un H che si trova su uno degli atomi di
carbonio b, cioè adiacente al cabonio che lega l’alogeno (X).
Cioè vengono eliminati un H ed un alogeno (X) e nel prodotto finale si
forma un legame p con rottura di due legami s nel reagente
Meccanismo delle reazioni di b
eliminazione:
-Il Nucleofilo: si comporta da base ovvero strappa un
protone al carbonio b, ovvero il carbonio adiacente a
quello che lega l’alogeno (carbonio a).
Le basi più usate per la b eliminazione sono:
OH-, OR-, NH2-
alchene
-Il prodotto finale di una reazione
di b eliminazione è un alchene
Quando l’alogenoalcano è 1° può formarsi un solo
prodotto di b eliminazione:
b
CH3-CH2Br
-OCH
3
CH2=CH2
Quando l’alogenoalcano è 2° o 3°possono formarsi
più prodotti di b eliminazione………………….
b
b
b
CH3CH2
Carbonio 3 °
CH3
CH3
2
Ma in questo caso le posizioni b’ e b’’ sono equivalenti per cui pur
avendo tre posizioni b disponibili si ottengono solo 2 prodotti.
Suggerimento: per accorgersi della formazione di prodotti
equivalenti basta assegnare loro il nome IUPAC.
In questo caso le 3 diverse posizioni b sono equivalenti per cui in tutti i casi si
ottiene lo stesso prodotto
b
b
b
Carbonio 3 °
b
b
Br
CH3O-
b
+
+
CH3OH + Br-
1-bromo,1-metilciclopentano
Carbonio 3 o
In questo caso le posizioni b e b’ sono equivalenti per cui si formano 2 prodotti
Per stabilire il prodotto principale tra quelli ottenuti:
La Regola di Zaitsev:
Si ottiene come prodotto principale l’alchene più
sostituito, in quanto è l’alchene più stabile
CH2CH3
H
Alchene
monosostituito
b
Alchene
disostituito
b’
Alogeno alcano 2 ario
CH3
Alchene
trisostituito
Alchene
tetrasostituito
Regioselettività = regola di Zaitsev
Il prodotto principale è l’alchene più stabile
Maggiore è il numero di sostituenti sul doppio legame,
più stabile è l’alchene
b’
b
Quando una reazione di Eliminazione può dar luogo alla
formazione di due diversi prodotti di eliminazione, il
prodotto principale è generalmente l’alchene più sostituito.
Competizione tra sostituzione e
eliminazione
Gli alogenuri alchilici possono dare Sostituzione nucleofila
e b Eliminazione
Per decidere se le condizioni di reazione favoriscono
l’eliminazione o la sostituzione nucleofila bisogna
considerare essenzialmente 2 fattori:
-il tipo di alogenoalcano (1°,2°,3°)
-Il tipo di nucleofilo/base (forte o debole):
(Basi/Nucleofili) forti: OH-, NH2-, RO(Basi/Nucleofili) deboli: H2O, ROH
Basi deboli/buoni nucleofili: I-, CH3COO-, -CN
N.B.
alcune specie hanno una maggiore tendenza a comportarsi come basi piuttosto che come Nu (es:OH-, RO-)
alcune altre invece hanno una maggiore tendenza a comportarsi da Nu (es:-CN, I-, CH3COO-).
E
Reazione non osservata
(H2O e ROH)
e con buoni nucleofili/basi deboli (CH3COO- e I-)
Esempi…..
SN2
+ Br-
E
N.B. due posizioni b equivalenti
E
N.B. tre posizioni b equivalenti
SN1
Cl
+
+ CH3OH
OCH3
Alogeno alcano III
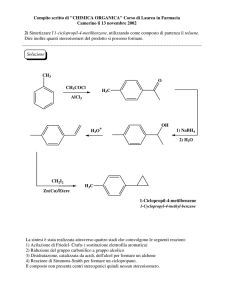
Uso degli alogenuri alchilici in sintesi
organica
1) Sintesi di Alcheni e/o Alcoli
2) Sintesi degli Eteri (Sintesi di Williamson)
Uso degli alogenuri in sintesi organica
Sintesi di Alcheni e/o Alcoli
(Scegliere bene il Substrato!)
Alogenuro 2°
E
SN2
Alogenuro 1°
Per sintetizzare un alcol: reazione di SN2 tra alogeno alcano 1 ° e OH-
Alcoli
Sono caratterizzati dalla presenza del gruppo
ossidrile legato ad un C sp3: R
OH
Il nome IUPAC si ottiene sostituendo la -o terminale dell’idrocarburo con il
suffisso -olo. La posizione dell’OH è specificata da un numero
-si sceglie la catena più lunga di carboni contenente il gruppo funzionale OH
numerandola a partire dall’estremità più vicina al gruppo OH.
-la localizzazione del gruppo OH ha la precedenza sui gruppi alchilici, gli
alogeni e anche dei doppi legami degli alcheni nel numerare la catena base.
Gli alcoli sono classificati a seconda del numero di gruppi R legati al C che porta il
gruppo -OH:
1-propanolo
2-propanolo
1-butanolo
2-butanolo
2-metil-1-propanolo
2-metil-2-propanolo
5
1
3
2
OH
4
OH
2-butanolo
butan-2-ol
2-etil-1-pentanolo
2-etilpentan-1-olo
3-bromo-1-propanolo
2-metil-4-eptanolo
La polarizzazione dei legami C-O-H determina le
proprietà chimico-fisiche degli alcoli
Il punto di ebollizione di un composto è
la temperatura alla quale la forma
liquida del composto diventa un gas
(vaporizzi).
Affinchè il composto vaporizzi, devono
essere vinte le forze che tengono le
molecole vicine tra loro. Questo vuol
dire che il p.e. di un composto dipende
dalla entità delle forze attrattive tra
le molecole.
Il punto di ebollizione più alto degli alcoli rispetto agli alcani di
peso molecolare simile è dovuto al fatto che gli alcoli,molecole
polari, possono asssociarsi allo stato liquido grazie ad un tipo di
interazione intermolecolare noto come legame a H
Eteri
R
..
O
..
R
Gli eteri vengono denominati tradizionalmente premettendo i
nomi dei gruppi alchilici legati all’atomo di ossigeno e
aggiungendo la parola etere.
CH3 O CH3
Dimetiletere (etere metilico)
Etilmetiletere
Nomenclatura IUPAC: Si sceglie la catena più lunga di
atomi di C come alcano di riferimento e poi al residuo
-OR si dà il nome di alc-ossi
CH3 O CH23 CH3
Esempi: il residuo CH3O- si definisce metossi
il residuo CH3CH2O- si definisce etossi
CH3 CH2 O CH23 CH3
Dietiletere (etere etilico)
IUPAC: etossietano
Il composto più utilizzato è l’etere etilico che è anche usato come anestetico
Gli eteri sono composti poco reattivi e
per questo vengono spesso utilizzati
come solventi nelle reazioni organiche.
Gli eteri possono formare legami a idrogeno
comportandosi da accettori di idrogeno
Confronto tra punti di ebollizione degli eteri e degli alcoli
Perché gli eteri hanno p.e. minori rispetto agli alcol?