Elisa Mori
139434
22/11/01 h.14.30-16.30
I gas perfetti
Il concetto di gas perfetto è un concetto astratto che semplifica la realtà fisica per
ricondursi a casi più semplici.
Il gas perfetto, anche detto gas ideale, in natura non esiste, però alcuni gas come
l’idrogeno o l’elio, si approssimano bene al comportamento del gas perfetto.
Si attua una schematizzazione per studiare sistemi e fenomeni che affrontati
direttamente presenterebbero notevoli difficoltà; l’introduzione del gas perfetto ci
permette di trattare in modo più semplice la teoria dei gas nel senso che prima si
studiano le proprietà di questo sistema ideale e successivamente si vede sotto quali
condizioni può essere esteso ai gas reali.
Il gas perfetto è un gas composto da atomi elementari che non interagiscono uno con
l’altro (gli atomi non sono consapevoli della presenza degli altri) ed è quindi molto
rarefatto.
Prima di definire le leggi dei gas perfetti è necessario riprendere alcuni concetti di
chimica come quello di atomo, reazione, mole.
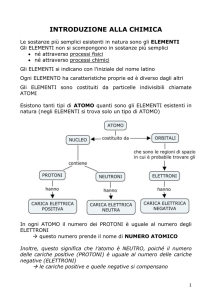
L’atomo è la parte più piccola costituente la materia,è costituita da un nucleo
centrale composto da protoni e neutroni, e da una nuvola di elettroni che vi girano
attorno a diverse distanze.
nucleo
protoni
neutroni
elettrone
Gli elettroni ( e ) hanno carica negativa, i protoni hanno carica positiva e ei neutroni
non hanno carica, in modo che tutto il sistema risulti neutro.
ELETTRONE
PROTONE
NEUTRONE
Carica elettrica
-1
+1
Massa in Kg
9,1 10 31
1,6 10 27
1,6 10 27
0
-1-
Elisa Mori
139434
22/11/01 h.14.30-16.30
Si indica con Z il numero di elettroni presenti in un atomo mentre con N si indica il
numero di nucleoni, cioè la somma di protoni e neutroni, un atomo è in equilibrio
quando Z=N .
Dal concetto di atomo si passa a quello di molecola, definita come la più piccola
parte di sostanza che mantiene tutte le proprietà chimico- fisiche della stessa
sostanza.
Nei gas perfetti le molecole sono indipendenti, hanno una loro massa, si muovono
indipendentemente le une dalle altre, mentre nei gas reali le molecole sono legate.
Le molecole dei gas possono essere :
o Monoatomiche, cioè composte da un solo atomo;
o Biatomiche, composte da più atomi.
Es. L’ossigeno ( O2 )è una molecola composta da due atomi.
Il metano ( CH 4 ) è una molecola composta da un atomo di carbonio e quattro
di Idrogeno.
H
C
H
H
H
Le molecole interagendo tra loro danno luogo a reazioni chimiche .
Le reazioni chimiche combinano le molecole per crearne di nuove.
Es.La combustione del metano:
CH 4 2O2 CO2 2H 2 O E
metano e ossigeno si combinano per dare luogo ad anidride carbonica e
acqua, inoltre viene anche rilasciata energia.
Le molecole in questo modo si trasformano e cambiano le loro caratteristiche.
Esistono reazioni:
o Esotermiche, dove è rilasciata energia
o Endotermiche, dove l’energia viene sottratta all’ambiente.
-2-
Elisa Mori
139434
22/11/01 h.14.30-16.30
Es. Reazione di una pila a combustione, sfrutta la reazione chimica per dar luogo ad
energia elettrica:
In un elettrolita costituito da idrossido di potassio (KOH) immergiamo due
elettrodi metallici,
Entra acqua
Entra ossigeno
Esce
idrogeno+vapor
d'acqua
Esce ossigeno
Catodo
Anodo
Se colleghiamo i due elettrodi a una lampadina questa si accende, ciò significa
che la reazione fornisce energia in eccesso sottoforma di energia elettrica.
Le reazioni che avvengono su catodo e anodo rispettivamente sono:
(+) O2 2H 2 O 4e 4OH
2H 2 O2 2H 2 O E
(- ) H 2 2OH 2H 2 O 2e
Le molecole reagiscono e danno luogo a nuove molecole più energia.
Le reazioni possono essere reversibili, cioè valide sia in un senso che nell’altro.
Es. la reazione nella cella elettrolitica:
Generatore di energia
elettrica
Soluzione di
NaCl e acqua
-3-
Elisa Mori
139434
22/11/01 h.14.30-16.30
(+) 2H 2 O 2e H 2 2OH
(- ) 4OH O2 2H 2 O 4e
Possiamo ora introdurre il concetto di mole , come un’altra grandezza per misurare
la massa:
Mole è la quantità di sostanza (quale che sia la sostanza) che contiene 6,02 10 23
Molecole della stessa sostanza
1Mol = 6,02 10 23 molecole
dove 6,02 10 23 è un numero costante (uguale al numero di atomi di carbonio
contenuti in 0,012 Kg di carbonio 12), detto Numero di Avogadro , ed è indicato con
NA .
Ricordiamo che il peso atomico equivale al peso di un atomo ed il peso molecolare
equivale al peso di una molecola, ad es.:
H ha peso atomico 1, perché è composto da un protone ed un elettrone (che però
ha massa trascurabile);
O2 ha peso atomico 16, infatti è composto da 8 protoni, 8 neutroni e 8 elettroni.
Per l’acqua, H 2 O , dovrò considerare il peso molecolare (PM):
peso atomico dell’ossigeno + peso atomico dell’idrogeno
16 + 2 = 18
Una mole di sostanza è uguale al peso molecolare espresso in grammi di quella
sostanza.
Es. Quanto pesa 1 mole di acqua?
Il peso equivale al peso molecolare dell’acqua espresso in grammi, quindi 18 g.
Quanto pesa una mole di ossigeno?
Il peso equivale al peso molecolare dell’ossigeno, cioè il peso atomico
moltiplicato per 2 (perché ho due atomi), quindi 16 2 = 32.
1 Kmole = 1000 6,02 10 23 molecole
-4-
Elisa Mori
139434
22/11/01 h.14.30-16.30
Diagramma dei gas ideali
P
T1
T2
T3
Le curve del grafico sono dette Isoterme ed hanno un andamento ad iperbole
equilatera.
In ascissa è rappresentato il volume specifico, in ordinata è espressa la pressione
assoluta.
La temperatura cresce da T3 a T1.
Se di un gas ideale conosco la temperatura e la pressione allora conosco anche la sua
densità:
p v R T
dove p è la pressione assoluta misurata in Bar o Pascal
3
v è il volume specifico espresso in m
Kg
R è la COSTANTE DEL GAS , che varia in funzione del gas considerato
T è la temperatura assoluta misurata in Kelvin (1K= 273+ temperatura in °C).
Tramite il numero di Avogadro ed il concetto di mole posso ricavare una formula
valida in generale per tutti i gas:
M
n
m
dove n è il numero di moli
M è la massa globale che si considera
-5-
Elisa Mori
139434
22/11/01 h.14.30-16.30
m è la massa molare, cioè la massa molecolare espressa in grammi.
10 gH 2
5mol
Es. nH 2
2g
mole
Dalla precedente si ricava:
p v m R m T
dove v m v m ,volume specifico molare (cioè il volume di una mole)
R m R0 , grandezza costante detta COSTANTE UNIVERSALE DEI GAS
che vale 8,315 J
mol K
Quindi possiamo scrivere un’equazione che valga per tutti i gas:
p v m R0 T
Moltiplicando l’uguaglianza per n , numero di moli, si ha:
n p v m n R0 T
poiché n v m V , cioè il volume totale totale, si ottiene l’equazione di stato dei gas
perfetti, espressa in funzione della temperatura assoluta :
p V n R0 T
Per poter applicare questa legge, valida per tutti i gas perfetti, devo conoscere n e
R0 8,315 J
mol K
Il rapporto tra R, costante variabile in funzione del gas, ed R0 , costante universale
R
valida per tutti i gas è: R 0 .
m
I valori di m e di R, legati dalla relazione precedente, sono riportati, per alcune
sostanze, nella seguente tabella:
Sostanza
Acetilene
Acqua
Ammoniaca
Formula
C2 H 2
H 2O
NH 3
M Kg/Kmol
26.039
18.016
17.032
R( J/KgK)
319.43
461.70
488.38
Anidride carbonica
Anidride solforosa
Argon
Aria
Azoto
CO2
SO2
Ar
44.012
64.066
39.950
28.968
28.014
188.99
129.83
208.21
287.13
296.91
N2
-6-
Elisa Mori
139434
22/11/01 h.14.30-16.30
Elio
Etano
He
C2 H 6
4.0028
30.071
2078.0
276.60
Etilene
Freon
Idrogeno
Metano
Neon
Ossido di carbonio
Ossido di Azoto
Ossigeno
Propano
C2 H 4
12CCl2 F2
H2
CH 4
Ne
CO
NO
O2
C3 H 8
28.055
120.914
2.0158
16.044
20.184
28.012
30.007
31.891
44.097
296.48
68.77
4126.4
518.46
412.10
296.93
277.19
260.83
188.55
Es.L’aria, che è una miscela costituita per 75% da azoto e per il 25% da ossigeno , si
R
considera come un gas perfetto: R 0
m ARIA
m ARIA
0,75 mN
2
R0
=286,7 J Kg K
0,25 mO
2
Un gas perfetto è tale solo se soddisfa esattamente alla legge di Boyle ed alle due
leggi di Gay-Lussac:
Legge di Boyle:A temperatura costante, il volume di una massa di gas è
inversamente proporzionale alla sua pressione
p V cost
per T costante.
Leggi di Gay-Lussac: 1)In tutti i gas, mantenendo costante la pressione, a
ogni determinato aumento di temperatura
corrisponde lo stesso aumento di volume
VT V0 1 T
per p costante,
dove, V 0 è il volume iniziale del gas alla temperatura
di 0°C,
VT il volume alla temperatura di T°C
è la costante caratteristica dei gas.
Se volessimo esprimere l’equazione in gradi Kelvin,
sarebbe:
VT V273K 1 T )
-7-
Elisa Mori
139434
22/11/01 h.14.30-16.30
2)In tutti i gas, mantenendo costante il volume, a ogni
determinato aumento di temperatura corrisponde lo
stesso aumento di pressione
pT p 0 1 T
per V costante,
dove, p 0 è la pressione iniziale del gas alla
temperatura di 0°C,
pT la pressione alla temperatura di T°C
è la costante caratteristica dei gas.
Una delle più importanti caratteristiche dei gas ideali è che l’energia interna (u) e
l’entalpia (h) sono funzioni solo della temperatura e sono completamente
indipendenti dalla pressione.
Ricordiamo dalle lezioni precedenti che :
u q pv
h q vp
Nel caso dei gas ideali avremo:
Cp
Cv
h
T
dove, C p è il calore specifico a pressione costante
u
T
dove, C v è il calore specifico a volume costante
u è la variazione di energia interna
T è la variazione di temperatura
h è la variazione di entalpia
T è la variazione di temperatura
Nel caso del gas perfetto i calori specifici a volume o pressione costante non variano
mai insieme ma sempre uno indipendentemente dall’altro:
C p Cv R
queste differenze sono sempre uguali all’interno della sostanza ma variano a
seconda del tipo di gas si consideri.
Cp
Definiamo anche:
e diamo alcuni valori di calori specifici per diverse
Cv
sostanze:
-8-
Elisa Mori
139434
22/11/01 h.14.30-16.30
Sostanza
C p in Kj
Acqua
Aria
Idrogeno
Ossigeno
0.44
1.01
14.2
0.917
C v in Kj
Kg K
Kg K
0.717
10.1
0.656
Una volta scritte le definizioni di C p e C v posso ricavare quanto vale u e h :
u C p T
h C v T
La terza grandezza da prendere in considerazione insieme all’energia interna e
all’entalpia è l’entropia , la cui variazione è stata definita nelle lezioni precedenti
come il rapporto tra variazione di calore e temperatura; si può ricavare attraverso
metodi di integrazione la relazione che esprime questa grandezza per i gas perfetti:
T
V
s 2 s1 CV log 2 R log 2
T1
V1
oppure
T
P
s 2 s1 CP log 2 R log 2
T1
P1
Nel diagramma dei gas perfetti si possono trovare anche curve adiabatiche, cioè
curve che esprimono trasformazioni i cui scambi di calore sono talmente veloci da
poter essere considerati trascurabili:
P
curva adiabatica
V
-9-
Elisa Mori
139434
22/11/01 h.14.30-16.30
La relazione che vale per le trasformazioni adiabatiche è:
p v cost
Se la trasformazione adiabatica avviene in modo reversibile, cioè se Q = 0, allora
anche s =0, si hanno così delle curve in cui l’entropia rimane costante.
-10-