METODICHE DI
IMMUNOCHIMICA
IMMUNOCHIMICA
permette la determinazione
quantitativa di proteine in
tessuti e omogenati
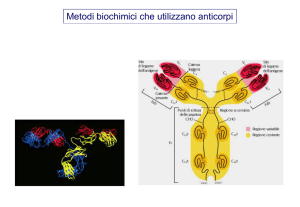
INTERAZIONI ANTIGENE-ANTICORPO
L’immunochimica
antigene-anticorpo
si
basa
sulle
interazioni
Idealmente, l’anticorpo dovrebbe riconoscere
l’antigene che è stato usato per la sua produzione
È tuttavia possibile che peptidi sintetici riescano
a riprodurre le caratteristiche di un antigene, e
questo può essere vantaggioso a fini sperimentali
anticorpi molto specifici
ANTIGENE
proveniente da animale A
(es: topo)
inoculazione
animale B (es: coniglio)
ANTICORPO
attivo contro l’antigene
proveniente da
animale A
risposta immunitaria
complesso antigene-anticorpo
ANTIGENE
epitopo
gli epitopi sono i siti dell’antigene a cui si lega
l’anticorpo
un antigene può contenere più di un epitopo
ANTICORPO POLICLONALE
lega più di un epitopo
ANTICORPO MONOCLONALE
lega solo un epitopo
alta
standardizzazione,
caratterizzazione,
selettività e riproducibilità dei risultati
applicazioni terapeutiche
TECNICA IBRIDOMA
MULTIPLO
l’animale vivo produce anticorpi
policlonali
le cellule di ibridoma producono
anticorpi monoclonali
splenociti
cellule di
mieloma
formazione
ibridi
formazione
ibridi
colonie
ibridomi
(7gg)
colonie
ibridomi
(10gg)
METODI IMMUNOCHIMICI
ELISA (Enzyme-Linked Immunoassorbent
Assay)
Western blot
Radioimmunotest
Immunoistochimica
METODO ELISA
determina la presenza di antigeni o anticorpi
può essere qualitativo, semi-quantitativo o
quantitativo a seconda di come viene svolto
prevede delle curve di competizione a diversi
valori di enzima (legato all’anticorpo) per
evidenziare l’affinità antigene-anticorpo
METODO ELISA
presenza antigene
presenza anticorpi contro antigene
METODO ELISA
un’applicazione analoga dell’ELISA è il dosaggio ormonale
IMMUNOBLOTTIG (WESTERN BLOTTING)
metodica quantitativa che permette di identificare
proteine mediante elettroforesi e reattività con
anticorpi spesso è usato per confermare ELISA
basato sulla migrazione elettroforetica delle proteine
PRINCIPI DI ELETTROFORESI
Macromolecole
cariche
positivamente
o
negativamente (acidi nucleici e proteine) sono
separate per mezzo di un campo elettrico.
La velocità alla quale una molecola migra è:
•direttamente proporzionale al voltaggio applicato e
alla carica elettrica della molecola
•inversamente proporzionale alle dimensioni della
molecola e alla viscosità della soluzione
Matrici: AGAROSIO, POLIACRILAMMIDE
IMMUNOBLOTTIG (WESTERN BLOTTING)
1. Separazione delle proteine (caricate negativamente)
sulla base del peso molecolare con gel elettroforesi
2. Trasferimento delle proteine separate dal gel ad una
membrana di supporto elettroforetico
(es:nitrocellulosa)
3. Immuno-rilevazione delle proteine di interesse con
anticorpo
2
3
1
4
ESEMPI DI WESTERN BLOT E APPLICAZIONI
analisi proteine della famiglia bcl-2
analisi proteine in fluorescenza
ESEMPI DI WESTERN BLOT E APPLICAZIONI
analisi recettori purinergici P2
proteine del cytomegalovirus
il Western Blot non è utile solo come metodica per la
ricerca di base, ma può essere impiegato come test
per confermare la sieropositività a HIV e epatiti
RADIOIMMUNOTEST
O
DOSAGGIO RADIOIMMUNOLOGICO
RADIOIMMUNOTEST
test quantitativo per dosaggi immunogenici che utilizza
composti marcati
test molto sensibile, preciso e riproducibile
presenta costi significativi
è applicabile ad analisi cliniche di vario tipo (ormoni,
stupefacenti)
RADIOIMMUNOTEST
ANTICORPO
ANTIGENE MARCATO (*)
ANTIGENE NON MARCATO
competizione
QUANTITA’ DI ANTIGENE NEL CAMPIONE
RADIOIMMUNOTEST
125I
O
cpm
CCK
+ Ab
BK
no Ab
CARBONE
max 1000
CARBONE
min 100
1
+Ab
CARBONE
900
CURVA
5
+Ab
CARBONE
800
STANDARD
10
+Ab
CARBONE
600
CCK
20
+Ab
CARBONE
400
50
+Ab
CARBONE
200
il carbone adsorbe il complesso antigene-anticorpo ad
alto peso molecolare
CURVA DI CALIBRAZIONE
sostanza non marcata = ridotta radioattività rilevata
l’utilizzo della curva di calibrazione permette di calcolare la
concentrazione di un campione ignoto, confrontando i valori di
radioattività rilevati
RADIOIMMUNOTEST
IMMUNOISTOCHIMICA
metodo qualitativo con applicazioni quantitative
valuta
peptidi (es:enzimi)
LOCALIZZAZIONE
recettori
canali ionici
trasportatori
COESISTENZA
TRACCIANTI
IMMUNOISTOCHIMICA
-fissazione tessuto (in vivo)
-post-fissazione tessuto (ex vivo)
-taglio (criostato o vibratomo)
-incubazione con anticorpo primario
-incubazione con anticorpo secondario
-visualizzazione della reazione
-eventuale quantificazione dei risultati
STRUMENTI PER PERFUSIONE
STRUMENTI PER IMMUNOISTOCHIMICA
CON FETTINE FLUTTUANTI
IMMUNOISTOCHIMICA
tecniche dirette un solo anticorpo
due livelli
il marker si lega
all’anticorpo primario
IMMUNOISTOCHIMICA
tecniche indirette più anticorpi
più di due livelli
il marker si
lega
all’anticorpo
secondario o
terziario, se
presente
IMMUNOISTOCHIMICA INDIRETTA CON LA
TECNICA PAP
l’anticorpo primario lega la CAT (proteina bersaglio), gli anticorpi secondario
e terziario servono per amplificare il segnale
IMMUNOISTOCHIMICA INDIRETTA CON LA
TECNICA ABC
sfrutta il reticolo di legami formato dalle proteine
avidina e biotina con l’anticorpo secondario che
permette una notevole amplificazione del segnale
-l’avidina ha 4 siti di legame per la biotina e i suoi
coniugati
-numerose molecole di biotina possono reagire con
una molecola di perossidasi e a loro volta interagire
con l’avidina
-regolando il rapporto avidina/biotina si può formare
un reticolo esteso con la perossidasi
-è possibile regolare la sensibilità modificando il
numero di molecole di perossidasi
ESEMPI DI COLORAZIONI IMMUNOISTOCHIMICHE
neuroni dopaminergici positivi
alla tirosina idrossilasi
astroglia
astroglia attivata in
corso di
neuroinfiammazione
ISTOCHIMICA
traccianti anterogradi
traccianti retrogradi
può
essere
all’immunoistochimica
combinata