L’atomo di Bohr
Per spiegare il mistero delle righe spettrali,
Bohr propose un
Modello Atomico dell’Atomo di Idrogeno
(1913)
L’atomo di Bohr
L’atomo di idrogeno presenta un solo elettrone
1. L’elettrone
può ruotare attorno al
nucleo solo su determinate orbite
circolari dette orbite stazionarie
2. Se l’elettrone rimane su un’orbita
stazionaria
l’atomo
non
emette
energia
3. All’elettrone sono permesse solo un
limitato
numero
di
orbite,
che
posseggono determinate energie. Si
dice
cioè
quantizzate
che
le
orbite
sono
L’atomo di Bohr
4. Per saltare da un orbita a un’altra di livello energetico superiore,
l’elettrone deve assorbire energia.
Tale energia può essere fornita per mezzo del calore o di una
scarica elettrica
E2
E1
E1
L'atomo è nello
stato di energia
più basso
L'atomo assorbe
energia dal
fotone
Stato
Fondamentale
passa nello
Stato Eccitato
L’atomo di Bohr
6. L’Atomo
Quando l’elettrone
cade
un livello
di energia
inferiore,
l’atomo
5.
non gradisce
unsu
eccesso
di energia
e tende
a perderla
per
ritornare
alloluce
Stato
fondamentale
emette una
caratteristica;
La luce emessa compare come riga colorata nello spettro a righe
E1
E2
E2
E1
E1
L'atomo è nello
stato di energia
più basso
L'atomo assorbe
energia dal
fotone
Stato
Fondamentale
passa nello
Stato Eccitato
E1
Questo stato ha un
eccesso di energia
L'atomo emette
un fotone
L'atomo deve perderla
e ritornare di nuovo allo
Stato Fondamentale
ritorna allo
Stato Iniziale!!
L’atomo di Bohr
6. L’energia della luce assorbita o emessa è uguale alla differenza
fra le energie delle due orbite
E1
E2
E2
E1
E1
E = E1 – E2
Per l’assorbimento
E = E2 – E1
Per l’emissione
E1
L’atomo di Bohr
n=5
n=5 E
E55
n=4
n=4 E
E44
n=3
n=3 E
E33
n=2
n=2 E
E22
n=1
n=1 E
E11
+
Il livello di energia più basso è
Ogni
appartiene a un livello
quelloorbita
con n=1.
di energia, denominato anche
Tale livello viene chiamato Stato
guscio o strato.
Fondamentale e ha un’energia
I livelli di energia delle orbite
pari a E1
dipendono dal numero n chiamato
Inumero
livelli di
energiaprincipale.
superiore E2 E3
quantico
E
sono
chiamati
n4…..
può assumere
solo valori Stati
interi
Eccitati
positivi: poiché l’elettrone li
raggiunge n=1,2,3….
soltanto se possiede
una
sufficiente
quantità
di
energia
L’atomo di Bohr
n=5
n=5 E
E55
n=4
n=4 E
E44
n=3
n=3 E
E33
n=2
n=2 E
E22
n=1
n=1 E
E11
+
Interpretazione
dello
Spettro A Righe
l’elettrone dell’atomo, eccitato
alla fiamma o in altro modo,
salta su livelli di energia più
elevati
assumendo
valori
energetici diversi
L’atomo di Bohr
Interpretazione
dello
Spettro A Righe
n=5
n=4
L’elettrone dell’atomo eccitato,
attratto dal nucleo ritorna nello
stato fondamentale direttamente
emettendo un fotone avente
energia pari a: ∆E = E5 – E1 = hν
O scendendo gradino per gradino
cioè passando per i livelli inferiori
di energia
n=3
n=2
n=1
+
L’atomo di Bohr
Nello spettro si
osservano n=6
tante righe
quanti sono i salti dagli
n=5
stati eccitati allo stato
n=4
fondamentale
n=6
n=5
n=4
n=3
n=2
n=1
+
n=3
n=2
Interpretazione dello
Spettro A Righe
Serie di Balmer
n=6
Il modello di Bohr si poteva
applicare solo
all’atomo di idrogeno
Non riusciva a spiegare lo spettro
degli altri elementi
Modello atomico a
strati
Il modello atomico a strati spiega la natura degli
spettri atomici di tutti gli elementi
Gli elettroni negli atomi sono legati al nucleo
dall’attrazione elettrostatica che si instaura tra
le cariche positive ( i protoni nel nucleo) e le
cariche negative (gli elettroni che si muovono
nel nucleo)
Come sono sistemati gli elettroni
che ruotano attorno al nucleo?
n=7
n=6
n=5
n=4
Gli elettroni sono sistemati in
livelli di energia crescenti
Tali
livelli
di
denominati
n=3
energia
anche
sono
strati
o
gusci elettronici dell’atomo
n=2
I
livelli
di
energia
sono
numerati dal più basso al più
n=1
alto
Questi sette principali livelli di energia sono in grado di descrivere la
struttura elettronica di tutti gli elementi della tavola periodica
Ciascun livello di energia è suddiviso in uno o
più sottolivelli
La teoria prevede sottolivelli g,h,i,l,m ma per scrivere le strutture
elettroniche di tutti gli elementi della tavola periodica sono
sufficienti i primi 4 sottolivelli
s
p
d
f
Tali lettere furono inventate dagli spettroscopisti per descrivere la
serie di righe dei metalli alcalini
s (Sharp) = riga netta
d (Diffuse) = diffusa
p (Principal) = principale
f (Fundamental) = fondamentale
I sottolivelli di un livello energetico hanno valori di energia
crescenti secondo l’ordine: s<p<d<f
Ciascun livello di energia è suddiviso in uno o
più sottolivelli
n=4
n=3
4f
4d
4p
4s
3d
3p
n=4 4 sottolivelli
n=3 3 sottolivelli
3s
2p
n=2
n=2 2 sottolivelli
2s
n=1
1s
n=1 1 sottolivello
l=0
nessun piano nodale
l=1
un piano nodale
Orbitali f
Appaiono col numero quantico n = 4
e corrispondono a
l=3
ml = 0, ±1, ±2, ± 3
Quanti elettroni può contenere un livello
principale di energia n?
Può essere ricavato dalla
seguente relazione:
n=4
n=3
4f
4d
4p
4s
3d
3p
3s
no max di elettroni =2 x n2
n=1 ⇒ 2 elettroni
n=2 ⇒ 8 elettroni
n=3 ⇒ 18 elettroni
n=4 ⇒ 32 elettroni
2p
Distribuiti nei sottolivelli
2s
s = 2 elettroni
n=2
p = 6 elettroni
d = 10 elettroni
n=1
1s
f = 14 elettroni
Configurazione elettronica
La rappresentazione completa dei sottolivelli
occupati da tutti gli elettroni in un
oppure in uno ione
Per rappresentare il numero di
elettroni
che
occupa
un
determinato
sottolivello
si
usano gli esponenti:
atomo
Numero massimo
di elettroni
livello
2
s
4
sottolivello
Configurazione elettronica
Per scrivere la disposizione degli elettroni di un atomo o di
uno ione si applica la seguente regola:
Ogni atomo, nel suo stato fondamentale, avrà gli
elettroni sui livelli a più bassa energia possibile,
cioè più vicini al nucleo
Configurazione elettronica
Gli elettroni iniziano a disporsi, uno alla volta
sul sottolivello a più bassa energia fino al
numero massimo consentito
n=3
3s
n=2
2p
2s
n=1
1s
1s2 2s2 2p6 3s1
Configurazione
elettronica
dei primi
18 elementi
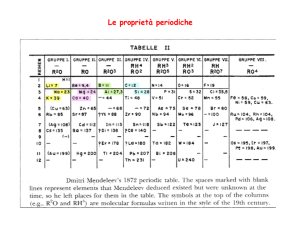
Z
atomo
Configirazione elettronica
1
H
1s1
2
He
1s2
3
Li
1s2 2s1
Il numero di
elettroni
in un atomo
neutro è uguale
al numero
atomico (Z)
dell'elemento
4
Be
1s2 2s2
5
B
1s2 2s2 2p1
6
C
1s2 2s2 2p2
7
N
1s2 2s2 2p3
8
O
1s2 2s2 2p4
9
F
1s2 2s2 2p5
10
Ne
1s2 2s2 2p6
11
Na
1s2 2s2 2p6 3s1
12
Mg
1s2 2s2 2p6 3s2
13
Al
1s2 2s2 2p6 3s2 3p1
14
Si
1s2 2s2 2p6 3s2 3p2
15
P
1s2 2s2 2p6 3s2 3p3
16
S
1s2 2s2 2p6 3s2 3p4
17
Cl
1s2 2s2 2p6 3s2 3p5
18
Ar
1s2 2s2 2p6 3s2 3p6
La somma degli
esponenti
corrisponde al
numero di elettroni
posseduto da
ciascun atomo
neutro nello stato
fondamentale
è uguale
al numero atomico
dell’elemento
Configurazione elettronica: anomalia
Perché
questa
anomalia?
n=4
n=3
3d
4s
3p
3s
n=2
2p
2s
n=1
1s
1s2 2s2 2p6 3s2 3p6 3d1
1s2 2s2 2p6 3s2 3p6 4s1
Supponiamo di avere due palazzine,
costruite lungo il fianco della montagna
Palazzina A
è stata costruita in basso
Quota 3
Il piano terra (4s)
si trova più in
basso rispetto al
terzo piano (3d)
Palazzina B
è stata costruita più in alto
Quota 4
Regola della
diagonale
Schema
che ci consente di
stabilire l’ordine
di riempimento
per tutti gli elementi del
sistema periodico
1s → 2s → 2p → 3s → 3p →
4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p →
7s → 5f → 6d → 7p
7s
7s
7p
7p
6s
6s
6p
6p
6d
6d
5s
5s
5p
5p
5d
5d
5f
5f
4s
4s
4p
4p
4d
4d
4f
4f
3s
3s
3p
3p
2s
2s
2p
2p
1s
1s
3d
3d
Configurazione Elettronica
Esterna
Strato di valenza
6e-
Lo strato più esterno di un
atomo viene chiamato
strato di valenza:
Gli elettroni contenuti nello
strato di valenza sono detti
Elettroni di valenza
3p
3o
strato
2e-
3s
6e-
2p
2o
strato
2e-
2s
1s
2e-
1o
strato
nucleo