ISTITUTO DI ISTRUZIONE SUPERIORE VIA DELLE SETTE CHIESE
LICEO PSICOPEDAGOGICO
PROGRAMMA DI
CLASSE
ANNO SCOLASTICO
INSEGNANTE
: CHIMICA
: II C P / II B P
: 2010-2011
: MARIA GRAZIA CERQUETANI
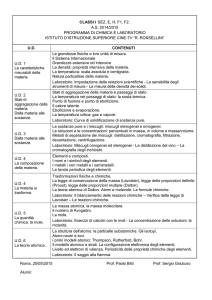
I miscugli e le sostanze
Definizione di materia, atomo, elemento, sostanza pura e miscuglio. Gli stati di aggregazione della
materia ed i passaggi di stato, ruolo di P e T . Miscugli omogenei e miscugli eterogenei..Le
soluzioni, concentrazione delle soluzioni, solvente e soluto. Solubilità e soluzioni sature. . Metodi
di separazione dei miscugli eterogenei e delle soluzioni. Le sostanze chimiche.
Le reazioni chimiche e la teoria atomica
Significato di reazione chimica. La conservazione della massa nelle reazioni chimiche: la legge di
Lavoisier.La legge di Proust e la legge di Dalton. Gli elementi chimici e i loro simboli. Definizione
di composto. La teoria atomica di Dalton.
Il linguaggio della chimica
Atomi e molecole: simboli e formule. Elementi e composti. Significato qualitativo e quantitativo
delle formule. Le equazioni chimiche. Scrittura e bilanciamento delle equazioni chimiche, i
coefficienti stechiometrici. La mole ed i calcoli stechiometrici. Il numero di Avogadro
La struttura degli atomi e la tavola periodica
Le particelle subatomiche, la loro carica e la loro massa.L’u.m.a. La struttura dell’atomo (modelli
atomici di Thomson, Rutherford e Bohr). Il principio di indeterminazione ed il modello atomico ad
orbitali. Configurazioni elettroniche.Numero atomico e numero di massa. Gli isotopi. I livelli di
energia. La struttura elettronica dell’atomo. Il sistema periodico degli elementi. I gruppi ed i
periodi. Metalli, non metalli e semimetalli. Famiglie chimiche ed elettroni di valenza.
L’elettronegatività.
I legami chimici
Le forze tra le particelle ed i legami chimici. Il legame ionico. Il legame covalente polare ed
apolare. Sostanze ioniche e molecolari. I legami tra molecole: legame idrogeno.
La nomenclatura dei composti chimici
Il concetto di valenza e numero di ossidazione.Costruzione e nomenclatura degli ossidi, delle anidridi,degli
idracidi ed ossiacidi.
Gli alunni con giudizio sospeso dovranno, con studio personale, raggiungere i seguenti:
OBIETTIVI MINIMI
1) Conoscere e comprendere i nuclei concettuali fondamentali degli argomenti trattati.
2) Esprimersi in modo chiaro anche se semplice.
3) Conoscere e usare in modo appropriato i termini e linguaggio disciplinare di base.
4) Saper risolvere semplici problemi.
5) Saper effettuare semplici collegamenti anche guidati
6) Saper leggere e utilizzare semplici grafici, schemi, disegni e tavola periodica.
Si consiglia di procedere nel seguente modo:
1) Studiare le Unità indicate nel programma.
2) Risolvere gli esercizi e i problemi proposti al termine di ogni Unità del libro di testo
3) Ripetere gli esercizi proposti in classe nel corso dell’anno.
L’Insegnante
Roma 30 maggio 2011