Comunicato Stampa
Fibrillazione Atriale: molti pazienti ad elevato
rischio di ictus non ricevono la terapia
anticoagulante orale raccomandata dalle
Linee Guida
Nuove analisi evidenziano il sottotrattamento dei pazienti con FA ad
alto rischio1,2
Sono ora disponibili i primi dati della Fase II del Registro GLORIA®FA, che evidenziano le modalità di prescrizione degli anticoagulanti
in Nord America
Risultati presentati al 64° Congresso dell’American College of
Cardiology (ACC.15)
Ingelheim, Germania, 18 marzo, 2015 – Boehringer Ingelheim ha
annunciato i risultati di due analisi del Registro GLORIA®-AF, che hanno
esaminato l’uso delle terapie anticoagulanti per la prevenzione dell’ictus
in pazienti con Fibrillazione Atriale (FA).1,2 Queste nuove analisi hanno
evidenziato che, benché l’uso di anticoagulanti orali sia in aumento negli
Stati Uniti, circa un quinto dei pazienti nordamericani con Fibrillazione
Atriale (FA) inclusi nel Registro GLORIA®-AF è stato trattato in maniera
inadeguata con antiaggregante piastrinico acido acetilsalicilico (ASA) o
non ha ricevuto alcuna terapia.1,2 Questo, nonostante le raccomandazioni
delle attuali Linee Guida statunitensi che indicano che i pazienti con
Fibrillazione Atriale con punteggio CHA2DS2-VASc, pari o superiore a 2,
sono ad alto rischio di ictus e necessitino di terapia anticoagulante.3
Questi nuovi dati sono stati presentati in sessioni poster al 64°
Congresso dell’American College of Cardiology il 16 marzo 2015 a San
Diego.
“Queste analisi di dati real life evidenziano come la classe medica abbia
diversi fattori da considerare per la scelta della terapia antitrombotica per
i pazienti con FA, ma resta il fatto che gli anticoagulanti orali, che sono lo
standard terapeutico per ridurre significativamente il rischio di ictus ed
embolia sistemica in questi pazienti, sono sottoutilizzati” - ha dichiarato
Jonathan L. Halperin, M.D., Professore di Medicina della Facoltà di
Medicina del Mount Sinai, principale autore dello studio e membro del
comitato direttivo di GLORIA®-AF “Dobbiamo continuare a comprendere
perché sia così, e cosa possiamo fare per colmare questa mancata
aderenza alle linee guida”.
Boehringer Ingelheim Comunicato Stampa pagina 1 di 7
Contatti:
Boehringer Ingelheim
Comunicazione:
Marina Guffanti
Phone: + 39 – 02 5355453
Cell. +39 348 3995284
e- mail:
[email protected]
More information
www.boehringer-ingelheim.com
2
Comunicato Stampa
Questi sono i primi dati disponibili sulle modalità prescrittive raccolti
nella Fase II del Registro GLORIA®-AF, avviato a novembre 2011, dopo
l’approvazione negli Stati Uniti di dabigatran etexilato, primo Nuovo
Anticoagulante Orale (NAO). I dati sono basati sui trend di trattamento
di 3.415 pazienti con FA, inclusi nel registro GLORIA®-FA , da novembre
2011 a febbraio 2014.1,2 Tutti i pazienti avevano una diagnosi recente di
FA e l’86% aveva punteggio CHA2DS2-VASc, pari o superiore a 2, quindi
ad alto rischio di ictus.1,2 I dati mostrano che dabigatran etexilato è
stato il NAO più ampiamente prescritto per la prevenzione dell’ictus fra
i pazienti inclusi nello studio.1,2
“Abbiamo ancora numerose sfide da vincere per garantire che i pazienti
con Fibrillazione Atriale ricevano il trattamento anticoagulante più
efficace per ridurre il rischio di ictus, che può essere invalidante o
addirittura mortale” - ha dichiarato il Professor Jörg Kreuzer, Vice
President Medicine Therapeutic Area Cardiovascular di Boehringer
Ingelheim - “Questi ultimi dati derivati da GLORIA®-AF, oltre alle
ulteriori future analisi dal registro, faranno luce sulle strategie
necessarie per eliminare le discrepanze di trattamento e garantire la
protezione ottimale contro l’ictus a tutti i pazienti”.
Poster presentati il 16 marzo
Sessione: 1246 – Risk Assessment, Exercise and Atrial Fibrillation
Patterns of newly detected atrial fibrillation and antithrombotic
treatment in North America (GLORIA™-AF Phase II)
Autori: Halperin JL, Huisman M, Diener H-C, et al. [Poster 1246124]
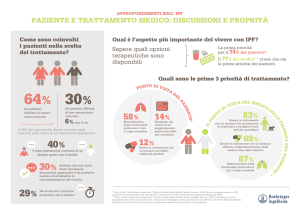
I risultati hanno dimostrato che il 21,9% dei pazienti con FA
parossistica e punteggio CHA2DS2-VASc, pari o superiore a 2, sono stati
o sottotrattati con acido acetilsalicilico (ASA) o non hanno ricevuto
alcuna terapia anticoagulante* rispetto al 12,4% e all’11,2% di coloro
che hanno avuto una diagnosi rispettivamente di FA persistente o FA
permanente.1 Le attuali Linee Guida sulla FA richiedono che i pazienti
ricevano terapia anticoagulante orale sulla base del loro rischio di ictus
e non in base al tipo di FA.3,4 Inoltre, data la disponibilità di NAO, le
Linee Guida indicano che l’uso di terapie con antiaggreganti piastrinici
*
L’analisi ha definito l’anticoagulazione orale come terapia con
warfarin o nuovo anticoagulante orale (dabigatran etexilato,
rivaroxaban o apixaban)
Boehringer Ingelheim Comunicato Stampa pagina 2 di 7
3
Comunicato Stampa
(quali ASA) per la prevenzione dell’ictus nella FA andrebbe limitata ai
pochi pazienti che rifiutano qualsiasi forma di anticoagulante orale, in
quanto le evidenze di efficace prevenzione dell’ictus con ASA sono
deboli, con possibile rischio di danno.3,4
Antithrombotic treatment in relation to age in patients with newly
diagnosed atrial fibrillation in North America (GLORIA™-AF Phase
II)
Autori: Halperin JL, Huisman M, Diener H-C, et al. [Poster 1246122]
Il secondo studio, che ha raggruppato i pazienti in base all’età e al
punteggio CHA2DS2-VASc, ha riscontrato che circa il 20% di pazienti
con FA di nuova insorgenza, di età inferiore ai 75 anni, e con punteggio
CHA2DS2-VASc pari o superiore a 2, ha ricevuto solo ASA o nessuna
terapia (20,6% dei pazienti d’età inferiore a 65 anni e 19,7% dei pazienti
d’età compresa fra 65 e 74 anni).2 A più della metà dei pazienti sono
stati prescritti NAO per la prevenzione dell’ictus, (al 25% dabigatran, al
20,5% rivaroxaban e al 6,6% apixaban).2 Gli antagonisti della vitamina K
(ad esempio warfarin) continuano a essere ampiamente usati,
soprattutto in pazienti anziani ad alto rischio, (31,7% dei pazienti d’età
pari o superiore a 80 anni e con punteggio CHA2DS2-VASc pari o
superiore a 2).2
Il registro GLORIA®-AF (Global registry on Long-Term
Antithrombotic Treatment in Patients with Atrial Fibrillation)
Oral
GLORIA®-AF è, ad oggi, il più grande studio osservazionale a livello
mondiale sull’uso delle terapie antitrombotiche nei pazienti con
fibrillazione atriale.
GLORIA®-AF amplierà la conoscenza sulle
caratteristiche del paziente che indirizzano la decisione del medico
nella scelta del farmaco.5 Il registro raccoglierà dati di efficacia e
sicurezza a lungo termine di pazienti in trattamento con differenti
terapie antitrombotiche, inclusi warfarin, ASA e NAO impiegati per la
prevenzione dell’ictus in pazienti con FA, così come gli outcome clinici
dei pazienti arruolati.
GLORIA®-AF arruolerà più di 56.000 pazienti con nuova diagnosi di
fibrillazione atriale a rischio di ictus da oltre 2200 centri in 50 Paesi. 5
Nella maggior parte dei Paesi è iniziato l’arruolamento dei pazienti, che
oggi sono oltre 20.000. La Fase II è iniziata dopo che dabigatran
Boehringer Ingelheim Comunicato Stampa pagina 3 di 7
4
Comunicato Stampa
etexilato, il primo anticoagulante orale, è stato approvato nel 2011
negli Stati Uniti.6
Per ulteriori informazioni
https://www.gloria-af.com/public/about.html
Il punteggio CHA2DS2-VASc
Il CHA2DS2-VASc è un sistema a punti utilizzato dai medici per valutare
il rischio di ictus in pazienti con fibrillazione atriale. Il sistema
attribuisce 1 punto per : età 65-74 anni, scompenso cardiaco,
ipertensione, diabete, patologie vascolari, e sesso femminile.
Attribuisce 2 punti per: età superiore ai 75 anni, precedenti ictus, TIA o
tromboembolismo (coagulo di sangue che ostruisce il flusso sanguigno
in un vaso).
In presenza di fibrillazione atriale, le linee guida europee
raccomandano la terapia anticoagulante per coloro che abbiano un
punteggio pari o superiore a 1 ad eccezione delle donne di età inferiore
a 65 anni, e che hanno solo la fibrillazione atriale in quanto il loro
punteggio pari a 1 è dovuto al loro genere. 4
Le linee guida europee ed americane raccomandano la terapia
anticoagulante in tutti i pazienti con fibrillazione atriale con punteggio
pari o superiore a 2, se non controindicato. 3,4
Dabigatran etexilato
L'esperienza clinica di dabigatran etexilato è pari a oltre 3,9 milioni di
anni/paziente per tutte le indicazioni registrate, in tutto il mondo.
Dabigatran etexilato è già da oltre 6 anni sul mercato ed è approvato in
più di 100 Paesi. 7
Attualmente, le indicazioni approvate per dabigatran etexilato sono: 8,9
Prevenzione di ictus e di embolia sistemica in pazienti con
fibrillazione atriale non valvolare
Prevenzione primaria di eventi tromboembolici in pazienti
sottoposti a intervento chirurgico elettivo di sostituzione
protesica totale di anca o ginocchio
Trattamento di trombosi venosa profonda in fase acuta ed
embolia polmonare e prevenzione secondaria di ricomparsa
della trombosi venosa e dell’embolia polmonare
Dabigatran etexilato è il farmaco pioniere e diffusamente approvato, di
una nuova generazione di farmaci anticoagulanti orali all’interno della
Boehringer Ingelheim Comunicato Stampa pagina 4 di 7
5
Comunicato Stampa
classe degli inibitori diretti della trombina (DTI), il cui obiettivo è quello
di far fronte alle esigenze mediche non ancora soddisfatte nella
prevenzione
e
nel
trattamento
delle
principali
malattie
tromboemboliche acute e croniche.10
È possibile ottenere potenti effetti antitrombotici con gli inibitori diretti
della trombina che ne bloccano l’attività in maniera mirata (sia di
trombina libera che legata al coagulo); l’enzima ha infatti un ruolo
centrale nel processo di formazione dei coaguli (trombi). 11
Diversamente dagli antagonisti della vitamina K, che agiscono in
maniera variabile tramite diversi fattori di coagulazione, dabigatran
etexilato esplica un’azione anticoagulante efficace, prevedibile e
costante, con un basso potenziale di interazione con altri farmaci e
nessuna interazione con il cibo e senza la necessità di controlli di
routine della coagulazione o adeguamenti di dosaggio. 10,12
Boehringer Ingelheim
Il gruppo Boehringer Ingelheim è una delle prime 20 aziende
farmaceutiche del mondo. Il gruppo ha sede a Ingelheim, Germania, e
opera a livello globale con 142 affiliate e più di 47.400 dipendenti.
Fondata nel 1885, l’azienda a proprietà familiare si dedica a ricerca,
sviluppo, produzione e commercializzazione di prodotti innovativi
dall’elevato valore terapeutico nel campo della medicina e della
veterinaria.
Operare in maniera socialmente responsabile è un punto centrale della
cultura e dell’impegno di Boehringer Ingelheim. La partecipazione a
progetti sociali in tutto il mondo, quali ad esempio l’iniziativa "Making
more Health", e l’attenzione per i propri dipendenti sono parte di
questo impegno di responsabilità sociale, così come lo sono il rispetto,
le pari opportunità e la conciliazione dei tempi di lavoro e della famiglia
che costituiscono le fondamenta della mutua collaborazione fra
l’azienda e i suoi dipendenti, e l’attenzione all’ambiente, alla sua tutela
e sostenibilità, che sono sottese in ogni attività che Boehringer
Ingelheim intraprende.
Nel 2013, Boehringer Ingelheim ha registrato un fatturato netto di circa
14,1 miliardi di euro e investimenti in ricerca e sviluppo pari al 19,5%
del suo fatturato netto.
Per maggiori informazioni visitate il sito
Boehringer Ingelheim Comunicato Stampa pagina 5 di 7
Per maggiori informazioni su
“quote”
Professor No Name
dabigatran
www.newshome.com
6
Comunicato Stampa
www.boehringer-ingelheim.it
Contatti:
Marina Guffanti
Comunicazione
Boehringer Ingelheim Italia SpA
Phone: + 39 – 02 5355453
Cell. +39 348 3995284
e-mail: [email protected]
Maria Luisa Paleari
Value Relations Srl
Phone: + 39 – 02 204249. 41
Cell. + 39 331 6718518
e-mail: [email protected]
Altri canali media:
www.newshome.com
www.facebook.com/boehringeringelheim
www.twitter.com/Boehringer
www.youtube.com/user/boehringeringelheim
www.youtube.com/user/CVTV
www.pinterest.com/biglobal/
www.instagram.com/boehringer_ingelheim
Bibliografia
1.
2.
Halperin JL, et al. Patterns of newly detected atrial fibrillation and antithrombotic
treatment in North America (GLORIA-AF Phase II). Abstract No./Poster No: 1246124, Presented at: the American College of Cardiology 64th Annual Scientific Session
(ACC.15), March 14-16, 2015, San Diego, CA.
Halperin JL, et al. Antithrombotic Treatment in Relation to Age in Patients with
Newly Diagnosed Atrial Fibrillation in North America (GLORIA-AF Phase II).
Abstract No./Poster No: 1246-122, Presented at: the American College of
Boehringer Ingelheim Comunicato Stampa pagina 6 di 7
7
Comunicato Stampa
Cardiology 64th Annual Scientific Session (ACC.15), March 14-16, 2015, San
Diego, CA.
3. January CT, et al. 2014 AHA/ACC/HRS Guideline for the Management of Patients
With Atrial Fibrillation: Executive Summary: A Report of the American College of
Cardiology/American Heart Association Task Force on Practice Guidelines and the
Heart Rhythm Society. Circulation. 2014 Dec 2;130(23):2071-104.
4. Camm AJ, et al. Guidelines for the management of atrial fibrillation. The Task Force
for the Management of Atrial Fibrillation of the European Society of Cardiology
(ESC). Eur Heart J. 2010;31(19):2369–2429.
5. GLORIA-AF Registry website. www.gloria-af.com, last accessed march 2015
6. Huisman M.V. et al. Design and rationale of Global Registry on Long-Term Oral
Antithrombotic Treatment in Patients with Atrial Fibrillation: A global registry
program on long-term oral antithrombotic treatment in patients with atrial
fibrillation. Am Heart J. 2014;167:329-34.
7. Boehringer Ingelheim Data on File.
8. Pradaxa® European Summary of Product Characteristics, 2014.
9. PRADAXA US Prescribing Information, 2014.
10. Stangier J. Clinical pharmacokinetics and pharmacodynamics of the oral direct
thrombin inhibitor dabigatran etexilate. Clin Pharmacokinet. 2008;47(5):285–95.
11. Di Nisio M. et al. Direct thrombin inhibitors. N Engl J Med. 2005;353:1028–40.
12. Stangier J. et al. Pharmacokinetic Profile of the Oral Direct Thrombin Inhibitor
Dabigatran Etexilate in Healthy Volunteers and Patients Undergoing Total Hip
Replacement. J Clin Pharmacol. 2005;45:555–63.
Boehringer Ingelheim Comunicato Stampa pagina 7 di 7