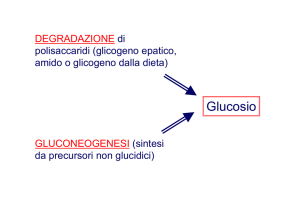
La gluconeogenesi
• La sintesi netta di glucosio, o la formazione di questo a
partire da una grande varietà di molecole che non sono
carboidrati è detta gluconeogenesi, una via metabolica che
utilizza come fonti di carbonio vari aminoacidi, lattato,
piruvato, propionato e glicerolo.
1
•La biosintesi del glucosio è una necessità assoluta
nei mammiferi, in quanto il cervello, il sistema
nervoso, la parte midollare del rene, i testicoli, gli
eritrociti e i tessuti embrionali utilizzano il glucosio
presente nel sangue come unica o principale
sostanza nutriente.
Il cervello umano consuma oltre 120 g di glucosio al
giorno
2
La gluconeogenesi permette il mantenimento
dei livelli di glicemia per molto tempo dopo la
3
completa utilizzazione di tutto il glucosio
La formazione di glucosio da precursori non
saccaridici è chiamata gluconeogenesi
(produzione di nuovo zucchero).
La gluconeogenesi è una via universale, identificata negli
animali, nelle piante, nei funghi e nei microrganismi. In tutti
i casi, le reazioni sono sempre le stesse.
Anche se le reazioni della gluconeogenesi sono le stesse in
tutti gli organismi, il contesto metabolico e la regolazione
della via differiscono da organismo a organismo e da tessuto
a tessuto.
4
I precursori del glucosio negli animali sono il lattato, il
piruvato, il glicerolo e alcuni amminoacidi (Fig. 20.1)
Negli animali superiori la gluconeogenesi avviene
prevalentemente nel fegato e in piccola parte nella corteccia
renale; il glucosio prodotto passa poi nel sangue per rifornire
gli altri tessuti.
5
6
Come la conversione glicolitica del glucosio in piruvato è
la via fondamentale del catabolismo dei carboidrati,
la conversione del piruvato in glucosio è una via
biosintetica essenziale.
Negli amimali, entrambe le vie avvengono
fondamentalmente nel citosol e necessitano di una
regolazione reciproca e coordinata. Le due vie non sono
identiche, anche se condividono diverse tappe (Fig. 20.2).
Sette delle reazioni enzimatiche della gluconeogenesi
sono l'inverso di reazioni della glicolisi
7
8
Tre tappe della glicolisi sono essenzialmente
irreversibili in vivo e non possono essere
utilizzate nella gluconeogenesi:
•
la conversione del glucosio in glucosio 6-fosfato
da parte dell'esochinasi,
•
la fosforilazione del fruttosio 6-fosfato a
fruttosio 1,6-bisfosfato da parte della
fosfofruttochinasi-1,
•
la conversione del fosfoenolpiruvato in piruvato
da parte della piruvato chinasi (Fig. 20.2).
Nelle cellule queste tre reazioni hanno una variazione di
energia libera, DG, fortemente negativa, mentre le
altre sette reazioni hanno un valore di DG vicino a 0
(Tabella 20.1).
9
10
•Queste tre tappe sono superate mediante un
gruppo diverso di enzimi, che catalizzano
reazioni diverse con, ovviamente, equilibri
diversi.
• Questi enzimi operano nella gluconeogenesi,
ma non nella glicolisi, e le loro reazioni sono
praticamente irreversibili nella direzione della
sintesi del glucosio.
•La glicolisi e la gluconeogenesi sono regolate
indipendentemente mediante controlli
esercitati su specifiche reazioni enzimatiche
che non sono comuni alle due vie.
11
Il fatto che la via che porta dal piruvato al PEP
attraversi anche i mitocondri non è certo casuale.
Il rapporto [NADH]/[NAD+) nel citosol è di 8 x 10-4,
circa 105 volte più basso di quello nei mitocondri.
Poiché il NADH viene consumato dalla gluconeogenesi
(nella
conversione
dell'I,3-bisfosfoglicerato
a
gliceraldeide 3-fosfato; Fig. 20.2), la biosintesi del
glucosio non può procedere se non è continuamente
disponibile NADH.
12
La conversione del piruvato in fosfoenolpiruvato richiede due
reazioni esoergoniche
La prima «deviazione» nella gluconeogenesi è la
conversione del piruvato in fosfoenolpiruvato.
Questa reazione non può avvenire invertendo la
reazione catalizzata dalla piruvato chinasi della
glicolisi , che ha una variazione di energia libera
molto negativa ed è irreversibile nelle condizioni
intracellulari (Tabella 20.1).
La fosforilazione del piruvato avviene mediante una
sequenza di reazioni che nei mammiferi, e in qualche
altro organismo, richiede la partecipazione di enzimi
13
sia dei mitocondri sia del citosol.
Il piruvato viene prima trasportato dal citosol nei
mitocondri oppure viene prodotto sempre nei mitocondri
dall'alanina per transamminazione.
La piruvato carbossilasi, un enzima mitocondriale che
richiede biotina come cofattore, converte poi il piruvato in
ossalacetato (Fig. 20.3):
Piruvato + HCO3- + ATP ossalacetato + ADP +
Pi
La piruvato carbossilasi è il primo enzima regolatore della
via gluconeogenetica;
l'acetil-CoA è un modulatore positivo dell'enzima.
Questa è anche una reazione anaplerotica in quanto
rifornisce di intermedi il ciclo dell'acido citrico.
Il meccanismo della reazione coinvolge la biotina come
14
trasportatore di HCO3-;).
Piruvato carbossilasi:
Biotina come gruppo prostetico
PEPCK
15
Struttura a domini della piruvato carbossilasi.
Il dominio di legame per l’ATP attiva lo ione HCO3- e trasferisce CO2 al dominio
di legame per la biotina. Da qui CO2 viene trasferito al piruvato nel dominio
centrale.
La biotina è su un “guinzaglio”
flessibile che le permette di muoversi
tra il sito dell’ATP e del bicarbonato e il
sito del piruvato.
16
17
L'ossalacetato formato dal piruvato direttamente nei
mitocondri viene ridotto reversibilmente a malato dalla
malato deidrogenasi mitocondriale a spese del
NADH: Ossalacetato + NADH + H+ L-malato + NAD+
Questa reazione, a giudicare dalla sua DG'o, è
altamente esoergonica. Ma, in condizioni fisiologiche, la
reazione ha un DG=0 ed è quindi reversibile.
La malato deidrogenasi mitocondriale perciò
funziona sia nella gluconeogenesi sia nel ciclo dell'acido
citrico, anche se l'intero flusso di metaboliti, nei due
processi, ha direzione opposta.
18
Il malato esce dai mitocondri attraverso il
trasportatore malato-a-chetoglutarato presente
nella membrana mitocondriale interna.
Nel citosol, il malato viene riossidato a
ossalacetato, con la contemporanea produzione di
NADH citosolico:
Malato + NAD+
ossalacetato + NADH + H+
19
Trasporto dell’ossalacetato
dal mitocondrio al citosol
20
L’ossalacetato
viene
poi
convertito
in
fosfoenolpiruvato (PEP) dalla fosfoenolpiruvato
carbossichinasi in una reazione in cui gli ioni Mg2+
sono cofattori essenziali e il donatore del gruppo
fosforico è il GTP (Fig. 20.3):
Ossalacetato + GTP fosfoenolpiruvato + CO2 +
GDP
Nelle condizioni intracellulari questa reazione è
reversibile; la formazione di un composto fosforilato ad
alta energia (PEP) è bilanciata dall'idrolisi di un altro
composto ad alta energia (GTP).
21
Meccanismo di reazione della PEPCK
L’ossalacetato perde CO2 e l’ossigeno attacca il gruppo g- fosforico del GTP
con la formazione di PEP e GDP.
22
La reazione complessiva di questa deviazione, è:
Piruvato + ATP + GTP + HCO3-
fosfoenolpiruvato + ADP + GDP + Pi + CO2
DG'o = 0,9 kJ/mole
23
La CO2 persa nella reazione della PEP carbossichinasi è
la stessa molecola che era stata aggiunta al piruvato
nella reazione della piruvato carbossilasi (Fig. 20.3).
Questa sequenza di reazioni di carbossilazione e di
decarbossilazione rappresenta un sistema di
«attivazione» del piruvato, in quanto la
decarbossilazione dell'ossalacetato facilita la formazione
del PEP.
Un sistema di attivazione simile viene usato per
attivare l'acetil-CoA nella biosintesi degli acidi grassi
24
Il trasporto del malato dai mitocondri al citosol e la
sua riconversione in ossalacetato ha come effetto
anche lo spostamento di equivalenti riducenti sotto
forma di NADH nel citosol, dove questo composto
tende a scarseggiare.
La via dal piruvato al PEP serve anche a bilanciare la
produzione e il consumo di NADH nel citosol durante la
gluconeogenesi.
25
Una seconda «reazione» piruvato PEP, più
breve,
diventa
predominante
quando
il
precursore della gluconeogenesi è il lattato (Fig.
20.4).
In questa via viene utilizzato il lattato prodotto
dalla glicolisi negli eritrociti o nel muscolo, in
particolare nei vertebrati di grandi dimensioni
dopo un esercizio fisico prolungato.
La conversione del lattato in piruvato nel citosol
degli epatociti genera NADH, e quindi non è più
necessaria
l'esportazione
di
malato
dai
mitocondri.
26
•Il piruvato prodotto nella reazione della
lattato deidrogenasi viene trasportato
all'interno dei mitocondri, dove viene
trasformato in ossalacetato dalla piruvato
carbossilasi.
•L'ossalacetato viene convertito in PEP
direttamente nei mitocondri ad opera di una
forma mitocondriale di PEP carbossichinasi.
•Il prodotto di questa reazione esce dai
mitocondri per entrare nella via
gluconeogenetica.
27
Il promotore del gene per la PEPcarbossichinasi
Gli ormoni influenzano l’espressione genica variando la velocità di trascrizione.
IRE = elemento di risposta all’insulina
GRE = elemento di risposta ai glucocorticoidi
TRE = elemento di risposta all’ormone tiroideo
CRE I e CRE II = elementi di risposta all’cAMP
28
Le forme citosolica e mitocondriale di
PEP carbossichinasi sono codificate da
geni nucleari diversi.
Questo è un altro esempio di enzimi
distinti che, pur catalizzando la stessa
reazione, hanno localizzazioni cellulari e
funzioni metaboliche diverse
29
Vie alternative da piruvato a
fosfoenolpiruvato.
La via che prevale dipende dalla
natura chimica del precursore
della gluconeogenesi (lattato o
piruvato).
La via indicata sulla destra (che è
più breve di quella indicata a
sinistra) prevale quando il suo
precursore è il lattato, in quanto il
NADH citosolico viene prodotto
nella reazione catalizzata dalla
lattato deidrogenasi e non è
quindi
necessario
trasportarlo
fuori dal mitocondrio.
Fig. 20.4
L’importanza relativa delle due vie
dipende dalla disponibilità di
lattato e dalla richiesta di NADH
citosolico
necessario
per
la
30
gluconeogenesi.
La conversione del fruttosio 1,6-bisfosfato in
fruttosio 6-fosfato è la seconda deviazione.
La seconda reazione della sequenza catabolica
glicolitica che non partecipa al processo
anabolico della gluconeogenesi è la
fosforilazione del fruttosio 6-fosfato catalizzata
dalla fosfofruttochinasi-1 (Tabella 20.1).
31
Nella cellula questa reazione è altamente
esoergonica
e
quindi
irreversibile,
la
formazione di fruttosio 6-fosfato da fruttosio
1,6-bisfosfato (Fig. 20.2) è catalizzata da un
altro enzima,
la fruttosio 1,6-bisfosfatasi Mg2+-dipendente,
che
produce
l'idrolisi
essenzialmente
irreversibile del gruppo fosforico sul C-1 (non il
trasferimento del gruppo fosforico all'ADP):
Fruttosio 1,6-bisfosfato + H2O
fosfato + Pi
fruttosio 6-
DG'o = - 16,3 kJ/mole
32
La conversione del glucosio 6-fosfato in glucosio
libero è la terza deviazione
La terza deviazione è la reazione finale della
gluconeogenesi, la defosforilazione del glucosio
6-fosfato a glucosio libero (Fig. 20.2). Poiché la
reazione
dell'esochinasi
nella
glicolisi
è
essenzialmente irreversibile, la reazione idrolitica
è catalizzata da un altro enzima, la glucosio 6fosfatasi:
Glucosio 6-fosfato + H2O glucosio + Pi
DG'o=-13,8 kJ/mole
33
Questo enzima, la cui attività dipende dalla presenza
di ioni Mg2+, si trova nel reticolo endoplasmatico degli
epatociti e nelle cellule renali.
La glucosio 6-fosfatasi non è presente nel muscolo o
nel cervello, e quindi la gluconeogenesi non può
avvenire in questi tessuti.
Il glucosio prodotto dalla gluconeogenesi nel fegato o
nei reni o ingerito con la dieta viene trasportato al
muscolo e al cervello dal flusso sanguigno.
34
35
La gluconeogenesi è energeticamente costosa
2 Piruvato + 4 ATP + 2 GTP + 2 NADH + 4 H2O
glucosio + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ + 2 H+
Glucosio + 2 ADP + 2 Pi + 2 NAD+
glicolisi
2 piruvato + 2 ATP + 2 NADH + 2 H+ + 2 H2O
36
La gluconeogenesi è energeticamente
costosa
Per ogni molecola di glucosio che si forma dal piruvato
vengono consumati sei legami fosforici ad alta energia,
quattro ricavati dall'ATP e due dal GTP.
Sono inoltre necessarie due molecole di NADH per la
riduzione di due molecole di 1,3-bisfosfoglicerato.
Questa reazione complessiva non è semplicemente
l'inverso della reazione della glicolisi, che converte
glucosio in piruvato producendo due molecole di ATP:
Glucosio + 2 ADP + 2 Pi + 2 NAD+ 2 piruvato + 2 ATP +
2 NADH + 2 H+ + 2 H2O
37
.
Molta dell'energia libera necessaria per rendere
possibile la gluconeogenesi rende la gluconeogenesi
stessa un processo irreversibile.
Nelle condizioni intracellulari, la variazione di energia
libera complessiva della glicolisi è di circa -63 kJ/mole.
Nelle stesse condizioni intracellulari, la variazione di
energia libera complessiva della gluconeogenesi è -16
kJ/mole.
In sostanza, sia la glicolisi sia la
gluconeogenesi sono processi essenzialmente
irreversibili nelle condizioni esistenti nella
cellula.
38
La gluconeogenesi è favorita
quando la cellula è ricca di
precursori biosintetici e di ATP.
39
40
Gli intermedi del ciclo dell'acido citrico e molti
amminoacidi sono glucogenici
La via biosintetica descritta in precedenza
consente una sintesi netta di glucosio non
solo dal piruvato, ma anche dagli intermedi
del ciclo dell'acido citrico:
1. citrato, isocitrato,
2. -a-chetoglutarato,
3. succinil-CoA,
4. succinato,
5. fumarato
6. malato
Tutti questi composti vengono ossidati nel ciclo
dell'acido citrico e sono trasformati in
ossalacetato.
41
Alcuni degli atomi di carbonio di molti
amminoacidi derivati dalle proteine sono
convertiti nelle cellule dei mammiferi sia in
piruvato sia in alcuni intermedi del ciclo
dell'acido citrico.
Dopo il distacco dei loro gruppi amminici nei
mitocondri epatici, lo scheletro carbonioso di
questi amminoacidi (rispettivamente i chetoacidi
piruvato ed a-chetoglutarato) è incanalato nella
gluconeogenesi.
42
Questi amminoacidi
possono essere
utilizzati per la
produzione di glucosio
e sono chiamati
glucogenici (Tabella
20.3).
L'alanina e la
glutammina
sono particolarmente
importanti in quanto
sono le molecole che
trasportano i gruppi
amminici dai tessuti
extraepatici al fegato
** Questi amminoacidi sono anche chetogenici
43
La gluconeogenesi e la glicolisi sono regolate in modo
reciproco
Per assicurarsi che i cicli futili non avvengano nelle
condizioni normali, la gluconeogenesi e la glicolisi
devono essere regolate separatamente e con sistemi
integrati e complementari.
Il primo punto di controllo è rappresentato dalle
reazioni catalizzate dal complesso della piruvato
deidrogenasi e dalla piruvato carbossilasi della
gluconeogenesi (Fig. 20.6)
l'acetilCoA da una parte è il modulatore positivo
allosterico della piruvato carbossilasi,
dall'altra è il modulatore negativo della piruvato
deidrogenasi,
mediante la stimolazione di una proteina chinasi che
inattiva la deidrogenasi.
44
45
•Quando le richieste energetiche della cellula
sono soddisfatte, la fosforilazione ossidativa
rallenta, il NADH non viene più consumato e il
ciclo dell'acido citrico è inibito, provocando come
conseguenza un accumulo di acetil-CoA.
• L'aumento della concentrazione di acetil-CoA
inibisce il complesso della piruvato deidrogenasi,
rallentando la sua formazione da piruvato,
•contemporaneamente stimola la gluconeogenesi
attivando la piruvato carbossilasi.
In questo modo l'eccesso di piruvato può essere
convertito in glucosio
46
Fig. 20.6
47
Il
secondo
punto
di
controllo
della
gluconeogenesi è a livello della reazione
catalizzata dalla fruttosio 1,6-bisfosfatasi, che è
inibita dall'AMP.
Il
corrispondente
enzima
glicolitico,
la
fosfofruttochinasi-1, è invece stimolato dall'AMP
e dall'ADP, mentre è inibito dall'ATP e dal
citrato.
Le due reazioni delle due vie sono quindi
regolate in modo coordinato e complementare.
48
Quando nella cellula sono presenti
concentrazioni sufficienti di acetil-CoA
o del suo prodotto di condensazione con
l'ossalacetato (il citrato),
oppure quando i nucleotidi adenilici sono per
la maggior parte nella forma di ATP,
viene favorita la gluconeogenesi.
49
La
funzione
speciale
del
fegato
nel
mantenere costante il livello di glucosio nel
sangue richiede un ulteriore meccanismo di
regolazione che coordini la produzione al
consumo.
50
Quando il livello di glucosio nel sangue
diminuisce, l'ormone glucagone segnala al
fegato di produrre e rilasciare più glucosio.
Una delle fonti di questo glucosio è il glicogeno
conservato nel fegato
L'altra è la gluconeogenesi.
51
Il F2,6P attiva la la fosfofruttochinasi e inibisce la fruttosio 1,6 bifosfatasi
Formazione e degradazione del fruttosio 2,6 bisfosfato
52
Struttura dei domini dell’enzima bifunzionale fosfofruttochinasi 2
PFK2 e FBPasi sono presenti in una singola catena polipeptidica
2
3
1
Sequenza amminoacidica dell’enzima
53
54
Fegato e cuore contengono differenti isoenzimi dell’enzima
bifunzionale PFK/FBPasi che danno differente risposta allo stesso
ormone (adrenalina).
adrenalina
glucagone
Cuore:
(attivazione glicolisi)
Fegato:
(inibizione della glicolisi)
55
Il promotore del gene per la PEPcarbossichinasi
Gli ormoni influenzano l’espressione genica variando la velocità di trascrizione.
IRE = elemento di risposta all’insulina
GRE = elemento di risposta ai glucocorticoidi
TRE = elemento di risposta all’ormone tiroideo
CRE I e CRE II = elementi di risposta all’cAMP
56
Il glucagone e l’insulina hanno effetti a lungo termine sui livelli
degli enzimi epatici coinvolti nella glicolisi e nella gluconeogenesi.
1. Nel fegato un elevato rapporto ematico glucagone/insulina
aumenta l’attività degli enzimi glucogenetici mentre dimunuisce
quella degli enzimi glicolitici.
2. Un basso rapporto glucagone/insulina ha gli effetti opposti.
Nel primo caso il glucagone segnala l’induzione della sintesi di
quantità maggiori di:
PEP carbossichinasi
fruttosio-1,6-difosfato
glucosio-6-fosfatasi
varie transaminasi
57
Il legame del glucagone col propro recettore determina un
aumento dei livelli di cAMP
1. Attivazione della proteina kinasi A (PKA) che fosforila una proteina,
CREB (cAMP response element binding protein)
2. Nella sua forma fosforilata CREB, può legarsi all’elemento di
risposta al cAMP : CRE (cAMP response element)
3. CRE a sua volta è un elemento che agisce nella regione di regolazione
dei geni che rispondono al cAMP.
4. Tutto questo promuove la trascrizione dei geni che codificano enzimi
chiave della gluconeogenesi quali la PEP carbossichinasi.
5. Con un meccanismo simile che però causa repressione della
trascrizione genica il glucagone determina la diminuzione dei livelli
di glucochinasi,6-fosofrutto-1-chinasi e piruvato chinasi.
58
L’Insulina si oppone all’azione del glucagone con un meccanismo
a cascata
1. Attivazione di una proteina legante l’elemento di risposta all’nsulina IREB.
2. IREB inibisce la trascrizione dei geni che codificano gli enzimi chiave della
gluconeogenesi legandosi all’elemento di risposta all’insulina IRE nella
regione di regolazione di tali geni.
3. Quando la sintesi di glucosio non è necessaria, in conseguenza dell’aumento
del rapporto insulina/glucagone nel sangue viene interrotta la biosintesi
degli enzimi chiave della gluconeogenesi mentre viene attivata quella degli
enzimi chiave della glicolisi
59
60
ciclo di Cori e cliclo dell’alanina
Nell’ambito della gluconeogenesi sono stati descritti 2
importanti cicli cui partecipano differenti tessuti. Il
ciclo di Cori e il ciclo dell’alanina prevedono una
prima fase di gluconeogenesi che si svolge nel
fegato, cui seguono la distribuzione e l’utilizzazione
del glucosio nei tessuti periferici. Lo scopo di
entrambi i cicli è quello di rifornire continuamente di
glucosio i tessuti che dipendono da esso come fonte
energetica primaria.
61
I cicli sono attivi soltanto tra il fegato e i tessuti che
non ossidano completamente il glucosio a CO2 e
H2O.
Per partecipare a questi processi, il tessuto
periferico deve liberare alanina o acido lattico come
prodotto finale del metabolismo del glucosio.
62
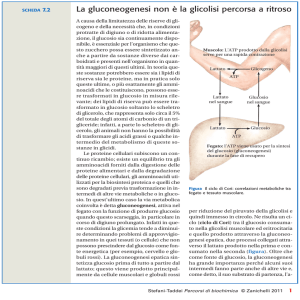
Ciclo di Cori
63
(a) Ciclo di Cori
(a)
Correlazione fra
gluconeogenesi
epatica e glicolisi
nel resto
dell’organismo.
(b)
b) Ciclo dell’alanina
64
La differenza sostanziale tra:
il ciclo di Cori
e il ciclo dell’alanina
• consiste nel tipo di intermedio a tre atomi di
carbonio che viene riciclato; infatti nel ciclo di Cori il
carbonio torna al fegato come lattato e nel ciclo
dell’alanina come alanina.
• un’altra differenza è che nel ciclo dell’alanina il
NADH ottenuto dalla glicolisi non può essere utilizzato
per produrre piruvato dal lattato
65
Nei tessuti forniti di mitocondri, gli elettroni del NADH
vengono trasferiti in questi organelli attraverso il sistema
navetta malato-aspartato o quello del glicerofosfato per la
sintesi di ATP attraverso la fosforilazione ossidativa
NADH + H+ + 1/2O2 + 3ADP + 3Pi
NAD+ + 3 ATP + H2O
oppure
FADH2 + 1/2O2 + 2ADP + 2Pi
FAD + 2ATP + H2O
Di conseguenza per ogni molecola di glucosio che partecipa
nel ciclo dell’alanina si possono produrre da 6 a 8 molecole di
ATP, mentre nel ciclo di Cori vengono prodotti soltanto 2ATP
per ogni molecola di glucosio.
66
Nel fegato le 6 molecole di ATP
necessarie per la gluconeogenesi.
sono
Il ciclo dell’alanina trasferisce anche energia
nei tessuti periferici; poiché produce da 6-8
molecole di ATP per molecola di glucosio, il
ciclo dell’alanina è più efficiente dal punto di
vista energetico.
67
La partecipazione dell’alanina al ciclo porta al fegato
azoto amminico, che deve essere eliminato come
urea.
La sintesi dell’urea è energeticamente dispendiosa,
richiedendo il consumo di 4 molecole di ATP per ogni
molecola di urea prodotta.
Le necessità energetiche per la sintesi dell’urea
determinano un aumento della quantità di ATP
necessario per sintetizzare una singola molecola di
glucosio nel fegato.
10ATPfegato + 6-8(ADP+Pi)muscolo + O2 muscolo
10(ADP+Pi)fegato + 6-8ATP muscolo
68
Cooperazione
metabolica
tra
muscolo scheletrico e fegato.
Durante un'attività muscolare molto
intensa,
il
muscolo
scheletrico
utilizza glicogeno come fonte di
energia,
generando
lattato
attraverso la glicolisi. Durante il
periodo di recupero, una parte del
lattato formato nel muscolo viene
trasportato al fegato e usato per
produrre
glucosio
mediante
la
gluconeogenesi. Il glucosio prodotto
viene rilasciato nel sangue e ritorna
al muscolo per ripristinare le riserve
di glicogeno.
Questa via (glucosio lattato
glucosio) costituisce il ciclo di Cori.
69
70
L'uso dell'alanina come trasportatore di
ammoniaca dal muscolo scheletrico che
sta lavorando al fegato è un altro esempio
dell'economia esistente negli organismi
viventi. Il muscolo che si contrae
violentemente
opera
in
condizioni
anaerobiche,
producendo
non
solo
ammoniaca dalla degradazione delle
proteine, ma anche una grande quantità di
piruvato e lattato dalla glicolisi. Questi
prodotti devono essere trasportati al
fegato: l'ammoniaca per essere convertita
in urea ed essere escreta, il piruvato e il
lattato per essere riconvertiti in glucosio e
ritornare al muscolo. Il ciclo del glucosioalanina, insieme con il ciclo di Cori realizza
questa operazione. Il dispendio energetico
della gluconeogenesi è quindi a carico del
fegato e tutto l'ATP presente nel muscolo
può essere utilizzato per la contrazione
muscolare.
71
L’aspartato fuoriesce dal mitocondrio e partecipa
alciclo dell’urea reagendo con la citrullina. Il
carbonio dell’aspartato abbandona il ciclo dell’urea
sotto forma di fumarato, successivamente
trasformato in malato ad opra della fumarasi
citosolica.
Sia questo malato che quello mitocondriale sono
trasformati in glucosio per azione degli enzimi
citosolici della gluconeogenesi.
72
I triacilgliceroli sono formati da tre gruppi O-acilici
combinati con una molecola di glicerolo.
L’idrolisi di un triacilglicerolo fornisce tre acidi
grassi e glicerolo.
Il glicerolo è un eccellente substrato per la
gluconeogenesi.
La fosforilazione del glicerolo ad opera della glicerolo
–chinasi produce glicerolo-3-fosfato che può essere
trasformato in diidrossiacetonfosfato, un intermedio
della gluconeogenesi per mezzo della glicerolofosfato
deidrogenasi.
73
74
Ossidazione degli acidi grassi a catena dispari:
Il propionato
si forma propionil CoA che
viene convertito in
succinil CoA
Il succinil CoA non viene direttamente consumato
dal ciclo dell’acido citrico ma viene prima
convertito in piruvato e poi in acetil CoA
75
Il propionil CoA che proviene dall’ossidazione degli cidi grassi a numero DISPARI di atomi di
carbonio nonché da alcuni amminoacidi, viene convertito a succinil CoA un intermedio del ciclo di
Krebs
La metil malonil CoA mutasi utilizza
un gruppo prostetico 5’ deossiadenosilcobalammina,
un derivato della vitamina B12
76
L’assunzione di etanolo inibisce la gluconeogenesi.
O
CH3-CH + NADH + H+
CH2-CH2-OH + NAD+
acetaldeide
etanolo
Piruvato + NADH + H+
Lattato + NAD+
Oppure
Ossalacetato + NADH+H+
malato+ NAD+
L’etanolo viena ossidato principalmente nel fegato con produzione di una grande quantità di equivalenti riducenti che
devono essere trasportati nel mitocondrio attraverso il sistema navetta malato-aspartato.
L’eccesso di NADH nel citosol crea dei problemi per la gluconeogenesi epatica poiché spinge l’equlibrio delle reazioni
catalizzate dalla lattato deidrogenasi e della malato deidrogenasi rispettivamente nella direzione del lattato e del
malato.
In condizioni in cui tali reazioni vengono forzate a decorrere nella direzione in cui sono scritte si ha inbizione della
sintesi di glucosio in quanto risultano limitanti le quantità di piruvato e ossalacetato disponibili per le reazioni
catalizzate, rispettivamente dalla piruvato carbossilasi e dalla PEP-carbossichinasi.
77
Ipoglicemia e intossicazione da alcol
Acidosi lattica
Ipoglicemia nei neonati prematuri:
I bambini sono più sensibili degli adulti all’ipoglicemia perché il
rapporto in peso fra cervello e corpo è maggiore nei bambini e il
loro cervello impiega quantità di glucosio sproporzionatamente
maggiori rispetto al resto del corpo.
1) Limitata capacità chetogenetica
2) Scarsa quantità di PEPCK: ridotta capacità di sintetizzare
glucosio da lattato e alanina.
3) Ridotti depositi di glicogeno epatico
Neonati più dipendenti dalla gluconeogenesi di quelli normali
78
FINE
79
80