Lavoro di gruppo Liceo Scientifico
27/28/29 settembre 2011
Ideazione di un modulo di diagnostica
Titolo: Stati di aggregazione
N. modulo 1
Ordinamento/indirizzo Liceo scientifico
Classe 3
N. ore: 10
Discipline implicate: 3 (Fisica), 2 (Matematica), 5 (Scienze Naturali)
Periodo di sviluppo Settembre /Ottobre
Docente responsabile: Scienze naturali
Risultati di apprendimento di riferimento
Competenze
Abilità
Aver raggiunto una conoscenza
Organizzare le diverse fasi delle
sicura dei contenuti fondamentali
esperienze di laboratorio
delle scienze fisiche e naturali, e
anche attraverso l’uso sistematico Interpretare i dati raccolti
del laboratorio, una padronanza
dei linguaggi specifici e dei
metodi di indagine propri delle
Elaborare relazioni di laboratorio
scienze sperimentali
Realizzare prove pratiche
Conoscenze
Stati di aggregazione.
Passaggi di stato
Miscugli omogenei
Concentrazione e solubilità
Teoria cinetica-corpuscolare
Evoluzione dei modelli atomici.
Legame chimico
Funzioni
Compito esperto/argomento (descrizione sintetica del prodotto o del servizio da realizzare):
Attraverso due prove di laboratorio lo studente applicherà il metodo scientifico seguendone le fasi:
osservazione dei fenomeni, raccolta dei dati, formulazione dell'ipotesi, verifica sperimentale, eventuale
enunciazione di una legge.
Alla fine di ciascuna esperienza laboratoriale, lo studente illustrerà l’attività svolta rispettando i requisiti
formali del metodo e del linguaggio scientifico.
1
PROCESSO DIDATTICO
Attività didattica
1) Lezione propedeutica alle
esercitazioni di laboratorio
2) Esercitazione 1 Solubilità
3) Lezione propedeutica alle
esercitazioni di laboratorio
4) Esercitazione 2 Trasformazione
fisica e trasformazione chimica
(miscuglio e composto)
Metodolo
gia
Lezione
frontale
Laboratori
alità
Lezione
frontale
I sett
Ottobre
II sett
III sett
IV sett
Laboratori
alità
5) Prova di verifica individuale
Esercitazione di laboratorio N.1 Solubilità
Materiale occorrente
Bilancia tecnica, cucchiaio o spatola, carta oleata, bacchetta di vetro, Becker da 250 ml, Becker da 500 ml,
cilindro graduato da 250 ml, cilindro graduato da 500 ml
Reagenti
sale da cucina, zucchero, bicarbonato di sodio, acqua
Modalità operativa
Pesare circa 50 g di sale da cucina su un foglio di carta oleata e annotare il dato nell'apposita tabella con la
sigla P1.
Versare 100 ml di acqua misurati con un cilindro graduato in un Becker da 250 ml.
Aggiungere, a piccole dosi, il sale all'acqua contenuta nel Becker, agitando con la bacchettina di vetro per
favorire la dissoluzione. Continuare tale operazione fino a quando anche una minima aggiunta di sale non si
solubilizzerà.
Pesare la quantità di sale rimasta sul foglio e annotare il dato in tabella con la sigla P2.
Ripetere lo stesso esperimento prima raddoppiando e poi triplicando sia il volume dell'acqua sia,
approssimativamente, la quantità di sale e annotare i relativi dati nella tabella.
Elaborazione Dati
Sottraendo dal valore P1 il valore P2, si ottiene la quantità massima di sale che è possibile sciogliere nel
volume di acqua previsto. Tale valore lo chiamerete P e lo riporterete in tabella. Dividendo il valore P per il
volume di acqua adoperato si ottiene la solubilità S, che indica la quantità massima di sale che si può
sciogliere in 1 ml di acqua.
Esperimento simulato
con sale da cucina
Volume
acqua
(mI)
100
200
300
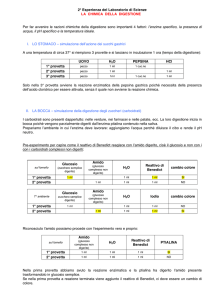
TABELLA DATI
P1(g)
P2(g)
P (g)
S(g / ml)
IPOTESI
Osservando i valori della colonna S della tabella, notate che la quantità massima di sale che si può
sciogliere in 1 mi di acqua è sempre costante, qualunque sia il volume di acqua adoperato. Tale valore è
0,36 g/ml e può essere considerato una proprietà caratteristica della soluzione sale-acqua a temperatura
ambiente.
L'osservazione dei dati ottenuti può indurre alla formulazione di un'ipotesi: la solubilità S assume un diverso
valore per ogni sostanza adoperata, rimanendo però un valore costante per ognuna di esse.
2
VERIFICA DELL’IPOTESI
Tale ipotesi va verificata attraverso l'esecuzione di altri esperimenti da condurre con la stessa metodica
descritta, ma adoperando sostanze differenti come ad esempio lo zucchero o il bicarbonato di sodio.
Volume
acqua
(mI)
TABELLA DATI
P1(g)
P2(g)
P (g)
S(g / ml)
Esperimento con
zucchero
Esperimento con
bicarbonato di sodio
Domande stimolo
1. Quali grandezze in grado di influenzare il sistema acqua- sale rimangono costanti (o meglio si ritiene
che rimangono tali, salvo misurazione ) nell’esecuzione della prova?
__________________________________________________________________________________
[Risposta: temperatura e pressione]
2. L'ipotesi formulata ha la validità di una legge generale che può essere espressa da una equazione
matematica. Quale tra le seguenti?
a) S = [g di sostanza] / [ ml solvente (acqua) ]
b) S= [g di sostanza]2 / [ ml solvente (acqua) ]
c) S = K * [g di sostanza] / [ ml solvente (acqua) ], dove K dipende dalla particolare
sostanza
d) S = [g di sostanza] / [ ml solvente (acqua) ] 2
Esercitazione di laboratorio N. 2 Trasformazione fisica e trasformazione chimica (miscuglio e composto)
Obiettivo dell’esperimento
Dall'esecuzione di questo esperimento si potrà dal vivo verificare la differenza che intercorre tra un miscuglio
e un composto e tra una trasformazione fisica reversibile e una trasformazione chimica irreversibile.
Materiale occorrente
Provette con porta provette, provetta di vetro resistente al calore, mortaio di porcellana, cucchiaio, vetrini
concavi, bilancia tecnica al decimo di grammo, becco Bunsen, pinza di legno, martello
Reagenti
Zolfo in polvere, limatura di ferro, acido cloridrico diluito, solfuro di carbonio
Modalità operativa
Prima parte
1. Porre limatura di ferro sopra un vetrino concavo e avvicinare una calamita. Osservare e riportare in
tabella quello che accade.
2. Porre una piccola quantità, circa 0,5 g, di limatura di ferro in una provetta e trattare con 8-10 ml di
soluzione di acido cloridrico diluito. Osservare e riportare in tabella quello che accade.
3. Porre 0,5 g di limatura in un'altra provetta e versare 5-10 ml di solfuro di carbonio. Osservare e
riportare in tabella quello che accade.
3
Ripetere le tre prove effettuate sulla polvere di zolfo. Osservare e riportare in tabella quello che accade.
Porre in un mortaio 10 g di limatura di ferro e 5,8 g di polvere di zolfo e mescolare i due componenti fino a
ottenere una polvere uniforme di colore grigio chiaro. Rieseguire sulla miscela ottenuta i tre saggi prima
descritti. Osservare e riportare in tabella quello che accade.
Ferro
Zolfo
Ferro+Zolfo
saggio con calamita
saggio con acido cloridrico
saggio con solfuro di
carbonio
Seconda parte
Porre in una provetta resistente al calore la miscela di 10 g di limatura di ferro e 5,8 g di polvere di zolfo,
avendo cura di non sporcare le pareti della provetta, e tappate con un batuffolo di cotone. Arroventate quindi
gradualmente con cautela il fondo della provetta che dovrà essere inclinata sulla fiamma di un becco Bunsen
e in continuo movimento. Dopo l'arroventamento, raffreddare la provetta e con un martello rompere la sua
parte inferiore sopra un mortaio, eliminando nel migliore modo possibile i cocci di vetro.
Pestare la massa scura ottenuta (solfuro di ferro) fino a ridurla in polvere e su essa eseguite ancora una
volta le tre prove che daranno i risultati da raccogliere nella seguente tabella:
Solfuro di ferro
note
saggio con calamita
saggio con acido
cloridrico
saggio con solfuro di
carbonio
Soluzione della intera raccolta dati
saggio con calamita
saggio
con
acido
cloridrico
saggio con solfuro di
carbonio
Ferro
Attira
Zolfo
non attira
Ferro+Zolfo
attira solo il ferro
Solfuro di ferro
non viene attirato
si scioglie
non si scioglie
scioglie solo il ferro
si scioglie
non si scioglie
si scioglie
scioglie
zolfo
non si scioglie
solo
lo
Domande stimolo
1. La miscela ferro+zolfo è un miscuglio. Perché?
2. La sostanza ottenuta nella seconda parte della prova è un composto. Perché?
3. Il composto ottenuto è il risultato di una reazione chimica. E’ una reazione di sintesi o di
decomposizione?
4. Come potrebbe essere schematizzata la reazione chimica che ha dato luogo al composto?
4
PROVA DI VERIFICA INDIVIDUALE
Finalità dell’accertamento: programmare l’attività didattica di laboratorio della classe terza partendo dalle
effettive capacità degli studenti di agire la competenza di riferimento.
Esperimento di laboratorio Reazione di decomposizione: composti ed elementi
In questo esperimento vengono eseguite alcune prove di decomposizione in maniera da verificare che da
una sostanza pura possono essere ottenute sostanze più semplici, che possono essere o composti o
elementi.
Materiale occorrente
Provetta con porta provette, provette resistenti al calore, pinza di legno, stecchini di legno, becco Bunsen,
spatolina
Reagenti
Ossido di mercurio
(HgO)
Clorato di potassio
(KClO3)
Soluzione diluita di nitrato d'argento (AgNO3)
Modalità operativa
(Il docente realizza le due prove di laboratorio descritte e somministra un questionario agli studenti)
Prima prova
Introdurre in una provetta, resistente al calore e ben asciutta, una piccola quantità di ossido di mercurio
(HgO), che è una sostanza rosso-arancio.
Adoperando una pinza di legno, riscaldare il fondo della provetta, prima delicatamente e poi fortemente,
spostandola continuamente sulla fiamma di un becco Bunsen.
Dopo averla riscaldata per almeno 5 minuti, mantenendola sempre sulla fiamma, affacciare allo sommità
della provetta uno stecchino di legno che brucia senza fiamma e osservare che la combustione dello
stecchino viene visibilmente ravvivata.
Interrompere il riscaldamento e osservare che dopo il raffreddamento sulla parete della provetta si sono
depositate piccole goccioline di mercurio.
Che cosa è verosimilmente accaduto?
Seconda prova
Introdurre in una provetta resistente al calore, ben asciutta, una piccola quantità (1-2 g) di clorato di potassio
KClO3, che è una sostanza bianca. Scaldare dapprima cautamente e poi energicamente il fondo della
provetta, reggendola con una pinza di legno e spostandola continuamente sulla fiamma. Per effetto del
calore la sostanza si rigonfia, eliminando gas, che, come nel caso precedente, ravviva la combustione di uno
stecchino di legno appena spento.
Interrompere il riscaldamento quando la sostanza non rigonfia più e comincia a fondere.
La sostanza che rimane nella provetta ha lo stesso aspetto del clorato di potassio prima introdotto, ma non
è detto che si tratti della stessa sostanza.
Infatti, inserendo una piccola quantità della sostanza ottenuta, disciolta in un po’ d’acqua, in un’altra provetta
e trattando con qualche goccia di soluzione diluita di nitrato d’argento, si osserverà la produzione di un
precipitato bianco.
Effettuando la stessa prova su una piccola quantità di clorato di potassio, non si otterrà lo stesso risultato.
Domanda stimolo
I due composti ottenuti nella seconda prova sono lo stesso composto o sono diversi? (barrare la riposta ritenuta esatta) :
Sì ; No ;
Non si è in grado di stabilirlo .
Motivate la risposta.
Risposta esatta:
No
E’ la differente azione prodotta sui due composti da parte del nitrato d’argento a stabilire che si tratta di due diverse sostanze.
5
Questionario da somministrare al termine dell’ esperimento di Laboratorio “Reazione di
decomposizione: composti ed elementi”
1. Completare il testo seguente
1.a Le due prove effettuate sono esempi di reazioni di ____________.
1.b Nel primo esperimento da una sostanza pura, l'ossido di mercurio (rosso arancio), si ottengono
________________.
1.c Schematizza la reazione eseguita, ricordando che HgO rappresenta una molecola di ossido di
mercurio (il mercurio ha simbolo Hg, dal lat. Hydrargirum) e che O2 rappresenta una molecola
di ossigeno : ___________________________
1.d Nella seconda prova da una sostanza pura, il clorato di potassio KClO3, si ottiene
_________________________________________________________________________
1.e Motivare la risposta ad 1.d____________________________________________________
____________________________________________________________________________
____________________________________________________________________________
1.f La reazione è quindi una reazione di _________________ .
Analisi degli item 1.a, 1.b, .1c, 1.d, 1.f
Risposte esatte:
1.a decomposizione
1.b due sostanze: il mercurio visibile sotto forma di piccole gocce sulla parete della provetta; l’ossigeno
rilevato per la sua proprietà di favorire la combustione (effetto comburente).
1.c Da HgO si passa a Hg ed O2 , quindi una coerente schematizzazione della reazione è la seguente, che
rispetta la legge della conservazione della massa,
HgO -> Hg + ½ O2
1.d Di nuovo ossigeno O2 e una sostanza residuale che si dimostra essere differente dal clorato di
partenza.
1.f decomposizione
Abilità di riferimento: Interpretare le osservazioni e/o i dati raccolti
Indicatore di prestazione : Esposizione (o descrizione)
Punteggio max: 15
Analisi dell’item 1.e
Risposta esatta:
1.e Lo sviluppo di ossigeno è attestato dal ravvivarsi della fiamma nello stecchino. Nel test con nitrato
d’argento, il clorato di potassio non reagisce (assenza di precipitato), mentre la sostanza residuale in
provetta reagisce (presenza di precipitato): le due sostanze pertanto sono differenti. Inoltre poiché il clorato
di potassio è una sostanza ternaria (KClO 3 ), costituita da ossigeno O2 ,cloro Cl2 e potassio K , e l’ossigeno
si è sviluppato in forma gassosa, abbandonando la provetta, la sostanza rimasta non potrà che essere un
composto di cloro e potassio.
Abilità di riferimento: Interpretare le osservazioni e/o i dati raccolti
Indicatore di prestazione: Argomentazione
Punteggio max : 3
2. Dire da quante fasi è costituito un miscuglio omogeneo.
________________________________________________________
Analisi dell’item 2
Risposta esatta: Un miscuglio omogeneo è costituito da un’unica fase.
Abilità di riferimento: Classificare
6
Indicatore di prestazione: Esposizione/descrizione
Punteggio max: 2
3.
Indicare con una X quali dei seguenti sistemi è un miscuglio eterogeneo e quale omogeneo
SISTEMA
una limonata zuccherata con
cubetti di ghiaccio
una sigaretta accesa
300 chiodi di ferro
un bicchiere di Coca-Cola
una tazza contenente olio e aceto
Omogeneo
Eterogeneo
Analisi dell’ item 3
Risposta esatta
SISTEMA
una limonata zuccherata con
cubetti di ghiaccio
una sigaretta accesa
300 chiodi di ferro
un bicchiere di Coca-Cola
una tazza contenente olio e
aceto
Omogeneo
Eterogeneo
X
X
X
X
X
Abilità di riferimento: Classificare
Indicatore di prestazione: Esposizione/descrizione
Punteggio max : 5
4. Tra le sostanze sotto elencate indicare con una X le sostanze pure.
SOSTANZA
acqua corrente
aria pura
cloruro di potassio
legno
idrogeno
acqua distillata
mercurio
ossigeno
PURA
Analisi dell’item 4
Risposta esatta
SOSTANZA
acqua corrente
aria pura
cloruro di potassio
legno
idrogeno
acqua distillata
mercurio
ossigeno
PURA
X
X
X
X
X
Abilità di riferimento: Classificare
Indicatore di prestazione: Esposizione/descrizione
Punteggio max: 8
7
5. Misurare la temperatura di un liquido incolore, che sappiamo essere una sostanza pura, non è
sufficiente per stabilire di quale liquido si tratta. In quali condizioni la misura della temperatura del
materiale può darci utili informazioni per la sua identificazione?
Analisi dell’item 5
Domanda semistrutturata a risposta aperta
Risposta esatta
Se misuriamo la temperatura a cui un liquido si trova in un determinato istante, non possiamo nient’altro
che constatare quello che misuriamo, senza poter fare ipotesi sulla sua identità. Non riusciamo a
stabilire di che liquido si tratta. Se proviamo a fornire al liquido calore in condizioni di pressione costante
fino ad indurre la trasformazione di stato liquido – vapore (evaporazione), e misuriamo la temperatura a
cui ciò avviene, individuiamo un punto fisso caratteristico della sostanza. Consultando tabelle dei liquidi
noti, si può così risalire all’identità del liquido.
Abilità di riferimento: Interpretare le osservazioni e/o i dati raccolti
Indicatore di prestazione: Argomentazione
Punteggio max: 3
6.
Esaminare la vignetta sotto riportata e fare considerazioni motivate sul tipo di trasformazione effettuata
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
Analisi dell’item 6
Risposta esatta
Si è di fronte ad una reazione di combustione di un fiammifero, avviata da un’altra reazione, di natura
violenta, innescata dall’azione meccanica di sfregamento della capocchia dello stesso. La natura chimica,
cioè irreversibile, della trasformazione è sancita dal fatto che dà esiti permanenti: il fiammifero è bruciato,
nero e fumante, è mutata quindi la propria composizione e non può essere riportato con mezzi fisici al sua
condizione iniziale.
Abilità di riferimento: Interpretare le osservazioni e/o i dati raccolti
Indicatore di prestazione: Argomentazione
Punteggio max: 3
7. Specificare con una X, per ciascuna delle seguenti trasformazioni, se si tratta di fenomeno fisico o di
fenomeno chimico, motivando brevemente la scelta effettuata
TRASFORMAZIONE
Fenom.
fisico
Fenom.
chimico
Motivazione della scelta
7.a
l'ingiallimento delle foglie in una
pianta in autunno
7.b
la dissoluzione di un'aspirina in
8
un bicchiere d'acqua
7.c
l'azione di un 'aspirina nel corpo
di un individuo che ha il
raffreddore
7.d
l'ebollizione dell'acqua
7.e
lo sturamento di un lavandino
mediante l'uso di una pompa
7.f
lo sturamento di un lavandino
mediante l'uso del Niagara
Analisi dell’item 7
Risposta esatta
TRASFORMAZIONE
7.a
l'ingiallimento delle foglie in
una pianta in autunno
7.b
la dissoluzione di un'aspirina
in un bicchiere d'acqua
7.c
l'azione di un 'aspirina nel
corpo di un individuo che ha il
raffreddore
Fenom.
Fisico
Fenom.
chimico
X
Il cambiamento di colore è un chiaro segnale del concretizzarsi di una
reazione chimica
Si tratta del concretizzarsi di una soluzione acquosa e quindi di una
trasformazione reversibile.
X
X
7.d
l'ebollizione dell'acqua
7.e
lo sturamento di un lavandino
mediante l'uso di una pompa
7.f
lo sturamento di un
lavandino mediante l'uso di
uno sgorgatore chimico
Motivazione della scelta
X
X
X
L’aspirina (l'acido acetilsalicilico) esplica la propria azione scindendosi in
vivo (nell’organismo) nel salicilato, il sale che ad alte concentrazioni
attiva l'AMPK, un “sensore” dell'energia cellulare presente in tutti gli
organismi eucarioti che regola diversi importanti processi, tra cui la
crescita cellulare e il metabolismo.
A livello biochimico, il salicilato agisce inibendo un enzima responsabile
della sintesi delle prostaglandine, che a loro volta regolano numerosi
fenomeni biologici, tra cui l'infiammazione, la sensibilità dolorifica, la
febbre, le secrezioni degli organi digerenti, la filtrazione dei liquidi a
livello renale, la riproduzione e la coagulazione del sangue.
Si è di fronte ad una trasformazione di stao, pertanto ad una
trasformazione reversibile quindi fisica.
L’azione meccanica svolta dalla pompa non produce alcuna
trasformazione della natura delle sostanze coinvolte.
Uno sgorgatore chimico può contenere acido solforico oppure soda
caustica, pertanto assolve al proprio compito dissolvendo le sostanze
che causano l’ostruzione. Si tratta di un’azione di natura chimica.
Abilità di riferimento (risposte date nelle colonne Fenomeno fisico e Fenomeno chimico):
Classificare
Indicatore di prestazione: Esposizione/descrizione
Punteggio max : 8
Abilità di riferimento (risposte delle colonne Motivazione della scelta): Interpretare le osservazioni e/o i
dati raccolti
Indicatore di prestazione: Argomentazione
Punteggio max: 16
8) Delle trasformazioni sottodescritte quali si riferiscono a una reazione di sintesi tra elementi per ottenere un
composto e quali si riferiscono a una reazione di decomposizione di un composto per ottenere composti più
semplici o elementi?
Motivare le scelte operate.
Trasformazione
Reazione di
Sintesi
Reazione di
Decomposizione
Motivazione della scelta
8.a
Un solido bianco viene
riscaldato in un sistema
chiuso; si sviluppa un gas
e il solido rimasto dopo il
riscaldamento pesa
9
meno del solido
originario.
8.b
Un metallo viene
riscaldato; dopo il
riscaldamento, cambia
colore e aumenta di
peso.
8.c
Una polvere nera viene
riscaldata con ossigeno;
il solo prodotto che si
ottiene è un gas incolore
il cui peso corrisponde a
quello della polvere
originale e dell'ossigeno
combinato.
Analisi dell’item 8
Risposta esatta
Trasformazione
8.a
Un solido bianco viene riscaldato in
un sistema chiuso; si sviluppa un gas
e il solido rimasto dopo il
riscaldamento pesa meno del solido
originario.
8.b
Un metallo viene riscaldato; dopo il
riscaldamento, cambia colore e
aumenta di peso.
8.c
Una polvere nera viene riscaldata
con ossigeno; il solo prodotto che si
ottiene è un gas incolore il cui peso
corrisponde a quello della polvere
originale e dell'ossigeno combinato.
Reazione di
Sintesi
Reazione di
Decomposizione
X
X
X
Motivazione della scelta
Lo sviluppo di gas e la diminuzione di peso del residuo
sono chiari sintomi che si in presenza di una reazione di
decomposizione.
Qualcosa si separa da qualcos’altro.
L’aumento di peso (ed il conseguente viraggio )
segnalano che qualcosa si aggiunto al metallo. La
reazione è additiva.
E’ ancora l’aumento di peso del prodotto della reazione (la
somma dei reagenti) ad esser una chiara indicazione che
si è assistito ad una reazione di sintesi.
Abilità di riferimento (colonne Reazione di sintesi e Reazione di composizione): Classificare
Indicatore di prestazione: Esposizione/descrizione
Punteggio max : 3
Abilità di riferimento (colonna Motivazione della scelta): Interpretare le osservazioni e/o i dati raccolti
Indicatore di prestazione: Argomentazione
Punteggio max: 6
10
Griglia di correzione della prova
Competenza
Abilità
Interpretare le
osservazioni e/o i
dati raccolti
Aver raggiunto una conoscenza
sicura dei contenuti fondamentali
delle scienze fisiche e naturali, e
anche attraverso l’uso sistematico del
laboratorio, una padronanza dei
linguaggi specifici e dei metodi di
indagine propri delle scienze
sperimentali
Classificare
Interpretare le
osservazioni e/o i
dati raccolti
Indicatori
Criteri
Item
prova
Punteggio
max
Esposizione /
descrizione
Ordine
Pertinenza
Esattezza
Completezza
1.a
1.b
1.c
1.d
1.f
3
3
3
3
3
Argomentazione
Ordine
Pertinenza
Esattezza
Completezza
1.e
3
Ordine
Pertinenza
Esattezza
Completezza
Esposizione/
descrizione
Argomentazione
Ordine
Pertinenza
Esattezza
Completezza
2
3
4
7.a
7.b
7.c
7.d
7.f
8.a
8.b
8.c
5
6
7.a
7.b
7.c
7.d
7.f
8.a
8.b
8.c
TOTALE PUNTI
2
5
8
1
1
1
1
1
1
1
1
3
3
2
2
2
2
2
2
2
2
63
Griglia di osservazione degli studenti in Laboratorio
Assente
Incerta
Sufficiente
Sicura
LIVELLO
INDICATORE
Manualità
Organizzazione del proprio lavoro
Autonomia nella soluzione di
difficoltà pratiche o cognitive che si
possono presentare
Scrupolosità di misura: attenzione e
rispetto del dato sperimentale
Osservazione logico-interpretativa
11