LA MATERIA- parte prima
LA MATERIA di cui sono costituiti i corpi è tutto quello che ci circonda che occupa spazio e che possiede
massa ed energia. Si può trovare nei tre stati di aggregazione: solido, liquido e gassoso.
Si presenta sotto una enorme varietà di forme e colori eppure è fatta da un numero relativamente piccolo di
componenti base: gli elementi chimici (sono 92 quelli naturali).
La materia ci appare come qualcosa di continuo ma in realtà è discontinua, composta da atomi singoli o da
atomi legati assieme a formare molecole.
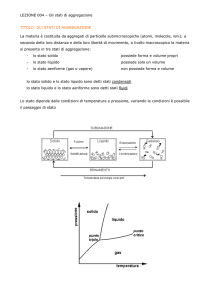
La materia esiste in diversi stati fisici, detti anche stati di aggregazione della materia: solido, liquido e
gassoso. A livello particellare nello stato solido gli atomi o molecole sono molto ravvicinate e possono dare
luogo a disposizioni ordinate ripetitive; non sono immobili, ma vibrano attorno alla propria posizione; in
quello liquido le particelle sono altrettanto vicine tra loro ma possono scorrere liberamente scambiandosi di
posto; allo stato gassoso le particelle sono molto distanti l’una dall’altra e libere di muoversi.
Esiste poi un quarto stato della materia: il plasma
La materia è uno di componenti fondamentali del nostro Universo, ma esiste un altro componente altrettanto
importante: l’energia, intesa come la capacità di compiere un lavoro o di fornire calore
UN CORPO è una porzione limitata di materia.
UN SISTEMA è un corpo o un insieme di corpi che costituiscono oggetto di indagine della chimica.
UNA FASE è una porzione di sistema che è separata dal resto da superfici limitanti definite, avente identiche
proprietà fisiche in tutti i suoi punti, es. acqua e ghiaccio.
PROPRIETA' MATERIA
Chimiche :descrivono una sostanza tramite la sua composizione chimica e la sua tendenza a cambiare in
un'altra sostanza cioè a subire trasformazioni chimiche es: infiammabilità dell'alcool, l'arrugginimento del
ferro, tossicità di una sostanza, l'annerimento alla luce di una pellicola fotografica, la combustione del
metano.
Fisiche: descrivono una sostanza tramite parametri fisici, grandezze fisiche misurabili; quelle tipiche di una
sostanza sono ad es.: densità, solubilità, punto di ebollizione, tensione di vapore, viscosità, tensione
superficiale, punto di fusione, durezza, duttilità, malleabilità.
Organolettiche: sono quelle rilevabili con i nostri sensi e a differenza di quelle fisiche non sono misurabili;
alcuni es sono: odore, sapore, colore, untuosità.
LA MATERIA SI TRASFORMA
Trasformazione fisica- cambia l’aspetto fisico della materia ma la sua composizione è la stessa
Trasformazione chimica- cambia la composizione della materia perchè si formano nuove sostanze
In molti casi le trasformazioni fisiche e chimiche della materia avvengono quando scaldiamo o raffreddiamo
la materia cioè somministriamo e sottraiamo calore.
Il calore non va confuso con la temperatura
Il calore (o Energia Termica) è l’energia in transito che si trasferisce spontaneamente da un corpo a temperatura
maggiore al corpo a temperatura minore fino al raggiungimento dell’equilibrio termico.
Gli atomi e le molecole che costituiscono la materia posseggono sempre una energia cinetica, perché sono in
movimento. L’energia termica deriva dall’incessante movimento delle particelle.
Possiamo misurare l’energia termica di un corpo misurando la temperatura: se ha bassa temperatura le particelle si
stanno muovendo lentamente, altrimenti se ha elevata temperatura le particelle si muovono più velocemente.
o A parità di calore assorbito la variazione di temperatura di due corpi differenti (acqua e ferro) può essere
differente perché la stessa energia si distribuisce tra particelle che l’assorbono in maniera diversa
o A parità di calor fornito a masse diverse della stessa sostanza, l’energia viene distribuita tra un numero più o
meno grande di particelle; il campione di massa maggiore si scalda più lentamente
Vapore e gas
L’acqua evaporando a temperatura ambiente diventa vapor d’acqua. Quando parliamo di ossigeno o azoto atmosferico
parliamo di gas. Vapori e gas indicano lo stato aeriforme ma con una differenza:
Mentre i vapori possono essere portati allo stato liquido anche per sola compressione a T ambiente, i gas passano allo
stato liquido per compressione solo dopo essere stati raffreddati al di sotto di una particolare Temperatura detta
“Temperatura critica”
L’ossigeno ha una T critica di –119°C a temperatura ambiente quindi è un gas e rimane tale anche se viene compresso.
Per portarlo allo stato liquido bisogna raffreddarlo al di sotto di –119°C. L’acqua ha una T critica di –374°C, pertanto
a T ambiente si trova allo stato liquido; il gas d’acqua esiste solo al di sopra di 374°C.