Terapia Cellulare e Cellule Staminali
Corso di Genetica Umana
secondo semestre, sessione estiva 2001
Prof.ssa M.L. Mostacciuolo
Introduzione (Gage 1998, Smith 1998, Solter 1999)
Lo stato di danno e malattia sono spesso
associati con perdita e morte di cellule o con
disfunzioni cellulari.
Lo scopo della terapia cellulare è sostituire,
riparare e aumentare la funzione biologica di un
tessuto od organo danneggiato. Il successo di
questa
terapia
a
livello
clinico
richiede
un’integrazione di molte discipline includendo
biologia cellulare e molecolare, immunologia,
ingegneria tissutale, biologia del trapianto e la
conoscenza clinica del singolo caso da trattare.
In generale i trapianti cellulari riusciti hanno
richiesto l’uso delle cellule staminali (SC).
Le SC sono definite cellule indifferenziate in
grado di produrre figlie identiche e figlie che
sono destinate a differenziarsi: sono in grado
cioè di autorinnovarsi e dare origine alle cellule
progenitrici di qualsiasi tessuto somatico; sono
perciò considerate pluripotenti in quanto in grado
di accrescersi in tutti i tipi cellulari adulti.
Derivano dalla massa interna della blastocisti, da
uno stadio embrionale precoce, da particolari
tumori germinali o da teratocarcinoma. Un
tessuto adulto contiene solo un piccolo numero di
SC e progenitori tissutali e sono spesso ristretti a
una discreta localizzazione anatomica; sono in
uno stato quiescente: sono necessari stimoli
ambientali, normalmente assenti, per la loro
attivazione.
In un organismo in cui un tessuto od organo sia
danneggiato, il riparo dipende dalla capacità
proliferativa del tessuto stesso: epatociti, cellule
endoteliali o mioblasti sono in grado di dividersi e
rimpiazzare ciò che è stato danneggiato; negli
altri tessuti la sostituzione delle cellule perse
avviene con le SC residenti. Ma non solo, studi di
trapianto in roditori indicano che cellule derivate
da midollo osseo o staminali extraepatiche
possono differenziarsi in epatociti: femmine, che
hanno ricevuto un trapianto di midollo osseo da
maschi, presentavano epatociti cromosomaY
positivo dopo danneggiamento epatico (alcuni
epatociti hanno proprietà simili a quelle delle
cellule staminali suggerendo che siano queste i
principali precursori degli epatociti); mentre
fegati di femmine trapiantati in maschi
presentavano epatociti cromosomaY positivo
(dopo un danno epatico, cellule staminali
facoltative
del
dotto
biliare
si
attivano
producendo cellule ovali che eventualmente si
differenziano in epatociti) (Alison 2000). Anche
analisi di muscolo scheletrico hanno evidenziato
l’esistenza di precursori diversi dal tessuto preso
in esame che partecipano alla sostituzione: il
numero
di
cellule
satelliti
(precursori
mononucleati dei mioblasti) residenti in un
muscolo adulto è inferiore a quello dei precursori
miogeni che popolano il muscolo dopo un danno;
ciò può essere spiegato come migrazione di cellule
satelliti da altre fibre o reclutamento alla
miogenesi di cellule non miogene residenti (Ferrari
1998).
Per i trapianti cellulari la proprietà delle SC di
autorinnovarsi è cruciale: mantiene a lungo
termine il trapianto e rinnova il tessuto in cui
risiede oltre che portare in larga scala alla
produzione di cellule per il trapianto.
L’isolamento e l’espansione ex vivo di SC sono la
prova decisiva per la produzione di cellule
immature che saranno componente del trapianto
in un tessuto adulto: ma isolamento, espansione e
manipolazione genetica di SC hanno avuto solo
parziale successo. Sono le cellule staminali
embrionali (ESC)
che
sono
geneticamente
trattabili, fenotipicamente stabili, si possono
espandere indefinitamente e possono essere
indotte a differenziare in vitro in linee diverse. Si
possono isolare ESC da blastocisti prima
dell’impianto ma in molti paesi è vietato: da
tessuto fetale abortito è invece consentito isolare
cellule staminali pluripotenti (umane, HPC). Le
ESC di topo sono tumorigeniche (infatti, crescono
da teratocarcinoma quando sono iniettate in
qualunque tessuto di topo adulto): la purificazione
completa di ESC deve essere perciò assolutamente
sicura per il trapianto, in modo da poterne
usufruire in terapia.
Esiste un dibattito sull’utilizzo in terapia di queste
cellule dovuto alla considerazione di che cosa sono
le ESC: sono in grado di sviluppare un embrione?
Lo zigote (cellula germinale fecondata) è la sola
cellula totipotente in grado di generare qualsiasi
tipo cellulare per qualsiasi tessuto dell’embrione
ed extraembrionale; Le ESC, in particolari
esperimenti (chimera di uno zigote tetraploide e
ESC), si sono dimostrate in grado di formare tutti i
tipi cellulari dell’organismo ma non è chiaro se
possano formare i tessuti extraembrionali: è
accertato però che ESC impiantate in utero non
sono in grado di sviluppare un embrione.
Materiale (Gage 1998, Smith 1998, Solter 1999)
Sostanzialmente esistono solo due tipi di approcci
per ottenere le cellule per il trapianto: si può
purificare SC dal tessuto adulto o servirsi del
nucleo di cellule di tessuto adulto.
La programmazione a cellule del tessuto
desiderato può avvenire in modi diversi:
isolamento, espansione e manipolazione delle
cellule staminali di un tessuto adulto
clonazione terapeutica: in un oocita (di
mammifero) denucleato è iniettato un nucleo
di cellula adulta (proveniente da una biopsia di
cellule somatiche); dalla massa interna della
blastocisti che si formerà in cultura, per
immunochirurgia, s’isolano ESC, che dopo
espansione, differenzieranno nelle cellule
desiderate secondo il protocollo adottato
La scelta della sorgente delle cellule per il
trapianto è dipendente da molti fattori: deve
essere
facilmente
accessibile,
abilmente
coltivabile, moltiplicabile e manipolabile.
Possono essere cellule autologhe: l’uso di
cellule
dello
stesso
organismo
è
immunologicamente privilegiato ma ha una
fornitura limitata (ecco la moltiplicazione in vitro
e la crioriserva); ci sono esempi di trapianto di
keratinociti per vittime di scottature estese,
condrociti per danni alle cartilagini articolari ed
esempi di aumento della risposta immunitaria
contro deboli antigeni o l’induzione delle cellule
tumorali ad esprimere più determinanti antigenici
di superficie.
Oppure cellule allogeniche: l’uso di cellule di
organismi della stessa specie fornisce una gran
quantità di materiale ma è immunologicamente
svantaggioso (ecco l’immunosoppressione del
paziente e l’incapsulamento del trapianto).
Esistono tipi cellulari che stimolano fortemente la
risposta immunitaria come leucociti e cellule
endoteliali: se si usano popolazioni pure si ha
una risposta minima come avviene con
mioblasti; oppure inducendo nell’ospite la
tolleranza specifica per le cellule del donatore, si
può minimizzare la risposta immunitaria. La
tecnologia dell’incapsulamento del trapianto vede
l’isolamento delle cellule del trapianto, con una
barriera impermeabile, da cellule ed agenti
ormonali del sistema immunitario dell’ospite; i
requisiti di un incapsulamento di successo
includono la diffusione bidirezionale attraverso la
membrana di piccole molecole come ossigeno o
glucosio e prodotti cellulari delle cellule della
capsula.
È requisito sia per trapianti autologhi sia
allogenici fare il cariotipo periodicamente per non
introdurre riarrangiamenti cromosomici.
Sorgente di cellule da trapianto possono
essere anche cellule xenogeniche: l’uso di cellule
di specie diverse presentano una gran fornitura
di materiale (ecco ancora incapsulamento ed
immunosoppressione
oltre
che
immunità
mascherata
geneticamente)
ma
possono
potenzialmente trasferire nuovi virus alla
popolazione umana.
Infine si possono utilizzare le linee cellulari
che sono facilmente clonabili e mantenute come
popolazione omogenea, più maneggevole per
l’ingegneria genetica a produrre nuove cellule
che possono sintetizzare e secernere prodotti
genici
terapeutici;
gli
svantaggi
sono
trasformazione e immortalizzazione che spesso
fanno perdere la loro abilità a differenziarsi
pienamente. Ma è possibile sviluppare linee
cellulari con l’espressione regolabile di oncogeni:
cellule
trasformate
o
immortalizzate
per
induzione sono create inserendo, con un vettore
retrovirale, il gene vmyc ad espressione
controllata dalla presenza (repressione del gene)
o assenza della tetraciclina. Anche le linee
cellulari possono avere lo svantaggio della
risposta immunitaria. Trapianti di mioblasti o
fibroblasti ingegnerizzati a secernere enzimi in
quantità fisiologiche hanno risolto molte lesioni in
alcuni organi come cervello, fegato, isole del
pancreas e milza.
In situazioni che richiedono più funzioni complesse
oppure in cui le SC (residenti nel tessuto adulto)
sono localizzate in spazi critici alla loro utilità,
sono utilizzate altre sorgenti: epitelio pigmentato
della retina da cadavere o feto per degenerazioni
all’occhio; e per danni al sistema nervoso centrale
o al midollo spinale, cellule neurali fetali.
Il morbo di Parkinson provoca disturbi di postura e
deambulazione collegati alla degenerazione dei
neuroni dopaminergici della sostanza nera (pars
compacta) che terminano nel corpo striato da cui
parte la risposta extrapiramidale ai motoneuroni di
muscoli di postura ed arti. Trapianti di dissezioni
fetali di sostanza nera contenenti neuroni
dopaminergici hanno dato effetti a lungo termine
in alcuni pazienti affetti.
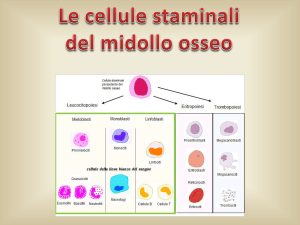
Per malattie legate alla linea ematopoietica, le
sorgenti primarie per i trapianti clinici includono
midollo osseo e cellule progenitrici del sangue
periferico (PSPC) ma più di recente anche sangue
di cordone ombelicale.
Tecniche
Un modello per crescere cellule di midollo osseo
umane in vivo è quello di iniettarle in un topo
immunodeficiente. Le HPC possono essere
trasdotte (poi in cultura distinte per la resistenza
alla neomicina: contenenti cioè il costrutto inserito
con il vettore retrovirale), cresciute in un modello
simile
per
poi
essere
recuperate
con
citofluorimetro ed analizzate con PCR per il gene
della resistenza alla neomicina; questo per
purificare ed amplificare le HPC che saranno
utilizzate in trapianto. Sistemi in vitro sono
inadeguati per l’analisi della biologia e trasduzione
delle HPC: i progenitori del tessuto espandendosi
in cultura offuscano la differenziazione della
progenie dalle rare HPC che possono esservi
presenti (Nolta 1996).
È interessante anche l’utilizzo di cellule del midollo
osseo ottenute da topo transgenico per il gene
lacZ sotto il controllo di un promotore muscolo
specifico: iniettate nel muscolo danneggiato
formano precursori per il tessuto muscolare.
Secondo l’estensione del danno queste possono
espandersi o mantenere il pool di precursori
miogeni: nuclei betagalattosio positivo sono stati
ritrovati in fibre nucleate immature e mature in
posizioni diverse, rispettivamente, centrali e
periferici. Confrontando questi dati coi controlli
(iniezione, nel muscolo danneggiato, di cellule
satelliti lacZ: precursori mononucleati dei mioblasti
provenienti dal topo transgenico per il gene lacZ
sotto il controllo di un promotore muscolo
specifico) è emerso che la cinetica delle due
popolazioni (cellule derivate dal midollo osseo e
cellule satelliti) era differente: i nuclei delle cellule
satelliti betagalattosio positivo erano presenti nelle
fibre nucleate già dopo cinque giorni, mentre le
cellule derivate dal midollo osseo solo dopo due
settimane dall’iniezione. Ciò suggerisce che queste
ultime debbano passare un processo a più stadi
che comprende migrazione, divisione cellulare,
diventare
parte
della
linea
miogena
ed
eventualmente maturazione terminale con fusione.
Le cellule satelliti non possono essere prese in
considerazione per un’applicazione terapeutica
per
la
loro
limitata
potenzialità
di
autorinnovamento: decresce con l’età oppure si
può esaurire in un processo rigenerativo cronico
(Ferrari 1998).
Discussione
È
importante
arrivare
ad
affinare
e
standardizzare i metodi di purificazione delle SC
di tessuto adulto o carcinogeno: la tecnica di
selezione
più
utilizzata
è
basata
sul
citofluorimetro e perciò si basa sulla fluorescenza
di determinati marcatori presenti all’interno della
cellula o sulla superficie cellulare. Solo la linea
ematopoietica è in questo campo molto avanzata
ma in questi ultimi anni l’isolamento di altre SC
di altri tessuti, come le SC di keratinociti (Tani
2000), ha portato a migliorare anche il metodo
della
separazione:
le
SC
sono
cellule
indifferenziate e di conseguenza non presentano
marcatori della linea del tessuto in cui si
trovano; perciò si purificano per l’assenza o la
presenza minima di marcatori caratteristici della
linea presa in esame.
Un’essenziale ricerca dovrà poi essere mirata alle
tecniche di trasferimento di geni alle cellule
staminali. La trasduzione di HSP potrà essere
importante per una varietà di disordini genetici.
Sembra che la trasduzione seguita dall’analisi
delle cellule sia un buon metodo ma i vettori
retrovirali hanno la capacità di trasportare inserti
di 7kb, quando invece un gene medio conta
10-15kb (con variazioni enormi e tralasciando le
sequenze fiancheggianti il gene che potrebbero
regolarlo). Esistono anche vettori virali basati su
adenovirus (in grado di contenere inserti che
raggiungono le 30kb) e vettori sintetici basati sui
liposomi (con capacità di trasportare inserti di
lunghezza illimitata) i quali però presentano,
rispettivamente,
forte
immunogenicità
e
frequenza di integrazione cromosomica molto
bassa (Strachan 1999).
Molte sono le sorgenti da cui si possono
prelevare cellule per la terapia cellulare e Gage
scrisse (1998) che non esiste un singolo tipo
cellulare che può fare da donatore universale.
Molti articoli anche qui riportati, evidenziano però
l’enorme potenzialità delle cellule staminali
derivate da midollo osseo o da PSPC
nell’originare tipi cellulari diversi, se indotte,
quali cellule epatiche (Alison 2000) e muscolari
scheletriche (Ferrari 1998). Più recentemente
sono stati condotti degli studi su topi
immunodeficienti (Krause 2001) per dimostrare
la capacità di autorinnovo e di differenziazione
delle HSC. Cellule di midollo osseo di maschio
sono frazionate via elutriazione (Fr25), raccolte
con citofluorimetro per l’assenza del marcatore
lin e marcate con PKH26 per poi essere iniettate
intravena in femmine irradiate in modo letale;
due giorni dopo, con citofluorimetro sono
recuperate le cellule PKH26 positivo; ogni cellula
PKH26 positivo è trapiantata in altre femmine
irradiate; il controllo era un trapianto di 102-103
cellule marcate PKH26+ Fr25lin- in femmine
irradiate. I 5/30 sopravvivono e la loro analisi (con
immunocolorazione per citokeratina e FISH per
identificare i nuclei cromosomaY positivo) rivela un
sorprendente repertorio di differenziazione; le
cellule trapiantate avevano sostituito i tessuti
epiteliali danneggiati da radiazione di stomaco,
esofago, intestino, cellule stellate, tubuli renali,
bronchi e pneumociti e pelle. L’incorporazione
epiteliale rivelava frequenze differenti in organi
diversi e questo può dipendere dal grado di danno
tissutale indotto dalla radiazione, dal trapianto,
dalle capacità rigenerative delle cellule staminali
tessuto specifiche residue e dal normale tasso di
turnover cellulare dei tessuti. Questo porta a due
modelli di incorporazione epiteliale di cellule
derivate da midollo osseo: ripopolazione su larga
scala come risposta a danno; basso livello
d’incorporazione come cellule singole e sparse in
assenza di marcati danni. È possibile poi che le
cellule siano chiamate a comparire sul sito del
danno da fattori secreti dall’organo danneggiato.
Sarebbe
molto
interessante
riprovare
l’esperimento analizzando con identica FISH per
identificare i nuclei cromosomaY positivo ma
immunocolorazione per marcatori di linee cellulari
diverse.
Bilardi Alessandra 422689/SB
Bibliografia
Alison, M.R., et al, Hepatocytes from non-hepatic adult
stem cells, Nature 2000, 406:257
Ferrari, G., et al, Muscle regeneration by bone
marrow-derived myogenic progenitors, Science 1998,
279:1528-1530
Gage,
F.H.,
Cell
Therapy,
Nature
1998,
392(suppl):18-24
Krause, D.S., et al, Multi-organ, multi-lineage
engraftment by a single bone marrow-derived stem
cell, Cell 2001, 105:369-377
Nolta, J.A., et al, Transduction of pluripotent human
hematopoietic stem cells demostrated by clonal
analysis after engraftment in immunedeficient mice,
Proc.. Matl. Acad. Sci. USA 1996, 93:2414-2419
Smith, A., Cell Therapy: in search of pluripotency, Curr.
Biol. 1998, 8:R802-R804
Solter, D., Gearhart, J., Putting stem cells to work,
Science 1999, 283:1468-1470
Strachan, T., Read, A.P., Human molecular genetics,
19992, BIOS Scientific Publishers Ltd
Tani, H., et al, Enrichment for murine keratinocyte stem
cells based on cell surface phenotipe, Proc.. Matl.
Acad. Sci. USA 2000, 97:10960-10965